Поликонъюгаты для введения in vivo полинуклеотидов
Иллюстрации
Показать всеНастоящее изобретение относится к композициям, которые можно применять для введения полинуклеотидов или других молекул, не обладающих способностью проникать в клетки молекул млекопитающих. Предлагаемая композиция, предназначенная для введения молекулы в клетку, содержит конъюгат формулы: N-L1-P-(L2-M)y, в которой N обозначает не обладающую способностью проникать через мембраны молекулу или молекулу с низкой способностью проникать через мембрану; L1 обозначает первое обратимое сцепление, содержащее лабильную в физиологических условиях связь; Р обозначает полимер, обладающий активностью в отношении мембраны; L2 обозначает второе обратимое сцепление, содержащее ортогональную лабильную в физиологических условиях связь; М обозначает маскирующий агент выбранный из группы, включающей стабилизаторы стерической конфигурации, обеспечивающие направленный перенос группы и агенты, модифицирующие заряд, и y обозначает целое число, большее 0. Системы поликонъюгатов обладают видами активности, которые обеспечивают направленный перенос, обладают антиопсонизизирующим, антиагрегационным и трансфекционным действием, в небольших биосовместимых предназначенных для введения in vivo носителях. 17 з.п. ф-лы, 36 ил.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка притязает на приоритет предварительной заявки на патент США №60/822833, зарегистрированной 18 августа 2006 г., и предварительной заявки на патент США №60/91868, зарегистрированной 3 мая 2007 г.
Предпосылки создания изобретения
Эффективность введения полинуклеотидов и других, не обладающих способностью проникать через мембраны соединений в живые клетки, в значительной степени ограничена комплексом мембранных систем клетки. Лекарственные средства, которые применяют для антисмысловой и генной терапии, представляют собой относительно крупные гидрофильные полимеры, и они часто несут также большой отрицательный заряд. Обе эти физические характеристики препятствуют их непосредственной диффузии через клеточную мембрану. По этой причине основной проблемой при введении полинуклеотидов является проникновение полинуклеотида внутрь клетки. Разработаны многочисленные реагенты для трансфекции, предназначенные для введения полинуклеотидов в клетки in vitro. Однако введение in vivo полинуклеотидов осложняется токсичностью, взаимодействиями с сывороткой и недостаточной эффективностью направленного переноса, обеспечиваемого реагентами для трансфекции, которые обладают активностью in vitro. Реагенты для трансфекции, которые хорошо «работают» in vitro, катионные полимеры и липиды, как правило, оказывают дестабилизирующее действие на клеточные мембраны и образуют крупные частицы. Положительный (катионный) заряд реагента для трансфекции облегчает введение связывание нуклеиновой кислоты, а также ее связывание с клеткой. Дестабилизация мембран облегчает введение не обладающих способностью проникать через мембраны полинуклеотидов через клеточную мембрану. Эти свойства делает реагенты для трансфекции неэффективными или токсичными in vivo. Заряд катиона приводит к взаимодействию с компонентами сыворотки, что обусловливает дестабилизацию взаимодействия полинуклеотид-реагент для трансфекции и недостаточную биологическую доступность, и эффективность направленного переноса. Заряд катиона может приводить также к токсичности in vivo. Активность в отношении мембраны реагента для трансфекции, который может обладать эффективностью in vitro, часто приводит к токсичности in vivo.
Для введения in vivo комплекс для трансфекции (реагент для трансфекции в сочетании с подлежащей введению нуклеиновой кислотой) должен быть небольшим, т.е. диаметром менее 100 нм, и предпочтительно менее 50 нм. Более эффективными могут быть комплексы еще меньшего размера, менее 20 нм или даже менее 10 нм. Комплексы для трансфекции крупнее 100 нм обладают очень незначительной способностью проникать в клетки, отличные от клеток кровеносных сосудов, in vivo. Применяемые in vitro комплексы также несут положительный заряд. Этот положительный заряд необходим для прикрепления комплекса к клетке и слияния с мембраной, ее дестабилизации или разрушения. Положительный заряд применяемых in vivo комплексов для трансфекции приводит к нежелательным взаимодействиям с сывороткой и, как следствие, к недостаточной биологической доступности. Практически нейтральные или отрицательно заряженные комплексы должны обладать in vivo лучшими характеристиками распределения и способностью осуществлять направленный перенос. Однако применяемые in vitro комплексы для трансфекции ассоциируют с нуклеиновыми кислотами путем взаимодействий типа заряд-заряд (электростатические взаимодействия). Отрицательно заряженные полимеры и липиды не взаимодействуют с отрицательно заряженными нуклеиновыми кислотами. Кроме того, эти электростатические комплексы имеют тенденцию к агрегации или осаждению при контакте с физиологическими концентрациями солей или компонентами сыворотки. И, наконец, комплексы для трансфекции, которые являются эффективными in vitro, часто являются токсичными in vivo. Полимеры и липиды, применяемые для трансфекции, разрушают или дестабилизируют клеточные мембраны. Баланса между этой активностью и эффективностью введения нуклеиновых кислот легче достигать in vitro, чем in vivo.
Хотя нескольким группам исследователей удалось добиться существенных улучшений в отношении введения генов в клетки in vivo, сохраняется необходимость в создании формы, которая обеспечивала бы эффективное введение в клетку-мишень полинуклеотида в сочетании с обеспечивающим введение агентом и не обладала бы токсичностью, как правило, ассоциированной с введением in vivo реагентов для трансфекции. В настоящем изобретении предложены композиции и способы введения в клетку и высвобождения в клетке полинуклеотида, основанные на применении систем для введения, включающих биологически лабильные конъюгаты.
Краткое изложение сущности изобретения
Предпочтительным вариантом осуществления отличительных признаков изобретения является композиция, предназначенная для введения полинуклеотида в клетку in vivo, которая содержит обратимо замаскированный обладающий активностью в отношении мембран полимер, обратимо конъюгированный с полинуклеотидом. Полимер присоединяют через одну или несколько первых обратимых ковалентных связей к одному или нескольким маскирующим агентам и дополнительно присоединяют через одну или несколько вторых обратимых ковалентных связей к одному или нескольким полинуклеотидам. Первые и вторые обратимые ковалентные связи могут представлять собой обратимые мостики, которые могут расщепляться в одинаковых или сходных условиях или которые могут расщепляться в различных условиях, т.е. они могут содержать ортогональные обратимые мостики. Конъюгат полинуклеотид-полимер вводят млекопитающему в фармацевтически приемлемом носителе или разбавителе.
Предпочтительным вариантом осуществления изобретения являются обладающие активностью в отношении мембран полимеры, представляющие собой статистические сополимеры простого поливинилового эфира. Сополимеры простого поливинилового эфира можно синтезировать из двух, трех или большего количества различных мономеров. Мономеры можно выбирать из группы, включающей: защищенный простой аминовиниловый эфир, такой как фталимидосодержащие простые виниловые эфиры, простой бутилвиниловый эфир, простой додецилвиниловый эфир, простой октадецилвиниловый эфир. Предпочтительные статистические сополимеры простого поливинилового эфира содержат три мономера: содержащий амин мономер, простой винилбутиловый эфир и простой октадецилвиниловый эфир.
В предпочтительном варианте осуществления изобретения одну или несколько биофизических характеристик обладающего активностью в отношении мембран полимера обратимо защищают или модифицируют с помощью маскирующего агента. Маскирующие агенты можно выбирать из группы, включающей стабилизаторы стерической конфигурации, обеспечивающие направленный перенос группы или модифицирующие заряд агенты. Маскирующий агент может улучшать биораспределение или направленный перенос конъюгата полимер-полинуклеотид путем ингибирования неспецифических взаимодействий полимера с компонентами сыворотки или нецелевыми клетками. Маскирующий агент может также снижать агрегацию полимера или конъюгата полимер-полинуклеотид. Маскирующие агенты, содержащие обеспечивающие направленный перенос группы, могут повышать специфический для клетки направленный перенос или интернализацию в клетке путем направленного переноса системы конъюгата к рецептору клеточной поверхности. Маскирующий агент можно конъюгировать с обладающим активностью в отношении мембран полимером до или после конъюгации полимера с полинуклеотидом.
В предпочтительном варианте осуществления изобретения полинуклеотид можно вводить в клетки с помощью описанных систем конъюгатов, которые можно выбирать из группы, включающей: ДНК, РНК, блокирующие полинуклеотиды, антисмысловые олигонуклеотиды, плазмиды, экспрессионные векторы, олигонуклеотиды, siPHK, микроРНК, мРНК, shPHK и рибозимы.
В предпочтительном варианте осуществления изобретения маскирующий агент(ы) и полинуклеотид(ы) ковалентно связывают с обладающим активностью в отношении мембран полимером через обратимые связи. Хотя маскировка полимера и присоединение полинуклеотида к полимеру являются важными, указанные присоединения могут оказывать влияние на трансфекционную активность полимера или активность полинуклеотида. Путем присоединения маскирующего агента и полинуклеотида к полимеру через обратимые связи, которые расщепляются в соответствующий момент времени, активность полимера восстанавливают и полинуклеотид высвобождается. Обратимые ковалентные связи содержат обратимые или лабильные мостики, которые можно выбирать из группы, включающей: лабильные в физиологических условиях мостики (физиологически лабильные мостики), лабильные в физиологических клеточных условиях мостики, лабильные при определенных значениях рН мостики (рН-лабильные мостики), очень лабильные при определенных значениях рН мостики, чрезвычайно лабильные при определенных значениях рН мостики, расщепляемые ферментами мостики и дисульфидные мостики. Присутствие двух обратимых связей, соединяющих полимер с полинуклеотидом и маскирующим агентом, обеспечивает совместное введение полинуклеотида с обеспечивающим введение полимером и избирательный направленный перенос, и инактивацию обеспечивающего введение полимера маскирующим агентом. Обратимость связей обеспечивает высвобождение полинуклеотида из обладающего активностью в отношении мембран полимера и избирательную активацию обладающего активностью в отношении мембран полимера.
Предпочтительным вариантом осуществления изобретения является композиция, которая содержит: обеспечивающий введение полимер, ковалентно связанный с: а) одной или несколькими обеспечивающими направленный перенос группами, стабилизаторами стерической конфигурации или модифицирующими заряд агентами через одну или несколько обратимых связей; и б) одним или несколькими полинуклеотидами через одну или несколько обратимых связей. В одном из вариантов осуществления изобретения обратимая ковалентная связь обеспечивающего направленный перенос агента, стабилизатора стерической конфигурации или модифицирующего заряд агента является ортогональной относительно ковалентной обратимой связи полинуклеотида.
Предпочтительным вариантом осуществления изобретения является система, включающая конъюгат полимера, предназначенная для введения полинуклеотида в клетку и высвобождения полинуклеотида в клетке, которая содержит: полинуклеотид, обратимо конъюгированный с обладающим активностью в отношении мембран полимером, который сам обратимо конъюгирован с маскирующим агентом. Обеспечивающие конъюгацию связи могут быть одинаковыми или различными. Кроме того, обеспечивающие конъюгацию связи могут расщепляться в одних и тех же или различных условиях.
Предпочтительным вариантом осуществления изобретения является система, включающая конъюгат полимера, предназначенная для введения не обладающей способностью проникать через мембраны молекулы в клетку и высвобождения молекулы в клетке. Система, включающая конъюгат полимера, содержит не обладающую способностью проникать через мембраны молекулу, обратимо связанную с обладающим активностью в отношении мембран полимером, при этом с обладающим активностью в отношении мембран полимером связано через обратимые ковалентные связи несколько маскирующих агентов. Обладающие активностью в отношении мембран полимеры могут обладать токсичностью или могут не обеспечивать направленный перенос при применении in vivo. Обратимое присоединение маскирующего агента обратимо ингибирует или изменяет взаимодействия с мембраной, взаимодействия с сывороткой, взаимодействия с клеткой, токсичность или заряд полимера. Предпочтительная обратимая ковалентная связь представляет собой: лабильный мостик, физиологически лабильный мостик или мостик, который расщепляется во внутриклеточной среде клетки млекопитающих. Предпочтительный лабильный мостик представляет собой лабильный при определенных значениях рН мостик. Предпочтительным лабильным при определенных значениях рН мостиком является малеаматный мостик. Другим предпочтительным лабильным мостиком является дисульфидный мостик. Не обладающие способностью проникать через мембрану молекулы включают (но, не ограничиваясь только ими): полинуклеотиды, белки, антитела и не обладающие способностью проникать через мембраны лекарственные средства.
В предпочтительном варианте осуществления изобретения полинуклеотид присоединяют к полимеру в присутствии избытка полимера. Избыток полимера может способствовать приготовлению препаративной формы конъюгата полинуклеотид-полимер. Избыток полимера может снижать агрегацию в процессе приготовления препаративной формы конъюгата. Конъюгат полинуклеотид-полимер можно отделять от избытка полимера до введения конъюгата в клетку или организм. В другом варианте конъюгат полинуклеотид-полимер можно вводить вместе с избытком полимера в клетку или организм. Взятый в избыточном количестве полимер может представлять собой тот же самый или другой полимер.
В предпочтительном варианте осуществления изобретения содержащие полимер конъюгаты, предлагаемые в изобретении, можно применять для введения in vitro полинуклеотида или другой не обладающей способностью проникать через мембрану молекулы. Для введения in vitro обратимая маскировка полимера повышает активность трансфекции некоторых не эффективных в противном случае полиаминов, таких как полилизин. Обратимая маскировка может повышать также применимость других обладающих активностью в отношении мембран полимеров посредством снижения их токсичности или ограничения их способности разрушать мембрану эндосом.
Предпочтительным вариантом осуществления изобретения является система, предназначенная для введения полинуклеотида в клетку in vivo, применение которой предусматривает: присоединение путем ковалентной связи обеспечивающей направленный перенос группы к полинуклеотиду, присоединение путем ковалентной связи второй обеспечивающей направленный перенос группы к обладающему активностью в отношении мембран полимеру и введение путем инъекции полинуклеотида и обладающего активностью в отношении мембран полимера в организм.
Другие объекты, отличительные признаки и преимущества изобретения должны стать очевидными после ознакомления с приведенным ниже подробным описанием изобретения в сочетании с прилагаемыми чертежами.
Краткое описание чертежей
На чертежах показано:
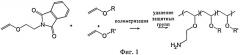
на фиг.1 - реакционная схема полимеризации полимеров простого поливинилового эфира;
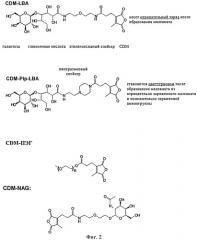
на фиг.2 - иллюстрация нескольких вариантов маскирующих агентов, предлагаемых в изобретении;
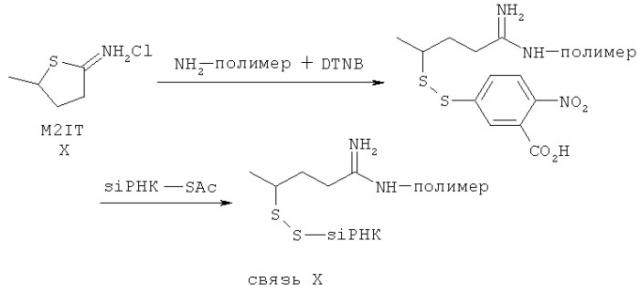
на фиг.3 - иллюстрация формирования обратимых конъюгатов полинуклеотид-полимер и обратимой маскировки конъюгата малеаматами;
на фиг.4 - микрофотографии, демонстрирующие целенаправленное введение в гепатоциты печени PBAVE-полимера, замаскированного A) CDM-ПЭГ (слева) или Б) CDM-ПЭГ плюс CDM-Pip-LBA;
на фиг.5 - микрофотографии, демонстрирующие введение замаскированного конъюгата полинуклеотид-полимер в гепатоциты in vivo;
на фиг.6 - график, иллюстрирующий «выключение» гена-мишени in vivo после опосредуемого поликонъюгатом введения обладающей активностью в отношении гена ppara siPHK (siPHK ppara);
на фиг.7 - микрофотографии, демонстрирующие введение dsДНК в печень in vivo с использованием (A) ДНК-DW1360-CDM-ПЭГ/NAG, (Б) ДНК+DW1360-CDM-ПЭГ/NAG (полинуклеотид, не конъюгирован с полимером), (В) ДНК-DW1360-CDM-ПЭГ/глюкоза и (Г) ДНК-DW1360-СВМ-ПЭГ/манноза. Данные для меченной с помощью Су3 ДНК представлены в левом верхнем квадрате на каждой панели, для актина, окрашенного снабженным флуоресцентной меткой ALEXA®-488 фаллоидином, - в верхнем правом квадрате, для ядер - в левом нижнем квадрате и объединенное изображение - в правом нижнем квадрате;
на фиг.8 - графики и блоты, иллюстрирующие «выключение» экспрессии гена-мишени в печени мышей после внутривенного введения включающих siPHK поликонъюгатов. (А) Снижение уровней мРНК ароВ в печени после обработки поликонъюгатами, содержащими обладающую активностью в отношении гена ароВ siPHK (siPHK ароВ). (Б) Уровни в сыворотке белка ароВ-100 у обработанных содержащими siPHK ароВ поликонъюгатами мышей. (В) Снижение уровней мРНК ppara в печени после внутривенного введения содержащих siPHK ppara поликонъюгатов;
на фиг.9 - график, иллюстрирующий дозовую зависимость содержащего siPHK ароВ-1 поликонъюгата. (А) «Выключение» мРНК ароВ после инъекции серийных разведений содержащего siPHK ароВ-1 поликонъюгата. (Б) «Выключение» мРНК ароВ после инъекции различных количеств siPHK;
на фиг.10 - график, иллюстрирующий уровни холестерина у мышей, обработанных содержащим siPHK ароВ-1 поликонъюгатом;
на фиг.11 - микрофотографии, демонстрирующие накопление липидов в печени мышей после введения поликонъюгата, содержащего (А) siPHK ароВ или (Б) siPHK GL3, применяемой в качестве отрицательного контроля, или (В) только физиологического раствора;
на фиг.12 - график, иллюстрирующий ингибирование экспрессии гена (А) и снижение в результате уровня холестерина (Б) через 2-15 дней после введения содержащего siPHK ароВ-1 конъюгата мышам в день 0;
на фиг.13 - микрофотографии, демонстрирующие введение in vivo антител к гепатоцитам посредством введения антитела, обратимо конъюгированного с DW1360 и замаскированного с помощью CDM-ПЭГ и CDM-NAG. В верхнем левом квадрате представлены данные для меченых антител, в верхнем правом квадрате - для актина, в нижнем левом квадрате - для ядер и в нижнем правом квадрате - объединенное изображение;
на фиг.14 - график, иллюстрирующий «выключение» гена в первичных гепатоцитах, трансфектированных siPHK АроВ, которую вводили с помощью поступающего в продажу реагента для трансфекции in vitro или с помощью различных количеств поликонъюгата, содержащего siPHK ароВ;
на фиг.15 - график, иллюстрирующий трансфекцию конъюгатами, содержащими siPHK, клеток линии Hepa-1c1c7 in vitro: «только конъюгат» обозначает замаскированную siPHK-PLL;
на фиг.16 - график, иллюстрирующий флуоресценцию DPH в присутствии PBAVE;
на фиг.17 - графики, иллюстрирующие А) профили элюции стандартов ПЭГ на колонке Shodex SB-803; Б) калибровочную кривую для колонки Shodex SB-803 и В) калибровочную кривую для расчета молекулярной массы PBAVE-полимера;
на фиг.18 - графики, иллюстрирующие А) профили элюции меченных Су3 стандартов нуклеиновых кислот и замаскированного конъюгата полинуклеотид-полимер. Б) калибровочную кривую для гель-фильтрации на Sephacryl S-500-колонке и В) калибровочную кривую для расчета молекулярной массы замаскированного конъюгата полинуклеотид-полимер;
на фиг.19 - микрофотографии, демонстрирующие введение in vivo полинуклеотида в позитивные по рецептору галактозы опухоли (А-Б) или негативные по рецептору галактозы опухоли (В-Г) с помощью конъюгатов олигонуклеотид-полимер-СDМ/ПЭГ/NAG (А, В) или конъюгатов олигонуклеотид-полимер-СDМ/ПЭГ/глюкоза (Б, Г).
Подробное описание изобретения
Настоящее изобретение относится к соединениям, композициям и способам, пригодным для введения в клетки млекопитающих полинуклеотидов или других не обладающих способностью проникать в клетку молекул. В настоящем описании предложена поликонъюгатная система для введения полинуклеотидов или других не обладающих способностью проникать через мембраны молекул в клетки in vivo. Поликонъюгатная система включает агенты, обладающие способностью обеспечивать направленный перенос, способностью противодействовать опсонизации, агрегации и обладающие трансфекционной активностью, сосредоточенные в предназначенном для введения носителе небольшого, менее 50 нанометров, размера. Имеющим решающее значение компонентом системы является обратимость связей, соединяющих компоненты системы.
Первым компонентом описанных конъюгатов, предназначенных для введения in vivo полинуклеотидов, является обратимая в физиологических условиях ковалентная связь полинуклеотида с обладающим активностью в отношении мембран полимером. Ковалентное присоединение полинуклеотида к обладающему активностью в отношении мембран полимеру гарантирует, что полинуклеотид не будет легко отщепляться в результате диссоциации от полимера при введении in vivo или ех vivo в присутствии сыворотки, и в результате обеспечивает совместное введение полинуклеотида с обладающим активностью в отношении мембран полимером в клетку-мишень. Однако ковалентное присоединение полинуклеотида к полимеру может делать полинуклеотид неактивным. Таким образом, присоединение полинуклеотида к обладающему активностью в отношении мембран полимеру осуществляют через физиологически обратимую связь или мостик. Благодаря применению физиологически обратимой связи полинуклеотид может отщепляться от полимера, высвобождая полинуклеотид, который вступает в функциональное взаимодействие с компонентами клетки. В результате выбора соответствующей обратимой связи можно создавать конъюгат, из которого полинуклеотид высвобождается только после его введения в требуемую область, такую как клеточная цитоплазма.
Второй компонент описанных применяемых in vivo конъюгатов, предназначенных для введения полинуклеотидов, содержит обратимую модификацию обладающего активностью в отношении мембран полимера. Обратимая модификация обладающего активностью в отношении мембран полимера снижает непродуктивные взаимодействия с сывороткой и не являющейся мишенью клеткой и снижает токсичность. Маскирующий агент может также придавать дополнительную требуемую функцию конъюгата, такую как повышение взаимодействия с клеткой-мишенью или усиление эндоцитоза конъюгата. Полимер маскируют путем ковалентного присоединения маскирующего агента к полимеру посредством физиологически обратимой ковалентной связи. Маскирующий агент может представлять собой стабилизатор стерической конфигурации, обеспечивающую направленный перенос группу или модифицирующий заряд агент. Маскирующий агент может защищать полимер от неспецифических взаимодействий, повышать время нахождения в кровотоке, повышать специфические взаимодействия, ингибировать токсичность или изменять заряд полимера. Каждая из указанных модификаций может изменять активность полимера в отношении мембраны, приводя к тому, что модифицированный полимер может оказаться неспособным облегчать введение полинуклеотида. Поэтому присоединение маскирующего агента к обладающему активностью в отношении мембран полимеру осуществляют через физиологически обратимую связь. Благодаря применению физиологически обратимой связи маскирующий агент может отщепляться от полимера, оставляя полимер без маскировки, и это приводит к восстановлению активности незамаскированного полимера. В результате выбора соответствующей обратимой связи можно создавать конъюгат, при использовании которого восстанавливается активность обладающего активностью в отношении мембран полимера после его введения в или достижения требуемого типа клеток или клеточной области.
Изобретение относится к системам введения на основе конъюгата общей формулы:
N-L1-P-(L2-M)y,
в которой N обозначает полинуклеотид или другую не обладающую способностью проникать в клетку молекулу, L1 обозначает обратимую связь, Р обозначает полимер, L2 обозначает вторую обратимую связь и М обозначает маскирующий агент. Маскирующий агент М защищает или модифицирует свойства или взаимодействие Р, y обозначает целое число больше 0. Предпочтительным полимером является обладающий активностью в отношении мембран полимер. Другой предпочтительный полимер представляет собой предназначенный для трансфекции полимер. Один полимер можно связывать с несколькими маскирующими агентами. Несколько маскирующих агентов можно связывать с полимером через несколько обратимых связей. После расщепления обратимой связи L2 замаскированное свойство или способность к взаимодействию у полимера Р восстанавливается. Маскирующий агент М может придавать дополнительную функцию полимеру Р, такую как связывание с клеточным рецептором. Обратимая связь L1 может быть такой же или может отличаться от обратимой связи L2 (быть ортогональной ей). Обратимое сцепление обратимой связи L1 или L2 выбирают так, чтобы расщепление происходило в требуемой физиологической среде, такой, которая присутствует в требуемой ткани, органе и субклеточной области, или в ответ на добавление фармацевтически приемлемого экзогенного агента. Полинуклеотид N и маскирующий агент М можно присоединять к полимеру Р в любом месте на полимере Р.
Полимеры
Полимер, представляет собой молекулу, состоящую из повторяющихся связанных между собой более мелких элементов (звеньев), которые называют мономерами. Полимер может быть линейным, разветвленным, разветвленным сетчатым, звездчатым, гребенчатым или лестничным. Основная цепь полимера состоит из атомов, связи которых необходимы для увеличения длины полимера. Например, поли-L-лизин, углерод карбонила, α-углерод и α-аминогруппы требуются для удлинения полимера и поэтому являются атомами, входящими в основную цепь. Боковая цепь полимера состоит из атомов, связи которых не требуются для увеличения длины полимера.
Полимер может представлять собой гомополимер, для получения которого применяют одинаковые мономеры, или полимер может представлять собой сополимер, для получения которого применяют два или большее количество различных типов мономеров. Сополимеры могут представлять собой чередующиеся, статистические (произвольные) сополимеры, блок-сополимеры и привитые (гребенчатые) сополимеры.
Чередующиеся полимеры содержат мономеры в различном повторяющемся порядке, таком как -[А-В]n-. Мономеры чередующихся полимеров, как правило, не гомополимеризуют, а подвергают взаимодействию друг с другом с образованием чередующегося сополимера.
Мономеры в статистических сополимерах не имеют определенного порядка или расположения в любой конкретной цепи, т.е. имеют следующее строение: -An-Bm-. Общие композиции таких полимеров отражают соотношение входящих в него (загруженных) мономеров. Однако точное соотношение одного и другого мономера может быть различным в разных цепях. Распределение мономеров также может быть различным в каждом полимере. Кроме того, химические свойства мономера могут влиять на уровень его включения в статистический сополимер и его распределение в полимере. Таким образом, хотя соотношение мономеров в статистическом сополимере зависит от соотношения загруженных мономеров, степень загрузки может не соответствовать точно соотношению включенных мономеров.
Блок-полимер имеет сегмент или блок одного полимера (полиА), за которым следует сегмент или блок второго полимера (полиВ): т.е. -полиА-полиВ-. В результате различные полимерные цепи соединяют по типу конфигурации голова-к-хвосту. Таким образом, блок-полимер имеет линейное расположение блоков различных по составу мономеров. Как правило, хотя и необязательно, полимерные блоки являются гомополимерами, при этом полимер А может состоять из мономеров, отличных от мономеров, из которых состоит полимер В. Диблок-сополимер представляет собой полиА-полиВ, а триблок-сополимер представляет собой полиА-полиВ-полиА. Если А представляет собой гидрофильную группу, а В представляет собой гидрофобную группу, то образовавшийся блок-сополимер может представлять собой полимерное поверхностно-активное вещество. Привитый полимер является таким типом блок-сополимера, в котором цепи одного полимера привиты в боковые цепи другого мономера, например, как показано ниже (где n, m, х, y и z обозначают целые числа):
Мономеры
В процессах полимеризации можно использовать широкое разнообразие мономеров. Мономеры могут быть катионными, анионными, цвиттерионными, гидрофильными, гидрофобными, липофильными, амфипатическими или амфотерными. Мономеры сами могут представлять собой полимеры. Мономеры могут содержать химические группы, которые можно модифицировать до или после полимеризации. Такие мономеры имеют реактивные группы, выбранные из ряда, включающего: амин (первичный, вторичный и третичный), амид, карбоновую кислоту, сложный эфир, гидразин, гидразид, гидроксиламин, галоидалкил, альдегид и кетон. Предпочтительно реактивную группу можно модифицировать после конъюгации полинуклеотида или в водном растворе.
Как известно специалистам в области полимеризации, существует несколько категорий процессов полимеризации. Например, полимеризация может быть цепной или ступенчатой.
Ступенчатая полимеризация
При ступенчатой полимеризации полимеризацию осуществляют постадийно. Для удлинения полимера используют реакцию между мономерами, олигомерами и полимерами. При этом не требуется никакой инициации, так как одна и та же реакция имеет место на всем протяжении и не имеет стадии обрыва цепи, поскольку концевые группы еще являются реактивными. Скорость полимеризации снижается в зависимости от поглощения функциональных групп.
Полимер можно создавать с помощью ступенчатой полимеризации, используя мономеры, которые имеют две реактивные группы (А и В) в одном и том же мономере (гетеробифункциональный), при этом А содержит реактивную группу и В содержит реактивную в отношении А группу (реактивная группа, которая образует ковалентную связь с А). Полимеризация А-В позволяет получать -[А-В]n-. Реактивные группы А и В можно соединять ковалентной связью или множеством ковалентных связей, получая состоящий из мономеров полимер. Полимер можно создавать также путем ступенчатой полимеризации, используя гомобифункциональные мономеры, такие как А-А+В-В, получая -[А-А-В-В]n-. Как правило, эти реакции могут включать ацилирование и алкилирование. Две реактивные группы мономера можно соединять одной ковалентной связью или множеством ковалентных связей.
Если реактивная группа А представляет собой амин, то В представляет собой обладающую реактивностью в отношении амина группу, которую можно выбирать из группы, включающей: изотиоцианат, изоцианат, ацилазид, N-гидроксисукцинимид, сульфонилхлорид, альдегид (включая формальдегид и глутаровый альдегид), кетон, эпоксид, карбонат, сложный имидоэфир, карбоксилат, активированный карбодиимидом, алкилфосфат, галоидарилы (дифтординитробензол), ангидрид, галогенангидрид, сложный пара-нитрофениловый эфир, сложный орто-нитрофениловый эфир, сложный пентахлорфениловый эфир, сложный пентафторфениловый эфир, карбонилимидазол, карбонилпиридиний и карборилдиметиламинопиридиний. Другими словами, если реактивная группа А представляет собой амин, то В может представлять собой ацилирующий или алкилирующий агент или агент для аминирования.
Если реактивная группа А представляет собой сульфгидрил (тиол), то В представляет собой обладающую реактивностью в отношении тиола группу, которую можно выбирать из группы, включающей: йодацетильное производное, малеимид, азиридиновое производное, акрилоильное производное, фторбензольное производное и дисульфидное производное (такое как пиридилдисульфид или производные 5-тио-2-нитробензойной кислоты (TNB)).
Если реактивная группа А представляет собой карбоксилат, то реактивная группа В представляет собой обладающую реактивностью в отношении карбоксилата группу, которую можно выбирать из группы, включающей: диазоацетат и амин, в качестве которого используют карбодиимид. Можно применять другие добавки, такие как карбонилимидазол, диметиламинопиридин (ДМАП), N-гидроксисукцинимид или спирт, в случае применения карбодиимида и ДМАП.
Если реактивная группа А представляет собой гидроксил, то реактивная группа В представляет собой обладающую реактивностью в отношении гидроксила группу, которую можно выбирать из группы, включающей: эпоксид, оксиран, активированный карбамат, активированный сложный эфир и галоидалкил.
Если реактивная группа А представляет собой альдегид или кетон, то реактивная группа В представляет собой обладающую реактивностью в отношении альдегида или кетона группу, которую можно выбирать из группы, включающей: гидразин, производное гидразида, амин (для получения основания Шиффа, которое можно не восстанавливать или восстанавливать с помощью восстановителя, такого как NaCNBH3) и гидроксилсодержащее соединение.
Полимер можно создавать с помощью ступенчатой полимеризации, используя бифункциональные. Мы вынуждены признать правоту экспертизы, признак, относящийся к приему с пищей, характеризует способ лечения и не имеет отношения к применению для приготовления лекарственного средства. Как нам кажется, можно было бы обосновать, что этот признак является существенным для заявленного применения, только если будет доказано, что прием лекарственного средства во время еды оказывает влияние на его получение. Мономеры и другие агенты, такие, например, как А-А плюс другой агент, с получением -[А-А]n-.
Если реактивная группа А представляет собой сульфгидрильную (тиол) группу, то ее затем можно превращать в дисульфидные мостики с помощью окислителей, таких как йод (I2), перйодат натрия (NaIO4) или кислород (O2). Если реактивная группа А представляет собой амии, то ее можно превращать в тиол путем взаимодействия с 2-иминотиолатом (реагент Траута), который затем подвергают окислению и образованию дисульфида. Для катализа формирования дисульфидного мостика можно применять также дисульфидные производные (такие как пиридилдисульфид или производные TNB).
Реактивные группы А или В в любом из приведенных выше примеров могут представлять собой также фотореактивную группу, такую как арилазид (включая галогенированный арилазид), диазогруппу, бензофенон, алкин или диазириновое производное.
Реакции с участием амина, гидроксила, сульфгидрила или карбоксилата позволяют получать химические связи, которые описаны как амиды, амидины, дисульфиды, простые эфиры, сложные эфиры, енамипы, имины, мочевины, изотиомочевины, изомочевины, сульфонамиды, карбаматы, алкиламинные связи (вторичные амины) и простые связи типа углерод-азот, в которых углерод содержит гидроксильную группу, простой тиоэфир, диол, гидразон, диазогруппу или сульфон.
Цепная полимеризация
При цепной реакции полимеризации рост полимера происходит в результате последовательного добавления мономерных звеньев до достижения определенной длины растущих цепей. Механизмы инициации и роста являются различными и, как правило, включают стадию обрыва цепи. Цепные реакции полимеризации могут быть радикальными, анионными или катионными. Мономеры для цепной полимеризации можно выбирать из таких групп, как: винил, простой виниловый эфир, акрилатные, метакрилатные, акриламидные и метакриламидные группы. Цепную полимеризацию можно осуществлять также посредством циклической полимеризации или полимеризации с раскрытием кольца. Можно применять также несколько различных типов ингибиторов свободных радикалов, включая (но, не ограничиваясь только ими): пероксиды, гидроксипероксиды и азосоединения, такие как дигидрохлорид 2,2′-азобис(амидинопропана) (ААР).
Эффективность трансфекции
Понятие трансфекция относится к переносу полинуклеотида или другого биологически активного соединения снаружи клетки внутрь клетки, так, чтобы при этом полинуклеотид или биологически активное соединение являлось функциональным. Примерами реагентов для трансфекции, предназначенных для введения полинуклеотидов в клетки т vitro, являются, но, не ограничиваясь только ими: липосомы, липиды, полиамины, осадки фосфата кальция, гистонные белки, полиэтиленимин и полиамфолитные комплексы и их комбинации. Многие из предназначенных для трансфекции in vitro реагентов являются катионными, что позволяет реагенту ассоциироваться или образовывать комплекс с отрицательно заряженными нуклеиновыми кислотами посредством электростатического взаимодействия.
Обладающие активностью в отношении мембран полимеры
Обладающие активностью в отношении мембран полимеры представляют собой амфипатические полимеры, которые могут индуцировать одно или несколько с