Способы и композиции для лечения гипералгезии
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована при лечении гипералгезии. Предложен способ лечения гипералгезии путем введения фармацевтической композиции, которая включает эффективное количество антагониста ионного канала TRPA1, причем антагонист TRPA1 специфически блокирует активирование TRPA1 и не блокирует активирования одного или нескольких других каналов термоТRР, таких как TRPV1, TRPV2, TRPV3, TRPV4 и TRPM8. Предлагается также применение антагониста ионного канала TRPA1 (Z)-4-(4-хлорофинил)-3-метилбут-3-ен-2-оксима или N,N'-бис-(2-гидроксибензил)-2,5-диамино-2,5-диметилгексана для получения лекарственного средства для лечения термической или механической гипералгезии. Предложен способ идентификации агента, подавляющего или устраняющего патологическую механическую чувствительность. Для этого обеспечивают контактирование исследуемых соединений с клеткой, которая экспрессирует мимолетный потенциал рецептора ионного канала TRPA1. При этом выявляют антагонист ионного канала TRPA1, который ингибирует сигнальную активность активированного TRPA1 в клетке в ответ на механический стимул и влияет на активирование или сигнальные активности одного или нескольких каналов термоТРР. Изобретения обеспечивают эффективное купирование острой или хронической боли с компонентом механической гипералгезии за счет избирательного ингибирования механотрансдукции, опосредованной ионным каналом TRPA1. 3 н. и 15 з.п. ф-лы, 4 ил.
Реферат
Перекрестные сведения на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с 35 разделом Свода законов США, §119(е), на основе предварительной заявки на патент США 60/775519, поданной 21 февраля 2006 г. Описание приоритетной заявки включено в настоящее описание в виде ссылки на ее целостность для разных целей.
Положение, касающееся государственной поддержки
Настоящее изобретение частично совершено при государственной поддержке грантами NINDS № NS42822 и NS046303, выданными Национальным институтом здоровья США. Таким образом, правительство США может обладать несомненными правами на настоящее изобретение.
Область техники, к которой относится изобретение
Настоящее изобретение в основном относится к способам и композициям для противодействия ионным каналам, участвующим в восприятии вредных химических, термических и механических раздражителей. Точнее настоящее изобретение относится к соединениям, которые специфически ингибируют механотрансдукцию, опосредуемую ионным каналом TRPA1, и способам применения таких соединений для лечения механической гипералгезии.
Предпосылки создания изобретения
Сенсорные нейроны ганглиев задних корешков спинного мозга (ГЗК) могут выявлять изменения во внешней среде через проекции с кожи. Ноцицепция является процессом, с помощью которого вредные раздражители, например тепло и касание, стимулируют сенсорные нейроны в коже (ноцицепторы) посылать сигналы в центральную нервную систему (ЦНС). Некоторые из этих нейронов обеспечивают либо чувствительность к механическим стимулам (с высоким или низким порогом), либо чувствительность к температуре (реагируя на жар, тепло или холод). Некоторые другие нейроны, называемые полимодальными ноцицепторами, улавливают и опасные термические (холод или тепло), и опасные механические стимулы.
Ионные каналы играют центральную роль в нейробиологии, выступая в качестве мембрано-стягивающих белков, регулирующих поток ионов. Классифицируя по механизму пропускания сигнала, ионные каналы могут быть активированы сигналами, например, специфическими лигандами, электрическим напряжением или механическим воздействием. Каналы подгруппы семейства катионных каналов кратковременного рецепторного потенциала (Transient Receptor Potential - TRP) дублируют термоТРР, участвующие в формировании ощущения холода, например TRPM8 и TRPA1. TRPM8 активируется при 25°С. Он также является рецептором ментола, что является молекулярным объяснением того обстоятельства, что многие мятные запахи обычно воспринимаются в качестве освежающей прохлады. Ионный канал TRPA1, также называемый ANKTM1, активируется при 17°С. Это ионный канал, экспрессируемый в полимодальных сенсорных нейронах, который может быть активирован вредным воздействием холода и различными природными жгучими соединениями, которые вызывают чувство жжения/боли. См., например, Patapoutian и др., Nat. Rev. Newosci. 4, 2003, сс.529-539, Story и др. Cell, 112, 2003, сс.819-829, Bandell и др. Neuron, 41, 2004, сс.849-857.
Восприятие механических раздражителей сложным образом связано с проявлением боли при многих заболеваниях и медицинских состояниях. Например, механотрансдукция является важным компонентом чувства боли, связанного с артритом и нейропатической болью. Однако, в противоположность чувствительности к вредным термическим раздражителям, не известна молекулярная идентичность каналов механотрансдукции, ответственных за восприятие вредных механических воздействий, которые были бы важны для формирование чувства боли. Настоящее изобретение нацелено на решение этой и других важных задач, имеющихся в данной области.
Краткое описание изобретения
Один из объектов настоящего изобретения предусматривает способы лечения гипералгезии у субъекта. Эти способы включают введение субъекту фармацевтической композиции, которая включает эффективное количество антагониста TRPA1, который за счет специфического блокирования активирования TRPA1 устранят или подавляет у субъекта вредную чувствительность к химическим, термическим и механическим раздражителям. В некоторых из этих способов используемый антагонист TRPA1 не блокирует активирование одного или нескольких из других каналов термоТКР, выбранных из группы, включающей TRPV1, TRPV2, TRPV3, TRPV4 и TRPM8. В некоторых способах используемым антагонистом TRPA1 является (Z)-4-(4-хлорофинил)-3-метилбут-3-ен-2-оксим. В некоторых других способах используемым антагонистом TRPA1 является N,N'-бис-(2-гидроксибензил)-2,5-диамино-2,5-диметилгексан. В некоторых других способах используют антитело-антагонист TRPA1.
Некоторые из терапевтических способов настоящего изобретения направлены на лечение субъектов с воспалительными состояниями или нейропатическими болями. В некоторых из этих способов субъект, подвергаемый лечению, страдает от механической или термической гипералгезии. В некоторых способах субъектом, подвергаемым лечению, является человек. Помимо антагониста TRPA1, второй понижающий боль агент вводят субъекту одним из известных в терапии способов. Например, второй понижающий боль агент может быть анальгетиком, выбранным из группы, включающей ацетаминофен, ибупрофен и индометацин, а также опиоиды.
Второй понижающий боль агент также может быть анальгетическим агентом, выбранным из группы, состоящей из морфина и моксонидина.
Другой объект настоящего изобретения предусматривает способы идентификации агента, который подавляет или устраняет вредную чувствительность к механическим раздражителям. Эти способы предусматривают: (а) контактирование исследуемых соединений с клеткой, которая экспрессирует ионный канал кратковременного рецепторного потенциала TRPA1, и (б) идентификацию соединения, которое ингибирует сигнальную активность активированного TRPA1 в клетке в ответ на механический стимул. В некоторых из этих способов у выявленного соединения затем исследуют способность воздействовать на активирование или сигнальное действие одного или нескольких каналов термоТRР, выбранных из группы, состоящей из TRPV1, TRPV2, TRPV3, TRPV4 и TRPM8. В некоторых способах идентифицированное соединение устраняет или понижает сигнальную активность активированного ионного канала TRPA1 относительно сигнальной активности ионного канала TRPA1 в отсутствие этого соединения. В некоторых из этих способов идентифицированное соединение не блокирует активирования одного или нескольких каналов термоТРР, выбранных из группы, включающей TRPV1, TRPV2, TRPV3, TRPV4 и TRPM8.
В некоторых из указанных способов скрининга ионный канал TRPA1 активируется агонистом TRPA1, выбранным из группы, включающей циннамальдегид, эвгенол, гингерол, метилсалицилат и аллицин. Примерами клеток, которые могут быть использованы в данных способах, являются TRPA1 - экспрессирующие клетки СНО (клетки яичника китайского хомячка - Chinese hamster ovary, СНО), TRPA1-экспрессирующие ооциты лягушки-быка Xenopus и культивируемые нейроны ГЗК (сенсорные нейроны ганглиев задних корешков спинного мозга - ГЗК). Сигнальной активностью, подвергаемой мониторингу в этих способах, могут быть, например, TRPA1-индуцируемый электрический ток через мембрану клетки или поступление кальция в клетку. Механическим стимулом, применяемым при скрининге, может быть, например, давление всасывания или гиперосмотический стресс.
Настоящее изобретение также предусматривает применение TRPA1 -специфического ингибитора для получения лекарственного средства для лечения термической или механической гипералгезии у субъекта. Соответствующими TRPA1-специфическими ингибиторами являются, например, (Z)-4-(4-хлорофинил)-3-метилбут-3-ен-2-оксим или N,N'-бис-(2-гидроксибензил)-2,5-диамино-2,5-диметилгексан. В настоящем изобретении также предусмотрены фармацевтические композиции, включающие такие TRPA1-специфические ингибиторы.
Дополнительные сведения о сути и преимуществах настоящего изобретения приведены в настоящем описании ниже и в формуле настоящего изобретения.
Описание чертежей
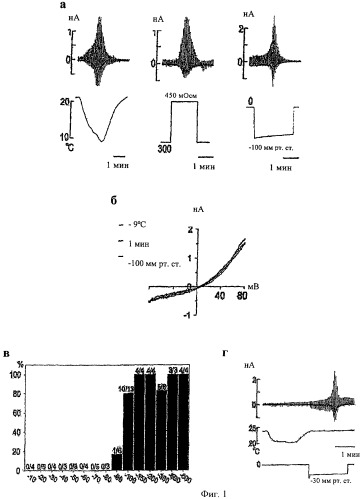
Фиг.1а-1г показывают, что канал TRPA1 активируется механическими стимулами. (а) Запись электрического тока от клеток, экспрессирующих TRPA1, в ответ на холод (справа, n=62), гипертоническую осмолярность (в центре, n=8) и (-) давление (слева, n=10), отображенная с помощью пера самописца; (б) типичная связь тока-напряжения в ответ на разные стимулы, которые активируют канал TRPA1; (в) клетки, экспрессирующие TRPA1 показывают четкие ответы в виде тока на отрицательное давление -90 мм рт. ст. или выше. Указанные сверху дроби означают число респондеров от общего числа пэтчей, исследованных при соответствующем давлении; (г) предварительная обработка холодом, температура которого является подпороговой, сенсибилизирует ответ клеток, экспрессирующих TRPA1, на низкий пороговый механический стимул (n=5).
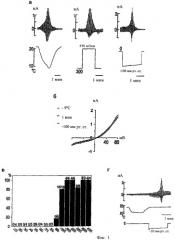
Фиг.2а-2г показывают, что ответы TRPA1 на механические импульсы блокируются различными известными агентами. (а) катионы Gd3+ полностью блокируют активирование тока в TRPA1 при гиперосмолярности (n=5 из 5 клеток), которая вызывается 5 мкМ рутения красного (n=5 из 5 клеток для (-) давление и n=6 из 6 клеток для гиперосмолярности). (б) циннамальдегид-чувствительный нейрон ГЗК отвечают на давление -200 мм рт. ст. и на капсаицин. Показано соотношение тока-напряжения в ответ на отрицательное давление (соотношение установлено в том месте, которое отмечено «*»). (в) камфора в концентрации 2 мМ полностью блокирует активирование тока в канале TRPA1 при (-) давлении в клетках СНО (n=5). (г) камфора в концентрации 2 мМ полностью блокирует ответ в виде тока на (-) давление в нейронах ГЗК (n=15 из 18 клеток, исследованных на (-) давление). В 12 из 15 клеток электрический ток также активируется циннамальдегидом в концентрации 500 мкМ.
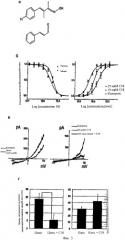
Фиг.3а-3г показывают, что соединение 18 блокирует активирование TRPA1. (а) химическая структура соединения 18 (вверху) и циннамальдегида (внизу), (б) взаимосвязи дозы-ответа для блокирования соединением 18 поступления кальция в клетки СНО, экспрессирующие TRPA1 мыши и человека, под воздействием циннамальдегида в концентрации 50 мкМ (левая панель). Поступление кальция измеряют, используя стандартный метод FLIPR, причем данные представлены в виде среднего значения по 4 лункам (~8000 клеток/лунку), а планки погрешностей показывают стандартную ошибку. Величины нормируют для получения максимального ответа (наблюдаемого в отсутствие соединения 18). Величины IC50 составляют 3,1 мкмолей и 4,5 мкмолей для TRPA1 человека и мыши соответственно. Соединение 18 сдвигает вправо величину ЕС50 для циннамальдегида у мышей, экспрессирующих TRPA1, в зависимости от концентрации (правая панель). Данные получают, применяя метод FLIPR для оценки поступления кальция, n=3 лункам (~8000 клеток/лунку), и нормализуют по максимальному ответу. Планки погрешностей показывают стандартную ошибку, а сплошные кривые означают вычерченные по точкам уравнения, производными от которых являются величины EC50. Величины ЕС50 для циннамальдегида составляют 50 мкМ (контроль), 111 мкМ (10 мкМ соединения 18) и 220 мкМ (25 мкМ соединения 18). Максимальные ответы во всех случаях составляют близкие величины. (в) соотношение тока-напряжения канала TRPA1. Внешние выпрямляющие токи, которые вытягиваются циннамальдегидом (левая панель) изнутри наружу в макропэтчах ооцитов Xenopus, экспрессирующих TRPA1, устраняются соединением 18 при совместных применениях (правая панель). (г) соединение 18 устраняет острые болевые проявления под воздействием циннамальдегида, но не капсаицина. Время, затраченное на резкие движения и зализывания задней лапы, в которую вводили инъекцией циннамальдегид (16,4 мМ) или капсаицин (0,328 мМ), измеряют в течение 5 мин и сопоставляют с задней лапой другого животного, которое одновременно инъецировали также соединением 18 (1 мМ). Число случаев для каждого эксперимента, начиная слева, составляет 8, 8, 6 и 6 соответственно (***р<0,001, *р<0,05, двусторонний критерий Стьюдента).
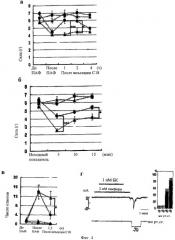
Фиг.4а-4г показывают, что TRPA1 опосредует гиперчувствительность к механическим воздействиям или холоду при воспалении (а-б). Соединение 18 - новый блокатор, который реверсирует ПАФ- (n=8) или БК-индуцированные (n=12) ноцицептивные механические реакции, но не термические (тепловые) реакции (n=8 и для ПАФ, и для БК) у мышей. Красные значки обозначают ответы на инъекцию в заднюю лапку ПАФ (а) или БК (б), а синие значки обозначают ответы от других не ноцицептивных задних лапок у тех же животных. Кружками отмечены ответы на лечение соединением 18, а треугольниками отмечены ответы на лечение наполнителем (а-в). Пороговые значения фон Фрея измеряют и усредняют. (***р<0,001, *р<0,05, двусторонний критерий Стьюдента). (в) соединение 18 реверсирует восприятие холода у крыс после инъекции ПАФ. Красные значки обозначают ответы на инъекцию ПАФ в заднюю лапку, а синие значки обозначают ответы от других, не подвергнутых инъекции задних лапок у тех же животных. Число резких движений, зализываний, подъемов лап в течение 10 мин в каждой временной точке подсчитывают и усредняют (n=8, *р<0,05, двусторонний критерий Стьюдента). (г) предварительная обработка 1 нмолем брадикинина (БК) сенсибилизирует ответ клеток СНО, экспрессирующих TRPA1, а также экспрессирующих рецептор В2, на низкий пороговый механический стимул. Во время обработки брадикинином (БК) клетки инкубируют с 2 ммолями камфоры для защиты умеренного активирования и последующей десенсибилизации TRPA1 брадикинином. Эти результаты показывают, что порог механического стимула для клеток снижается до -60 мм рт. ст.
Подробное описание изобретения
Общее представление
Настоящее изобретение, в частности, основывается на результатах, полученных в настоящем изобретении, которые заключаются в том, что канал TRPA1, помимо того, что он является важным компонентом восприятия боли, сигнализирующей о вредном воздействии низкой температуры, также является сенсором вредных механических раздражителей. В настоящем изобретении также были выявлены соединения, которые специфически ингибируют активирование TRPA1,
но не другие ионные каналы семейства TRP. В приводимых ниже примерах подробно описано установленное в настоящем изобретении обстоятельство, заключающееся в том, что TRPA1 активируется вредными механическими воздействиями и что такое активирование облегчается при воспалениях. Также было установлено, что низкомолекулярные ингибиторы TRPA1 могут существенно понизить ноцицептивное поведение в виде реакции мышей на циннамальдегид, но не на капсаицин. Кроме того, ингибиторы блокируют гипералгезию в ответ на механическую и холодовую гипералгезию, но не на тепловую гипералгезию.
В соответствии с этими установленными данными настоящее изобретение предусматривает способы скрининга терапевтических агентов, которые могут применяться для устранения или подавления вредной механической чувствительности. В настоящем изобретении также предусмотрены способы применения TRPA1-специфических ингибиторов для ослабления боли, связанной с вредными механическими воздействиями при различных заболеваниях или состояниях. Последующие разделы представляют руководство по получению и применению композиций настоящего изобретения и выполнению способов настоящего изобретения.
Определения
Если не указано иначе, все технические и научные термины, применяемые в настоящем изобретении, имеют те же значения, которые обычно подразумеваются специалистами в той области, к которой относится настоящее изобретение. С основными определениями специалисты могут ознакомиться в следующих книгах: Singleton и др. «Dictionary of Microbiology and Molecular Biology», 2-е изд., 1994; «The Cambridge Dictionary of Science and Technology» под ред. Walker, 1988; Hale, Marham, «The Harper Collins Dictionary of Biology», 1991. Кроме того, приводимые ниже определения предусмотрены для того, чтобы помочь читателю в практике применения настоящего изобретения.
Понятия «агент» или «исследуемый агент» означают какие-либо вещества, молекулы, элементы, соединения, объекты или их комбинации. К ним относятся, но ими не ограничиваются, например, белки, полипептиды, низкомолекулярные органические молекулы, полисахариды, полинуклеотиды и др. Это может быть природный продукт, синтезированное соединение, химическое соединение или комбинация двух или нескольких веществ. Если не указано иначе, понятия «агент», «вещество» и «соединение» применяются в настоящем изобретении взаимозаменяемо.
В контексте настоящего изобретения понятие «аналог» относится к молекуле, которая структурно схожа с контрольной молекулой, но которую модифицируют направленным и контролируемым способом - путем замены специфического заместителя контрольной молекулы на другой заместитель. При сравнении с контрольной молекулой специалист в данной области может ожидать, что аналог проявляет те же, схожие или улучшенные полезные свойства. Синтез и скрининг аналогов для идентификации вариантов известных соединений, обладающих улучшенными свойствами (например, повышенным связывающим сродством с молекулой-мишенью), являются подходом, хорошо известным в фармацевтической химии.
В контексте настоящего изобретения понятие «контактирующий» относится к комбинированию двух или нескольких агентов (например, полипептидов или низкомолекулярных соединений) или к комбинированию агентов и клеток. Контактирование может происходить in vitro, например, комбинирование двух или нескольких агентов или комбинирование исследуемого агента и клеток или клеточного лизата в пробирке или другом контейнере. Контактирование также может происходить в клетке или in situ, например, контактирование двух полипептидов в клетке путем совместной экспрессии в клетке рекомбинантных полинуклеотидов, кодирующих два полипептида, или в клеточном лизате.
В контексте настоящего изобретения понятия «гипералгезия» или «состояние гипералгезии» относятся к состоянию, при котором теплокровное животное чрезвычайно чувствительно к механическому, химическому или термическому стимулированию, которое вне такого состояния может быть безболезненным. Известно, что гипералгезия сопровождает некоторые физические повреждения организма, например повреждения, неизбежно связанные с физическими травмами. Также известно, что гипералгезия сопутствует определенным воспалительным состояниям у человека, например артриту и ревматизму. Таким образом, гипералгезия связана с болью, выраженной слабо, умеренно или сильно, например с болью при воспалительных состояниях, но не только при них (например, при ревматоидном артрите и остеоартрите), с послеоперационной болью, послеродовой болью, зубной болью (например, при кариесе и гингивите), с болью, связанной с ожогами, включая, но, не ограничиваясь ими, с солнечные ожоги, ссадинами, контузиями и т.п., с болью, связанной со спортивными травмами и растяжениями, воспалениями кожи, включая, но, не ограничиваясь ими, воспаление от ядовитого плюща, с аллергическими высыпаниями и дерматитами, а также с другими видами боли, которые повышают чувствительность к умеренным стимулам, например к вредному для здоровья холоду.
Понятие «модулировать» по отношению к контрольному белку (например, TRPA1) относится к ингибированию или активированию биологической активности контрольного белка (например, боли, сигнализирующей о связанной с ее проявлением активности TRPA1). Модулирование может приводить к повышению (т.е. активированию или стимулированию) или понижению регуляции (т.е. подавлению или устранению). Механизм действия может быть прямым, например, за счет связывания контрольного белка в качестве лиганда. Модулирование также может быть непрямым, например, через связывание с другой молекулой и/или ее модификацию, которая, в свою очередь, связывается с контрольным белком или модулирует его.
Понятие «невропатическая боль» означает боль, возникающую при состояниях или обстоятельствах, при которых происходит повреждение нервов. Понятие «невропатия» означает процесс заболевания, приводящий к повреждению нервов. Понятие «жгучая боль или каузалгия» означает состояние хронической боли после повреждения нерва, или состояние или заболевание, например, инфаркт миокарда, которое вызывает отраженную боль. Понятие «аллодиния» означает состояние, при котором субъект испытывает боль в ответ на нормальные не связанные с болью, стимулы, например легкое прикосновение. Понятие «анальгезирующий или обезболивающий агент» означает молекулу или комбинацию молекул, которые вызывают снижение боли. Анальгезирующий агент действует по механизму, отличному от ингибирования TRPA1, если его механизм действия (за счет электростатических или химических взаимодействий) не включает прямого связывания с TRPA1 и понижения функции TRPA1.
Понятия «полинуклеотид» или «последовательность нуклеиновой кислоты» относятся к полимерной форме нуклеотидов (полирибонуклеотидам или полидезоксирибонуклеотидам). Иногда понятие «полинуклеотид» относится к последовательности, которая непосредственно не соприкасается с любой из двух кодирующих последовательностей, с которыми она непосредственно соприкасается (с 5'-конца и с 3'-конца) в естественном геноме организма, к которому этот полинуклеотид относится. Таким образом, настоящий термин обозначает, например, рекомбинантную ДНК, которая включена в вектор, в автономно реплицирующуюся плазмиду или вирус, в геномную ДНК прокариота или эукариота, или которая существует в виде отдельной молекулы (например, кДНК) независимо от других последовательностей. Полинуклеотиды могут быть рибонуклеотидами, дезоксирибонуклеотидами или модифицированными формами других нуклеотидов.
Понятия «полипептид» или «белок» (например, TRPA1) обозначают полимер, в котором мономерами являются остатки аминокислот, которые соединены друг с другом амидными связями. Если аминокислоты являются альфа-аминокислотами, они могут быть или L-оптическими изомерами, или D-оптическими изомерами, типичными являются L-изомеры, Фрагмент полипептида или белка (например, TRPA1) может иметь ту же или в существенной степени идентичную аминокислотную последовательность, что и у природного белка. Понятие «полипептид или пептид, в существенной степени идентичный» означает, что аминокислотная последовательность в большей своей части, но не целиком, такая же и сохраняет функциональную активность той родственной последовательности, с которой ее сравнивают.
Полипептиды в основном могут возникать в результате консервативных замещений, например, TRPA1 и варианты TRPA1, содержащие такие замены. Консервативная вариация означает замену аминокислотного остатка на другой, биологически близкий остаток. К примерам консервативных вариаций относятся замещения гидрофобного остатка, например изолейцина, валина, лейцина или метионина, на другой, или замещение одного полярного остатка на другой, например замещение аргинина на лизин, глутамина на аспарагиновые кислоты или глутамина на аспарагин и д.п. К другим иллюстративным примерам консервативных замещений относятся следующие замещения: аланина на серин, аргинина на лизин, аспарагина на глутамин или гистидин, аспартата на глутамат, цистеина на серин, глутамина на аспарагин, глутамата на аспартат, глицина на пролин, гистидина на аспарагин или глутамин, изолейцина на лейцин или валин, лейцина на валин или изолейцин, лизина на аргинин, глутамин или глутамат, метионина на лейцин или изолейцин, фенилаланина на тирозин, лейцин или метионин, серина на треонин, треонина на серин, триптофана на тирозин, тирозина на триптофан или фенилаланин, валина на изолейцин или на лейцин.
К понятию «субъект» относятся млекопитающие, особенно люди, а также другие животные, например лошади, собаки и кошки.
Понятие «вариант» применительно к контрольной молекуле (например, молекуле полипептида TRPA1 или модулятора TRPA1) относится к молекуле, которая в значительной степени схожа по структуре и биологическому действию с целой контрольной молекулой или ее фрагментом. Таким образом, в контексте настоящего изобретения две молекулы, которые проявляют сходное действие, рассматриваются в качестве вариантов, даже если композиция или вторичная, третичная или четвертичная структуры молекул не идентичны или если последовательности аминокислотных остатков не идентичны.
TRPA1-специфические ингибиторы
Поскольку TRPA1 является рецептором вредных химических, термических и механических стимулов, соединения - антагонисты TRPA1 применимы для снижения боли, связанной с соматическим восприятием, в том числе с механической чувствительностью, например с механической гипералгезией и аллодинией. Соединения, которые специфически ингибируют или устраняют механическую чувствительность, опосредованную TRPA1, могут иметь различные терапевтические или профилактические (например, антиноцицептивные) применения. Какая-либо молекула, которая ингибирует ионный канал TRPA1, может быть способна уменьшить боль, опосредованную вредными воздействиями, например механической чувствительностью. Однако молекулы, которые могут ингибировать другие термоТRР (например, TRPV1, TRPV2, TRPV3 и TRPM8) помимо TRPA1, могут оказывать воздействие на различные функции, выполняемые этими молекулами. Такие неизбирательные ингибиторы TRPA1, хотя они способны уменьшить боль, вероятно, обладают многими нежелательными побочными эффектами. Таким образом, молекулы, которые селективно ингибируют ионные каналы TRPA1, являются предпочтительными для таких терапевтических применений. С помощью специфического ингибирования передачи сигнала, опосредованной TRPA1, но не затрагивающего передачу сигнала другими каналами термоТКР, симптомы, проявляемые у субъекта с механической гиперестезией, могут быть уменьшены или подавлены.
К ингибиторам TRPA1, которые могут применяться в практике настоящего изобретения, относятся соединения, которые интерферируют с экспрессией, модификацией, регуляцией или активированием TRPA1, или соединения, которые понижают одну или несколько нормальных биологических активностей белка TRPA1 (например, его ионный канал). Селективный ингибитор TRPA1 в существенной степени блокирует активирование TRPA1 или ингибирует сигнальные активности TRPA1 в концентрации, при которой активирование или сигнальные активности других термоТRР (например, TRPV1, TRPV2, TRPV3, TRPV4 и/или TRPM8) значительно не изменяются. Различные TRPA1-специфические антагонисты могут применяться по настоящему изобретению. Некоторые из таких TRPA1-специфических ингибиторов были идентифицированы в настоящем изобретении согласно описанному в приводимых ниже примерах. Эти соединения могут быть коммерческими или иным образом известными в данной области. Одним из таких соединений является соединение 18 ((Z)-4-(4-хлорофинил)-3-метилбут-3-ен-2-оксим). Это соединение может быть коммерческим, получаемым фирмой Maybridge (Корнуолл, Великобритания). Другим примером является соединение 40 (N,N'-бис-(2-гидроксибензил)-2,5-диамино-2,5-диметилгексан), описанное в US 4129556. В примерах, приводимых ниже, показано, что эти два соединения могут специфически ингибировать активирование или функцию TRPA1 и, таким образом, подавлять TRPA1-опосредованную механическую ноцицепцию. Они не обладают или обладают небольшим воздействием на активирование или проявление активностей других термоТRР, например TRPV1, TRPV2, TRPV3, TRPV4 или TRPM8. Таким образом, эти два соединения могут применяться для лечения или облегчения механической гипералгезии, о чем подробно описано ниже.
Помимо указанных выше в качестве примера TRPA1-специфических антагонистов, дополнительные TRPA1-специфические ингибиторы могут быть легко идентифицированы с помощью способов, описанных в настоящем изобретении, или способов, описанных в данной области техники. К новым антагонистам TRPA1, которые могут быть идентифицированы данными способами скрининга, относятся низкомолекулярные органические соединения и антагонистические антитела, которые специфически ингибируют активность TRPA1 при распознавании механического стимула. Антагонистические антитела TRPA1, предпочтительно моноклональные антитела, могут быть получены, используя способы, хорошо известные в данной области. Например, моноклональные антитела, не являющиеся антителами человека, например антитела мышей или крыс, могут быть получены, например, иммунизацией животного полипептидом TRPA1 или его фрагментом (см., кн. Harlow и Lane: «Antibodies, A Laboratory Manual», изд-во Cold Spring Harbor Laboratory Press, Нью-Йорк, 1988). Такой иммуноген может быть получен из природного источника, пептидным синтезом или рекомбинантной экспрессией.
Новые низкомолекулярные TRPA1 могут быть идентифицированы скринингом исследуемых соединений по способности ингибировать активности ионного канала TRPA1. Для скрининга соединений, которые проявляют антагонизм в отношении сигнальных активностей TRPA1, сначала следует активировать TRPA1. Один из методов, позволяющих это осуществить, заключается в применении холода. Однако такой подход непрактичен при больших объемах скрининга. В способах, описанных в патентной заявке РСТ WO 05/089206, соединение - агонист TRPA1, например брадикинин, эвгенол, гингерол, метилсалицилат, аллицин и циннамальдегид, применяют для активирования TRPA1. Исследуемые соединения затем могут быть подвергнуты скринингу для обнаружения способности блокировать активирование TRPA1 каким-либо из этих агонистов TRPA1 или ингибировать сигнальные активности активированного ионного канала TRPA1.
В качестве примера, способы скрининга настоящего изобретения, обычно включающие контактирование TRPA1-экспрессирующих клеток с исследуемыми соединениями, и выявление соединения, которое устраняет или подавляет биологическую или сигнальную активность активированного TRPA1 в клетках в ответ на механическое воздействие. В клетке TRPA1 может быть активирован добавлением одного из указанных выше соединений - агонистов TRPA1 до, одновременно или после контакта клеток с исследуемыми соединениями. Может проводиться скрининг соединений для выявления способности модулировать поступление в клетки кальция или уровень содержания свободного межклеточного кальция у TRPA1-экспрессирующих клеток или культивируемых нейронов ГЗК в ответ на механический стимул. Ниже в примерах описано, что модулирующее действие исследуемых соединений на TRPA1-опосредованную чувствительность к механическим стимулам, может быть исследовано методом с применением планшет-ридера для флуориметрической визуализации (Fluormetric Imaging Plate Reader - FLIPR), используя TRPA1-экспрессирующие клетки СНО или культивируемые нейроны ГЗК крысы, в ответ на механическое давление (например, сосание) или гиперосмотический стресс. Они также могут быть оценены по способности модулировать токи мембран целых TRPA1 - экспрессирующих клеток, например, путем записи циннамальдегид-индуцированных TRPA1 токов в иссеченных пэтчах ооцитов Xenopus. Предпочтительно эти способы скрининга выполняют в формате высокой пропускной способности. Например, каждое исследуемое соединение может быть приведено в соприкосновение с TRPA1-экспрессирующими клетками в разных лунках планшета для микротитрований. Агонист TRPA1 находится в каждой из этих лунок для активирования TRPA1.
Если исследуемое соединение устраняет или подавляет действие активированных TRPA1 (например, действие ионного канала), исследуемый антагонист или ингибитор TRPA1 является выявленным. В качестве контроля у исследуемого антагониста TRPA1 также исследуют какое-либо воздействие на передачу сигнала или активность ионного канала одного или нескольких других термоТRР каналов, что показано в примерах, приводимых ниже. Это позволяет идентифицировать TRPA1-специфические ингибиторы, которые могут не влиять на нормальные функции других термоТRР каналов. В некоторых вариантах осуществления настоящего изобретения выявленный TRPA1-специфический антагонист может быть дополнительно исследован на применимых моделях животных in vivo, например, путем исследования поведения (изучения отдергивания лапки) крыс или мышей, согласно приводимому ниже описанию в примерах. Дополнительные указания по проведению исследований гипералгезии описаны в литературе, например, Morqrich и др. Science 307, 2005, с.1468, Caterina и др. Science 288, 2000, с.306. В качестве контроля также могут применяться сходные модели животных чтобы удостовериться, что исследуемые TRPA1-специфические антагонисты не оказывают какого-либо существенного воздействия на другие термоТRР in vivo.
К исследуемым соединениям, которые могут быть подвергнуты скринингу для выявления новых модуляторов TRPA1 (например, ингибиторов), относятся полипептиды, миметики с бета-спиралью, полисахариды, фосфолипиды, гормоны, простагландины, стероиды, ароматические соединения, гетероциклические соединения, бензодиазепины, олигомерные N-замещенные глицины, олигокарбаматы, полинуклеотиды (например, ингибиторные нуклеиновые кислоты, например, малые интерферирующие рибонуклеиновые кислоты - миРНК), полипептиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, производные, структурные аналоги или их комбинации. Некоторые исследуемые соединения являются искусственными, другие природными. В некоторых предпочтительных вариантах осуществления настоящего изобретения исследуемые агенты являются низкомолекулярными органическими соединениями (например, соединениями с молекулярной массой примерно не более 500 или 1000). Предпочтительно исследования большой пропускной способности адаптируют и применяют для скрининга таких низкомолекулярных соединений. В некоторых методах комбинаторные библиотеки низкомолекулярных соединений-тестов могут быть легко применимы для скрининга низкомолекулярных модуляторов TRPA1. Ряд исследований в данной области техники может быть легко модифицирован или адаптирован к практике применения методов скрининга настоящего изобретения, например, описанных Schultz и др. в Bioorg Med Chem Lett 8, 1998, сс.2409-2414, Weller и др. Mol Divers. 3, 1997, сс.61-70, Fernandes и др. Curr Opin Chem Biol 2, 1998, сс.597-603, Sittampalam и др. Curr Opin Chem Biol 1, 1997, сс.384-391.
IV. Лечение механической гипералгезии TRPA1-специфическоми ингибиторами
Настоящее изобретение предусматривает способы снижения болевой чувствительности при физиологических и патофизиологических условиях (например, при аллодинии и гипералгезии), особенно восприятия боли, которая связана или опосредована механической чувствительностью через TRPA1. Например, механическая гипералгезия наблюдается при многих медицинских расстройствах. Например, воспаление может индуцировать гипералгезию. Примерами воспалений являются остеоартрит, колит, кардит, дерматит, миозит, неврит, коллагеновые болезни сосудов, например, ревматоидный артрит и волчанка. Субъекты с какими-либо из указанных состояний часто проявляют повышенную чувствительность к боли, причем механическая гипералгезия является составляющей этой чувствительности. К другим медицинским состояниям или процедурам, которые могут вызывать сильную боль, относятся травмы, хирургические вмешательства, ампутации, абсцессы, каузалгия, демиелинизирующие заболевания, тригеминальная невралгия, хронический алкоголизм, удар, синдром таламической боли, диабет, вирусные инфекции, вызывающие рак, и химиотерапия. Механическая чувствительность может играть важную роль в ноцицепции каких-либо из этих состояний.
Обычно способы предусматривают введение субъекту, нуждающемуся в таком лечении, фармацевтической композиции, которая содержит TRPA1-специфический ингибитор настоящего изобретения. TRPA1-специфический ингибитор может применяться отдельно или в соединении с другими известными анальгетическими агентами для облегчения боли у субъекта. Примерами таких известных анальгетических агентов являются морфин и моксонидин (US 6117879). К субъектам, которых можно лечить способами настоящего изобретения, относятся те субъекты, которые болеют механической гиперестезией (особенно гипералгезией), или те субъекты, у которых в медицинском состоянии или расстройстве принимает участие механическая чувствительность. К таким субъектам относятся люди, другие млекопитающие, а также другие субъекты или организмы, которые экспрессируют TRPA1. Субъекты могут находиться в таком состоянии, которое в настоящее время вызывает боль и, вероятно, будут продолжать вызывать боль. Они также были или могут длиться на протяжении процедуры или события, которые обычно имеют болезненные последствия. Например, у субъекта могут быть хронические болезненные состояния, например диабетическая невропатическая гипералгезия или коллагеновая болезнь сосудов. У субъекта также может быть воспаление, повреждение нервов или экспозиция токсином (включая экс