Состав хлорида натрия для восстановления или разбавления лекарственных препаратов
Иллюстрации
Показать всеИзобретение относится к способам получения фармацевтических составов для инъекций. Для предотвращения агглютинации готовый инъекционный фармацевтический состав должен иметь достаточную ионную силу. Для предотвращения гемолиза или сжатия клеток готовый инъекционный фармацевтический состав должен быть примерно изотоническим по отношению к плазме. Способ включает применение растворов хлорида натрия с концентрацией примерно от 25 мМ до 150 мМ для перевода в раствор лиофилизатов (или других фармацевтических составов, не являющихся жидкостями) или для разбавления растворов на основе фармацевтических составов. Полученные составы при введении не вызывают агглютинацию эритроцитов, гемолиз и/или сжатие клеток. 3 н. и 23 з.п. ф-лы, 9 табл., 2 ил.
Реферат
Настоящая заявка испрашивает приоритет на основании заявки США номер 60/732221, поданной 1 ноября 2005 г., описание которой включено в настоящее изобретение во всей полноте посредством ссылки.
Все патенты, заявки на патент и публикации, упоминаемые в настоящей заявке, включены в настоящую заявку во всей полноте посредством ссылки. Полное содержание указанных публикаций включено в настоящую заявку посредством ссылки с тем, чтобы дать более полное представление о существующем уровне техники на дату подачи настоящей заявки с точки зрения специалиста в данной области техники.
Некоторые разделы настоящего документа защищены законом об авторском праве. Правообладатель не возражает против факсимильного воспроизведения данного документа или его частей, в том виде, в котором он представлен в фондах или на носителях Патентного ведомства, однако сохраняет за собой все права на данное изобретение.
При смешении цельной крови с раствором лекарственного препарата, например, в устройстве для внутривенного (IV) введения лекарственного препарата, подходящего для указанного введения, может происходить образование «монетных» столбиков из эритроцитов, или агрегация эритроцитов (также называемая агглютинация красных кровяных телец), если этот раствор лекарственного препарата не обладает достаточной ионной силой. Агрегация эритроцитов наблюдается, например, для 5% раствора декстрозы в воде (обычный раствор для парентерального введения в больших объемах) и для многих других фармацевтических препаратов с низкой ионной силой.
Фармацевтические препараты часто находятся в лиофилизированной форме, поэтому перед парентеральным введением их необходимо восстановить с помощью раствора. Однако, если восстановление лиофилизированных препаратов проводят с помощью растворов с низкой ионной силой, то полученный препарат также может вызывать агрегацию эритроцитов. Несмотря на то, что восстановление лиофилизатов с помощью физиологического раствора (0,9% NaCl), в отличие от стерильной воды для инъекций (sWFI), обеспечивает увеличение ионной силы, полученный раствор лекарственного препарата может быть гипертоническим и при введении оказывать нежелательные побочные эффекты.
Таким образом, необходим раствор, подходящий для восстановления лиофилизатов или разбавления фармацевтических растворов, обеспечивающий получение в результате указанного восстановления или разбавления инъекционного препарата, который является изотоническим по отношению к плазме и обладает ионной силой, достаточной для предотвращения агрегации эритроцитов.
В настоящем изобретении впервые установлено, что агглютинация эритроцитов обусловлена низкой ионной силой растворов, контактирующих с кровью. Таким образом, если фармацевтические составы приготовлены для внутривенного введения путем восстановления или разбавления растворами с низкой ионной силой, такими как 5% раствор декстрозы, 3% раствор декстрана или стерильная вода для инъекций, то осмолярность полученных препаратов может быть достаточной для того, чтобы раствор препарата был по существу изотоническим по отношению к крови, однако ионная сила указанного раствора зачастую недостаточна для предотвращения агглютинации. С другой стороны, если фармацевтические составы подготовлены для внутривенного введения путем восстановления или разбавления растворами с высокой ионной силой, такими как физиологический раствор (0,9% NaCl или 154 мМ NaCl), то ионная сила полученного препарата может быть достаточной для предотвращения агглютинации, однако его осмолярность может быть такой, что полученный состав может являться гипертоническим по отношению к крови, что приводит к дегидратации красных кровяных телец (red blood cells, RBCs), венозному воспалению и/или может приводить к тромбофлебиту, если такие инъекции делают часто или в течение длительного времени.
Согласно одному из аспектов в настоящем изобретении предложен способ получения фармацевтического состава для внутривенного введения. Указанный способ включает добавление к фармацевтическому составу примерно от 25 мМ до 150 мМ раствора хлорида натрия с получением состава, готового для внутривенного введения, при этом полученный состав является по существу изотоническим по отношению к плазме, или слабо гипотоническим или слабо гипертоническим по отношению к плазме, и при этом ионная сила полученного состава является достаточной для предотвращения агглютинации эритроцитов (или агрегации эритроцитов).
Полученный состав является по существу изотоническим по отношению к плазме, например, если его осмолярность составляет примерно от 270 до 330 мОсм/л. Полученный состав является слабо гипотоническим по отношению к плазме, например, если его осмолярность составляет примерно от 220 до 270 мОсм/л. Полученный состав является слабо гипертоническим по отношению к плазме, например, если его осмолярность составляет примерно от 330 до 600 мОсм/л.
Согласно одному из аспектов полученный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, если он содержит, например, по меньшей мере примерно 25 мг-экв/л ионов Na+ и Cl-. Согласно другому аспекту полученный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, если он содержит, например, по меньшей мере примерно 40 мг-экв/л ионов Na+ и Cl-. Согласно другому аспекту полученный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, если он содержит, например, по меньшей мере примерно 40 мг-экв/л ионов Na+ и Cl-, но менее примерно 150 мг-экв/л ионов Na+ и Cl-. Согласно другому аспекту полученный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, если, например, ионная сила указанного раствора соответствует измеренному значению электропроводности, составляющему по меньшей мере примерно 2,5 мСм/см. Согласно другому аспекту полученный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, если, например, его ионная сила соответствует измеренному значению электропроводности, составляющему по меньшей мере примерно 4,0 мСм/см.
Фармацевтический состав, который должен быть приготовлен для инъекционного введения, может представлять собой, например, состав, не являющийся жидкостью, или состав в виде раствора. Соответственно, состав, не являющийся жидкостью, можно восстановить с помощью раствора хлорида натрия с концентрацией примерно от 25 до 150 мМ, от 25 до 100 мМ, от 25 до 80 мМ, от 25 до 40 мМ, от 25 до 35 мМ, от 25 до 30 мМ или примерно 40 мМ. Соответственно, жидкий состав, или состав в виде раствора, можно разбавить раствором хлорида натрия с концентрацией примерно от 25 до 150 мМ, от 25 до 100 мМ, от 25 до 80 мМ, от 25 до 40 мМ, от 25 до 35 мМ, от 25 до 30 мМ или примерно 40 мМ. Состав, не являющийся жидкостью, может представлять собой, например, лиофилизированный состав.
Согласно одному из аспектов настоящего изобретения раствор хлорида натрия, который добавляют к фармацевтическому составу, содержит примерно от 40 до 150 мМ хлорида натрия. Согласно одному из аспектов раствор хлорида натрия, который добавляют к фармацевтическому составу, представляет собой по существу раствор хлорида натрия с концентрацией примерно от 40 до 150 мМ. Согласно одному из аспектов раствор хлорида натрия, который добавляют к фармацевтическому составу, содержит примерно 40 мМ хлорида натрия. Согласно одному из аспектов раствор хлорида натрия, который добавляют к фармацевтическому составу, представляет собой по существу раствор хлорида натрия с концентрацией 40 мМ. Согласно одному из аспектов раствор хлорида натрия, который добавляют к фармацевтическому составу, представляет собой по существу раствор, содержащий раствор хлорида натрия с концентрацией примерно 40 мМ±10 мМ.
Согласно одному из аспектов настоящего изобретения до добавления раствора хлорида натрия фармацевтический состав не содержит значительного количества диссоциирующей соли. Значительным количеством диссоциирующей соли может быть, например, количество более примерно 5 мМ. Согласно другому аспекту значительное количество диссоциирующей соли может составлять, например, количество более примерно 25 мМ. Если фармацевтический состав представляет собой лиофилизированный состав, то указанный состав не содержит значительного количества диссоциирующей соли в случае, если после восстановления водой он содержит, например, не более 5 мМ или 25 мМ диссоциирующей соли.
Согласно одному из аспектов до добавления раствора хлорида натрия фармацевтический состав содержит гистидин, глицин, сахарозу и полисорбат. Согласно другому аспекту до добавления раствора хлорида натрия фармацевтический состав содержит гистидин, глицин, сахарозу, полисорбат и терапевтический белок. Согласно настоящему изобретению указанный терапевтический белок может представлять собой, например, белок, применяемый для лечения нарушений свертываемости крови или при гемостазе, включая без ограничения Фактор VII, Фактор VIII, Фактор IX, Фактор XIII, антитела, аналоги и производные указанных соединений. Согласно другому аспекту до добавления раствора хлорида натрия фармацевтический состав содержит гистидин, глицин, сахарозу, полисорбат и Фактор IX (включая рекомбинантный Фактор IX (rFIX)). Согласно настоящему описанию Фактор IX может включать модифицированные версии Фактора IX, такие как, например, ПЭГилированный Фактор IX, Фактор IX, содержащий слитые белки, например, альбуминсодержащий Фактор IX или Фактор IX, содержащий иммуноглобулин (целый или его домены), и гликозилированный Фактор IX.
Согласно одному из аспектов, где фармацевтический состав представляет собой лиофилизированный состав, этот состав перед добавлением раствора хлорида натрия содержит: (а) примерно от 5 до 30 мМ гистидина; (b) примерно от 0,1 до 0,3 М глицина; (с) примерно от 0,5 до 2% сахарозы; и (d) примерно от 0,001 до 0,05% полисорбата (или примерно от 0,005 до 0,05%), где указанные содержания приведены для состава, восстановленного водой до первоначального объема, т.е. объема состава до лиофилизации. Согласно одному из аспектов указанный состав может дополнительно содержать: (е) примерно от 0,1 до 100 мг/мл или более терапевтического белка, или примерно от 10, 50, 100, 200, 300, 400, 500, 1000, 2000 МЕ/мл (международных единиц/мл) или более терапевтического белка, где указанные содержания приведены для состава, восстановленного водой. Согласно одному из аспектов указанный состав может дополнительно содержать: (е) примерно от 0,1 до 100 мг/мл или более Фактора IX, или примерно от 0,4 до 20 мг/мл Фактора IX, или примерно от 10, 50, 100, 200, 300, 400, 500, 1000, 2000 МЕ/мл или более Фактора IX, где указанные содержания приведены для состава, восстановленного водой.
Согласно одному из аспектов в настоящем изобретении предложен способ предотвращения агглютинации эритроцитов, вызванной внутривенным введением. Указанный способ включает восстановление или разбавление фармацевтического состава с помощью примерно от 25 до 150 мМ раствора хлорида натрия, при этом восстановленный или разбавленный фармацевтический состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов при внутривенном введении указанного восстановленного или разбавленного фармацевтического состава пациенту.
Согласно одному из аспектов в настоящем изобретении предложен способ подготовки лиофилизированного фармацевтического состава с получением фармацевтического состава, готового для внутривенного введения. Указанный способ включает восстановление лиофилизированного фармацевтического состава с помощью примерно от 25 до 150 мМ раствора хлорида натрия, при этом после восстановления указанный состав обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов, и осмолярностью, соответствующей примерно изотоническому (или слабо гипертоническому, или слабо гипотоническому) раствору.
Согласно одному из аспектов лиофилизированный состав восстанавливают раствором хлорида натрия, при этом объем раствора хлорида натрия, применяемого для восстановления, меньше, чем объем указанного состава до лиофилизации (то есть меньше объема наполнения (fill volume)). Таким образом, в настоящем изобретении предложен способ уменьшения объема состава, предназначенного для введения.
Согласно одному из аспектов лиофилизированный состав восстанавливают раствором хлорида натрия, при этом объем раствора хлорида натрия, применяемого для восстановления, больше объема указанного состава до лиофилизации (то есть больше объема наполнения). Таким образом, в настоящем изобретении предложен способ обеспечения изотоничности состава, предназначенного для введения.
Например, лиофилизированный состав может быть восстановлен с помощью раствора хлорида натрия, объем которого больше, чем объем указанного состава до лиофилизации. Например, восстановление осуществляют с помощью 5 мл хлорида натрия, в то время как объем состава до лиофилизации составлял 4 мл. Например, лиофилизированный состав объемом 4 мл, восстановленный с помощью 4 мл воды, представляет собой изотонический раствор, содержащий 10 мМ гистидина, 260 мМ глицина, 1% сахарозы, 0,005% полисорбата, что соответствует осмолярности примерно 300 мОсм/л. Однако если этот лиофилизированный состав восстановить с помощью 4 мл 40 мМ раствора NaCl (80 мОсм/л), то полученный состав будет представлять собой слабо гипертонический раствор (300 мОсм/л + 80 мОсм/л = 380 мОсм/л). Если этот лиофилизированный состав восстановить с помощью 5 мл 40 мМ раствора NaCl, то полученный раствор будет содержать примерно 8 мМ (8 мОсм/л) гистидина, 208 мМ (208 мОсм/л) глицина, 0,8% (24 мОсм/л) сахарозы, 0,004% (пренебрежимо малая осмолярность) полисорбата и 40 мМ (80 мОсм/л) NaCl, что составляет примерно 320 мОсм/л. Таким образом, согласно настоящему изобретению при восстановлении предварительно лиофилизированного состава, который является по существу изотоническим, раствором хлорида натрия, объем которого превышает объем наполнения, полученный раствор также является по существу изотоническим. Другими словами, при восстановлении предварительно лиофилизированного состава, который является по существу изотоническим, раствором хлорида натрия, объем которого меньше или примерно равен объему наполнения, полученный раствор может являться слабо гипертоническим. Чтобы избежать этого, в настоящем изобретении предложен способ обеспечения изотоничности путем восстановления лиофилизированного состава раствором хлорида натрия, объем которого превышает объем указанного состава до лиофилизации.
Согласно одному из аспектов в настоящем изобретении предложен способ обеспечения изотоничности лиофилизированного состава после восстановления. Указанный способ включает восстановление лиофилизированного состава до объема, по меньшей мере на 20% превышающего объем указанного состава до лиофилизации, при этом указанный состав до лиофилизации является по существу изотоническим, и восстановленный состав является по существу изотоническим и обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов. При восстановлении лиофилизированного состава до объема, превышающего объем указанного состава до лиофилизации, вклад осмолярности лиофилизата в осмолярность восстановленного состава снижается прямо пропорционально увеличению объема состава, полученного после восстановления, по сравнению с объемом состава до лиофилизации. Например, при восстановлении состава, тоничность которого до лиофилизации составляла 300 мОсм/л при объеме X, с помощью раствора объемом Y, превышающим на 20% объем X, осмолярность восстановленного раствора объемом Y становится равной 240 мОсм/л вместо исходных 300 мОсм/л (20% снижение осмолярности из-за 20% увеличения объема). Если раствор объемом Y представляет собой раствор хлорида натрия, то вклад раствора хлорида натрия в тоничность равен удвоенной концентрации хлорида натрия в этом растворе. Например, если раствор объемом Y имеет концентрацию 40 мМ, то тоничность восстановленного раствора составляет 240 мОсм/л плюс 80 мОсм/л, и, таким образом, восстановленный раствор является по существу изотоническим и обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов.
Согласно одному из аспектов в настоящем изобретении предложен способ получения лиофилизированного состава на основе Фактора IX для внутривенного введения. Указанный способ включает добавление примерно от 25 до 150 мМ раствора хлорида натрия к лиофилизированному составу Фактора IX с получением состава, готового для внутривенного введения, при этом полученный состав является по существу изотоническим по отношению к плазме, или слабо гипотоническим, или слабо гипертоническим по отношению к плазме, и обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов. Согласно одному из аспектов лиофилизированный состав на основе Фактора IX содержит: (а) примерно от 5 до 30 мМ гистидина; (b) примерно от 0,1 до 0,3 М глицина; (с) примерно от 0,5 до 2% сахарозы; (d) примерно от 0,001 до 0,05% полисорбата; и (е) примерно от 0,4 до 20 мг/мл Фактора IX, или примерно от 0,1 до 100 мг/мл или другое растворимое количество Фактора IX, или примерно от 10 до 500 МЕ/мл Фактора IX, или примерно от 10 до 5000 МЕ/мл Фактора IX, где указанные содержания приведены для состава, восстановленного водой. Согласно одному из аспектов к лиофилизированному составу на основе Фактора IX добавляют примерно 40 мМ раствор хлорида натрия. Согласно одному из аспектов к лиофилизированному составу на основе Фактора IX добавляют примерно 5 мл примерно 40 мМ раствора хлорида натрия. Согласно одному из аспектов лиофилизированный состав на основе Фактора IX содержит примерно 10 мМ гистидина, примерно 0,26 М глицина, примерно 1% сахарозы и примерно 0,005% полисорбата, где указанные содержания приведены для состава, восстановленного водой.
Согласно одному из аспектов в настоящем изобретении предложен фармацевтический набор, содержащий: (а) ампулу, содержащую лиофилизат, раствор которого, полученный путем восстановления указанного лиофилизата примерно 5 мл воды, содержит: (i) примерно от 5 до 30 мМ гистидина; (ii) примерно от 0,1 до 0,3 мМ глицина; (iii) примерно от 0,5 до 2% сахарозы; (iv) примерно от 0,001 до 0,05% полисорбата; и (v) примерно от 0,4 до 20 мг/мл Фактора IX, или примерно от 0,1 до 100 мг/мл или другое растворимое количество Фактора IX, или примерно от 50 до 500 МЕ/мл Фактора IX, или примерно от 10 до 5000 МЕ/мл Фактора IX; (b) примерно от 25 до 150 мМ раствор хлорида натрия; и (с) инструкции по восстановлению лиофилизата раствором хлорида натрия, при этом после восстановления полученный раствор является по существу изотоническим и обладает ионной силой, достаточной для предотвращения агрегации эритроцитов при внутривенном введении.
Согласно одному из аспектов в настоящем изобретении предложен фармацевтический набор, содержащий: (а) ампулу, содержащую лиофилизат, раствор которого, полученный при восстановлении указанного лиофилизата 4 мл воды, содержит: (i) примерно 10 мМ гистидина; (ii) примерно 0,26 М глицина; (iii) примерно 1% сахарозы; (iv) примерно 0,005% полисорбата 80; и (v) примерно от 50 до 5000 МЕ/мл Фактора IX; (b) примерно 40 мМ раствор хлорида натрия; и (с) инструкции по восстановлению лиофилизата в ампуле с помощью примерно 5 мл примерно 40 мМ раствора хлорида натрия, при этом раствор, полученный после восстановления, содержит: (i) примерно от 7 или 8 примерно до 10 мМ гистидина; (ii) примерно от 200 до 210 мМ глицина; (iii) примерно от 0,7 до 0,9% сахарозы; (iv) примерно 0,004% полисорбата 80; (v) примерно от 50 до 5000 МЕ/мл Фактора IX; и (vi) примерно 40 мМ NaCl.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
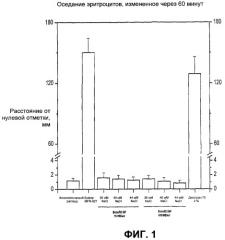
На Фиг.1 представлены значения оседания эритроцитов, полученные в ходе экспериментов, описанных в Примере 3. Оседание эритроцитов измеряли через 60 минут, используя вариант модифицированного метода Вестергрена (Westergren) (см. Пример 2), согласно которому человеческую кровь, собранную в ЭДТА, смешивали в соотношении 1:4 с исследуемыми растворами. Через 60 минут измеряли расстояние в миллиметрах от нулевой отметки до поверхности раздела эритроциты/плазма. Горизонтальные отрезки представляют среднее значение, а вертикальные скобки - стандартное отклонение для группы из 12 доноров. Результаты были получены в ходе 4-х независимых экспериментов, каждый из которых проводили с использованием крови 3-х доноров.
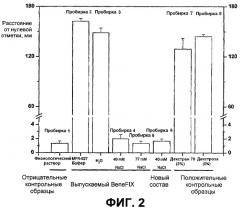
На Фиг.2 представлена оценка оседания эритроцитов для составов BeneFIX®, восстановленных растворами NaCl. 40 мМ раствора NaCl достаточно для предотвращения агглютинации эритроцитов при восстановлении как выпускаемого в настоящее время продукта BeneFIX®, так и нового состава BeneFIX® (BeneFIX®-R, где до лиофилизации объем раствора составлял 4 мл и раствор содержал 10 мМ гистидина, 260 мМ глицина, 1% сахарозы, 0,005% полисорбата 80; а после лиофилизации указанный раствор был восстановлен в 5 мл 40 мМ хлорида натрия, при этом после восстановления BeneFIX®-R содержал 40 мМ NaCl, 8 мМ гистидина, 208 мМ глицина, 0,8% сахарозы и 0,004% полисорбата).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены способы получения фармацевтических составов для инъекций (в частности, препаратов, подготовленных для внутривенных инъекций), которые не вызывают агглютинации эритроцитов, гемолиза и/или сжатия клеток. Для предотвращения агглютинации готовый к инъекции фармацевтический состав должен обладать достаточной ионной силой. Для предотвращения гемолиза или сжатия клеток готовый к инъекции фармацевтический состав должен быть по существу изотоническим по отношению к плазме. В настоящем изобретении предложены способы получения фармацевтических составов для инъекций, при этом указанные составы обладают ионной силой, достаточной для предотвращения агглютинации, и тоничностью, необходимой для предотвращения значительного гемолиза или дегидратации или сжатия клеток. Предложенные способы включают использование раствора хлорида натрия с концентрацией примерно от 25 до 150 мМ для восстановления лиофилизатов (или других фармацевтических составов, не являющихся жидкостью), или для разбавления растворов фармацевтических составов. При использовании указанных растворов хлорида натрия для восстановления или разбавления добавление конкретных растворов хлорида натрия обеспечивает получение фармацевтического препарата для инъекций, который является по существу изотоническим по отношению к плазме или крови и обладает ионной силой, достаточной для предотвращения агрегации эритроцитов при инъекции, в частности, при внутривенной инъекции.
Термины
Согласно настоящему описанию «моляльность» раствора представляет собой число молей растворенного вещества на килограмм растворителя.
Согласно настоящему описанию «молярность» раствора представляет собой число молей растворенного вещества в литре раствора.
Согласно настоящему описанию «осмоль» представляет собой количество вещества, которое, в случае идеального раствора, образует такое количество частиц (число Авогадро), что способно понижать температуру замерзания растворителя на 1,86 K.
Согласно настоящему описанию «осомоляльность» раствора представляет собой число осмолей растворенного вещества на килограмм растворителя. Осмоляльность является мерой количества частиц, присутствующих в растворе, и не зависит от размера или массы этих частиц. Осмоляльность можно измерить только путем измерения свойства раствора, которое зависит только от концентрации частиц. К таким свойствам относятся понижение давления паров, понижение температуры замерзания, повышение температуры кипения и осмотическое давление, именуемые в целом коллигативными свойствами.
Согласно настоящему описанию «осмолярность» раствора представляет собой число осмолей растворенного вещества в литре раствора.
Согласно настоящему описанию «фармацевтический состав», который подготовлен для инъекции, может представлять собой любое лекарственное средство, предназначенное для введению субъекту. Например, фармацевтический состав может представлять собой лиофилизат, раствор, порошок или твердое вещество. Этот состав, если он не находится в жидкой форме, переводят в раствор с помощью раствора NaCl согласно настоящему изобретению. Если состав находится в жидкой форме, то этот состав разбавляют раствором NaCl согласно настоящему изобретению или смешивают с ним.
Ионная сила
Ионная сила является характеристикой раствора электролита (жидкости, содержащей растворенные положительно и отрицательно заряженные ионы). Обычно ее выражают как среднюю величину электростатического взаимодействия между ионами электролита. Ионная сила электролита равна половине суммы произведений моляльности (количества вещества на единицу массы растворителя) каждого из ионов на квадрат его валентности.
Ионная сила тесно связана с концентрацией электролитов и указывает, насколько эффективно заряд, имеющийся на конкретном ионе, экранирован или стабилизирован другими ионами в электролите (так называемая ионная атмосфера). Основным различием между ионной силой и концентрацией электролита является то, что ионная сила возрастает с увеличением заряда ионов. Например, ионная сила раствора полностью диссоциированного (распавшегося на ионы) сульфата магния (Mg2+SO4 2-) в 4 раза превышает ионную силу раствора хлорида натрия (Na+Cl-) той же концентрации. Другим отличием между этими двумя величинами является то, что ионная сила выражает концентрацию свободных ионов, а не просто количество соли, добавленное в раствор. Иногда соль может находиться в растворенном состоянии, но соответствующие ионы могут быть по-прежнему попарно связаны друг с другом наподобие незаряженных молекул в растворе. В этом случае ионная сила будет намного ниже, чем концентрация соли.
Согласно настоящему изобретению фармацевтические препараты для инъекций получают таким образом, чтобы они были не только изотоничными, но также обладали ионной силой, достаточной для предотвращения агглютинации красных кровяных телец. Достаточная ионная сила препарата, готового для инъекции (то есть лиофилизата, восстановленного раствором NaCl согласно настоящему изобретению, или раствора лекарственного средства, разбавленного раствором NaCl согласно настоящему изобретению) может обеспечиваться, например, при содержании ионов Na+ и Cl-, составляющем по меньшей мере примерно 25 миллиграмм-эквивалентов на литр (мЭкв/л). Согласно одному из вариантов реализации достаточная ионная сила обеспечивается при содержании ионов Na+ и Сl-, составляющем по меньшей мере примерно 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или по меньшей мере примерно 40 мЭкв/л.
Ионная сила также может быть выражена через электропроводность раствора. Электропроводность представляет собой способность материала или раствора проводить электрический ток. Принцип, на котором основано инструментальное измерение электропроводности, прост - две пластины помещают в образец, между этими пластинами прикладывают потенциал (обычно синусоидальное напряжение), и измеряют ток. Электропроводность (G), которая обратно пропорциональна сопротивлению (R), определяют на основании значений напряжения и тока по закону Ома: G=I/R=I (амперы)/Е (вольты).
Так как заряд находящихся в растворе ионов облегчает прохождение электрического тока, электропроводность раствора пропорциональна концентрации ионов в растворе. Однако в некоторых случаях электропроводность может не коррелировать прямо с концентрацией. Однако для растворов хлорида натрия электропроводность прямо пропорциональна концентрации ионов. Основной единицей электропроводности является сименс (См), который раньше называли «мо». Так как геометрия испытуемого образца влияет на значение электропроводности, стандартизованные измерения выражаются в единицах удельной электропроводности (См/см), чтобы учесть различия в геометрии электродов. Удельная электропроводность (С) является произведением измеренной электропроводности (G) и постоянной электродной ячейки (L/A), где L представляет собой длину столба жидкости между электродами, а А представляет собой площадь электродов. С=G×(L/A). Если постоянная ячейки равна 1 см-1, то удельная электропроводность будет равна измеренной электропроводности раствора. Хотя форма электродов может быть различной, электрод всегда можно представить в виде эквивалентной теоретической ячейки.
Таким образом, согласно одному из вариантов реализации достаточная ионная сила препарата, готового для инъекции, может соответствовать электропроводности, равной, например, по меньшей мере примерно 4 мСм/см или выше. Согласно другому варианту реализации достаточная ионная сила раствора, готового для инъекции, соответствует удельной электропроводности, составляющей по меньшей мере примерно 2,5; 2,6; 2,7; 2,8; 2,9; 3,0; 3,1; 3,2; 3,3; 3,4; 3,5; 3,6; 3,7; 3,8 или по меньшей мере примерно 3,9 мСм/см.
Для пояснения термина «достаточная ионная сила» можно также использовать эмпирическое определение, согласно которому раствор обладает достаточной ионной силой, если его ионная сила достаточна для предотвращения агглютинации эритроцитов. Вывод о том, является ли ионная сила достаточной, может быть сделан, например, на основании эксперимента, в ходе которого к цельной крови добавляют испытуемый раствор и определяют расстояние, на которое оседают эритроциты (см. Пример 2; адаптированный модифицированный метод Вестергрена). Согласно одному из вариантов реализации, если при смешении испытуемого раствора с цельной кровью в соотношении 4:1 оседание эритроцитов через 60 минут составляет менее 10 мм (см., например, Пример 2, Фиг.1 и 2), то испытуемый раствор обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов. Согласно другому варианту реализации, если при смешении испытуемого раствора с цельной кровью в соотношении 4:1 оседание эритроцитов через 60 минут составляет менее примерно 5 мм, то испытуемый раствор обладает ионной силой, достаточной для предотвращения агглютинации эритроцитов.
Осмолярность раствора
Способы согласно настоящему изобретению обеспечивают получение фармацевтических препаратов для инъекций, которые являются по существу изотоническими по отношению к крови. Для того чтобы определить, является ли фармацевтический препарат по существу изотоническим по отношению к крови, рассчитывают осмолярность всех химических компонентов раствора, включая растворитель. Осмолярная концентрация фармацевтических препаратов для инъекций (парентеральных растворов) может оказывать неблагоприятное воздействие на клетки крови и сосуды человеческого тела. Для жидкостей и растворенных или разбавленных лекарственных препаратов можно рассчитать тоничность, которая выражается количеством миллиосмолей на литр жидкости (мОсм/л). Эта величина известна также как осмолярность. Осмолярность крови составляет от 285 до 310 мОсм/л. Если в кровь вводят гипотонические или гипертонические растворы, жидкость переходит внутрь клеток или из них, что может вызвать ряд негативных эффектов.
Осмолярность раствора основана, в частности, на теории осмоса и осмотического давления. Осмос представляет собой диффузию растворенных веществ (растворенных частиц) или перенос жидкости через полунепроницаемые мембраны, такие как стенки сосудов или клеточные мембраны. Осмотическое давление, которое способствует переносу молекул через мембраны, выражают через осмолярную концентрацию и подразделяют на гипоосмотическое (гипотоническое), изоосмотическое (изотоническое) или гиперосмотическое (гипертоническое) по сравнению с биологическими жидкостями, такими как кровь или плазма. Термины «тоничность» и «осмотическое давление» часто являются синонимами.
Осмотическое давление представляет собой гидростатическое (или гидравлическое) давление, необходимое для того, чтобы противостоять движению воды через полунепроницаемую мембрану, возникающее в ответ на «осмотический градиент» (то есть различие концентраций частиц с двух сторон мембраны). Осмоляльность сыворотки крови можно измерить с помощью осмометра, или же ее можно рассчитать как сумму концентраций растворенных веществ, присутствующих в растворе. Величина, измеренная в лабораторных условиях, обычно называется осмоляльностью. Величина, рассчитанная на основании концентраций растворенных веществ, в лаборных отчетах указывается как осмолярность. Осмотическая разность представляет собой разность между этими двумя величинами.
В настоящем описании тоничность и осмотическое давление считают синонимами и трактуют широко. Тоничность может означать эффективную осмоляльность и равна сумме концентраций растворенных веществ в растворе, способном оказывать осмотическое давление на мембрану, включая клеточную мембрану. Строго говоря, осмоляльность является свойством конкретного раствора и не зависит от мембраны. Тоничность представляет собой свойство раствора по отношению к конкретной мембране. Однако настоящее изобретение относится к растворам, которые являются изотоническими по отношению к биологическим растворам, таким как кровь или плазма, что означает, что конкретный раствор является изотоническим с кровью или плазмой по отношению к клеточной мембране клетки, содержащейся в крови или плазме, или в другом биологическом растворе.
Для пояснения указанного термина можно использовать эмпирическое определение тоничности, основанное на результате, наблюдаемом в ходе эксперимента, согласно которому испытуемый раствор добавляют к цельной крови. Если красные кровяные тельца в цельной крови набухают и разрываются, то говорят, что испытуемый раствор является гипотоническим по сравнению с нормальной плазмой. Если красные кровяные тельца сжимаются и становятся зазубренными, то говорят, что испытуемый раствор является гипертоническим по сравнению с нормальной плазмой. Если красные кровяные тельца остаются без изменения, то говорят, что испытуемый раствор является изотоническим относительно плазмы. Клеточная мембрана красных кровяных телец является мембраной сравнения. Например, цельная кровь, помещенная в физиологический раствор (то есть 0,9% раствор хлорида натрия), не набухает, и следовательно, можно сказать, что физиологический раствор является изотоническим.
Характеристики изотонических растворов
В настоящем изобретении предложены способы получения или подготовки фармацевтических составов для инъекций субъекту, при этом указанные составы получают в виде растворов, которые являются (1) по существу изотоническими по отношению к крови (или плазме, или другой биологической жидкости), или же являются не настолько гипертоническими или гипотоническими, чтобы вызывать значительный гемолиз, тромбоз или раздражение сосудов, и (2) обладают ионной силой, достаточной для предотвращения агрегации эритроцитов.
Согласно одному из примеров реализации тоничность или осмолярность изотонических (по отношению к крови) фармацевтических составов, готовых для инъекций, составляет более примерно 270 мОсм/л и менее примерно 330 мОсм/л. Согласно одному из вариантов реализации тоничность или осмолярность изотонических фармацевтических составов, готовых для инъекции, составляет более примерно 270 мОсм/л и менее примерно 328 мОсм/л.
Хотя такие растворы, как 0,9% раствор хлорида натрия и 5% раствор декстрозы, являются изотоническими, при использовании их для восстановления или разбавления многих фармацевтических составов ионная сила полученного раствора может быть недостаточной для предотвращения агглютинации эритроцитов (как в случае 5% раствора декстрозы), или слишком высокой, так что полученный раствор является гипертоническим. Таким образом, согласно способам, предложенным в настоящем изобретении, для разбавления или восстановления используют растворы с минимальным содержанием хлорида натрия с обеспечением (а) ионной силы, достаточной для уменьшения агрегации эритроцитов, и (b) тоничности, достаточной для предотвращения гемолиза, и растворы с максимальным содержанием хлорида натрия с обеспечением (с) суммарной тоничности, которая не настолько велика, чтобы растворы были гипертоническими. Кроме того, способы согласно настоящему изобретению предусматривают использование для разбавления или восстановления