Моноклональные антитела и их применения
Иллюстрации
Показать всеИзобретение относится к биотехнологии и иммунологии. Предложено моноклональное антитело, которое связывается с глобуломером Аβ, содержащее CDRs тяжелой и легкой цепи. Описаны композиция для диагностики болезни Альцгеймера, а также композиция и вакцина для профилактики или лечения болезни Альцгеймера на основе антитела. Раскрыто применение антитела для получения лекарственного средства по тому же назначению. Описаны варианты способа диагностики болезни Альцгеймера, набор для диагностики болезни Альцгеймера на основе антитела. Использование изобретения обеспечивает новые антитела к глобуломеру Аβ, которые выявляют более избирательно Аβ (1-42), чем известные антитела. 8 н. и 8 з.п. ф-лы, 10 ил., 1 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее изобретение относится к моноклональным антителам (например, 8F5 и 8C5), которые можно применять, например, для профилактики, лечения и диагностики болезни Альцгеймера или других нейродегенеративных расстройств.
Известный уровень техники
Болезнь Альцгеймера (AD) является нейродегенеративным заболеванием, характеризуемым прогрессирующей потерей когнитивных способностей и характерными нейропатологическими признаками, включая отложения амилоида, нейрофибриллярные клубки и утрату нейронов в некоторых областях головного мозга, см. Hardy and Selkoe (Science 297, 353 (2002); Mattson (Nature 431, 7004 (2004)). Основными составляющими амилоидных отложений являются амилоидные бета-пептиды (Aβ), при этом наиболее известным является тип пептида длиной в 42 аминокислоты (Aβ1-42).
В частности, амилоидный белок β(1-42) является полипептидом, имеющим 42 аминокислоты, который происходит из белка-предшественника амилоида (APP) в результате протеолитического процессинга. Указанный белок, кроме человеческих вариантов, включает также изоформы амилоидного белка β(1-42), присутствующего в других организмах, отличных от человека, в частности других млекопитающих, в частности в организме крысы. Указанный белок, который склонен к полимеризации в водной среде, может присутствовать в самых разных молекулярных формах.
Простая корреляция отложения нерастворимого белка с наличием или прогрессированием связанных с деменцией расстройств, таких, например, как болезнь Альцгеймера, оказалась не доказанной (Terry et al., Ann. Neurol. 30. 572-580 (1991); Dickson et al., Neurobiol. Aging 16, 285-298 (1995)). Напротив, утрата синапсов и когнитивного восприятия, по-видимому, лучше коррелирует с растворимыми формами Aβ(1-42) (Lue et al., Am. J. Pathol. 155, 853-862 (1999); McLean et al., Ann. Neurol. 46, 860-866 (1999)).
Хотя ранее были получены поликлональные и моноклональные антитела против Aβ(1-42), не одно из них, как было доказано, не дает требуемого терапевтического эффекта, не вызывая также серьезных побочных эффектов у животных и/или человека. Например, результаты пассивной иммунизации, полученные в доклинических исследованиях на очень старых мышах APP23, которые получали направленное на N-конце анти-Aβ(1-42)-антитело один раз в неделю в течение 5 месяцев, показывают терапевтически значимый побочный эффект. В частности, у таких мышей наблюдали увеличение количества и тяжести микрогеморрагий по сравнению с мышами, которых лечили физиологическим раствором (Pfeifer et al., Science 2002 298: 1379). Недавно описано также сходное увеличение геморрагии у очень старых (>24 месяцев) мышей Tg2576 и PDAPP (Wilcock et al., J. Neuroscience 2003, 23: 3745-51; Racke et al., J. Neuroscience 2005, 25: 629-636). У обеих линий инъекция анти-Aβ(1-42) приводила к значительному увеличению микрогеморрагий. Таким образом, существует огромная терапевтическая необходимость в разработке биологических средств, которые предотвращают или замедляют прогрессирование заболевания, не проявляя негативных и потенциально летальных эффектов в организме человека. Такая необходимость особенно очевидна в виду увеличения продолжительности жизни в общей популяции и связанного с таким увеличением возрастания количества пациентов, у которых ежегодно диагностируют болезнь Альцгеймера. Кроме того, такие антитела позволят правильно диагностировать болезнь Альцгеймера у пациентов, испытывающих симптомы такого заболевания, диагноз которого в настоящее время может быть подтвержден только при аутопсии. Кроме того, антитела позволят выяснять биологические свойства белков и других биологических факторов, ответственных за такое истощающее заболевание.
Все патенты и публикации, упоминаемые в данном описании, таким образом, включены в виде ссылки в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к изолированному антителу, которое связывается с глобуломером амилоидного бета-(Aβ)-белка с более высокой специфичностью, чем с мономером амилоидного бета-белка. Таким образом, наблюдается предпочтительное связывание. Антитело может представлять собой, например, моноклональное антитело, такое как 8F5 или 8C5. Отношение специфичности связывания с глобуломером по сравнению с мономером составляет по меньшей мере 1,4. В частности, отношение предпочтительно составляет по меньшей мере от примерно 1,4 до меньшей мере примерно 16,9. (Отношение 1,0-17,5, включая конечные точки) также входит в объем настоящего изобретения, так же как их десятые доли. Например, 1,1, 1,2, 1,3, .., 2,0, 2,1, 2,2.., 17,1, 17,2, 17,3, 17,4, 17,5, а также все целые числа меду ними и их доли входят в объем настоящего изобретения.) Мономер бета-амилоидного белка может представлять собой, например, мономер Aβ(1-42) или мономер Aβ(1-40).
Кроме того, настоящее изобретение также охватывает моноклональное антитело (называемое в данном описании «8F5»), продуцируемое гибридомой, имеющей номер PTA-7238 в Американской коллекции типовых культур, а также гибридому, которая продуцирует такое моноклональное антитело (т.е. 8F5). Также настоящее изобретение относится к моноклональному антителу (называемому в данном описании «8C5»), продуцируемому гибридомой, имеющей номер A-7407 в Американской коллекции типовых культур PT, а также к гибридоме, которая продуцирует такое моноклональное антитело (т.е. 8C5).
Кроме того, настоящее изобретение относится к моноклональному антителу, содержащему вариабельную тяжелую цепь, кодируемую последовательностью SEQ ID NO: 1. Такое антитело может быть мышиным, человеческим или гуманизированным.
Кроме того, настоящее изобретение относится к моноклональному антителу, содержащему вариабельную легкую цепь, кодируемую последовательностью SEQ ID NO: 2. Такое антитело также может быть мышиным, человеческим или гуманизированным. Антитело может дополнительно содержать вариабельную тяжелую цепь, кодируемую последовательностью SEQ ID NO: 1, и может быть человеческим или гуманизированным.
Кроме того, настоящее изобретение относится к моноклональному антителу, содержащему последовательность SEQ ID NO: 3. Антитело может быть мышиным, человеческим или гуманизированным.
Кроме того, настоящее изобретение охватывает моноклональное антитело, содержащее последовательность SEQ ID NO: 4. Такое антитело может быть мышиным, человеческим или гуманизированным. Такое антитело дополнительно может содержать последовательность SEQ ID NO: 3 и может быть мышиным, человеческим или гуманизированным.
Дополнительно, настоящее изобретение относится к моноклональному антителу, содержащему вариабельную тяжелую цепь, кодируемую последовательностью SEQ ID NO: 11. Такое антитело может быть мышиным, человеческим или гуманизированным.
Кроме того, настоящее изобретение относится к моноклональному антителу, содержащему вариабельную легкую цепь, кодируемую последовательностью SEQ ID NO: 12. Такое антитело также может быть мышиным, человеческим или гуманизированным. Антитело дополнительно может содержать вариабельную тяжелую цепь, кодируемую последовательностью SEQ ID NO: 11 и может быть человеческим или гуманизированным.
Кроме того, настоящее изобретение относится к моноклональному антителу, содержащему последовательность SEQ ID NO: 19. Антитело может быть мышиным, человеческим или гуманизированным.
Кроме того, настоящее изобретение охватывает моноклональное антитело, содержащее последовательность SEQ ID NO: 20. Такое антитело может быть мышиным, человеческим или гуманизированным. Такое антитело дополнительно может содержать последовательность SEQ ID NO: 19 и может быть мышиным, человеческим или гуманизированным.
Настоящее изобретение также относится к изолированному антителу, которое связывается с глобуломером бета-амилоидного белка с более высокой специфичностью, чем с фибриллой бета-амилоидного белка. Такое антитело может быть, например, моноклональным и может быть моноклональным антителом, продуцируемым гибридомой, имеющей номер PTA-7243 в Американской коллекции типовых культур, или гибридомой, имеющей номер PTA-7407 в Американской коллекции типовых культур. Гибридомы, продуцирующие такие моноклональные антитела, также входят в объем настоящего изобретения.
Кроме того, настоящее изобретение относится к антителу, в котором по меньшей мере одна из областей, определяющих комплементарность (CDR), вариабельной тяжелой цепи выбрана из группы, состоящей из последовательностей SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7.
Кроме того, настоящее изобретение также относится к антителу, в котором по меньшей мере одна из CDR вариабельной легкой цепи выбрана из группы, состоящей из SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10. Такое антитело дополнительно может содержать по меньшей мере одну CDR вариабельной тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7.
Настоящее изобретение также относится к антителу, в котором по меньшей мере одна из CDR вариабельной тяжелой цепи выбрана из группы, состоящей из SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15.
Кроме того, настоящее изобретение также охватывает антитело, в котором по меньшей мере одна из CDR вариабельной легкой цепи выбрана из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 17 и SEQ ID NO: 18. Такое антитело дополнительно может содержать по меньшей мере одну CDR вариабельной тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 13, SEQ ID NO: 14 и SEQ ID NO: 15.
Кроме того, настоящее изобретение охватывает способ лечения или профилактики болезни Альцгеймера у пациента, нуждающегося в таком лечении или профилактике. Такой способ включает в себя введение любого одного или нескольких изолированных антител, описанных выше, пациенту в количестве, достаточном для осуществления лечения или профилактики.
Изолированное антитело может быть введено, например, путем, выбранным из группы, состоящей из внутримышечного введения, внутривенного введения и подкожного введения.
Настоящее изобретение также относится к способу диагностирования болезни Альцгеймера у пациента, у которого предполагается наличие такого заболевания. Указанный способ включает в себя стадии: 1) выделения биологического образца из организма пациента; 2) осуществления контакта биологического образца по меньшей мере с одним из антител, описанных выше, в течение периода и в условиях, достаточных для образования комплексов антиген/антитело; и 3) выявления наличия комплексов антиген/антитело в указанном образце, при этом присутствие комплексов свидетельствует о диагнозе болезни Альцгеймера у пациента. Антигеном может быть, например, глобуломер, или его часть, или фрагмент, которые обладают такими же функциональными свойствами, что и полный глобуломер (например, активностью связывания).
Кроме того, настоящее изобретение относится к другому способу диагностирования болезни Альцгеймера у пациента, у которого предполагается наличие такого заболевания. Указанный способ включает в себя стадии: 1) выделения биологического образца из организма пациента; 2) осуществления контакта биологического образца с антигеном в течение периода и в условиях, достаточных для образования комплексов антитело/антиген; 3) добавления конъюгата к полученным в результате комплексам антитело/антиген в течение периода и в условиях, достаточных для того, чтобы обеспечить возможность для связывания конъюгата со связанным антителом, при этом конъюгат содержит одно из антител, описанных выше, связанное с генерирующим сигнал соединением, способным генерировать регистрируемый сигнал; и 4) выявления наличия антитела, которое может присутствовать в биологическом образце, посредством регистрации сигнала, создаваемого генерирующим сигнал соединением, при этом сигнал свидетельствует о диагнозе болезни Альцгеймера у пациента. Антигеном может быть глобуломер, или его часть, или фрагмент, обладающие такими же функциональными свойствами, как и полный глобуломер (например, активностью связывания).
Настоящее изобретение относится к дополнительному способу диагностирования болезни Альцгеймера у пациента, у которого предполагается наличие болезни Альцгеймера. Такой способ включает в себя стадии: 1) выделения биологического образца из организма пациента; 2) осуществление контакта биологического образца с анти-антителом, при анти-антитело специфично по отношению к одному из антител, описанных выше, в течение периода и в условиях, достаточных для обеспечения образования комплексов анти-антитело/антитело, при этом комплексы содержат антитело, присутствующее в биологическом образце; 2) добавления конъюгата к полученным в результате комплексам анти-антитело/антитело в течение периода и в условиях, достаточных для обеспечения связывания конъюгата со связанным антителом, при этом конъюгат содержит антиген, который связывается с генерирующим сигнал соединением, способным генерировать регистрируемый сигнал; и 3) выявления сигнала, создаваемого генерирующим сигнал соединением, при этом сигнал свидетельствует о диагнозе болезни Альцгеймера у пациента.
Кроме того, настоящее изобретение относится к композиции, содержащей любое одно или несколько антител, описанных выше (например, 8F5 и 8C5).
Настоящее изобретение относится к другому способу профилактики или лечения болезни Альцгеймера у пациента, нуждающегося в такой профилактике или лечении. Такой способ включает в себя стадию введения пациенту композиции, описанной непосредственно выше, в количестве, достаточном для осуществления профилактики или лечения.
Кроме того, настоящее изобретение охватывает вакцину, содержащую по меньшей мере одно из антител, описанных выше, и фармацевтически приемлемый адъювант.
Кроме того, настоящее изобретение относится к следующему способу профилактики или лечения болезни Альцгеймера у пациента, нуждающегося в такой профилактике или лечении. Такой способ включает в себя стадию введения пациенту вакцины, указанной выше, в количестве, достаточном для осуществления профилактики или лечения.
Кроме того, настоящее изобретение охватывает способ идентификации соединений, подходящих для активной иммунизации пациента, у которого предполагается развитие болезни Альцгеймера. Такой способ включает в себя: 1) экспонирование одного или нескольких представляющих интерес соединений с одним или несколькими антителами, описанными выше, в течение периода и в условиях, достаточных для связывания одного или нескольких соединений с антителом или антителами; 2) идентификацию таких соединений, которые связываются с антителом или антителами, идентифицированные соединения могут быть использованы для активной иммунизации пациента, у которого предполагается развитие болезни Альцгеймера.
Также настоящее изобретение относится к набору, содержащему: a) по меньшей мере одно из изолированных антител, описанных выше, и b) конъюгат, содержащий антитело, связанное с генерирующим сигнал соединением, при этом антитело в конъюгате отличается от изолированного антитела. Набор также может содержать вкладыш в упаковку с инструкциями о том, как использовать компоненты набора.
Настоящее изобретение также охватывает набор, содержащий: a) анти-антитело к одному из антител, описанных выше, и b) конъюгат, содержащий антиген, связанный с генерирующим сигнал соединением. Антиген может представлять собой глобуломер, или его фрагмент, или часть, обладающие такими же функциональными свойствами, как и глобуломер (например, активность связывания). И, кроме того, набор также может содержать вкладыш в упаковку с инструкциями о том, как использовать компоненты набора.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует избирательность 8F5 в отношении глобуломеров по сравнению с мономерами Aβ(1-42), Aβ(1-40) и sAPP. Коэффициенты избирательности для 8F5 могут быть рассчитаны в виде отношений между значениями EC50 (по сравнению с мономером Aβ(1-42) в HFIP: 555,8/90,74 = 6,1; по сравнению с мономером Aβ(1-42) в NH4OH: 1007/90,74 = 11,1; по сравнению с мономером Aβ(1-40): 667,8/90,74 = 7,4 по сравнению с sAPP: >100).
Фигура 2 иллюстрирует анализ в SDS-ПААГ связанных с фибриллами тяжелых и легких цепей антител (дорожки 4, 6, 8) и соответствующих несвязанных свободных фракций (дорожки 3, 5, 7) в надосадках.
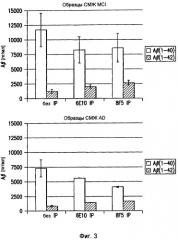
Фигура 3 иллюстрирует содержание Aβ42 и Aβ40 в образцах спинномозговой жидкости (СМЖ) пациентов с умеренными когнитивными нарушениями (MCI, слева) или болезнью Альцгеймера (AD, справа). В обеих группах можно видеть, что 8F5 улавливает большую часть Aβ(1-42) и меньшее или равное количество Aβ(1-40) по сравнению со стандартным антителом 6E10 или по сравнению с прямым анализом образца в тех же самых анализах ELISA.
Фигура 4 иллюстрирует индекс распознавания новых объектов, основанный на затраченном времени, с использованием неизвестного объекта по сравнению с известным объектом в трех группах трансгенных мышей APP (т.е. 6G1, 8F5, PBS) и одной группе нетрансгенного потомства одного помета (дикий тип). Животных (количество указано под столбиками) иммунизировали моноклональными антителами 6G1 или 8F5 или обрабатывали наполнителем (т.е. фосфатно-солевым буфером; PBS, и дикий тип) один раз в неделю посредством внутрибрюшинной инъекции в течение трех недель. В день последней инъекции выполняли задачу распознавания нового объекта. Различие между группами «PBS» и «дикий тип» свидетельствует о нарушении когнитивной способности у трансгенных мышей APP в данной модели. Мыши, которым инъецировали PBS, выполняли задачу на уровне случайности (т.е. не значимое отличие от 50), тогда как все другие мыши показали распознавание объектов (t-критерий; звездочки). В том случае, когда выполнение задачи трансгенными мышами APP, обработанными антителами, сравнивали с контрольными группами, обнаружили значимое отличие по сравнению с мышами, обработанными PBS, но не по сравнению с мышами дикого типа (ANOVA с апостериорным t-критерием; кружки), что свидетельствует о том, что обработка антителами восстанавливала нарушенную когнитивную способность у указанных трансгенных мышей APP.
Фигура 5(A) иллюстрирует последовательность ДНК (SEQ ID NO: 1), кодирующей вариабельную тяжелую цепь моноклонального антитела, называемого в данном описании «8F5», и фигура 5(B) иллюстрирует последовательность ДНК (SEQ ID NO: 2), кодирующую вариабельную легкую цепь моноклонального антитела 8F5. (Определяющие комплементарность области (CDR) подчеркнуты в каждой последовательности; см. также фигуру 6.)
Фигура 6(A) иллюстрирует аминокислотную последовательность (SEQ ID NO: 3) вариабельной тяжелой цепи моноклонального антитела 8F5, и Фигура 6(B) иллюстрирует аминокислотную последовательность (SEQ ID NO: 4) вариабельной легкой цепи моноклонального антитела 8F5. Одна CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью SYGMS (SEQ ID NO: 5). Другая CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью ASINSNGGSTYYPDSVKG (SEQ ID NO: 6), и еще одна CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью SGDY (SEQ ID NO: 7). Одна CDR вариабельной легкой цепи представлена аминокислотной последовательностью RSSQSLVYSNGDTYLH (SEQ ID NO: 8). Другая CDR вариабельной легкой цепи представлена аминокислотной последовательностью KVSNRFS (SEQ ID NO: 9), и еще одна CDR вариабельной легкой цепи представлена аминокислотной последовательностью SQSTHVPWT (SEQ ID NO: 10). Все описанные выше CDR подчеркнуты на фигуре 6(A) и 6(B).
На фигуре 7 показано связывание антител в различных концентрациях с поперечными срезами неокортекса головного мозга у пациентов с болезнью Альцгеймера (AD) или у старых трансгенных мышей APP. В частности, фигура 7(A) иллюстрирует исследование амилоидных отложений посредством окрашивания Конго красным в виде бляшек в ткани головного мозга и в виде церебральной амилоидной ангиопатии (CAA) в сосудах головного мозга у трансгенных мышей APP линии Tg2576 и у пациентов с AD (RZ55). Фигура 7(B) иллюстрирует, что окрашивание паренхимных отложений Aβ (амилоидные бляшки) у пациентов с AD (RZ16) происходит только в случае 6G1 и коммерчески доступного антитела 6E10, тогда как 8F5 и 8C5 дают значительно более слабое окрашивание. Фигура 7(C) иллюстрирует, что сильное окрашивание паренхимных отложений Aβ (амилоидные бляшки) у мышей TG2576 происходит только в случае 6G1 и коммерчески доступного антитела 6E10, тогда как 8F5 и 8C5 дают значительно более слабое окрашивание. Фигуры 7 (D)-(G) иллюстрируют количественный анализ окрашивания бляшек Aβ на гистологических изображениях с использованием анализа изображений. Значения оптической плотности (0% = нет окрашивания) рассчитывали на основании значений серой шкалы для бляшек, из которых вычитали значения серой шкалы для фоновой ткани. (Фиг. (D)= связывание 0,7 мкг/мл антитела у мышей Tg2576; фиг. (E)= связывание 0,07-0,7 мкг/мл антитела у мышей APP/L; фиг. (F)= связывание 0,7 мкг/мл антитела у пациента с AD (RZ55); и фиг. (G)= связывание 0,07-0,7 мкг/мл антитела у пациента с AD (RZ16).) Различия между окрашиванием коммерчески доступных антител 6E10 (звездочки) и 4G8 (кружочки) и антител 6G1, 8C5 и 8F5 (одна звездочка/кружочек: p <0,05, две звездочки/кружочка: p <0,01, и три звездочки/кружочка: p <0,001 по сравнению с контролем; апостериорный t-критерий Бонферрони после ANOVA с p < 0,001) были оценены статистически (фиг. (D) и фиг. (E)). На фиг. (E) и (G) антитела 8C5 и 8F5 всегда давали значимо менее интенсивное окрашивание, чем коммерчески доступные антитела 6E10 и 4G8 (p <0,05 на основании оценки апостериорного t-критерия после p <0,001 в ANOVA). Фигура (H) иллюстрирует, что интенсивное окрашивание сосудистых отложений Aβ (стрелки) происходит только в случае 6G1 и коммерчески доступного антитела 6E10, тогда как окрашивание 8F5 или 8C5 было намного слабее. Количественно сходная ситуация обнаружена у мышей Tg2576 (не показано).
Фигура 8 иллюстрирует избирательность 8C5 по отношению к глобуломерам по сравнению с мономерами Aβ(1-42), Aβ(1-40) и sAPP. Коэффициенты избирательности для 8C5 можно рассчитать в виде отношений между значениями EC50 (по сравнению с мономером Aβ(1-42) в HFIP: 2346/568,2 = 4,1; по сравнению с мономером Aβ(1-42) в NH4OH: >100; по сравнению с мономером Aβ(1-40): >100; по сравнению с sAPP: >100).
Фигура 9(A) иллюстрирует нуклеотидную последовательность (SEQ ID NO: 11), кодирующую тяжелую цепь 8C5, и фигура 9(B) иллюстрирует нуклеотидную последовательность (SEQ ID NO: 12), кодирующую легкую цепь 8C5. Нуклеотидные последовательности, кодирующие соответствующие CDR, указанные на фигуре 10(A) и 10(B), подчеркнуты.
Фигура 10(B) иллюстрирует аминокислотную последовательность (SEQ ID NO: 19) вариабельной тяжелой цепи моноклонального антитела 8C5, и Фигура 10(B) иллюстрирует аминокислотную последовательность (SEQ ID NO: 20) вариабельной легкой цепи моноклонального антитела 8F5. Одна CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью SYGMS (SEQ ID NO: 13). Другая CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью SIKNNGGSTYYPDSLKG (SEQ ID NO: 14), и еще одна CDR вариабельной тяжелой цепи представлена аминокислотной последовательностью SGDY (SEQ ID NO: 15). Одна CDR вариабельной легкой цепи представлена аминокислотной последовательностью RSSQSLVHSNGDTFLH (SEQ ID NO: 16). Другая CDR вариабельной легкой цепи представлена аминокислотной последовательностью KVSNRFS (SEQ ID NO: 17), и еще одна CDR вариабельной легкой цепи представлена аминокислотной последовательностью SQSIHVPWT (SEQ ID NO: 18). Все описанные выше CDR подчеркнуты на фигуре 10(A) и 10(B).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к моноклональному антителу, называемому в данном описании «8F5», а также к другим родственным антителам (например, 8C5). Такие антитела могут быть использованы, например, для диагностики, профилактики и лечения болезни Альцгеймера и других нейродегенеративных расстройств.
Моноклональное антитело 8F5, а также моноклональное антитело 8C5 обладают множеством интересных свойств, которые делают их очень интересными кандидатами для использования в терапии, а также очень полезными кандидатами для использования в диагностике. Например, моноклональные антитела 8F5 и 8C5 предпочтительно связываются с глобуломерами Aβ(1-42) по сравнению с мономерами или фибрилами.
Термин «Aβ(X-Y)» в данном описании относится к аминокислотной последовательности от положения аминокислоты X до положения аминокислоты Y белка β-амилоида человека, включая X и Y, и, в частности, относится к аминокислотной последовательности от положения аминокислоты X до положения аминокислоты Y аминокислотной последовательности DAEFRHDSGY EVHHQKLVFF AEDVGSNKGA IIGLMVGGW IA или любого из встречающихся в природе вариантов, в частности вариантов по меньшей мере с одной мутацией, выбранной из группы, состоящей из A2T, H6R, D7N, A21G («Фламандская»), E22G («Арктическая»), E22Q («Голландская»), E22K («Итальянская»), D23N («Айова»), A42T и A42V, где номера указаны относительно стартового положения пептида Aβ, включая положение X и положение Y, или последовательности, имеющей до трех дополнительных аминокислотных замен, ни одна из которых не может предотвращать образование глобуломера. «Дополнительную» аминокислотную замену определяют в данном описании как любое отклонение от канонической последовательности, которое не встречается в природе.
Более конкретно, термин «Aβ(1-42)» в данном описании относится к аминокислотной последовательности от положения аминокислоты 1 до положения аминокислоты 42 белка β-амилоида человека, включая аминокислоты 1 и 42, и, в частности, относится к аминокислотной последовательности от положения аминокислоты 1 до положения аминокислоты 42 аминокислотной последовательности DAEFRHDSGY EVHHQKLVFF AEDVGSNKGA IIGLMVGGW IA (соответствующей положениям аминокислот 1-42) или любому из ее встречающихся в природе вариантов. Такие варианты могут представлять собой, например, варианты по меньшей мере с одной мутацией, выбранной из группы, состоящей из A2T, H6R, D7N, A21G («Фламандская»), E22G («Арктическая»), E22Q («Голландская»), E22K («Итальянская»), D23N («Айова»), A42T и A42V, где номера указаны относительно начала пептида Aβ, включая 1 и 42, или последовательность, имеющую до трех дополнительных аминокислотных замен, ни одна из которых не может предотвращать образование глобуломера. Подобным образом, термин «Aβ(1-40)» в данном описании относится к аминокислотной последовательности от положения аминокислоты 1 до положения аминокислоты 40 белка β-амилоида человека, включая 1 и 40, и, в частности, относится к аминокислотной последовательности от положения аминокислоты 1 до положения аминокислоты 40 аминокислотной последовательности DAEFRHDSGY EVHHQKLVFF AEDVGSNKGA IIGLMVGGW или ее любого встречающегося в природе варианта. Такие варианты включают, например, варианты по меньшей мере с одной мутацией, выбранной из группы, состоящей из A2T, H6R, D7N, A21G («Фламандская»), E22G («Арктическая»), E22Q («Голландская»), E22K («Итальянская») и D23N («Айова»), где номера указаны относительно стартового положения пептида Aβ, включая 1 и 40, или последовательность, содержащую до трех дополнительных аминокислотных замен, ни одна из которых не может предотвращать образование глобуломера.
Термин «глобуломер Aβ(X-Y)» (также известный как глобулярный олигомер «Aβ(X-Y)») в данном описании относится к растворимой, глобулярной, нековалентной ассоциации пептидов Aβ(X-Y), которые определены выше, обладающей гомогенностью и особыми физическими свойствами. Глобуломеры Aβ(X-Y) являются стабильными, нефибриллярными, олигомерными сборными структурами пептидов Aβ(X-Y), которые можно получить при инкубации с анионными детергентами. В отличие от мономера и фибрилл такие глобуломеры характеризуются определенным количеством субъединиц в сборке (например, формы ранней сборки, n = 3-6, олигомеры «олигомеры A», и формы поздней сборки, n = 12-14, «олигомеры B», которые описаны в публикации международной заявки PCT No. WO 04/067561). Глобуломеры имеют 3-мерную структуру глобулярного типа («расплавленная глобула», см. Barghorn et al., 2005, J. Neurochem., 95, 834-847). Они могут быть охарактеризованы одним или несколькими из следующих признаков:
- возможность отщепления N-концевых аминокислот X-23 протеазами, которые делают случайный выбор (такими как термолизин или эндопротеиназа GluC), с получением укороченных форм глобуломеров Aβ(X-Y);
- недоступность C-концевых аминокислот 24-Y для делающих случайный выбор протеаз и антител; и
- укороченные формы таких глобуломеров Aβ(X-Y) сохраняют 3-мерную структуру кора глобуломеров с лучшей доступностью эпитопа кора Aβ(20-Y) в конформации глобуломера.
Согласно изобретению и, в частности, в целях оценки аффинностей связывания антител согласно настоящему изобретению термин «глобуломер Aβ(X-Y)» в данном описании относится к продукту, который может быть получен способом, описанным в публикации международной заявки No. WO 04/067561, которая включена в данное описание в виде ссылки в полном объеме. Способ включает в себя разворачивание природного, рекомбинантного или синтетического пептида Aβ(X-Y) или его производного; воздействие на по меньшей мере частично развернутый пептид Aβ(X-Y) или его производное детергентом, уменьшение действия детергента и продолжение инкубации.
В целях разворачивания пептида можно обеспечить воздействие на белок агентов, разрушающих водородные связи, таких, например, как гексафторизопропанол (HFIP). Время действия в течение нескольких минут, например приблизительно от 10 до 60 минут, достаточно, когда температура действия составляет примерно от 20 до 50ºC и, в частности, примерно от 35 до 40ºC. Последующее растворение остатка, полученного после упаривания досуха, предпочтительно в концентрированной форме в подходящих органических растворителях, смешиваемых с водными буферами, такими как, например, диметилсульфоксид (ДМСО), дает суспензию по меньшей мере частично развернутого пептида или его производного, которую можно использовать позже. При необходимости исходную суспензию можно хранить при низкой температуре, например при температуре около -20ºC в течение необходимого периода времени.
Альтернативно пептид или его производное может находиться в слегка подкисленном, предпочтительно водном растворе, например в водном растворе примерно 10 мМ HCl. После инкубационного периода времени, составляющего приблизительно несколько минут, нерастворимые компоненты удаляют центрифугированием. Подходящим является центрифугирование в течение нескольких минут при 10000. Указанные стадии способа предпочтительно осуществляют при комнатной температуре, т.е. при температуре в диапазоне от 20 до 30ºC. Надосадок, полученный после центрифугирования, содержит пептид Aβ(X-Y) или его производное, и его можно хранить при низкой температуре, например при температуре около -20ºC в течение необходимого периода времени.
Следующая экспозиция с детергентом имеет отношение к олигомеризации пептида или его производного с получением промежуточного типа олигомеров (в публикации международной заявки No. WO 04/067561 называемых олигомерами A). В указанных целях обеспечивают возможность воздействия детергента на необязательно по меньшей мере частично развернутый пептид или его производное вплоть до получения достаточного количества промежуточного олигомера. Предпочтительно применение ионных детергентов, в частности анионных детергентов.
Согласно конкретному варианту используют детергент формулы (I):
R-X,
в которой радикал «R» означает неразветвленный или разветвленный алкил, имеющий от 6 до 20 и предпочтительно от 10 до 14 атомов углерода, или неразветвленный или разветвленный алкенил, имеющий от 6 до 20 и предпочтительно от 10 до 14 атомов углерода, а радикал «X» означает кислотную группу или ее соль, при этом X предпочтительно выбран из -COO-M+, -SO3 -M+ и наиболее предпочтительно -OSO3 -M+, и M+ означает катион водорода или неорганический или органический катион, предпочтительно выбранный из катионов щелочных металлов, катионов щелочноземельных металлов и катионов аммония. Наиболее предпочтительными являются детергенты формулы (I), в которых R означает неразветвленный алкил, из которых, в частности, следует упомянуть алк-1-ильные радикалы. Особенно предпочтительным является додецилсульфат натрия (SDS). Также предпочтительно могут быть использованы лауриновая кислота и олеиновая кислота. Также особенно предпочтительной является натриевая соль детергента лауроилсаркозина (также известная как саркозил-NL-30 или Gardol®).
Время действия детергента, в частности, зависит от того, развернут ли, и если развернут, то в какой степени, пептид или его производное, подвергаемое олигомеризации. Если в соответствии с протоколом стадии разворачивания пептид или его производное обработали заранее агентом, разрывающим водородные связи (т.е., в частности, гексафторизопропанолом), то достаточно время действия в диапазоне нескольких часов, преимущественно примерно от 1 до 20 и, в частности, примерно от 2 до 10 часов, когда температура во время действия составляет примерно от 20 до 50ºC и, в частности, примерно от 35 до 40ºC. Если исходной точкой является менее развернутый или по существу неразвернутый пептид или его производное, то, соответственно, необходимы более длительные периоды времени действия. Если пептид или его производное были предварительно обработаны, например, согласно способу, указанному выше в качестве альтернативы обработке HFIP, или указанный пептид или его производное непосредственно подвергают олигомеризации, то достаточным является время действия в диапазоне примерно от 5 до 30 часов и, в частности, примерно от 10 до 20 часов, когда температура во время действия составляет примерно от 20 до 50ºC и, в частности, примерно от 35 до 40ºС. После инкубации нерастворимые компоненты преимущественно удаляют центрифугированием. Достаточно центрифугирование в течение нескольких минут при 10000 g.
Выбираемая концентрация детергента зависит от используемого детергента. Если используют SDS, то подходящей оказывается концентрация в диапазоне от 0,01 до 1% мас., предпочтительно от 0,05 до 0,5% мас., например около 0,2% мас. Если используют лауриновую кислоту или олеиновую кислоту, то необходимы несколько более высокие концентрации, например в диапазоне от 0,05 до 2% мас., предпочтительно от 0,1 до 0,5% мас., например около 0,5% мас. Действие детергента должно происходить при концентрации соли примерно в физиологическом диапазоне. Таким образом, подходящими являются, в частности, концентрации NaCl в диапазоне от 50 до 500 мМ, предпочтительно от 100 до 200 мМ и более конкретно примерно 140 мМ.
Последующее уменьшение действия детергента и продолжение инкубации связано с последующей олигомеризацией с получением глобуломера Aβ(X-Y) согласно изобретению (называемого в публикации международной заявки No. WO 04/067561 олигомером B). Так как композиция, получаемая на предшествующей стадии, обычно содержит детергент и концентрацию соли в физиологическом диапазоне, то затем требуется уменьшить действие детергента, а также предпочтительно уменьшить концентрацию соли. Это можно осуществить посредством уменьшения концентрации детергента и соли, например, соответствующим образом разбавляя водой или буфером с низкой концентрацией соли, например трис-HCl, pH 7,3. Показано, что подходящими являются коэффициенты разбавления в диапазоне примерно от 2 до 10, преимущественно в диапазоне примерно от 3 до 8 и, в частности, примерно 4. Уменьшения действия детергента также можно достичь добавлением веществ, которые могут нейтрализовать такое действие детергента. Примеры веществ включают такие вещества, которые способны к образованию комплексов с детергентами, подобные веществам, способным стабилизировать клетки в процессе очистки и экстракции, в частности, например блок-сополимеры EO/PO, в частности блок-сополимер, продаваемый под торговой маркой Pluronic® F 68. В равной мере могут быть использованы алкоксилированные и, в частности, этоксилированные алкилфенолы, такие как этоксилированные t-оксилфенолы серии Triton® X, в частности тритон X100, 3-(3-холамидопропилдиметиламмонио)-1-пропансульфонат (CHAPS®), или алкоксилированные и, в частности, этоксилированные сложные эфиры жирной кислоты и сорбитана, такие как эфиры серии Tween®, в частности твин 20, в диапазоне концентраций около или выше конкретной критической концентрации мицеллообразования.
Затем раствор инкубируют вплоть до образования достаточного количества глобуломера Aβ(X-Y). Достаточным является время действия в диапазоне нескольких часов, предпочтительно в диапазоне примерно от 10 до 30 часов и, в частности, в диапазоне примерно от 15 до 25 часов, когда температура во время действия составляет примерно от 20 до 50ºC и, в частности, примерно от 35 до 40ºC. Затем раствор можно концентрировать, и возможный остаток может быть удален центрифугированием. Также достаточно центрифугирование в течение нескольких минут при 10000 g. Надосадок, полученный после центрифу