Рекомбинантный полипептид со свойствами плазминогена человека превращаться при активации в плазмин, который катализирует расщепление фибрина, фрагмент днк, кодирующий полипептид, рекомбинантная плазмидная днк для экспрессии полипептида и трансформированная клетка escherichia coli - продуцент полипептида
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению аналогов плазминогена человека, и может быть использовано в медицине. Генно-инженерным путем получают в клетках Escherichia coli рекомбинантные полипептиды со свойствами плазминогена человека, содержащие каталитический домен плазминогена, 5-ый крингл-домен плазминогена и видоизмененный фрагмент аминокислотной последовательности, предшествующий 5-му крингл-домену плазминогена. Изобретение позволяет получить полипептиды с высокой фибринолитической активностью плазминогена человека и выходом 50-80% при экспрессии в клетках Escherichia coli. 4 н. и 3 з.п. ф-лы, 1 ил.
Реферат
Изобретение относится к области биотехнологии, генетической и белковой инженерии, т.е. к технологии получения белков с видоизмененными природными или новыми свойствами.
Более конкретно, настоящее изобретение относится к рекомбинантным полипептидам со свойствами плазминогена человека, что предполагает возможность их использования для создания фибринолитических лекарственных средств.
Изобретение относится также к последовательностям ДНК, которые кодируют новые полипептиды со свойствами плазминогена человека, рекомбинантным плазмидным ДНК, содержащими кодирующие новые полипептиды последовательности ДНК, а также трансформированным клеткам Escherichia coli - продуцентам новых полипептидов со свойствами плазминогена человека.
Тромбозы и их лечение - очень острая проблема в медицине. Тромбоз - образование внутрисосудистых сгустков крови, препятствующих нормальному кровотоку. Тромбоз в системе коронарного кровообращения ведет к инфаркту миокарда, тромбоз сосудов мозга - к инсульту. При отрыве тромба может произойти эмболия - внезапная закупорка сосудистого русла оторвавшимся кусочком тромба. Клиническая практика последних десятилетий свидетельствует о продолжающемся нарастании количества тромбозов и эмболии магистральных сосудов, их тяжелых осложнений. (Bramlage P. et al., Current concepts for the prevention of venous Thromboembolism, European Journal of Clinical Investigation (2005) 35, (Suppl. 1), pp.4-11). Международная статистика такова: на 100000 человек приходится 150 случаев тромбоза глубоких вен в год. Диагностика и лечение таких больных пока неудовлетворительны; доказательством этого является высокая смертность больных - по литературным данным от 20 до 35%, и высокая частота ампутаций конечностей по поводу гангрены, достигающая почти 20% (Савельев B.C., Ангиографическая диагностика и рентгеноэндоваскулярная хирургия неотложных состояний. М., 1986, с.7). Не менее чем у 600 тыс. человек развивается тромбоэмболия легочной артерии. При тромбоэмболии легочной артерии (ТЭЛА) летальность среди нелеченных пациентов достигает 40%, тогда как при проведении своевременной терапии она не превышает 10%. ТЭЛА стала ведущей причиной материнской смертности в экономически развитых странах. Большое количество мозговых инсультов в неврологии - следствие эмболии тромбами. По статистике на втором месте причиной смерти больных со злокачественными опухолями стоят тромбозы.
Проблема лечения инфаркта миокарда также остается одной из наиболее актуальных проблем медицины и здравоохранения, ибо касается около 0,2% населения ежегодно. Несмотря на введение тромболитической терапии (ТЛТ) в стандартную практику лечения в большинстве промышленно развитых стран мира (значительно снизившей госпитальную смертность от инфаркта миокарда), общая смертность от инфаркта достигает 45%, а госпитальная 15%. (Sayer J.W et al., Prognostic implications of ventricular fibrillation in acute myocardial infarction: new strategies required for further mortality reduction; Heart, 2000, 84, pp.258-261). Применение, в основном на догоспитальном этапе, активаторов плазминогена таких как «Актилиза», «Тенектеплаза» (Германия, Берингер) на основе рекомбинантного tPA (тканевого активатора плазминогена) или «Пуролаза» (Россия, экспериментальное предприятие ФГУ «РКНПК Росмедтехнологий») на основе рекомбинантного uPA (урокиназного активатора плазминогена), двух естественных активаторов плазминогена, весьма эффективно при условии быстрого (до 3-6 часов) применения после возникновения окклюзии.
При других тромбозах больные обращаются к врачу, как правило, когда применение активаторов плазминогена уже малоэффективно. Более того, удаление протяженных и застарелых тромбов требует неоднократного введения активатора плазминогена и поддержание его концентрации на уровне, значительно превышающем физиологический, в течение длительного времени. Это приводит к изменению общего гемостаза: индукции ингибиторов активаторов плазминогена РАI1 и PAI2 и истощению содержания плазминогена, альфа-2 антиплазмина и др., что естественно приводит к неэффективности повторных введений активаторов плазминогена из-за, в частности, отсутствия субстрата для активатора плазминогена. Естественное восстановление концентрации этих компонент происходит за 24 часа.
Препарата, в полной мере пригодного для локального растворения протяженных тромбов, на мировом рынке пока нет.
Для восстановления кровотока необходимо растворить фибриновые нити, из которых состоит тромб. Растворение тромба, происходит оно физиологически или фармакологически, обусловлено в конце концов активной короткоживущей сериновой протеазой плазмином. В нормальных физиологических условиях плазминоген, синтезируемый в печени, циркулирует в кровотоке и лимфотоке в концентрации около 1-2 мкМ, в два раза меньшей, чем концентрация основного необратимого ингибитора плазмина альфа-2 антиплазмина. Плазминоген в отличие от плазмина полностью устойчив к альфа-2 антиплазмину. Плазмин получается из плазминогена, циркулирующего в плазме гликопротеина, с помощью активаторов: tPA, стрептокиназы, uPa .
Все ныне применяющиеся тромболитические агенты - активаторы плазминогена. Их свойства позволяют им эффективно работать на относительно небольших тромбах в коронарных артериях (инфаркт миокарда). Однако их недостаток - зависимость от концентрации плазминогена - проявляется, когда тромб протяженный, а доставка плазминогена из кровотока нарушена. Такие тромбы обычно бывают при окклюзии периферических артерий или при тромбозе глубоких вен. Фактически, в этом случае системное введение активаторов плазминогена неэффективно для растворения этих массивных тромбов. Более эффективна местная доставка с помощью катетера. В тех случаях когда тромбы обрабатывают локально с помощью катетера, традиционные тромболитики (такие, как активаторы плазминогена), по-видимому не являются лучшими лекарствами для этой цели, растворение проходит малоэффективно и длительно, и представляется заманчивым применение прямого тромболитика. Плазмин проявляет прямую фибринолитическую активность, не требуя плазминогена или плазминоген-активатора. По сравнению с плазминоген-активаторами эта независимость от эндогенного плазминогена позволяет плазмину эффективно растворять протяженные образования.
Активный плазмин рассматривали как тромболитический агент еще полстолетия назад. Впервые опробованный более 40 лет назад, плазмин оказался неэффективным при внутривенном введении, так как нейтрализовался антиплазмином плазмы. Непосредственная доставка плазмина к тромбу через катетер предотвращает нейтрализацию плазмина и он проявляет свою тромболитическую активность, однако технические сложности по доставке препарата прямо к тромбу в то время привели к отказу от этого направления. Плазмин, который получали из плазмы крови человека, был недостаточно чистым, в нем была примесь стрептокиназы или трипсина, которые превращали плазминоген в плазмин, существовала опасность контаминации препарата вирусами. Наконец, выделенный плазмин был нестабилен и разлагался на всех стадиях выделения, хранения и применения. Быстрая инактивация препарата существующим в крови избытком альфа-2 антиплазмина позволяло использование этих препаратов для локального применения, например, в офтальмологии. С развитием методов малоинвазивной хирургии возобновился интерес к применению плазмина в качестве тромболитика. Идея ведения прямого тромболизиса активными протеиназами с недавних пор стала очень привлекательной для фармацевтических компаний. Появились сообщения о создании штаммов-продуцентов рекомбинантного плазминогена человека, а также различных мутантных форм этого белка (Nagai N. Recombinant human microplasmin production and potencial therapeutic properties, Thrombosis and Haemostasis, 2003, v.1, pp.307-313) с целью обработки периферических тромбозов и для очистки тромбированных инструментов, таких как петля-катетер, и синтетических сосудистых трансплантатов. Начаты работы по применению кислотозащищенных препаратов плазмина для фибринолиза, особенно при тромбоэмболиях сонной артерии, на лабораторных животных.
Исследование препарата на кроликах показало, что плазмин в отличие от тканевого активатора плазминогена не вызывает геморрагии, плазмин имеет 6-кратный запас безопасности в отличие от тканевого активатора плазминогена, который вызывает геморрагию в тромболитической концентрации. Плазмин вызывает кровотечения, лишь когда полностью исчерпаны факторы коагуляции, что можно определить для каждого больного аналитически, таким образом предсказав вероятность осложнений (Novokhamy V.V. et al., Locally delivered plasmin: why should it be superior to plasminogen activators for direct thrombolysis, Trends Pharmacol. Sci., 2004, 25(2), pp.72-75; ShIansky-Goldberg R.D. et al., A first-in-human phase I trial of locally delivered human plasmin forhemodialysis graft occlusion. Thrombosis and Haemostasis, 2008, 6(6), pp.944-950).
Таким образом, плазмин более пригоден и более безопасен, чем активаторы плазминогена при растворении протяженных кровяных тромбов у человека. Его единственным ожидаемым недостатком является очень короткое время жизни в кровотоке. Поскольку плазмин является активным ферментом, производить и хранить его значительно удобнее в виде плазминогена, активируя непосредственно перед применением или в процессе применения.
Природный плазминоген состоит из каталитического домена (предшественника сериновой протеазы), пяти крингл-доменов и аминотерминального фрагмента. После протеолитической активации соответствуюшей протезазой-активатором каталитический домен превращается в активную протеазу - плазмин, гидролизующую фибрин тромба или некоторые белки межклеточного матрикса до растворимых пептидных фрагментов. Аминотерминальный фрагмент и крингл-домены обеспечивают специфичность плазминогена (и образующегося из него плазмина) именно к фибрину.
Человеческий плазминоген имеет последовательность, состоящую их 791 аминокислоты, без сигнального пептида, отрезаемого при секреции (http://www.uniprot.org/uniprot/P00747: Forsgren M. et al., Molecular cloning and characterization of a full-length cDNA clone for human plasminogen, FEBS Lett. 1987, v. 213,pp.254-260).
Природный не модифицированный плазминоген может быть выделен из плазмы донорской крови. Однако это трудоемкий и дорогостоящий процесс, базирующийся на дефицитном сырье, к тому же чреватый вирусным заражением.
Получение природного плазминогена в культуре клеток человека дорого и также требует постоянного внимания в отношении вирусов.
Плазминоген из рогатого скота биохимически похож на человеческий, но иммуногенен, и также остается опасность вирусного заражения.
Поэтому предпочтительным решением оказывается продукция плазминогена в клетках микроорганизмов, например, в клетках Escherichia coli.
Известны различные рекомбинантные модифицированные варианты природного плазминогена. Так, в патенте США №5,688,644 сайт активации, по которому происходит расщепление молекулы плазминогена активаторами плазминогена, заменен участком, который расщепляется тромбином. А в патенте США №5,637,495 сайт активации заменен участком, который расщепляется тромбином или Фактором Ха. Описаны аналоги природного плазминогена, имеющие такие замены в сайте активации, которые позволяют катализировать расщепление одним из следующих ферментов, вовлеченных в процесс тромбообразования: калликреин. Факторы XIIa, XIa, IXa, VIIa, Ха, тромбин или активированный белок С (Европейский патент №0502968). Все вышеописанные варианты модифицированного плазминогена по свойствам мало отличаются от фермента плазмина, а вот по развитию кинетики активации во времени и пространстве они совершенно иные. Эти варианты модифицированного плазминогена нацелены на лизис свежеобразующихся (а не застарелых) тромбов. Кроме того, они не являются прямыми аналогами человеческого плазминогена и функционально они ближе даже к антикоагулянтам, нежели к фибринолитикам.
Вследствие сложной структуры полноразмерной молекулы природного человеческого плазминогена (каталитический домен, 5 крингл-доменов, каждый из которых содержит по 3 дисульфидных связи, аминотерминальный домен и пр.) затруднительно использовать бактериальную систему экспрессии для производства этого белка: плазминоген, получаемый в виде нерастворимых телец включения, плохо поддается рефолдингу, выход низок, реконструкция не эффективна.
Домены плазминогена достаточно автономны. Так, каталитический домен, отщепляемый в результате автопротеолиза in vitro, может быть активированным, после чего обладает каталитической активностью полного плазминогена, но лишен способности специфически связываться с фибрином (Wu H L. et al., Structure and formation of microplasmin, Proc. Natl. Acad. Sci. USA, 1987, 84(24), pp.8793-8795). Он получил название микроплазминогена и имеет последовательность, состоящую из 249 аминокислот (с 543 по 791 АК последовательности плазминогена человека).
Фрагмент, отщепляемый при неполном гидролизе in vitro эластазой, включающий в себя каталитический домен и 5-й крингл-домен, называют миниплазминогеном (Moroz L.A., Mini-plasminogen: a mechanism for leukocyte modulation of plasminogen activation by urokinase. Blood, 1981, v.58 pp.97-104; Machovich R., Owen W.G., An elastase-dependent pathway of plasminogen activation, Biochemistry, 1989, 28(10), pp.4517-4522). Он также обладает каталитической активностью и способностью связываться с отдельными доменами фибрина (Takada A et al., Activation of Val442-plasminogen (mini-plasminogen) by urokinase, streptokinase and tissue plasminogen activator, Thromb Res., 1988, v.9 (№2), pp.253-263,), но лишен характерной для плазминогена лизинсвязывающей активности (см. Moroz L.A.). Таким образом, миниплазминоген, получаемый in vitro гидролизом полноразмерного плазминогена эластазой, имеет фибринсвязывающие свойства, промежуточные между полноразмерным плазминогеном и микроплазминогеном (Suenson E., Thorsen S., Secondary-site binding of Glu-plasmin, Lys-plasmm and miniplasmin to fibrin, Biochem. J. (1981) v.197, pp.619-428). Миниплазминоген состоит из 348 аминокислот (с 444 по 791 АК последовательности плазминогена человека).
Микроплазминоген и миниплазминоген экспрессировались в клетках E.coli с удоволетворительным выходом продукта (Medynski D et al., Refolding, purification and activation of miniplasminogen and microplasminogen isolated from E.coli inclusion bodies, Protein Expr. Purif., 2007, 52(2), pp.395-402).
Однако микроплазминоген неспецифичен к фибрину и имеет сниженную ферментативную активность по отношению даже к модельным пептидам (см. ссылку выше (Medynski D et al.).
Достаточно близким к описываемым рекомбинантным полипептидам со свойствами плазминогена человека является делеционный вариант плазминогена (delta-plasminogen), содержащий каталитический домен и один из крингл-доменов: 1-й крингл-домен. Утверждается, что кроме каталитической активности, проявляющейся после активации, этот белок обладает выраженными свойствами связывать лизин и фибрин, характерными для полноразмерного плазминогена (WO 2005/105990). Однако дельта-плазминоген после активации обладает фибринолитической активностью, которая ингибируется α-2-антиплазмином со скоростью от 5 до 60 раз большей, чем плазмин, что является непреемлемым для наших целей.
Заявляемые новые рекомбинантные полипептиды со свойствами плазминогена были получены путем направленного поиска вариантов человеческого плазминогена, обладающих высокой каталитической активностью в активированной форме, способностью к эффективной продукции в клетках E.coli с последующей реконструкцией трехмерной структуры.
Фибринсвязывающая активность позволяет плазминогену и его модификациям физически находиться на месте тромболизиса, тем самым создавая высокую локальную концентрацию. Отсутствие сродства к фибрину, как в случае микроплазминогена, может рассматриваться как недостаток. С другой стороны, высокая фибринсвязывающая активность полноразмерного плазминогена или дельта-плазминогена (WO 2005/105990) затрудняет диффузию препарата при больших физических размерах тромба или сгустка. Более того, в природном полноразмерном плазминогене существует достаточно сложная регуляция фибринсвязывающей активности, предусматривающая взаимодействие крингл-доменов между собой и взаимодействие их с аминотерминальным фрагментом, модулирующие сродство к фибрину (см выше Suenson Т., Thorsen S., Biochem. J. (1981) v.197, pp.619-428) и (An S.S.A. et al., Structural/functional properties of the Glul-Ser57 N-terminal and interaction with kringle domains fragment of human plasminogen: Conformational characterization, Protein Sci. 1998 №7, pp.1947-1959).
Таким образом, оба варианта: как с отсутствием фибринсвязывающей активности, так и с высокой фибринсвязывающей активностью не являются оптимальными как возможный инструмент лизиса тромбов.
Поэтому поиски оптимального варианта велись среди вариантов структур плазминогена, содержащих по крайней мере один крингл-домен (5-й) и не содержащих аминотерминального фрагмента и 1-го крингла, поскольку микроплазминоген, т.е. только каталитический домен, не имеющий дополнительного сродства к субстрату - фибрину, не представляет интереса, а излишнее сродство к фибрину, обусловленное прежде всего 1-м кринглом, нецелесообразно. Поиск производился среди вариантов, заведомо содержащих некоторые, но не все структуры, участвующие в связывании фибрина.
Новые рекомбинантные полипептиды со свойствами плазминогена человека содержат каталитический домен плазминогена, 5-ый крингл-домен плазминогена и существенно видоизмененный фрагмент аминокислотной последовательности, предшествующий 5-му крингл-домену плазминогена и имеют аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:5.
Известно, что расположение аминокислот в белке не случайно. Статистически, неполярные аминокислоты (лейцин, изолейцин, валин и т.п.) оказываются предпочтительно в контакте друг с другом, а не с растворителем, тем самым понижается свободная энегрия системы растворитель-белок. Немногие экспонированные на поверхность гидрофобные группы часто оказываются причиной желательного или нежелательного белок-белкового взаимодействия или агрегации. (Stemberg M J E et al. «Protein structure prediction», Oxford University Press, 1996). Надрез протеазой или искусственное прерывание последовательности в произвольном месте может привести к экспонированию кластеров гидрофобных аминокислот находившихся исходно во внутренних областях глобулы. Так, например, полипептиды SEQ ID NO:5, SEQ ID NO:7 и SEQ ID NO:9 содержат перед крингл-доменом последовательность ValAlaProProProValValLeuLeu, содержащую 50% гидрофобных аминокислот.Это проявляется в пониженной эффективности укладки полипептидов SEQ ID NO:5, SEQ ID NO:7 и SEQ ID NO:9 по сравнению с полипептидами SEQ ID NO:1 и SEQ ID NO:3. Действительно, если выход при реконструкции для полипептидов SEQ ID NO:1 и SEQ ID NO:3 составляет 80% (примеры 1 и 2, раздел E), то для полипептида SEQ ID NO:5 выход составляет 50% (пример 3, разделы В и E), а для полипептидов SEQ ID NO:7 и SEQ ID NO:9 составляет менее трети (примеры 4 и 5, раздел В). Более высокий выход при реконструкции полипептида SEQ ID NO:5 по сравнению с полипептидами SEQ ID NO:7 и SEQ ID NO:9 может быть объяснен наличием дополнительного кластера гидрофильных аминокислот Ser Gly Thr Glu, благодаря которому равновесие при реконструкции смещается в сторону образования водорастворимых конформаций.
В рекомбинантном полипептиде с аминокислотной последовательностью SEQ ID NO:1 участок, предшествующий 5-му крингл-домену, представляет собой аминокислотную последовательность Met Glu Glu Glu Asp.
В рекомбинантном полипептиде с аминокислотной последовательностью SEQ ID NO:3 участок, предшествующий 5-му крингл-домену, представляет собой аминокислотную последовательность Met Asp Ser Ser Glu Glu Asp.
Последовательность Glu Glu Glu в SEQ ID NO:1 является частью последовательности между 1-м и 2-м кринглами плазминогена человека, а последовательность Asp Ser Ser в SEQ ID NO:3 является частью последовательности между 3-м и 4-м кринглами плазминогена человека, что гарантирует отсутствие чужеродных последовательностей в новых полипептидах.
В рекомбинантном полипептиде с аминокислотной последовательностью SEQ ID NO:5 участок, предшествующий 5-му крингл-домену, представляет собой аминокислотную последовательность Met Ser Gly Thr Glu Ala Ser Val Val Ala Pro Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp.
Следующим объектом описываемой группы изобретений являются фрагменты ДНК, кодирующие полипептиды со свойствами плазминогена человека по п.1 и имеющие нуклеотидные последовательности SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6 или аналогичные последовательности, обусловленные вырожденностью генетического кода.
Так, фрагмент ДНК с нуклеотидной последовательностью SEQ ID NO:2 кодирует полипептид, имеющий аминокислотную последовательность SEQ ID NO:1.
Фрагмент ДНК с нуклеотидной последовательностью SEQ ID NO:4 кодирует полипептид, имеющий аминокислотную последовательность SEQ ID NO:3.
Фрагмент ДНК с нуклеотидной последовательностью SEQ ID NO:6 кодирует полипептид, имеющий аминокислотную последовательность SEQ ID NO:5.
Фрагменты ДНК получают путем обратной траскрипции мРНК клеток человека с последующей амплификацией нужного фрагмента методом ПЦР. В дальнейшем участки, расположенные между сайтами рестрикции, могут быть заменены синтетическими фрагментами с требуемой последовательностью.
Еще одним объектом изобретения являются рекомбинантные плазмидные ДНК pPGM для экспрессии новых полипептидов со свойствами плазминогена человека, содержащие один из фрагментов ДНК, их кодирующих, и одну или несколько регуляторных последовательностей.
Примером такой плазмидной ДНК может служить рекомбинантная плазмидная ДНК pPGM2 для экспрессии полипептида SEQ ID NO:1, содержащая следующие последовательно соединенные конструктивные элементы: HmdIII-EcoRI фрагмент плазмиды pUC19 размером 2.7 т.п.о., несущий в себе участок начала репликации, ген устойчивости к антибиотику и lac-промотор; HindIII-BbsI фрагмент, представляющий 5'-нетранслируемую область, участок инициации трансляции и инициирующий ко дон; фрагмент BbsI-BamHI, кодирующий последовательность SEQ ID NO:1 и имеющий ДНК-последовательность SEQ ID NO:2, в совокупности фрагменты HindIII-BbsI и BbsI-BamHI образуют HindIII-BamHI фрагмент, представляющий 5'-нетранслируемую область и ДНК, кодирующую полипептид со свойствами плазминогена человека; 3'-нетранслируемая область BamHI-Acc65 I; BsaBI-SphI-фрагмент генома Escherichia coli размером 450 п.о.
Рекомбинантная плазмидная ДНК pPGM4 служит для экспрессии полипептида с последовательностью SEQ ID NO:3. В ней фрагмент BbsI-BamHI имеет ДНК-последовательность SEQ ID NO:4.
Рекомбинантная плазмидная ДНК pPGM6 служит для экспрессии полипептида с последовательностью SEQ ID NO:5. В ней фрагмент BbsI-BamHI имеет ДНК-последовательность SEQ ID NO:6
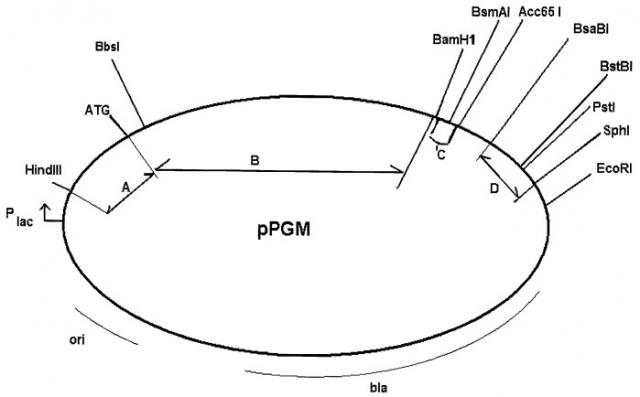
Карта плазмид pPGM представлена на чертеже. Карта не дает исчерпывающей информации о деталях последовательности, например, о сайтах рестрикции, присутствующих в данной ДНК, однако указанные на этом чертеже сайты являются достаточными для однозначного распознавания функциональных элементов плазмиды. В основе получения плазмид pPGM лежит технология рекомбинантных ДНК, все методы которой хорошо известны специалистам в данной области. Для получения рекомбинантных плазмид pPGM плазмиду pUC19 между сайтами HindIII и EcoRI последовательно модифицируют, синтетическим видоизмененным фрагментом гена ompA E.coli, фрагментом кДНК плазминогена человека, далее следует добавление синтетического фрагмента BamHI-Acc65I (SEQ ID NO:12), фрагмент Acc65I-EcoRI замыкает кольцо и содержит в себе BsaBI-SphI фрагмент ДНК E.coli.
Следующим объектом описываемой группы изобретений являются клетки бактерий Escherichia coli штамма JM109, трансформированные рекомбинантными плазмидными ДНК pPGM2, pPGM4 или pPGM6, кодирующими новые полипептиды со свойствами плазминогена человека.
Еще одним объектом заявляемой группы изобретений является фармацевтическая композиция, обладающая фибринолитическим действием, которая содержит в качестве действующего вещества любой из рекомбинантных полипептидов со свойствами плазминогена человека и имеющий последовательность SEQ ID NO:1, или SEQ ID NO:3 или SEQ ID:5 в эффективной терапевтической дозе.
Для лучшего понимания настоящего изобретения описание сопровождается следующей иллюстрацией.
На чертеже представлена карта рекомбинантных плазмидных ДНК pPGM, содержащая основные функциональные элементы плазмид и характерные участки узнавания рестриктазами. Промотор lac-оперона E.coli обозначен как "Plac"; «ori» - участок начала репликации; «bla» - ген β-лактамазы, обеспечивающий устойчивость к ампициллину; «А» - 5'-нетранслируемая область; «В» - область, кодирующая новые полипептиды со свойствами плазминогена человека; области "А" и "В" в совокупности представляют собой SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:6; «С» - 3'-нетранслируемая область, имеющая последовательность SEQ ID NO:12; «D» - фрагмент ДНК E.coli. Для привязки расположения функциональных элементов к физической карте (последовательности) приведены участки узнавания рестриктазами: HindIII, EcoRI, BbsI, BamHI, Acc65I, SphI и др.
Перечень последовательностей аминокислот и нуклеотидов, характеризующих настоящее изобретение, включает следующие последовательности.
SEQ ID NO:1 представляет собой аминокислотную последовательность рекомбинантного полипептида со свойствами плазминогена человека, в котором участок, предшествующий 5-му крингл-домену, имеет последовательность Met Glu Glu Glu Asp.
SEQ ID NO:2 представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:1. SEQ ID NO:2 представляет собой последовательность SEQ ID NO:13, эвристически видоизмененную таким образом, что вторичная структура соответствующей ей РНК благоприятствует более эффективной экспрессии кодируемого ею полипептида SEQ ID NO:1.
SEQ ID NO:3 представляет собой аминокислотную последовательность полипептида, в котором участок, предшествующий 5-му крингл-домену, имеет последовательность Met Asp Ser Ser Glu Glu Asp.
SEQ ID NO:4 представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:3. SEQ ID NO:4 представляет собой последовательность SEQ ID NO:14, эвристически видоизмененную таким образом, что вторичная структура соответствующей ей РНК благоприятствует более эффективной экспрессии кодируемого ею полипептида SEQ ID NO:3.
SEQ ID NO:5 представляет собой аминокислотную последовательность полипептида, в котором участок, предшествующий 5-му крингл-домену, имеет последовательность Met Ser Gly Thr Glu Ala Ser Val Val Ala Pro Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp.
SEQ ID NO:6 функционально представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:5. Структурно последовательность состоит из 5'-нетранслируемой области (SEQ ID NO:11, нуклеотиды 1-143 и собственно кодирующей области).
SEQ ID NO:7 представляет собой аминокислотную последовательность полипептида, в котором участок, предшествующий 5-му крингл-домену, имеет последовательность Met Ala Pro Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp.
SEQ ID NO:8 функционально представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:7. Структурно последовательность состоит из 5'-нетранслируемой области (SEQ ID NO:11, нуклеотиды 1-143) и собственно кодирующей области.
SEQ ID NO:9 представляет собой аминокислотную последовательность полипептида, в котором участок, предшествующий 5-му крингл-домену, имеет последовательность Met Ala Ser Val Val Ala Pro Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp
SEQ ID NO:10 функционально представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:9. Структурно последовательность состоит из 5'-нетранслируемой области (SEQ ID NO:11, нуклеотиды 1-143) и собственно кодирующей области.
SEQ ID NO:11 представляет собой 5'-нетранслируемую область гена ompА E.coli, видоизмененную таким образом, что на 5' конце появляется сайт HindIII, а на 3' конце появляется сайт NdeI, при этом последовательность содержит участок, комплементарный 3'-концу 16S рибосомной РНК E.coli (нуклеотиды 125-135 данной последовательности). Данная последовательность SEQ ID NO:11 имеет существенное значение для построения последовательностей SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:6, SEQ ID NO:8, А SEQ ID NO:10 и их производных SEQ ID NO:2 и SEQ ID NO:4.
SEQ ID NO:12 представляет собой синтетическую последовательность, помещаемую при конструировании плазмид сразу после кодирующих полипептиды областей.
SEQ ID NO:13 функционально представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:1. Структурно последовательность состоит из 5'-нетранслируемой области (SEQ ID NO:11, нуклеотиды 1-143) и собственно кодирующей области.
SEQ ID NO:14 функционально представляет собой фрагмент ДНК, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO:3. Структурно последовательность состоит из 5'-нетранслируемой области (SEQ ID NO:11, нуклеотиды 1-143) и собственно кодирующей области.
Ниже приводятся примеры конкретного осуществления настоящего изобретения. Однако следует иметь в виду, что эти примеры иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1. Получение полипептида с последовательностью SEQ ID NO:1.
А. Создание кодирующей последовательности.
На матрице РНК из печени человека синтезируют кДНК и затем с помощью полимеразной цепной реакции и нижеуказанных олигонуклеотидов получают фрагмент ДНК с последовательностью, кодирующей полипептид с аминокислотной последовательностью SEQ ID NO:1. Для осуществления ПЦР были использованы следующие олигонуклеотиды:
5'-CCCATATGGAAGAAGAAGACTGTATGTTTGGGAATGGGAAAGGATACCG-3'
5'-AGGTGGATCCAGTGCGTCACTCTGTCTCCCGTCCAATTA-3'
Использовали двухтактный режим цепной реакции с температурой денатурации 94°С и температурой отжига и элонгации 68°С. Используя встроенные в ПЦР-праймеры участки узнавания NdeI (catatg) и BamHI (ggatcc), получают фрагмент NdeI -BamHI, кодирующий SEQ ID NO:1.
Б. Конструирование экспрессирующей плазмиды рХ2.
Последовательность 5' нетранслируемой области E.coli ompA гена модифицируют таким образом, чтобы получить SEQ ID NO:11 (с HindIII на 5'- и с NdeI на 3'- конце фрагмента). Химически синтезируют этот фрагмент и фосфорилируют его полинуклеотидкиназой фага Т4. В pUC19 между рестриктными сайтами HindIII и BamHI клонируют вышеупомянутый фрагмент SEQ ID NO:11 и соостветственно фрагмент из раздела А примера 1, гидролизованый рестриктазами NdeI и BamHI. Продуктом лигирования трансформируют клетки E.coli JM109 и ДНК колоний анализируют методом ПЦР с последующим электрофорезом по наличию NdeI-BamHI вставки размером 1.3 т.п.о. Определяют последовательность нуклеотидов, получают промежуточную плазмиду рХ2, со вставкой SEQ ID NO:13.
В. Получение биомассы и первичная очистка. Определение уровня экспресии, реконструкция ферментативной активности и оценка эффективности реконструкции полипептида SEQ ID NO:1.
Бактерии штамма E.coli JM109, трансформированные плазмидой рХ2, выращивают до плотности OD600=2.5 в течение 14 ч в 250 мл LB-среды с ампициллином (100 мкг/мл) при 37°С и интенсивной аэрации. По окончании выращивания клетки собирают центрифугированием в течение 30 мин при 3000 об/мин, суспендируют в 20 мл буферного раствора (трис-HCl 20 мМ, рН 6.7, NaCl 50 мМ), добавляют 20 мг лизоцима и инкубируют 10 мин при 4°С. К полученной смеси добавляют Трис-HCl, рН 8.3, до 100 мМ. Тритон Х-100 до 0,5% и ЭДТА до 20 мМ, инкубируют 30 мин при 4°С, после чего обрабатывают ультразвуком 1 мин. Осадочную фракцию клеточного экстракта отделяют центрифугированием в течение 90 мин при 5000 об/мин, суспендируют в 20 мл раствора (50 мМ Трис-HCl 7,5, 2%-ный Тритона X-100. 50 мМ NaCl) и центрифугируют 10 мин при 10000 об/мин. Осадок суспендируют в 20 мл раствора, содержащего 5 мМ ЭДТА и 50 мМ Трис-HCl, рН 7.5 и осаждают в тех же условиях. Промытый осадок растворяют в 25 мл денатурирующего раствора (6М мочевина, 0,1М Трис-основание) при перемешивании, нерастворимый осадок убирают центрифугированием.
Для определения уровня экспресии аликвоты суспензии осадочной фракции клеточного экстракта, соответствующие 20 мкл культуры, анализируют электофорезом в полиакриламидном геле (Laemmli U.K., Cleavage of structural proteins during the assembly of the head of bacteriophage Т4. Nature (1970) у.227(№5259), pp.680-685). На одном геле с исследуемым образцом наносят разведения стандартов: БСА и лизоцима куриных яиц с нагрузкой от 0.05 до 2 мкг на трек. Интенсивность полосы 37 кДа сравнивают с интенсивностями методом просвечивающей денситометрии. Выход рекомбинантного белка составляет 15 мг в пересчете на 1 л культуры.
Процедуру реконструкции ферментативной активности проводят следующим образом: раствор разбавляют в 10 раз буфером: 100 мМ Трис-основание, 0.5 мМ восстановленный глютатион, 0.5 мМ окисленный глютатион, и инкубируют в течение 20 ч при 4°С. Выпавший осадок удаляют центрифугированием и подтверждают активность растворимой фракции белка тестом на амидолитическую активность. Ренатурированный рекомбинантный модифицированный плазминоген представлен, главным образом, проферментной формой с молекулярной массой 37 кДа, выход водорастворимого белка определяется по данным электрофоретического анализа, выполняемого, как описано выше. Выход при реконструкции составляет 80%.
Д. Оптимизация продукции SEQ ID NO:1 и получение плазмиды pPGM2.
1. Проводят модификацию 5'-нетранслируемой области E.coli ompA гена. Для этой цели проводят теоретический анализ конструкций вторичных структур РНК, соответствующих гену ompA E.coli до ATG и фрагменту кодирующих областей полипептида SEQ ID NO:1. Используя вырожденность генетического кода, в ходе анализа проводят замены в последовательности 5'-концевых участков кодирующей области и 5'-нетранслируемой области с целью получить структурированную 5'-нетранслируемую область, и вместе с тем участок инициации трансляции вне вторичных структур с низкими значениями свободной энергии укладки. Оптимальную найденную структуру синтезируют как пару комплементарных олигонуклеотидов, содержащих рестриктные сайты HindIII и BbsI. Используя имеющийся в кДНК плазминогена сайт BbsI- заменяют фрагмент HindIII-BbsI в плазмиде рХ2 на синтетический. Получают плазмиду pY2 со вставкой SEQ ID NO:2, кодирующую полипептид SEQ ID NO:1.
2. В плазмиде pY2 заменяют фрагмент 3'-нетранслируемой области между BamHI и Асс651 на синтетический SEQ ID NO:12. Получают промежуточную плазмиду pZ2.
3. Плазмиду pZ2 гидролизуют рестриктазами BsaBI и Sphl. Теми же рестриктазами гидролизуют ДНК E.coli JM109. Фрагмент вектора и область фрагментов ДНК E.coli размером 0.4-0.6 т.п.о. изолируют препаративным электрофорезом в агарозном геле, затем лигируют. Полученным продуктом трансформируют клетки E.coli JM109, отдельные колонии анализируют по продукции водонерастворимого полипептида размером 37 кДа и из наиболее продуктивных клонов выделяют плазмиду. Таким образом, отбирают плазмиду с фрагментом ДНК E.coli BsaBI-SphI размером 450 п.о., содержащим сайты рестриктаз PstI и BstBI, который активирует экспрессию в транс-положении по отношению к экспрессируемому полипептиду. Плазмида - производная pZ2 со вставкой BsaBI-SphI, получила название pPGM2.
Е. Получение биомассы и первичная очистка. Определение уровня экспресии полипептида для плазмиды pPGM2. Реконструкция ферментативной активности и оценка эффективности реконструкции полипептида SEQ ID NO:1.
Наработка биомассы, определение уровня экспрессии полипептида SEQ ID NO:1 плазмидой pPGM2 и реконструкция активности осуществляются, как в разделе В примера 1. Выход рекомбинантного белка составляет 60 мг в пересчете на 1 л культуры, что значительно выше, чем в случае первичной плазмиды рХ2, кодирующей тот же полипептид. Выход при реконструкции составляет 80%.
Пример 2 Получение полипептида с последовательностью SEQ ID NO:3.
А. Создание кодирующей последовательности.
На матрице РНК из печени человека синтезируют кДНК и затем с помощью полимеразной цепной реакции и нижеуказанных олигонуклеотидов получают фрагмент ДНК с последовательностью, кодирующей полипептид с аминокислотной последовательностью SEQ ID NO:3. Для осуществления ПНР были использованы следующие олигонуклеотиды:
5'-CCCATATGGATAGTTCCGAAGAAGACTGTATGTTTGGGAATGG-3'
5'-AGGTGGATCCAGTGCGTCACTCTGTCTCCCGTCCAATTA-3'
Используют двухтактный режим цепной реакции с температурой денатурации 94°С и температурой отжига и элонгации 68°С.
Используя встроенные в ПЦР-праймеры участки узнавания NdeI (catatg) и BamHI (ggatcc), получают фрагмент NdeI -BamHI, кодирующий SEQ ID NO:3.
Б. Конструирование экспрессирующей плазмиды рХ4.
Последовательность 5' нетранслируемой области E.coli ompA гена модифицируют таким образом, чтобы получить SEQ ID NO:11 (с HindIII на 5'- и с NdeI на 3'-конце фрагмента). Химически синтезируют этот фрагмент и фосфорилируют его полинуклеотидкиназой фага Т4. В pUC19 между HindIII и BamHI клонируют вышеупомянутый фрагмент SEQ ID NO:11 и соответственно фрагмент из раздела А примера 2, гидролизованый Nde и BamHI. Продуктом лигирования трансформируют клетки E.coli JM109 и ДНК колоний анализируют в ПЦР с последующим электрофорезом по наличию NdeI-BamHI вставки размером 1.3 т.п.о. Определяют последовательность нуклеотидов, получают промежуточную плазмиду рХ4 со вставкой SEQ ID NO:14.
В. Получение биомассы и первичная очистка. Определение уровня экспресии для плазмиды рХ4. Реконструкция ферментативной активности и оценка эффективности реконструкции полипептида SEQ ID NO:3.
Производится аналогично р