Семейство генов (lbfl313), ассоциированных с злокачественным ростом поджелудочной железы
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой применение выделенной молекулы нуклеиновой кислоты, кодирующей белок, который дифференциально экспрессируется в тканях злокачественного роста поджелудочной железы, в диагностике и лечении раковых заболеваний поджелудочной железы. Также для диагностики и лечения раковых заболеваний поджелудочной железы представлены: применение вектора, содержащего указанную молекулу нуклеиновой кислоты, применение указанного выделенного полипептида или белка, а также применение выделенного антитела, которое связывается с указанным полипептидом или белком. Изобретение может эффективно использоваться при точной диагностике аденокарциномы поджелудочной железы, а также в способах лечения и способах идентификации агентов, которые помогут эффективно лечить это заболевание. 4 н. и 3 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Область техники
Изобретение относится к изменениям экспрессии генов в ткани злокачественного роста поджелудочной железы от пациентов с злокачественным ростом поджелудочной железы. Изобретение в частности относится к гену человека, который по-разному экспрессируется в тканях злокачественного роста поджелудочной железы и в соответствующей нормальной ткани поджелудочной железы, а также в других злокачественных новообразованиях.
Предшествующий уровень техники
Злокачественный рост поджелудочной железы - четвертая ведущая причина смертности от злокачественного роста у мужчин и женщин - является важной проблемой здравоохранения в развитых странах и ассоциирован с чрезвычайно плохим прогнозом (Faint et al. (2004) Datamonitor DMHC2045; Garcea et al. (2005) Pancreatology 5:514-529; Kern et al. (2002) Cancer Biol Therapy 1:607-613; Laheru and Jaffee (2005) Nature Rev Cancer 5:59-467; Li et al (2004) Lancet 363:1049-1057). Согласно оценкам, в год примерно у 30000 американцев развивается это заболевание, и они от него умирают. Несмотря на агрессивное хирургическое и медикаментозное лечение, средняя ожидаемая продолжительность жизни составляет около 15-18 месяцев для пациентов с локальным и ограниченным заболеванием и 3-6 месяцев для пациентов с метастазирующей опухолью. Почти у 100% пациентов с злокачественным ростом поджелудочной железы развиваются метастазы, и они умирают из-за ослабляющих метаболических эффектов неограниченного роста, и общая пятилетняя выживаемость для групп пациентов, которым не были проведены резекционные процедуры, составляет менее чем пять процентов. Оно является особенно агрессивным с неспецифическими начальными симптомами и трудной ранней диагностикой. Разрабатываются способы раннего определения злокачественного роста поджелудочной железы, но еще не используются на практике, и обычная противораковая терапия оказывает небольшое влияние на прогноз и исход болезни. Плохой прогноз злокачественного роста поджелудочной железы определяется его тенденцией к позднему проявлению, агрессивной местной инвазии, раннему метастазированию и плохой реакции на химиотерапию.
Как и многие другие злокачественные заболевания, злокачественный рост поджелудочной железы возникает в результате накопления приобретенных мутаций. Множественные генетические и эпигенетические изменения, включая активацию протоонкогенов, инактивацию генов-супрессоров опухоли и нарушения поддерживающих генов, вовлечены в развитие, непрерывный рост и метастазирование злокачественного роста поджелудочной железы. Считают, что накопленные мутации в таких генах возникают в предсказуемый временной период в течение стадий «PanINs» (Интраэпителиальная Неоплазия Поджелудочной железы (Pancreatic Intraepithelial Neoplasia) (Hruban et al (2000) Clin Cancer Res 6:2969-2972; Kern et al. (2002) Cancer Biol Therapy 1:607-613; Li et al. (2004) Lancet 363:1049-1057). Мутация K-ras возникает в середине PanIN-1. Стадия PanIN-2 отмечена дополнительными изменениями и увеличением степени мутаций K-ras и появлением множества аномалий р16, и повышенной экспрессии белка р53, которая может указывать на присутствие мутаций р53, и возникает случайно на более поздних стадиях PanINs. Потеря генов-супрессоров опухолей ТР53, DPC4 и BRCA2, вероятно, возникает позднее в развитии неоплазии поджелудочной железы PanIN-3.
Более чем 85% злокачественного роста протоков поджелудочной железы имеют активирующую точечную мутацию гена K-ras при развитии злокачественного роста поджелудочной железы (Li et al. (2004) Lancet 363:1049-1057; Xiong (2004) Cancer Chem Pharm 54:S69-77). Мутация K-ras приводит к постоянной активации внутриклеточного сигнального пути, Ras-Raf-MEK-ERK, приводящего к пролиферации клеток, и, таким образом, придает трансформирующие свойства клеткам, содержащим точечные мутации в этом гене. Мутация Ras не ассоциирована со стадией или прогнозом опухоли, что свидетельствует о том, что онкоген K-ras может быть связан с развитием онкогенеза, но не связан со злокачественным потенциалом или развитием злокачественного роста поджелудочной железы человека. Одной из ключевых последующих целей семейства Ras является фосфоинозитол-3-киназа (PI3K). Активация PI3K вовлечена в устойчивость злокачественного роста поджелудочной железы к апоптозу, индуцированному химиотерапевтическими или молекулярными нацеливающимися веществами.
Инактивация гена-супрессора опухолей р16, вероятно, возникает немного позже. Ген р16 инактивируется практически во всех аденокарциномах протоков мутацией, гомозиготной делецией или транскрипционным отключением, ассоциированным с метилированием промотора (Kern et al. (2002) Cancer Biol Therapy 1:607-613; Maitra et al. (2006) Best Pract Res Clin Gastroenterol 20:211-226). Белок р16 регулирует клеточный цикл посредством пути р16/Rb, следовательно, генетическая инактивация гена р16 означает, что при злокачественном росте поджелудочной железы теряется критический регулятор клеточного цикла. Интересно, что наследственные мутации гена р16 являются причиной синдрома Семейной Атипичной Множественной Невусной Меланомы (FAMMM), и у пациентов с FAMMM имеется повышенный риск развития меланомы и злокачественного роста поджелудочной железы.
Инактивация гена ТР53 почти всегда возникает в результате внутригенной мутации в одном аллеле, связанной с потерей второго аллеля (Maitra et al. (2006) Best Pract Res Clin Gastroenterol 20:211-226). Нарушение функции р53 означает, что в большинстве случаев злокачественного роста поджелудочной железы нарушены два критических регулятора количества клеток, контрольной точки клеточного цикла G1/S и поддержания остановки G2/M.
Ген DPC4, также известный как SMAD4, генетически инактивируется более чем в половине случаев злокачественного роста поджелудочной железы, в 35% посредством гомозиготной делеции и в 20% путем внутригенной мутации, связанной с потерей оставшегося аллеля (Maitra et al. (2006) Best Pract Res Clin Gastroenterol 20:211-226; Wilentz et al. (2000) Am J Pathol 156:37-43). Однако генетическая инактивация DPC4 только изредка возникает при других типах опухолей. Белок dpc4 играет критическую роль в сигнальном пути и контроле роста посредством пути TGF-B.
Ген BRCA, связанный с репарацией ДНК, поражается только в небольшом количестве случаев (~10%) злокачественного роста поджелудочной железы, но вызывает семейное накопление злокачественного роста поджелудочной железы (Maitra et al. (2006) Best Pract Res Clin Gastroenterol 20:211-226; Murphy et al. (2002) Cancer Res 62:3789-3793). Носители единственной пары оснований гена BRCA (называемой мутацией гена 6174delT BRCA) имеют в 10 раз больший риск развития злокачественного роста поджелудочной железы.
Ядерный фактор кВ (NF-кВ), транскрипционный фактор, который преимущественно существует в виде гетеродимера р65(RelA)/p50, также рассматривается как один из генов, связанных с злокачественным ростом поджелудочной железы (Garcea et al. (2005) Pancreatology 5:514-529; Xiong (2004) Cancer Chem Pharm 54:S69-77). RelA, субъединица р65 NF-кВ, постоянно активируется примерно около 67% аденокарцином поджелудочной железы, но не в здоровой ткани поджелудочной железы, и IкВб экспрессируется в повышенных количествах в опухолевых тканях поджелудочной железы и клеточных линиях человека. Конститутивная активация RelA, вероятно, коррелирует с вышестоящим сигнальным путем, таким как RAS, в клетках опухоли поджелудочной железы. Предполагают, что NF-кВ играет важную роль в устойчивости опухоли при злокачественном росте поджелудочной железы к апоптозу, индуцированному цитотоксическими агентами. Другие результаты также говорят о том, что основным механизмом, посредством которого NF-кВ, вероятно, запускает рост клеток поджелудочной железы, является ингибирование апоптоза.
В данной области все еще существует необходимость в материалах и методах более точной диагностики аденокарцином поджелудочной железы. Кроме того, в данной области остается необходимость в способах лечения и способах идентификации агентов, которые помогут эффективно лечить это заболевание. Настоящее изобретение соответствует этим и другим нуждам.
Описание
Техническая проблема
Настоящее изобретение обеспечивает материал и метод для точной диагностики аденокарциномы поджелудочной железы.
Настоящее изобретение также обеспечивает способ эффективного лечения аденокарциномы поджелудочной железы.
Техническое решение
Настоящее изобретение основано на новом гене (далее называемом «LBFL313»), который дифференциально экспрессируется в ткани аденокарциномы поджелудочной железы по сравнению с тканью нормальной поджелудочной железы. Изобретение обеспечивает (а) выделенную молекулу нуклеиновой кислоты, включающую SEQ ID NO: 1, (b) выделенную молекулу нуклеиновой кислоты, кодирующую SEQ ID NO:2, (c) выделенную молекулу нуклеиновой кислоты, обладающую по меньшей мере 95% идентичностью последовательности нуклеотидов с SEQ ID NO: 1, и (d) выделенную молекулу нуклеиновой кислоты, содержащую ее комплемент.
Настоящее изобретение, кроме того, относится к молекулам нуклеиновой кислоты, оперативно связанным с одним или более элементами, контролирующими экспрессию, включая векторы, включающие выделенные молекулы нуклеиновой кислоты. Изобретение, кроме того, относится к клеткам организма хозяина, трансформированным таким образом, что они содержат молекулы нуклеиновой кислоты согласно изобретению, и способы получения белка, включающие стадию культивирования клеток-хозяев, трансформированных молекулой нуклеиновой кислоты согласно изобретению, в условиях, в которых экспрессируется белок.
Изобретение, кроме того, связано с выделенным полипептидом или белком, содержащии последовательность аминокислот SEQ ID NO: 2 или проявляющим по меньшей мере 95% идентичность аминокислотной последовательности SEQ ID NO:2.
Изобретение, кроме того, связано со способами идентификации агента, который модулирует экспрессию молекулы нуклеиновой кислоты, кодирующей белок, согласно изобретению.
Изобретение, кроме того, связано со способами идентификации агента, который модулирует уровень или по меньшей мере одну активность белка, согласно изобретению.
Настоящее изобретение, кроме того, связано со способами модуляции экспрессии молекулы нуклеиновой кислоты, кодирующей белок, согласно изобретению.
Изобретение, кроме того, обеспечивает способы идентификации связывающих партнеров для белка согласно изобретению.
Настоящее изобретение, кроме того, связано со способами идентификации агентов, которые могут блокировать или модулировать ассоциацию белка согласно изобретению со связывающим партнером.
Настоящее изобретение, кроме того, связано со способами снижения или блокады ассоциации белка согласно изобретению с одним или более его связывающими партнерами.
Настоящее изобретение, кроме того, связано с трансгенными животными, отличными от человека, которые содержат молекулы нуклеиновой кислоты согласно изобретению, или отличными от человека трансгенными животными, модифицированными таким образом, что они содержат мутантные молекулы нуклеиновой кислоты, такие, что экспрессия кодируемых полипептидов согласно изобретению предотвращается.
Настоящее изобретение, кроме того, связано с отличными от человека трансгенными животными, у которых целиком или частично ген, включающий в себя полностью или частично последовательность SEQ ID NO: 1, нокаутирован или удален из генома животного.
Изобретение, кроме того, связано с композициями, включающими в себя разбавитель и полипептид или белок, где полипептид или белок содержит аминокислотную последовательность SEQ ID NO: 2 или обладает по меньшей мере 95% идентичностью аминокислотной последовательности с SEQ ID NO: 2.
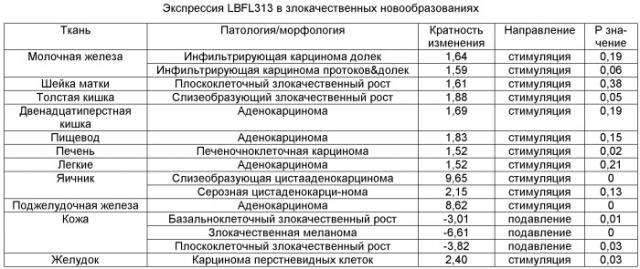
Гены и белки согласно изобретению могут быть использованы в качестве диагностических агентов или маркеров для определения злокачественного роста поджелудочной железы или для дифференцировки в образце аденокарциномы поджелудочной железы от нормальных тканей. Они также могут служить в качестве мишени для агентов, которые модулируют экспрессию или активность гена. Например, могут быть идентифицированы агенты, которые модулируют биологические процессы, ассоциированные с ростом опухоли, включая гиперпластический процесс злокачественного роста поджелудочной железы.
А. Белки, ассоциированные с злокачественным ростом поджелудочной железы
Настоящее изобретение связано с выделенными белками, аллельными вариантами белков и консервативными аминокислотными заменами белков. В настоящем описании «белок» или «полипептид» относится отчасти к белку, который имеет аминокислотную последовательность человека, приведенную в SEQ ID NO: 2. Термины также относятся к естественным аллельным вариантам и белкам, которые имеют немного отличную аминокислотную последовательность, чем та, которая отдельно указана выше. Аллельные варианты, так как обладают немного отличной аминокислотной последовательностью, чем указанная выше, все еще будут иметь такие же или сходные биологические функции, ассоциированные с такими белками.
В настоящем описании семейство белков, родственных с человеческой аминокислотной последовательностью SEQ ID NO: 2, относится к белкам, которые были выделены из других организмов помимо организма человека. Способы, используемые для идентификации и выделения других членов семейства белков, связанных с такими белками, описаны ниже.
Белки согласно настоящему изобретению предпочтительно находятся в выделенной форме. В настоящем описании белок называют выделенным, когда физические, механические или химические методы используют для выделения белка из составляющих клетки, которые обычно ассоциированы с белком. Специалист в данной области может легко использовать стандартные методы очистки для получения выделенного белка.
Белки согласно настоящему изобретению, кроме того, включают варианты SEQ ID NO: 2 с вставками, делециями или консервативными заменами аминокислот. В настоящем описании консервативный вариант относится к изменениям аминокислотной последовательности, которые отрицательным образом не влияют на биологические функции белка. Замена, вставка или делеция считаются отрицательным образом влияющими на белок, когда измененная последовательность нарушает биологическую функцию, ассоциированную с белком, предотвращает или препятствует ее реализации. Например, свойства общего заряда, структура или гидрофобные/гидрофильные свойства белка в определенных обстоятельствах могут быть изменены без ущерба для его биологической активности. Соответственно, аминокислотную последовательность можно изменить, например, придавая пептиду большую гидрофобность или гидрофильность без ущерба для биологической активности белка.
Обычно аллельные варианты, варианты консервативной замены и члены семейства белков имеют последовательность аминокислот, обладающую по меньшей мере примерно 50%, 60%, 70% или 75% идентичностью аминокислотной последовательности с последовательностью SEQ ID NO: 2, более предпочтительно по меньшей мере примерно 80-90%, еще более предпочтительно по меньшей мере примерно 92-94%, и наиболее предпочтительно по меньшей мере примерно 95%, 98% или 99% идентичностью последовательности. Идентичность или гомологию таких последовательностей определяют в настоящем описании как процент аминокислотных остатков в последовательности-кандидате, которые идентичны SEQ ID NO: 2 после выравнивания последовательностей и введения, если необходимо, пробелов, для достижения максимальной степени гомологии, и не расценивая какие-либо консервативные замены как часть идентичности последовательности (см. раздел В для релевантных параметров). Слитые белки, или N-концевые, С-концевые или внутренние удлинения, делеции или вставки в пептидную последовательность, не должны рассматриваться как влияющие на гомологию.
Следовательно, белки согласно настоящему изобретению включают молекулы, имеющие аминокислотную последовательность, описанную в SEQ ID NO: 2; их фрагменты, имеющие последовательность, состоящую по меньшей мере примерно из 3, 4, 5, 6, 10, 15, 20, 25, 30, 35 или более аминокислотных последовательных остатков этих белков; варианты последовательности аминокислот, где один или более аминокислотных остатков вставлены на N- или С-конце или внутри описанной кодирующей последовательности; и варианты аминокислотной последовательности описанной последовательности или ее фрагментов, как определено выше, в которых осуществлена замена по меньшей мере одного остатка. Такие фрагменты, называемые также пептидами или полипептидами, могут содержать антигенные участки, функциональные участки белков, идентифицируемые как участки аминокислотной последовательности, которые соответствуют известным белковым доменам, а также участки выраженной гидрофильности. Все участки легко определяются с использованием обычного программного обеспечения для анализа белковой последовательности, такого как MacVector (Oxford Molecular).
Предусматриваемые варианты, кроме того, включают в себя таковые, содержащие заранее определенные мутации посредством, например, гомологичной рекомбинации, сайт-направленного или ПЦР-мутагенеза и соответствующие белки других видов животных, включая, но ими не ограничиваясь, виды кроликов, мышей, крыс, свиней, быков, птиц, лошадей и нечеловекообразных приматов, и аллели или другие естественные варианты семейства белков; и производные, где белок ковалентно модифицирован путем замены химическим, ферментативным или другим путем компонентом, отличным от природной аминокислоты (например, детектируемым компонентом, таким как фермент или радиоизотоп).
Настоящее изобретение, кроме того, связано с композициями, содержащими белок или полипептид согласно изобретению и разбавитель. Подходящими разбавителями могут быть водные или неводные растворители или их комбинации и могут включать дополнительные компоненты, например, водорастворимые соли или глицерин, которые влияют на стабильность, растворимость, активность и/или хранение белка или полипептида.
Как описано ниже, члены семейства белков могут быть использованы (1) для идентификации агентов, которые модулируют уровень по меньшей мере одной активности белка, (2) для идентификации связывающих партнеров белка, (3) в качестве антигена для повышения уровня поликлональных или моноклональных антител, (4) в качестве лечебного средства или мишени и (5) в качестве диагностического агента или маркера злокачественного роста поджелудочной железы и других гиперпластических заболеваний.
В. Молекулы нуклеиновой кислоты
Настоящее изобретение, кроме того, связано с молекулами нуклеиновой кислоты, которые кодируют белок, имеющий SEQ ID NO: 2, и связанные белки, описанные в настоящем описании, предпочтительно в выделенной форме. Здесь «нуклеиновая кислота» определяется как РНК или ДНК, которая кодирует белок или пептид, как определено выше, комплементарна последовательности нуклеиновой кислоты, кодирующей такие пептиды, гибридизуется с нуклеиновой кислотой SEQ ID NO: 1 и остается стабильно связанной с ней в соответствующих жестких условиях, кодирует полипептид, обладающий по меньшей мере примерно 50%, 60%, 70% или 75%, предпочтительно примерно 80-90%, более предпочтительно по меньшей мере примерно 92-94% и наиболее предпочтительно по меньшей мере примерно 95%, 98%, 99% или большей степенью идентичности пептидной последовательности SEQ ID NO: 2, или проявляет по меньшей мере 50%, 60%, 70% или 75%, предпочтительно по меньшей мере примерно 80-90%, более предпочтительно по меньшей мере примерно 92-94%, и еще более предпочтительно по меньшей мере примерно 95%, 98%, 99% или большую степень идентичности нуклеотидной последовательности в открытых рамках считывания SEQ ID NO: 1.
Настоящее изобретение, кроме того, включает в себя выделенные молекулы нуклеиновой кислоты, которые специфически гибридизуются с комплементарной SEQ ID NO: 1, в частности молекулы, которые специфически гибридизуются в открытых рамках считывания. Такие молекулы обычно специфически гибридизуются с комплементарными SEQ ID NO: 1, в жестких условиях гибридизации.
В частности, предусмотрены геномные ДНК, кДНК, мРНК и антисмысловые молекулы, а также нуклеиновые кислоты на основе альтернативного остова или содержащие альтернативные основания, либо полученные из природных источников, либо синтезированные. Такие гибридизующиеся или комплементарные нуклеиновые кислоты, однако, определяются далее как новые и неочевидные среди любых нуклеиновых кислот предшествующего уровня техники, включая такие, которые кодируют, гибридизуются в соответствующих жестких условиях или являются комплементарными нуклеиновой кислоте, кодирующей белок, согласно изобретению.
Гомология или идентичность на уровне нуклеотидов или аминокислотной последовательности определяют посредством анализа BLAST (Basic Local Alighnment Search Tool) с использованием алгоритма, используемого программами bpastp, blastn, blastx, tblastn и tblastx (Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402, и Karlin et al. (1990), Proc. Natl. Acad. Sci. USA 87: 2264-2268, оба эти источника полностью включены в виде ссылки), которые разработаны для поиска подобия последовательностей. Подход, используемый в программе BLAST, представляет собой сначала рассмотрение сходных сегментов, с пробелами или без них, между искомой последовательностью и последовательностью из базы данных, затем оценку статистической значимости всех соответствий, которые обнаружены, и, наконец, для суммирования только тех соответствий, которые удовлетворяют заранее выбранному порогу значимости. Для обсуждения основных проблем при поиске сходства в базе данных последовательностей, см. Altschul et al. (1994) Nat. Genet. 6:119-129, который полностью включен в виде ссылки. Параметры поиска для гистограмм, описаний, выравнивания, ожидания (т.е. порог статистической значимости для указания соответствий относительно последовательностей из базы данных), ограничение, матрица и фильтр (низкая сложность) являются настройками по умолчанию. Матрица параметров по умолчанию, используемая bpastp, blastx, tblastn и tblastx, представляет собой матрицу BLOSUM62 (Henikoff et al (1992), Proc. Natl. Acad. Sci. USA 89: 10915-10919, полностью включено в виде ссылки), рекомендуются для искомых последовательностей длиной более 85 нуклеотидов или аминокислот.
Для blastn оценочная матрица устанавливается по соотношению М (т.е. прибавляемый балл для пары соответствующих остатков) к N (т.е. вычитаемый штраф для несоответствующих остатков), где установочные значения для M и N составляют 5 и -4, соответственно. Для blastn установлены следующие параметры: Q=10 (штраф за создание пропусков); R=10 (штраф за удлинение пропусков); wink=1 (создает попадания слов в каждом wink положении по запросу) и gapw=16 (устанавливает ширину окна, в котором создаются прерывистые выравнивания). Эквивалентные установки параметров Blastp представляют собой Q=9; R=2; wink=1 и gapw=32. Сравнение Bestfit между последовательностями, доступное в партии GCG, версия 10.0, использует параметры ДНК GAP=50 (штраф за создание пробелов) и LEN=3 (штраф за удлинение пробелов), и эквивалентные установки в сравнении белков представляют собой GAP=8 и LEN=2.
«Жесткие условия» представляют собой (1) низкую ионную силу и высокую температуру для промывания, например, 0,015 М NaCl/0,0015 M цитрат натрия/ 0,1% SDS при 50°С, или (2) используемые во время гибридизации денатурирующий агент, такой как формамид, например, 50% (об./об.) формамид с 0,1% альбумином бычьей сыворотки/0,1% Ficoll/0,1% поливинилпирролидон/ 50 мМ буферного раствора фосфата натрия при рН 6,5 с 750 мМ NaCl, 75 мМ цитрата натрия при 42°С. Другим примером является гибридизация в 50% формамиде, 5×SSC (0,75 М NaCl, 0,75 М цитрата натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5×раствора Денхардта, ДНК обработанной ультразвуком спермы лосося (50 мкг/мл), 0,1% SDS и 10% декстрансульфата при 42°С с промывками при 42°С в 0,2×SSC и 0,1% SDS. Специалист в данной области может легко определить и варьировать жесткие условия соответствующим образом для получения чистого и определяемого сигнала гибридизации. Предпочтительными молекулами являются такие, которые гибридизуются в вышеуказанных условиях с комплементарной SEQ ID NO: 1 и которые кодируют функциональный или полноразмерный белок. Еще более предпочтительными гибридизующимися молекулами являются такие, которые гибридизуются в вышеуказанных условиях с комплементарной цепью открытой рамки считывания SEQ ID NO: 1.
В настоящем описании молекулу нуклеиновой кислоты называют «выделенной», когда молекула нуклеиновой кислоты является по существу отделенной от загрязняющих молекул нуклеиновой кислоты, кодирующих другие полипептиды.
Настоящее изобретение, кроме того, обеспечивает фрагменты описанных молекул нуклеиновой кислоты. В настоящем описании фрагмент молекулы нуклеиновой кислоты относится к небольшой части кодирующей или некодирующей последовательности. Размер фрагмента определяет предназначение. Например, если выбирают фрагмент, кодирующий активную часть белка, фрагмент должен быть достаточно большим для кодирования функционального участка(ов) белка. Например, могут быть использованы фрагменты, которые кодируют пептиды, соответствующие предсказуемым антигенным участкам. Если фрагмент будет использоваться в качестве зонда нуклеиновой кислоты или праймера ПЦР, тогда длину фрагмента выбирают так, чтобы получить относительно небольшое количество ложноположительных результатов при зондировании/примировании (см. обсуждение в Разделе G).
Фрагменты молекул нуклеиновой кислоты согласно настоящему изобретению (т.е. синтетические олигонуклеотиды), которые используют в качестве зондов или специфических праймеров для полимеразной цепной реакции (ПЦР) или для синтеза последовательности гена, кодирующего белки согласно изобретению, могут быть легко синтезированы химическими методами, например, фосфорамидитным методом Matteucci et al., ((1981) J. Am. Chem. Soc. 103: 3185-3191) или с использованием автоматизированных методик синтеза. Кроме того, более крупные сегменты ДНК легко могут быть получены хорошо известными способами, такими как синтез группы олигонуклеотидов, которые определяют различные блочные сегменты гена, с последующим связыванием олигонуклеотидов для построения полного модифицированного гена.
Молекулы нуклеиновой кислоты согласно настоящему изобретению могут далее быть модифицированы так, чтобы они содержали определяемую метку для диагностических целей и целей зондирования. Множество таких меток известны в данной области и могут быть легко использованы с кодирующими молекулами, описанными в настоящем описании. Подходящие метки включают в себя, но не ограничиваются ими, биотин, меченный радиоактивной меткой, или нуклеотиды, меченные флуоресцентной меткой, и пр. Специалист в данной области может легко использовать любую такую метку для получения меченых вариантов молекул нуклеиновой кислоты согласно изобретению.
С. Выделение других связанных молекул нуклеиновой кислоты
Как описано выше, идентификация и характеристика молекулы нуклеиновой кислоты, имеющей SEQ ID NO: 1, позволяют специалисту выделять молекулы нуклеиновой кислоты, которые, помимо последовательностей, описанных в настоящем описании, кодируют другие члены семейства белков. Кроме того, описанные в настоящее время молекулы нуклеиновой кислоты позволяют специалисту выделять молекулы нуклеиновой кислоты, которые кодируют другие члены семейства белков, помимо белков, имеющих SEQ ID NO: 2.
Например, специалист легко может использовать аминокислотную последовательность SEQ ID NO: 2 для получения антител-зондов для исследования библиотек экспрессии, полученных из соответствующих клеток. Обычно поликлональная антисыворотка от млекопитающих, таких как кролики, иммунизированных очищенным белком (как описано ниже), или моноклональные антитела могут быть использованы для зондирования кДНК млекопитающих или геномной библиотеки экспрессии, такой как библиотека лямбда gtll, для получения соответствующей кодирующей последовательности для других членов семейства белков. Клонированная последовательность кДНК может быть экспрессирована в виде сшитого белка, экспрессирована непосредственно с использованием ее собственной контрольной последовательности, или экспрессирована путем конструкций с использованием контрольных последовательностей, соответствующих определенному организму хозяину, используемому для экспрессии фермента.
Альтернативно, часть кодирующей последовательности, описанной в настоящем изобретении, может быть синтезирована и использована в качестве зонда для поиска ДНК, кодирующей член семейства белков любого организма млекопитающего. Получали олигомеры, содержащие приблизительно 18-20 нуклеотидов (кодирующих отрезок примерно в 6-7 аминокислот), и использовали для скрининга библиотек геномной ДНК или кДНК для гибридизации в жестких условиях или условиях достаточной жесткости для исключения нежелательного уровня ложноположительных результатов.
Кроме того, пары олигонуклеотидных праймеров могут быть получены для использования в ПЦР для селективного клонирования кодирующей молекулы нуклеиновой кислоты. Цикл ПЦР денатурации/отжига/удлинения для использования таких ПЦР-праймеров хорошо известны в данной области и может легко быть адаптирован для использования в выделении других кодирующих молекул нуклеиновой кислоты.
Молекулы нуклеиновой кислоты, кодирующие другие члены семейства белков, также могут быть идентифицированы в существующей геномной или другой информации о последовательностях с использованием любого доступного расчетного метода, включая, но не ограничиваясь ими, следующие: PSI-BLAST (Altschul et al. (1997) Nucl. Acids Res. 25:3389-3402); PHI-BLAST (Zhang et al. (1998), Nucl. Acids Res. 26: 3986-3990), 3D-PSSM (Kelly et al. (2000), J. Mol. Biol. 299: 499-520); и других методов компьютерного анализа (Shi et al. (1999), Biochem. Biophys. Res. Commun. 262: 132-138 и Matsunami et al. (2000), Nature 404: 601-604).
D. Молекулы рДНК, содержащие молекулу нуклеиновой кислоты
Настоящее изобретение, кроме того, связано с рекомбинантными молекулами ДНК (рДНК), которые содержат кодирующую последовательность. В настоящем описании рДНК представляет собой молекулу ДНК, которая была подвергнута молекулярным манипуляциям in situ. Способы создания молекул рДНК хорошо известны в данной области, например, см. Sambrook et al. Molecular Cloning - A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001. В предпочтительных молекулах рДНК кодирующая последовательность ДНК оперативно связана с последовательностями, контролирующими экспрессию, и/или последовательностями векторов.
Выбор вектора и/или последовательностей, контролирующих экспрессию, с которыми одна из последовательностей, кодирующих семейство белков согласно настоящему изобретению, оперативно связаны, зависит непосредственно, как хорошо известно в данной области, от желаемых функциональных свойств, например, экспрессии белка и трансформируемой клетки-хозяина. Вектор, предусмотренный настоящим изобретением, способен по меньшей мере направлять репликацию или вставку в хромосомы хозяина, а предпочтительно также и экспрессию структурного гена, включенного в молекулу рДНК.
Элементы, контролирующие экспрессию, которые используют для регуляции экспрессии оперативно связанной последовательности, кодирующей белок, известны в данной области и включают в себя, но не ограничиваются ими, индуцируемые промоторы, конститутивные промоторы, сигналы секреции и другие регуляторные элементы. Предпочтительно, индуцируемый промотор является легко контролируемым, например, отвечающим на питательные вещества в среде клетки-хозяина.
В одном варианте осуществления изобретения вектор, содержащий кодирующую молекулу нуклеиновой кислоты, будет включать в себя прокариотический репликон, т.е. последовательность ДНК, обладающую способностью направлять автономную репликацию и поддерживать рекомбинантную молекулу ДНК вне хромосомы в прокариотической клетке-хозяине, такой как бактериальная клетка-хозяин, трансформированной с его помощью. Такие репликоны хорошо известны в данной области. Кроме того, векторы, которые включают в себя прокариотический репликон, также могут содержать ген, чья экспрессия дает определяемый маркер, такой как устойчивость к лекарственным средствам. Типичными генами бактериальной устойчивости к лекарственным средствам являются таковые, которые придают устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину.
Векторы, которые содержат прокариотический репликон, могут, кроме того, содержать промотор прокариот или бактериофагов, способный направлять экспрессию (транскрипцию и трансляцию) кодирующей последовательности гена в бактериальной клетке-хозяине, такой как E.coli. Промотор представляет собой элемент, регулирующий экспрессию, образованный последовательностью ДНК, которая допускает связывание РНК-полимеразы и транскрипцию. Последовательности промотора, совместимые с бактериальными хозяевами, обычно обеспечивают в плазмидных векторах, содержащих удобные сайты рестрикции для вставки ДНК сегмента согласно настоящему изобретению. Типичными такими векторными плазмидами являются pUC8, pUC9, pBR322 и pBR329, доступные от BioRad Laboratories (Richmond, CA), pPL и pKK223, доступные от Pharmacia (Piscataway, NJ).
Векторы экспрессии, совместимые с эукариотическими клетками, предпочтительно совместимые с клетками позвоночных, также могут быть использованы для получения молекул ДНК, которые содержат кодирующую последовательность. Векторы экспрессии эукариотических клеток, включающих вирусные векторы, хорошо известны в данной области и доступны из нескольких коммерческих источников. Обычно обеспечивают такие векторы, содержащие удобные участки рестрикции для вставки желаемого сегмента ДНК. Такие типичные векторы представляют собой pSVL и pKSV-10 (Pharmacia), pBPV-1/pML2d (International Biotechnologies, Inc.), pTDT1 (ATCC #31255), вектор pCDM8, описанный в настоящем описании, и подобные эукариотические векторы экспрессии. Векторы могут быть модифицированы и включать тканеспецифичные промоторы, если необходимо.
Векторы экспрессии эукариотических клеток, используемые для создания молекул рДНК согласно настоящему изобретению, могут, кроме того, содержать селективный маркер, который эффективен в эукариотических клетках, предпочтительно, маркер устойчивости к лекарственным средствам. Предпочтительным маркером устойчивости к лекарственным средствам является ген, чья экспрессия приводит к устойчивости к неомицину, т.е. ген неомицинфосфотрансферазы (neo) (Southern et al. (1982) J. Mol. Anal. Genet. 1:327-341). Альтернативно, селективный маркер может присутствовать на отдельной плазмиде, и два вектора вводят путем совместной трансфекции клетки-хозяина и отбирают путем культивирования в соответствующем лекарственном средстве в качестве селективного маркера.
Е. Клетки-хозяева, содержащие экзогенно вводимую молекулу кодирующей нуклеиновой кислоты
Настоящее изобретение, кроме того, обеспечивает клетки-хозяева, трансформированные молекулой нуклеиновой кислоты, которая кодирует белок согласно настоящему изобретению. Клетка-хозяин может быть прокариотической или эукариотической. Эукариотические клетки, применимые для экспрессии белка согласно изобретению, не ограничены, пока клеточная линия совместима с методами культуривирования клеток и совместима с репродукцией вектора экспрессии и экспрессией генного продукта. Предпочтительные эукариотические клетки-хозяева включают в себя, но не ограничиваются ими, клетки дрожжей, насекомых и млекопитающих, предпочтительно клетки позвоночных, такие как клеточные линии мышей, крыс, обезьян и человека. Предпочтительные эукариотические клетки-хозяева включают клетки яичника китайского хомяка (СНО), доступные от ATCC как CCL61, клетки мышиных эмбрионов NIH Swiss (NIH/3T3), доступные от ATCC как CRL 1658, клетки почек детенышей хомяка (BHK) и пр. клеточные линии эукариотических тканевых культур.
Любой прокариотный организм-хозяин может быть использован для экспрессии молекулы рДНК, кодирующей белок согласно изобретению. Предпочтительным прокариотическим организмом-хозяином является E.coli.
Трансформация соответствующих клеток-хозяев с помощью молекулы рДНК согласно настоящему изобретению осуществляется хорошо известными способами, которые обычно зависят от типа используемого вектора и используемой системы организма-хозяина. В отношении трансформации прокариотических клеток-хозяев обычно используют способы электропорации и обработки солью (см., например, Cohen et al. (1972), Proc. Natl. Acad. Sci. USA 69:2110; и Sambrook et al. выше). В отношении трансформации клеток позвоночных векторами, содержащими рДНК, о