Аминоацильные производные пролекарства и лекарственные средства для лечения тромбоэмболических заболеваний
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I):
в которой R1 означает водород или алкил с 1-4 атомами углерода, R2 означает водород и L означает алкандиильную группу с 1-4 атомами углерода, одна СН2-группа в которой может быть заменена на атом кислорода или группу формулы:
, , или ,
в которой * означает место соединения с атомом азота, R3 означает водород, метил, пропан-2-ил, пропан-1-ил, имидазол-4-илметил, гидроксиметил или 4-аминобутан-1-ил или R3 соединен с R1, совместно с которым образует (СН2)3- или (СН2)4-группу, R4 означает водород или метил, R5 означает алкил с 1-4 атомами углерода и R6 означает водород или алкил с 1-4 атомами углерода, а также к его соли и к способу их получения. Технический результат - получены новые соединения, которые могут найти свое применение в медицине для лечения и/или профилактики болезней, прежде всего тромбоэмболических заболеваний. 3 н. и 2 з.п. ф-лы, 4 табл.
Реферат
Настоящее изобретение относится к производным пролекарства 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксоморфолин-4-ил)фенил]-1,3-оксазолидин-5-ил}метил)-тиофен-2-карбоксамида, способу их получения, их применению для лечения и/или профилактики болезней, а также к их применению для изготовления лекарственных средств, предназначенных для лечения и/или профилактики болезней, прежде всего тромбоэмболических заболеваний.
Пролекарствами называют производные действующего вещества, которые перед непосредственным высвобождением действующего вещества претерпевают протекающую in vivo одностадийную или многостадийную биотрансформацию ферментативного и/или химического типа. Для оптимизации комплекса свойств лежащего в основе пролекарства действующего вещества, как правило, используют остаток пролекарства [Р.Ettmayer и другие, J. Med. Chem. 47, 2393 (2004)]. При этом для обеспечения оптимального действия как структура остатка пролекарства, так и необходимый механизм высвобождения действующего вещества следует приводить в чрезвычайно точное соответствие с индивидуальным действующим веществом, показанием, местом действия и способом применения. Большое количество лекарственных средств применяют в виде пролекарств, обладающих более высокой биодоступностью по сравнению с лежащим в их основе действующим веществом, которой достигают, например, благодаря оптимизации физико-химических характеристик, в частности растворимости, активных и пассивных абсорбционных свойств или специфического распределения в тканях. Из обширного перечня посвященной пролекарствам литературы особо следует упомянуть, например, Н.Bundgaard (издатель), Design of Prodrugs: Bioreversible derivatives for various functional groups and chemical entities, издательство Elsevier Science Publishers B.V., 1985.
5-Хлор-N-({(5S)-2-оксо-3-[4-(3-оксоморфолин-4-ил)фенил]-1,3-оксазолидин-5-ил}метил)тиофен-2-карбоксамид [BAY 59-7939, соединение (А)] является орально действующим прямым ингибитором фактора Ха серин-протеазы, которая выполняет незаменимую функцию при регулировании свертывания крови. В настоящее время указанное соединение находится на стадии углубленного клинического испытания в качестве возможного нового действующего вещества лекарственных средств, используемых для предупреждения и лечения тромбоэмболических заболеваний [S.Roehrig и другие, J. Med. Chem. 48, 5900 (2005)].
Однако соединение (А) обладает лишь ограниченной растворимостью в воде и физиологических средах, что, например, осложняет его внутривенное применение в качестве действующего вещества. В связи с этим в основу настоящего изобретения была положена задача выявить производные или пролекарства соединения (А), которые обладают повышенной растворимостью в указанных средах и одновременно допускают возможность контролируемого высвобождения действующего вещества (А) в организме пациента после применения.
В международной заявке WO 2005/028473 описаны ацилоксиметилкарбаматные пролекарства оксазолидинонов, используемые для повышения оральной биодоступности. Из международной заявки WO 01/00622 известно об ацильных пролекарствах карбаматных ингибиторов инозин-5'-монофосфат-дегидрогеназы. Иной тип амидных пролекарств оксазолидинонов, которые высвобождают лежащее в их основе действующее вещество в соответствии с многостадийным механизмом активирования, приведен в международной заявке WO 03/006440.
Объектом настоящего изобретения являются соединения общей формулы (I):
в которой
R1 означает водород или алкил с 1-4 атомами углерода, который может быть замещен гидрокси или алкокси с 1-4 атомами углерода,
R2 означает водород или алкил с 1-4 атомами углерода и
L означает алкандиильную группу с 1-4 атомами углерода, одна СН2-группа в которой может быть заменена на атом кислорода или группу формулы:
, ,
или ,
в которой
* означает место соединения с атомом азота,
R3 означает боковую группу природной α-аминокислоты или ее гомологов или изомеров или
R3 соединен с R1, совместно с которым образует (СН2)3- или (СН2)4-группу,
R4 означает водород или метил,
R5 означает алкил с 1-4 атомами углерода и
R6 означает водород или алкил с 1-4 атомами углерода,
а также их соли, сольваты и сольваты солей.
Предлагаемыми в изобретении соединениями являются соединения формулы (I), их соли, сольваты и сольваты солей, указанные ниже соединения, обладающие формулой (I), их соли, сольваты и сольваты солей, а также указанные ниже в качестве примеров осуществления изобретения соединения, обладающие формулой (I), их соли, сольваты и сольваты солей, если под указанными ниже соединениями, обладающими формулой (I), уже не подразумеваются соли, сольваты и сольваты солей.
Предлагаемые в изобретении соединения в зависимости от их структуры могут находиться в форме стереоизомеров (энантиомеров, диастереомеров). В связи с этим настоящее изобретение относится также к энантиомерам или диастереомерам и их смесям. Стереоизомеры с соответствующей структурой могут быть выделены из подобных смесей энантиомеров и/или диастереомеров известными методами.
В случае если предлагаемые в настоящем изобретении соединения могут находиться в форме таутомеров, изобретение относится ко всем без исключения таутомерным формам.
В соответствии с настоящим изобретением предпочтительными солями являются физиологически приемлемые соли предлагаемых в изобретении соединений. Под подобными солями подразумеваются также соли, которые непригодны для фармацевтического применения, однако могут быть использованы, например, для выделения или очистки предлагаемых в изобретении соединений.
Физиологически приемлемыми солями предлагаемых в изобретении соединений являются образующиеся по реакции присоединения соли минеральных кислот, карбоновых кислот и сульфокислот, например соли соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфокислоты, этансульфокислоты, толуолсульфокислоты, бензолсульфокислоты, нафталиндисульфокислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты.
В соответствии с настоящим изобретением под сольватами подразумевают формы предлагаемых в изобретении соединений, которые представляют собой комплексы, образуемые этими соединениями в твердом или жидком состоянии благодаря координации молекул растворителя. Гидраты являются особой формой сольватов и образуются благодаря координации молекул воды. В соответствии с настоящим изобретением предпочтительными сольватами являются гидраты.
Согласно настоящему изобретению заместители в отсутствие особых указаний могут означать следующее.
Алкил с 1-4 атомами углерода и алкил с 1-3 атомами углерода согласно изобретению означают неразветвленный или разветвленный алкильный остаток с 1-4, соответственно 1-3 атомами углерода. Предпочтительным является неразветвленный алкильный остаток с 1-3 атомами углерода. Примерами предпочтительных алкильных остатков являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Алкокси с 1-4 атомами углерода согласно изобретению означает неразветвленный или разветвленный алкоксильный остаток с 1-4 атомами углерода. Примерами предпочтительных алкоксильных остатков являются метокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси.
Алкандиил с 1-4 атомами углерода согласно изобретению означают неразветвленный или разветвленный двухвалентный алкильный остаток с 1-4 атомами углерода. Предпочтительным является неразветвленный алкандиильный остаток с 2-4 атомами углерода. Примерами предпочтительных алкандиильных остатков являются метилен, 1,2-этилен, этан-1,1-диил, 1,3-пропилен, пропан-1,1-диил, пропан-1,2-диил, пропан-2,2-диил, 1,4-бутилен, бутан-1,2-диил, бутан-1,3-диил и бутан-2,3-диил.
Остатком R3 могут являться как боковые группы α-аминокислот природного происхождения, так и боковые группы гомологов и изомеров подобных α-аминокислот. При этом α-аминокислота может обладать как L-, так и D-конфигурацией или может являться смесью соответствующих L- и D-форм. Примерами боковых групп являются водород (глицин), метил (аланин), пропан-2-ил (валин), пропан-1-ил (норвалин), 2-метилпропан-1-ил (лейцин), 1-метилпропан-1-ил (изолейцин), бутан-1-ил (норлейцин), фенил (2-фенилглицин), бензил (фенилаланин), п-гидроксибензил (тирозин), индол-3-илметил (триптофан), имидазол-4-илметил (гистидин), гидроксиметил (серин), 2-гидроксиэтил (гомосерин), 1-гидроксиэтил (треонин), меркаптометил (цистеин), метилтиометил (S-метилцистеин), 2-меркаптоэтил (гомоцистеин), 2-метилтиоэтил (метионин), карбамоилметил (аспарагин), 2-карбамоилэтил (глутамин), карбоксиметил (аспарагиновая кислота), 2-карбоксиэтил (глутаминовая кислота), 4-аминобутан-1-ил (лизин), 4-амино-3-гидроксибутан-1-ил (гидроксилизин), 3-аминопропан-1-ил (орнитин), 3-гуанидинопропан-1-ил (аргинин) и 3-уреидопропан-1-ил (цитруллин). Предпочтительными α-аминокислотными боковыми группами в качестве остатка R3 являются водород (глицин), метил (аланин), пропан-2-ил (валин), пропан-1-ил (норвалин), имидазол-4-илметил (гистидин), гидроксиметил (серин), 1-гидроксиэтил (треонин), карбамоилметил (аспарагин), 2-карбамоилэтил (глутамин), 4-аминобутан-1-ил (лизин), 3-аминопропан-1-ил (орнитин) и 3-гуанидинопропан-1-ил (аргинин). Предпочтительной является соответствующая L-конфигурация.
В случае если остатки предлагаемых в изобретении соединений содержат заместители, количество последних в отсутствие особых указаний может составлять один или более. В случае замещения предлагаемых в изобретении соединений несколькими остатками того или иного типа последние являются такими, как указано выше, независимо друг от друга. Предпочтительным является замещение одним, двумя или тремя одинаковыми или разными заместителями. Еще более предпочтительным является замещение одним заместителем.
Предпочтительными являются соединения формулы (I), в которой
R1 означает водород или алкил с 1-4 атомами углерода,
R2 означает водород и
L означает алкандиильную группу с 2-4 атомами углерода или группу формулы:
, или ,
в которой
* означает место соединения с атомом азота,
R3 означает водород, метил, пропан-2-ил, пропан-1-ил, имидазол-4-илметил, гидроксиметил, 1-гидроксиэтил, карбамоилметил, 2-карбамоилэтил, 4-аминобутан-1-ил, 3-аминопропан-1-ил или 3-гуанидинопропан-1-ил или
R3 соединен с R1, совместно с которым образует (СН2)3- или (СН2)4-группу,
R4 означает водород или метил,
R5 означает метил и
R6 означает водород или метил,
а также их соли, сольваты и сольваты солей.
При этом особое значение имеют соединения формулы (I), в которой R1 означает водород или алкил с 1-3 атомами углерода.
Особое значение имеют также соединения формулы (I), в которой
L означает неразветвленную алкандиильную группу с 2-4 атомами углерода.
Особенно предпочтительными являются соединения формулы (I), в которой
R1 означает водород, метил или н-бутил,
R2 означает водород и
L означает CH2CH2-группу или группу формулы:
или ,
в которой
* означает место соединения с атомом азота,
R3 означает водород, метил, пропан-2-ил, пропан-1-ил, имидазол-4-илметил, гидроксиметил, 1-гидроксиэтил, карбамоилметил, 2-карбамоилэтил, 4-аминобутан-1-ил, 3-аминопропан-1-ил или 3-гуанидинопропан-1-ил или
R3 соединен с R1, совместно с которым образует (СН2)3- или (СН2)4-группу,
R4 означает водород или метил и
R6 означает водород или метил,
а также их соли, сольваты и сольваты солей.
При этом особое значение имеют соединения формулы (I), в которой
R1 означает водород или метил.
Особое значение имеют также соединения формулы (I), в которой
L означает CH2CH2-группу.
Другим объектом настоящего изобретения является способ получения предлагаемых в изобретении соединений формулы (I), отличающийся тем, что
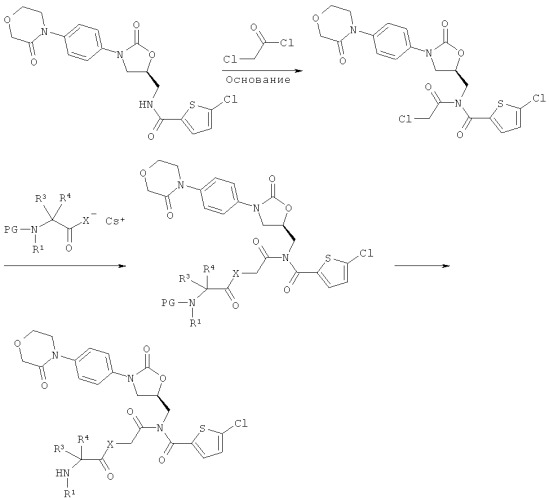
[А] соединение (А):
благодаря реализуемому в инертном растворителе в присутствии основания взаимодействию с соединением формулы (II):
,
в которой R2 такой, как указано выше, и
Q означает отщепляемую группу, например, такую как хлор, бром или йод,
переводят в соединение формулы (III):
,
в которой Q и R2 такие, как указано выше,
которое в инертном растворителе подвергают взаимодействию с цезиевой солью α-аминокарбоновой или α-аминотиокарбоновой кислоты формулы (IV):
в которой R1, R3 и R4 соответственно такие, как указано выше,
PG означает аминозащитную группу, например, такую как трет-бутоксикарбонил (Вос) или бензилоксикарбонил (Z), и
Х означает атом кислорода или серы,
приводящему к образованию соединения формулы (V):
,
в которой R1, R2, R3, R4, PG и Х соответственно такие, как указано выше,
и защитную группу PG удаляют обычными методами, получая соединение формулы (I-A):
,
в которой R1, R2, R3, R4 и Х соответственно такие, как указано выше,
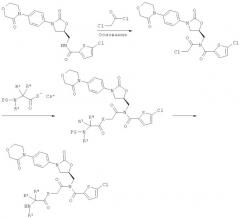
[В] соединение (А) подвергают осуществляемому в инертном растворителе в присутствии основания взаимодействию с соединением формулы (VI):
,
в которой PG такой, как указано выше,
R1A означает алкил с 1-4 атомами углерода, который может быть замещен гидрокси или алкокси с 1-4 атомами углерода, и
L1 означает алкандиильную группу с 1-4 атомами углерода, в которой одна СН2-группа может быть заменена на атом кислорода,
приводящему к образованию соединения формулы (VII):
,
в которой R1A, L1 и PG соответственно такие, как указано выше,
и защитную группу PG удаляют обычными методами, получая соединение формулы (I-B):
,
в которой R1A и L1 такие, как указано выше,
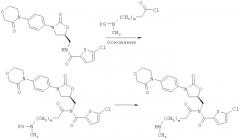
[С] соединение (В):
стандартными методами химии пептидов переводят в соединение формулы (VIII):
,
в которой PG, R1, R2 и R5 соответственно такие, как указано выше, и
L2 означает (СН2)2- или CR3R4-группу, в которой R3 и R4 соответственно такие, как указано выше,
которое подвергают осуществляемому в инертном растворителе в присутствии основания взаимодействию с соединением формулы (IX):
,
приводящему к образованию соединения формулы (X):
,
в которой PG, L2, R1, R2 и R5 соответственно такие, как указано выше,
и защитную группу PG удаляют обычными методами, получая соединение формулы (I-C):
,
в которой L2, R1, R2 и R5 соответственно такие, как указано выше,
или
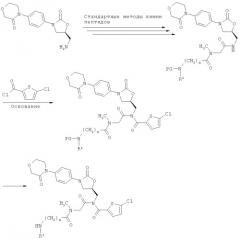
[D] соединение (А) подвергают осуществляемому в инертном растворителе в присутствии основания взаимодействию с соединением формулы (XI):
в которой
L1 означает алкандиильную группу с 1-4 атомами углерода, в которой одна СН2-группа может быть заменена на атом кислорода, и
PG1 и PG2 независимо друг от друга означают аминозащитную группу, например, такую как трет-бутоксикарбонил (Boc), бензилоксикарбонил (Z) или п-метоксибензил (РМВ), и могут быть одинаковыми или разными,
приводящему к образованию соединения формулы (XII):
,
в которой L1, PG1 и PG2 соответственно такие, как указано выше,
и защитные группы PG1 и PG2 одновременно или последовательно удаляют обычными методами, получая соединение формулы (I-D):
,
в которой L1 такой, как указано выше,
и соответствующие соединения формул (I-A), (I-B), (I-C) или (I-D) при необходимости с использованием соответствующих (i) растворителей и/или (ii) кислот переводят в их сольваты, соли и/или сольваты солей.
Соединения формул (I-A), (I-B), (I-C) и (I-D) могут образоваться также непосредственно при реализации указанных выше способов в виде соответствующих солей. Подобные соли обработкой основаниями в инертном растворителе, методами хроматографии или посредством ионообменных смол при необходимости могут быть переведены в соответствующие свободные основания.
В соответствии с указанными выше реакционными последовательностями функциональные группы, при необходимости присутствующие в остатках R1, R1A и/или R3, в случае целесообразности и необходимости также могут находиться во временно защищенном состоянии. При этом введение и удаление этих защитных групп, подобно защитным группам PG, PG1 и PG2, осуществляют обычными, известными из химии пептидов методами [см., например, T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, издательство Wiley, Нью-Йорк, 1999; M.Bodanszky, A.Bodanszky, The Practice of Peptide Synthesis, издательство Springer, Берлин, 1984].
При этом при необходимости присутствующие в остатках R1, R1A и/или R3 подобные защитные группы могут быть удалены одновременно с отщеплением защитных групп PG или на отдельной реакционной стадии, реализуемой до или после отщепления защитных групп PG.
В соответствии с рассмотренными выше способами в качестве аминозащитной группы PG, PG1 или PG2 предпочтительно используют трет-бутоксикарбонил (Boc), бензилоксикарбонил (Z) или п-метоксибензил (РМВ). Отщепление этих защитных групп осуществляют обычными методами, предпочтительно взаимодействием с сильной кислотой, такой как водородхлорид, водородбромид или трифторуксусная кислота, в инертном растворителе, таком как диоксан, дихлорметан или уксусная кислота, причем отщепление при необходимости можно осуществлять также в отсутствие дополнительного инертного растворителя.
Превращение (В) → (VIII) осуществляют стандартными методами химии пептидов ацилированием соединения (В) соответствующим защищенным дипептидным производным или последовательным сочетанием отдельных, при необходимости надлежащим образом защищенных аминокислотных компонентов [см., например, М.Bodanszky, Principles of Peptide Synthesis, издательство Springer, Berlin, 1993; H.-D.Jakubke, H.Jeschkeit, Aminosauren, Peptide, Proteine, издательство Chemie, Вейнгейм, 1982].
В качестве инертного растворителя на реакционных стадиях (А)+(II) → (III), (А)+(VI) → (VII), (VIII)+(IX) → (X) и (А)+(XI) → (XII) предпочтительно используют тетрагидрофуран, N,N-диметилформамид или диметилсульфоксид, причем особенно предпочтительным является N,N-диметилформамид. Основанием, пригодным для осуществления указанных реакций, прежде всего является гидрид натрия. Указанные реакции в общем случае осуществляют при нормальном давлении в температурном интервале от 0 до +40°С.
Реакционную стадию (III)+(IV) → (V) предпочтительно осуществляют в среде используемого в качестве растворителя N,N-диметилформамида. Взаимодействие в общем случае осуществляют при нормальном давлении в температурном интервале от 0 до +50°С, предпочтительно от +20 до +50°С. Его предпочтительно можно осуществлять также при ультразвуковой обработке.
Соединения формул (II), (IV), (VI), (IX) и (XI) являются известными из литературы, коммерчески доступными продуктами, которые можно синтезировать известными из литературы методами. Получение соединений (А) и (В) описано в S.Roehrig и другие, J. Med. Chem. 48, 5900 (2005).
Получение предлагаемых в изобретении соединений может быть представлено в виде следующих реакционных схем.
Схема 1
[X означает кислород или серу; PG означает аминозащитную группу, например трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Z)].
Схема 2
[m означает целое число от 1 до 4; PG означает аминозащитную группу, например трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Z)].
Схема 3
[n означает 1 или 2; PG означает аминозащитную группу, например трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Z)].
Схема 4
[m означает целое число от 1 до 4; PG1, PG2 означают аминозащитные группы, например трет-бутоксикарбонил (Вос), бензилоксикарбонил (Z) или п-метоксибензил (РМВ)].
Предлагаемые в изобретении соединения и их соли являются полезными пролекарствами действующего вещества - соединения (А). С одной стороны, они обладают высокой стабильностью при рН, равном 4, а с другой стороны, эффективным превращением в действующее вещество - соединение (А), происходящим in vivo при физиологическом показателе рН. Кроме того, предлагаемые в изобретении соединения хорошо растворимы в воде и других физиологически совместимых средах, в связи с чем они пригодны для терапии прежде всего при внутривенном применении.
Другим объектом настоящего изобретения является применение предлагаемых в изобретении соединений для лечения и/или профилактики заболеваний, предпочтительно тромбоэмболических заболеваний и/или тромбоэмболических осложнений.
К тромбоэмболическим заболеваниям в соответствии с настоящим изобретением прежде всего относятся такие заболевания, как инфаркт миокарда с повышением и без повышения сегмента ST, стабильная стенокардия, нестабильная стенокардия, повторные закупорки и рестенозы после вмешательств в венечные сосуды сердца, таких как ангиопластика или аортокоронарное шунтирование, периферические облитерирующие эндартерииты, эмболии легочной артерии, глубокие венозные тромбозы и тромбозы почечной вены, кратковременные приступы ишемии, а также тромботическое и тромбоэмболическое кровоизлияние в мозг.
Таким образом, предлагаемые в изобретении вещества пригодны также для предупреждения и лечения тромбоэмболий сердечного происхождения, например, таких как мозговые ишемии, апоплексия и систематические тромбоэмболии и ишемии, у пациентов с острой, прерывистой или постоянной мерцательной аритмией, например, такой как мерцание предсердий, у подвергаемых кардиоверсии пациентов, а также у пациентов, страдающих заболеваниями сердечных клапанов или снабженных искусственными сердечными клапанами. Кроме того, предлагаемые в изобретении соединения пригодны для лечения пациентов с распространенным внутрисосудистым свертыванием крови.
Тромбоэмболические осложнения возникают также при микроангиопатических гемолитических анемиях, экстракорпоральных кровообращениях, таких как экстракорпоральный гемодиализ, а также при наличии у пациентов искусственных клапанов сердца.
Кроме того, предлагаемые в изобретении соединения пригодны для профилактики и/или лечения атеросклеротических заболеваний сосудов и воспалительных заболеваний, таких как ревматические заболевания двигательного аппарата, а также для профилактики и/или лечения болезни Альцгеймера. Кроме того, предлагаемые в изобретении соединения можно использовать для торможения опухолевого роста и метастазирования, при микроангиопатии, старческой дегенерации макулы, диабетической ретинопатии, диабетической нефропатии и других микрососудистых заболеваниях, а также для предупреждения и лечения тромбоэмболических осложнений, например, таких как венозные тромбоэмболии, возникающих у онкологических пациентов, прежде всего подвергнутых обширному хирургическому вмешательству или химио- и лучевой терапии.
Другим объектом, настоящего изобретения является применение предлагаемых в изобретении соединений для лечения и/или профилактики заболеваний, прежде всего указанных выше заболеваний.
Другим объектом настоящего изобретения является применение предлагаемых в изобретении соединений для изготовления лекарственного средства, предназначенного для лечения и/или профилактики заболеваний, прежде всего указанных выше заболеваний.
Другим объектом настоящего изобретения является способ лечения и/или профилактики заболеваний, прежде всего указанных выше заболеваний, предусматривающий применение предлагаемых в изобретении соединений.
Другим объектом настоящего изобретения являются лекарственные средства, содержащие предлагаемое в изобретении соединение и одно или несколько других действующих веществ, которые прежде всего предназначены для лечения и/или профилактики указанных выше заболеваний. Примерами предпочтительных действующих веществ, пригодных для использования в соответствующих комбинациях, являются:
- вещества, снижающие уровень липидов, прежде всего ингибиторы НМС-СоА-(3-гидрокси-3-метилглутарил-кофермент А)-редуктазы;
- вещества, используемые для коронарной терапии/вазодилататоры, прежде всего ингибиторы ферментов превращения ангиотензина (АСЕ-ингибиторы); антагонисты рецептора AII (ангиотензина II); антагонисты β-адреноблокатора; антагонисты альфа-1-адреноблокатора; диуретики; блокаторы кальциевого канала; вещества, способствующие повышению уровня циклического гуанозинмонофосфата (cGMP), например, такие как стимуляторы растворимой гуантилатциклазы;
- активаторы плазминогена (тромболитики/фибринолитики) и соединения, повышающие тромболиз/фибринолиз, такие как ингибиторы ингибитора активатора плазминогена (PAI-ингибиторы) или ингибиторы активированного тромбином ингибитора фибринолиза (TAFI-ингибиторы);
- вещества с противосвертывающим действием (антикоагулянты);
- вещества, подавляющие агрегацию тромбоцитов (ингибиторы агрегации тромбоцитов);
- антагонисты рецептора фибриногена (антагонисты гликопротеида-IIb/IIIa);
- антиаритмические средства.
Другим объектом настоящего изобретения являются лекарственные средства, содержащие по меньшей мере одно предлагаемое в изобретении соединение обычно в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически пригодными вспомогательными веществами, а также их применение для указанных выше целей.
Предлагаемые в изобретении соединения могут обладать систематическим и/или местным действием. В соответствии с этим они пригодны, например, для орального, парентерального, пульмонального или назального применения. Предлагаемые в изобретении соединения можно применять в виде форм, соответствующих указанным выше способам применения.
Для орального приема пригодны функционирующие согласно уровню техники формы применения, которые содержат предлагаемые в изобретении соединения в кристаллическом, аморфизованном и/или растворенном состоянии и способны быстро и/или модифицированно их высвобождать: под подобными формами применения подразумевают, например, таблетки (без покрытия или с покрытием, которое, например, обладает устойчивостью к воздействию желудочного сока, замедленной растворимостью или отсутствием растворимости и обеспечивает контролируемое высвобождение предлагаемого в изобретении соединения), таблетки, способные к быстрому разрушению в полости рта, пленки/облатки, пленки/лиофилизаты, капсулы (например, капсулы из жесткого или мягкого желатина), драже, гранулы, пеллеты, порошки, эмульсии, суспензии, аэрозоли или растворы.
Парентеральное применение (например, внутривенное, внутриартериальное, интракардиальное, интраспинальное или интралюмбальное) позволяет исключить стадию резорбции или включает стадию резорбции (например, внутримышечное, подкожное, внутрикожное, чрескожное или внутрибрюшинное применение). Для парентерального применения, в частности, пригодны такие лекарственные формы, как, например, инъекционные и инфузионные препараты в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков.
Для прочих способов применения пригодны, например, ингаляционные лекарственные формы (в частности, порошковые ингаляторы, распылители) или назально применяемые лекарственные формы, такие как капли, растворы или распыляемые растворы.
Предпочтительным является парентеральное, прежде всего внутривенное применение.
Предлагаемые в изобретении соединения могут быть преобразованы в указанные выше формы применения. Соответствующий технологический процесс может быть реализован известным образом благодаря смешиванию предлагаемых в изобретении соединений с инертными, нетоксичными, фармацевтически пригодными вспомогательными веществами. К подобным вспомогательным веществам относятся, в частности, основы (например, микрокристаллическая целлюлоза, лактоза, маннитол), растворители (например, жидкие полиэтиленгликоли), эмульгаторы, диспергаторы, смачивающие агенты (например, додецилсульфат натрия, полиоксисорбитанолеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (в частности, антиоксиданты, например, такие как аскорбиновая кислота), красители (в частности, неорганические пигменты, например, такие как оксиды железа) и средства для корректировки вкуса и/или запаха.
Предпочтительная дозировка действующего вещества, обеспечивающая достижение эффективного результата при парентеральном применении, в общем случае составляет примерно от 0,001 до 1 мг, предпочтительно от 0,01 до 0,5 мг на кг массы тела. В случае орального применения оптимальной дозировке соответствует примерный интервал от 0,01 до 100 мг, предпочтительно от 0,01 до 20 мг и еще более предпочтительно от 0,1 до 10 мг на кг массы тела.
Несмотря на это в некоторых случаях может возникать необходимость в корректировании указанных дозировок, которое определяется массой тела, способом применения действующего вещества, индивидуальным отношением к нему, а также типом препарата и моментом времени, соответственно периодичностью его применения. Так, например, в определенных случаях могут оказаться достаточными дозировки, более низкие по сравнению с указанными выше нижними предельными значениями, тогда как в иных случаях могут потребоваться дозировки, превышающие указанные выше максимальные значения. В последнем случае рекомендуется распределять дозировку на несколько применяемых в течение суток доз.
Приведенные ниже примеры предназначены для пояснения изобретения и не ограничивают его объема.
В отсутствие особых указаний процентные данные в нижеследующих опытах и примерах приведены в массовых процентах, части в массовых частях. Количественные соотношения между растворителями, степени разбавления и концентрации растворов жидких компонентов в жидкостях указаны в соответствующих объемных единицах.
А. Примеры
| Сокращения и аббревиатуры | |
| abs. | абсолютный |
| Boc | трет-бутоксикарбонил |
| ТХ | тонкослойная хроматография |
| ДМФ | N,N-диметилформамид |
| ДМСО | диметилсульфоксид |
| d.Th. | выход от теоретического |
| h | час(-ы) |
| ВЭЖХ | высокоэффективная жидкостная хроматография под высоким давлением |
| ЖХ-МС | комбинированная жидкостная хромато-масс-спектрометрия |
| мин | минута(-ы) |
| МС | масс-спектрометрия |
| ЯМР | ядерный магнитный резонанс |
| Р | пара |
| Pd/C | палладий на активированном угле |
| РМВ | п-метоксибензил |
| quant. | количественный выход |
| Rf | время удержания (при тонкослойной хроматографии) |
| RT | комнатная температура |
| Rt | время удержания (при ВЭЖХ) |
| UV | УФ-спектрометрия |
| об. | объемное соотношение компонентов раствора |
| Z | бензилоксикарбонил |
Методы ЖХ-МС и ВЭЖХ
Метод 1 (препаративная ВЭЖХ)
Колонка VP 250/21 Nukleodur 100-5 С18 ec, Macherey & Nagel Nr. 762002; элюент А: вода/0,01% трифторуксусной кислоты, элюент В: ацетонитрил/0,01% трифторуксусной кислоты; градиент: 0 мин 0% В → 20 мин 20% В → 40 мин 20% В → 60 мин 30% В → 80 мин 30% В → 90 мин 100% В → 132 мин 100% В; расход 5 мл/мин; комнатная температура; УФ-детектор: 210 нм.
Метод 2 (аналитическая ВЭЖХ)
Колонка XTerra 3,9×150 WAT 186000478; элюент А: 10 мл 70%-ной перхлорной кислоты в 2,5 л воды, элюент В: ацетонитрил; градиент: 0,0 мин 20% В → 1 мин 20% В → 4 мин 90% В → 9 мин 90% В; комнатная температура; расход 1 мл/мин.
Метод 3 (ЖХ-МС)
Прибор Micromass LCT с ВЭЖХ Agilent серии 1100; колонка Waters Symmetry С18, 3,5 мкм, 50 мм × 2,1 мм; элюент А: 1 л воды + 1 мл 98-100%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила + 1 мл 98-100%-ной муравьиной кислоты; градиент: 0 мин 100% А → 1 мин 100% А → 6 мин 10% А → 8 мин 0% А → 10 мин 0% А → 10,1 мин 100% А → 12 мин 100% А; расход: 0-10 мин 0,5 мл/мин → 10,1 мин 1 мл/мин → 12 мин 0,5 мл/мин; температура 40°С; УФ-детектор DAD: 208-500 нм.
Метод 4 (ЖХ-МС)
Прибор Micromass ZQ с ВЭЖХ серии HP 1100; УФ-детектор DAD; колонка Phenomenex Synergi, 2 мкм, гидро-RP Mercury 20 мм × 4 мм; элюент А: 1 л воды + 0,5 мл 50%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50%-ной муравьиной кислоты; градиент: 0,0 мин 90% А → 2,5 мин 30% А → 3,0 мин 5% А → 4,5 мин 5% А; расход; 0,0 мин 1 мл/мин → 2,5 мин/3,0 мин/4,5 мин 2 мл/мин; температура 50°С; УФ-детектор: 210 нм.
Метод 5 (ЖХ-МС)
Прибор Micromass Quattro LCZ с ВЭЖХ Agilent серии 1100; колонка Phenomenex Synergi, 2 мкм, гидро-RP Mercury 20 мм × 4 мм; элюент А: 1 л воды + 0,5 мл 50%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50%-ной муравьиной кислоты; градиент: 0,0 мин 90% А → 2,5 мин 30% А → 3,0 мин 5% А → 4,5 мин 5% А; расход: 0,0 мин 1 мл/мин → 2,5 мин/3,0 мин/4,5 мин 2 мл/мин; температура 50°С; УФ-детектор: 208-400 нм.
Метод 6 (ЖХ-МС)
Масс-спектрометр типа Micromass ZQ; ВЭЖХ: Waters Alliance 2795; колонка Phenomenex Synergi, 2 мкм, гидро-RP Mercury 20 мм × 4 мм; элюент А: 1 л воды + 0,5 мл 50%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50%-ной муравьиной кислоты; градиент: 0,0 мин 90% А → 2,5 мин 30% А → 3,0 мин 5% А → 4,5 мин 5% А; расход: 0,0 мин 1 мл/мин → 2,5 мин/3,0 мин/4,5 мин 2 мл/мин; температура 50°С; УФ-детектор: 210 нм.
Метод 7 (аналитическая хиральная ВЭЖХ)
Хиральная силикагелевая фаза (250 мм × 4,6 мм) на основе поли(N-метакрилоил-L-лейциндициклопропилметиламида); элюент: изогексан/этилацетат 35:65 (об.); температура 24°С; расход 2 мл/мин; УФ-детектор: 270 нм.
Метод 8 (аналитическая хиральная ВЭЖХ)
Хиральная силикагелевая фаза (250 мм × 4,6 мм) на основе поли(N-метакрилоил-L-лейцин-трет-бутиламида); элюент: изогексан/этилацетат 35:65 (об.); температура 24°С; расход 2 мл/мин; УФ-детектор: 270 нм.
Метод 9 (аналитическая хиральная ВЭЖХ)
Хиральная силикагелевая фаза (250 мм × 4,6 мм) на основе поли(N-метакрилоил-L-лейцин-трет-бутиламида); элюент: изогексан/этилацетат 65:35 (об.); температура 24°С; расход 2 мл/мин; УФ-детектор: 270 нм.
Метод 10 (препаративная хиральная ВЭЖХ)
Хиральная силикагелевая фаза (670 мм × 40 мм) на основе поли(N-метакрилоил-L-лейцин-дициклопропилметиламида); элюент: изогексан/этил ацетат 25:75 (об.); температура 24°С; расход 80 мл/мин; УФ-детектор: 270 нм.
Метод 11 (препаративная хиральная ВЭЖХ)
Хиральная силикагелевая фаза (670 мм × 40 мм) на основе поли(N-метакрилоил-L-лейцин-трет-бутиламида); элюент: изогексан/этилацетат 65:35 (об.); температура 24°С; расход 50 мл/мин; УФ-детектор: 260 нм.
Метод 12 (ЖХ-МС)
Прибор Micromass Quattro LCZ с ВЭЖХ Agilent серии 1100; колонка Phenomenex Onyx Monolithic C18, 100 мм × 3 мм; элюент А: 1 л воды + 0,5 мл 50%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50%-ной муравьиной кислоты; градиент: 0,0 мин 90% А → 2 мин 65% А → 4,5 мин 5% А → 6 мин 5% А; расход: 2 мл/мин; температура печи 40°С; УФ-детектор: 208-400 н