Антитела и иммуноконъюгаты и их применения
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложены варианты антител, специфичных к эпитопу CD22, расположенному от аминокислоты 22 до аминокислоты 240 CD22. Раскрыты: кодирующий полинуклеотид, вектор экспрессии, клетка-хозяин на его основе и способ получения антитела с использованием клетки. Описаны варианты способа детекции CD22 на основе антител. Раскрыты варианты иммуноконъюгата против CD22 и фармацевтические композиции на их основе для лечения нарушения пролиферации В-клеток, а также варианты способа лечения с использованием фармацевтической композиции. Раскрыт способ ингибирования пролиферации В-клеток на основе иммуноконъюгата. Описаны варианты сконструированного антитела с цистеиновыми заменами, специфичного к CD22 с одним или несколькими свободными цистеинами с величиной тиоловой реактивности в пределах от 0,6 до 1,0. Раскрыты варианты конъюгата «антитело-лекарственное средство», иммуноконъюгата и фармацевтические составы для лечения нарушения пролиферации В-клеток на их основе. Также описаны способ детекции белка CD22 в образце на основе иммуноконъюгата, способ детекции В-клеток и способ лечения злокачественной опухоли на основе конъюгата «антитело-лекарственное средство». Раскрыты: изделие для лечения нарушения пролиферации В-клеток на основе фармацевтического состава и способ получения конъюгата антитело-лекарственное средство. Использование изобретения обеспечивает новые специфичные антитела к CD22 и лекарственные средства на их основе с приемлемой терапевтической эффективностью при пониженной токсичности, что может найти применение в терапии опухолей. 32 н. и 195 з.п. ф-лы, 25 ил., 16 табл.
Реферат
Эта заявка представляет собой непредварительную заявку, поданную в соответствии с 37 CFR раздел 1.53(b), по которой испрашивается приоритет в соответствии с 35 USC раздел 119(e) предварительных заявок США с серийными номерами 60/809328, поданной 30 мая 2006 года, 60/908941, поданной 29 марта 2007 года, и 60/911829, поданной 13 апреля 2007 года, полное содержание которых, таким образом, приведено в описании в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам к CD22 и их иммуноконъюгатам. Изобретение, кроме того, относится к способам применения антител к CD22 и их иммуноконъюгатов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Лимфоциты представляют собой один из многих типов лейкоцитов, образующихся в костном мозге в процессе гемопоэза. Существуют две популяции лимфоцитов: B-лимфоциты (B-клетки) и T-лимфоциты (T-клетки). В настоящей заявке лимфоцитами, представляющими особый интерес, являются B-клетки.
B-клетки созревают в костном мозге и покидают костный мозг, экспрессируя на своей поверхности антигенсвязывающее антитело. Когда наивная B-клетка впервые встречает антиген, к которому специфично ее связанное с мембраной антитело, клетка начинает быстро делиться и ее потомство дифференцируется в B-клетки памяти и эффекторные клетки, называемые "плазматические клетки". B-клетки памяти обладают более длительной продолжительностью жизни и продолжают экспрессировать связанное с мембраной антитело с той же специфичностью, что и исходная родительская клетка. Плазматические клетки не продуцируют связанное с мембраной антитело, но вместо этого продуцируют антитело в форме, которую можно секретировать. Секретируемые антитела являются основными эффекторными молекулами гуморального иммунитета.
Связанные с B-клетками нарушения включают, в качестве неограничивающих примеров, злокачественную лимфому (неходжкинская лимфома, NHL), множественную миелому и хронический лимфолейкоз (CLL, B-клеточный лейкоз (CD5+ B-лимфоциты). Неходжкинские лимфомы (NHL), гетерогенная группа злокачественных опухолей, преимущественно возникающих из B-лимфоцитов, представляют собой приблизительно 4% всех вновь диагностированных злокачественных опухолей (Jemal, A. et al., CA-Cancer J. Clin., 52: 23-47, (2002)). Агрессивная NHL включает приблизительно 30-40% взрослых NHL (Harris, N.L. et al., Hematol. J. 1: 53-66 (2001)) и включает диффузную крупноклеточную B-клеточную лимфому (DLBCL), лимфому мантийных клеток (MCL), лимфому периферических T-клеток и анапластическую крупноклеточную лимфому. Передовая сочетанная химиотерапия вылечивает менее чем половину пациентов с агрессивной NHL, и большинство пациентов, в конечном счете, умирают от этого заболевания (Fisher, R.I. Semin. Oncol. 27(suppl. 12): 2-8 (2000)).
Связанные с B-клетками нарушения также включают аутоиммунные заболевания. Аутоиммунные заболевания остаются клинически важными заболеваниями у людей. Как видно из названия, аутоиммунные заболевания воздействуют посредством собственной иммунной системы организма. Хотя у конкретных типов аутоиммунных заболеваний патологические механизмы отличаются, один из основных механизмов включает связывание определенных антител (называемых в настоящем документе как аутореактивные антитела или аутоантитела) с эндогенными белками организма. Доктора и ученые идентифицировали более 70 клинически определенных аутоиммунных заболеваний, включая ревматоидный артрит, рассеянный склероз, васкулит, иммуноопосредованный диабет и волчанку, такую как системная красная волчанка. Хотя многие аутоиммунные заболевания являются редкими - поражая менее 200000 индивидуумов - в совокупности эти заболевания поражают миллионы американцев, приблизительно пять процентов населения, где большинство заболеваний непропорционально поражает женщин. Хронический характер этих заболеваний приводит к громадной социальной и финансовой нагрузке.
Цитотоксические средства, нацеленные на поверхностные антигены B-клеток, представляют собой важный фокус лечения связанной с B-клетками злокачественной опухоли. Один такой поверхностный антиген B-клеток представляет собой CD20. Первым терапевтическим антителом, одобренным United States Food and Drug Administration для лечения рецидивирующей или устойчивой низкодифференцированной или фолликулярной NHL, был ритуксимаб (ритуксан; Genentech, Inc. (South San Francisco, CA) и IDEC Pharmaceutical Corp. (San Diego, CA)), химерное (мышь/человек) моноклональное антитело к CD20 (Leonard, J.P. et al., Clin. Cane. Res. 10: 5327-5334 (2004)).
Другие B-клеточные антигены, такие как CD19, CD22 и CD52, представляют мишени терапевтического потенциала для лечения лимфомы (Grillo-Lopez A.J. et al., Curr. Pharm. Biotechnol., 2: 301-11, (2001)). CD22 представляет собой 135 кДа рестриктированный B-клетками сиалогликопротеин, экспрессируемый только на поверхности B-клеток на поздних стадиях дифференцировки (Dorken, B. et al., J. Immunol. 136: 4470-4479 (1986)). Преобладающей формой CD22 у людей является CD22-бета, который содержит во внеклеточном домене семь доменов иммуноглобулинового суперсемейства (фиг.1) (Wilson, G.L. et al., J. Exp. Med. 173: 137-146 (1991)). У другой формы, CD22-альфа, отсутствуют домены иммуноглобулинового суперсемейства 3 и 4 (Stamenkovic, I. and Seed, B., Nature 345: 74-77 (1990)). Показано, что связывание лигандов с CD22 человека ассоциировано с доменами иммуноглобулинового суперсемейства 1 и 2 (также обозначаемыми как эпитопы 1 и 2) (Engel, P. et al., J. Exp. Med. 181: 1581-1586, 1995).
При B-клеточной NHL экспрессия CD22 находится в диапазоне от 91% до 99% в агрессивной и медленно растущей популяциях, соответственно (Cesano, A. et al., Blood 100: 350a (2002)). CD22 может функционировать в качестве компонента активационного комплекса B-клетки (Sato, S. et al., Semin. Immunol. 10: 287-296 (1998)) и в качестве молекулы адгезии (Engel, Pl et al., J. Immunol. 150:4719-4732 (1993)). B-клетки мышей с отсутствием CD22 обладают более короткой продолжительностью жизни и усиленным апоптозом, что свидетельствует о ключевой роли этого антигена в жизнеспособности B-клеток (Otipoby, K.L. et al., Nature (Lond) 384: 634-637 (1996)). После связывания с ее природным лигандом(ами) или антителами CD22 быстро интернализуется, обеспечивая мощный костимулирующий сигнал в первичных B-клетках и проапоптотические сигналы в неопластических B-клетках (Sato, S. et al., Immunity 5: 551-562 (1996)).
Антитела к CD22 исследовали в качестве потенциальных лекарственных средств для B-клеточных злокачественных опухолей и других B-клеточных пролиферативных заболеваний. Такие антитела к CD22 включают RFB4 (Mansfield, E. et al., Blood 90: 2020-2026 (1997)), CMC-544 (DiJoseph, J.F., Blood 103: 1807-1814 (2004)) и LL2 (Pawlak-Byczkowska, E.J. et al., Cancer Res. 49: 4568-4577 (1989)). Антитело LL2 (ранее называемое HPB-2) представляет собой моноклональное антитело IgG2a мыши, направленное к антигену CD22 (Pawlak-Byczkowska, E.J. et al., (1989), выше). Иммуногистохимические анализы in vitro продемонстрировали реактивность антитела LL2 относительно 50 из 51 тестируемых образцов B-клеточной NHL, но не относительно других злокачественных опухолей или нормальных лимфоидных тканей (Pawlak-Byczkowska (1989), выше; Stein, R. et al., Cancer Immunol. Immunother. 37: 293-298 (1993)).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; патент США 4975278), обеспечивает направленную доставку молекулы лекарственного средства к опухолям и накопление внутри них, когда системное введение этих неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности для нормальных клеток, также как и для опухолевых клеток, которые необходимо устранить (Baldwin et al., (1986) Lancet pp.(Mar. 15, 1986): 603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al., (ed.), p.475-506). Таким образом добиваются максимальной эффективности с минимальной токсичностью. Как о пригодных при этих стратегиях сообщалось и о поликлональных антителах, и о моноклональных антителах (Rowland et al., (1986) Cancer Immunol. Immunother., 21: 183-87). Лекарственные средства, применяемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., Cancer Immunol. Immunother. 21: 183-87 (1986)). Токсины, применяемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Kerr et al., (1997) Bioconjugate Chem. 8(6): 781-784; Mandler et al., (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13: 786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623) и калихимицин (Lode et al., (1998) Cancer Res. 58: 2928; Hinman et al., (1993) Cancer Res. 53: 3336-3342). Токсины могут осуществлять свое цитотоксическое и цитостатическое действие посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы (Meyer, D.L. and Senter, P.D. "Recent Advances in Antibody Drug Conjugates for Cancer Therapy" в Annual Reports in Medicinal Chemistry, Vol.38 (2003) Chapter 23, 229-237). Некоторые цитотоксические лекарственные средства при конъюгации с большими антителами или белковыми лигандами рецепторов имеют тенденцию становиться неактивными или менее активными.
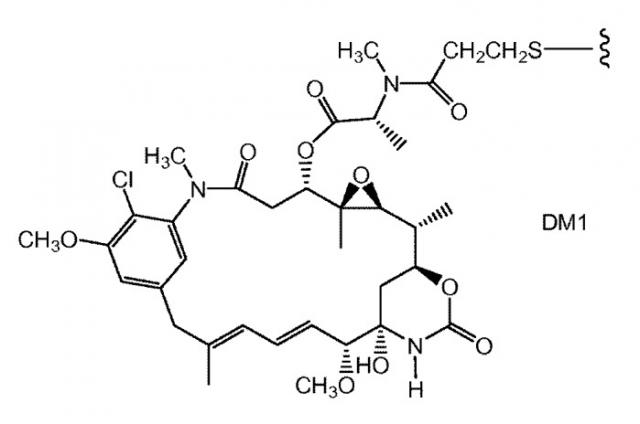
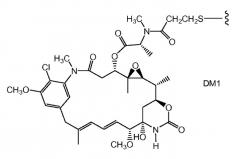
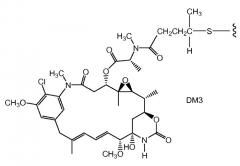
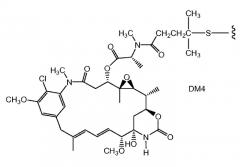
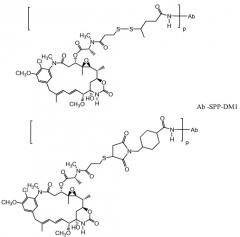
ZEVALIN® (зевалин®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из моноклонального антитела IgG1 каппа мыши, направленного к антигену CD20, находящемуся на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа 111In или 90Y, связанного посредством тиомочевинного линкера-хелатора (Wiseman et al., (2000) Eur. Jour. Nucl. Med. 27(7): 766-77; Wiseman et al., (2002) Blood 99(12): 4336-42; Witzig et al., (2002) J. Clin. Oncol. 20(10): 2453-63; Witzig et al., (2002) J. Clin. Oncol. 20(15): 3262-69). Хотя зевалин обладает активностью против B-клеточной неходжкинской лимфомы (NHL), введение у большинства пациентов приводит к тяжелым и продолжительным цитопениям. В 2000 году для лечения острого миелолейкоза посредством инъекции одобрен MYLOTARG™ (милотарг™) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из антитела CD33 человека, связанного с калихимицином (Drugs of the Future (2000) 25(7):686; патенты США №4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Для лечения злокачественных опухолей, экспрессирующих антиген CanAg, таких как злокачественная опухоль толстого кишечника, поджелудочной железы, желудка и других, разработан кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP с молекулой майтанзиноидного лекарственного средства, DM1. В разработке для потенциального лечения опухолей предстательной железы находится MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела к специфическому мембранному антигену простаты (PSMA), связанного с молекулой майтанзиноидного лекарственного средства, DM1. Ту же молекулу майтанзиноидного лекарственного средства, DM1, посредством недисульфидного линкера, SMCC, связали с моноклональным антителом мыши, TA.1 (Chari et al., (1992) Cancer Research 52: 127-131). Сообщалось, что этот конъюгат в 200 раз менее эффективен, чем соответствующий конъюгат с дисульфидным линкером. В приведенном документе предположено, что линкер SMCC был "нерасщепляемым".
Из морского моллюска, Dolabella auricularia, выделено несколько коротких пептидных соединений и обнаружено, что они обладают биологической активностью (Pettit et al., (1993) Tetrahedron 49: 9151; Nakamura et al., (1995) Tetrahedron Letters 36: 5059-5062; Sone et al., (1995) Journal Org. Chem. 60: 4474). Также получены аналоги этих соединений и для некоторых из них обнаружено, что они обладают биологической активностью (для ознакомления, см. Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277). Например, ауристатин E (US 5635483) представляет собой синтетический аналог природного морского продукта доластатина 10, средства, ингибирующего полимеризацию тубулина посредством связывания того же участка на тубулине, что и противораковое лекарственное средство винкристин (G.R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE и ауристатин E представляют собой линейные пептиды из четырех аминокислот, три из которых являются уникальными для соединений класса доластатина, и C-концевой амид.
Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с (i) химерными моноклональными антителами cBR96 (специфичными к антигенам Lewis Y на карциномах); (ii) cAC10, специфичным к CD30 на злокачественных новообразованиях гематологического происхождения (Klussman, et al. (2004), Bioconjugate Chemistry 15(4): 765-773; Doronina et al. (2003) Nature Biotechnology 21(7): 778-784; "Monometylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al. (2003) Blood 102(4): 1458-1465; US 2004/0018194); (iii) антителами к CD20, такими как Rituxan® (ритуксан®, ритуксимаб) (WO 04/032828), для лечения экспрессирующих CD20 злокачественных опухолей и иммунных нарушений; (iv) антителами к EphB2 2H9 и антителами к IL-8 для лечения колоректального рака (Mao, et al. (2004) Cancer Research 64(3): 781-788); (v) антителом к E-селектину (Bhaskar et al. (2003) Cancer Res. 63: 6387-6394) и (vi) другими антителами к CD30 (WO 03/043583). Монометилауристатин (MMAE) также конъюгировали с 2H9 антителом к EphB2R, который представляет собой т/м тирозинкиназный рецептор 1 типа с большой гомологией у мыши и человека и который сверхэкспрессирован в клетках колоректального рака (Mao et al. (2004) Cancer Res. 64: 781-788).
Монометилауристатин MMAF, вариант ауристатина E (MMAE) с фенилаланином на C-конце (патент США №5767237; патент США №6124431), является менее сильнодействующим, чем MMAE, но более сильнодействующим при конъюгации с моноклональными антителами (Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 623, представленный 28 марта 2004 года). Ауристатин F фенилендиамин (AFP); вариант MMAE с фенилаланином соединяли с mAb к CD70, 1F6, посредством C-конца 1F6 через фенилендиаминовый спейсер (Law et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 625, представленный 28 марта 2004 года).
В качестве возможных терапевтических соединений также исследовали конъюгаты антитело к CD22-токсину. Например, в прежних публикациях в качестве противораковых средств описаны содержащие цепь рицина A иммунотоксины, направленные к анти-CD22 (May, R.D. et al., Chemical Abstracts 106(21): 168656x pages 35-36 (1987); Ghetie, M.A. et al., Cancer Research 48: 2610-2617 (1988); и Amlot, P.L. et al., Blood 82(9):2624-2633 (1993)). В случае если токсин представлял собой радиоактивный изотоп, для эпратузумаба, гуманизированной версии (привитая на CDR) IgG1 LL2, показано наличие терапевтической активности радиоиммуноконъюгата (Juweid, M.E. et al., Clin. Cancer Res. 5 (Suppl 10): 3292s-3303s (1999); Griffiths, G.L. et al., J. Nucl. Med. 44: 77-84 (2003); Linden, O. et al., Clin. Cancer Res. 5(suppl 10): 3287s-3291s (1999)).
В данной области существует необходимость в дополнительных лекарственных средствах для лечения различных связанных с B-клетками злокачественных опухолей, таких как лимфомы, такая как неходжкинская лимфома и другие B-клеточные пролиферативные нарушения. Особенно пригодные для данной цели лекарственные средства включают направленные к B-клеткам против CD22 конъюгаты антитело-лекарственное средство, обладающие значительно меньшей токсичностью, при приемлемой терапевтической эффективности. Настоящее изобретение относится к этим и другим ограничениям и проблемам прошлого.
Приведение в данной заявке любой ссылки не является признанием того, что ссылка относится к известному уровню техники для данной заявки. Все цитируемые в данном документе ссылки, включая патенты, патентные заявки и публикации, в полном объеме включены в качестве ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам к CD22 и способам их использования.
В одном из аспектов предоставлено антитело, связывающееся с CD22, где антитело содержит, по меньшей мере, одну, две, три, четыре, пять или шесть HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 10;
(5) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 10, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(5) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 10;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(5) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В одном из вариантов осуществления антитело содержит HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 10. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4. В одном из вариантов осуществления антитело дополнительно содержит HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 12, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14.
В определенных вариантах осуществления любое из указанных выше антител дополнительно содержит, по меньшей мере, один каркас, выбранный из консенсусного каркаса подгруппы III VH и консенсусного каркаса подгруппы I VL.
В одном из аспектов предоставлено антитело, связывающееся с CD22, где антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 16. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи SEQ ID NO: 16.
В одном из аспектов антитело дополнительно содержит вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 17. В одном из вариантов осуществления антитело содержит вариабельный домен легкой цепи SEQ ID NO: 17.
В одном из аспектов антитело дополнительно содержит вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 18. В одном из вариантов осуществления антитело содержит вариабельный домен легкой цепи SEQ ID NO: 18.
В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 16 и вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 17. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 16 и вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 18. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 16, а вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 17. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 16, а вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 18.
В определенных вариантах осуществления предоставлен полинуклеотид, кодирующий любое из указанных выше антител. В одном из вариантов осуществления предоставлен вектор, содержащий полинуклеотид. В одном из вариантов осуществления предоставлена клетка-хозяин, содержащая вектор. В одном из вариантов осуществления клетка-хозяин является эукариотической. В одном из вариантов осуществления клетка-хозяин представляет собой клетку яичника китайского хомяка (CHO). В одном из вариантов осуществления предоставлен способ получения антитела к CD22, где способ включает культивирование клетки-хозяина в условиях, подходящих для экспрессии полинуклеотида, кодирующего антитело, и выделение антитела.
В одном из аспектов предоставлено антитело, связывающееся с CD22, экспрессируемым на поверхности клетки. В одном из вариантов осуществления антитело связывается с эпитопом в области CD22 человека или мыши, содержащей домен 1, или домен 2, или домены 1 и 2. В одном из вариантов осуществления клетка представляет собой клетку млекопитающего. В одном из вариантов осуществления клетка представляет собой клетку человека. В одном из вариантов осуществления клетка представляет собой злокачественную клетку. В одном из вариантов осуществления клетка представляет собой B-клетку. В одном из вариантов осуществления злокачественная клетка представляет собой B-клетку.
В определенных вариантах осуществления любое из указанных выше антител представляет собой моноклональное антитело. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из фрагментов Fab, Fab'-SH, Fv, scFv или (Fab')2. В одном из вариантов осуществления антитело является гуманизированным. В одном из вариантов осуществления антитело представляет собой антитело человека.
В одном из аспектов предоставлен способ выявления присутствия CD22 в биологическом образце, где способ включает приведение биологического образца в контакт с любым из указанных выше антител в условиях, позволяющих связывание антитела с CD22, и выявление того, образовался ли комплекс между антителом и CD22. В одном из вариантов осуществления биологический образец содержит B-клетки. В одном из вариантов осуществления биологический образец получен у млекопитающего с B-клеточным нарушением и/или с B-клеточным пролиферативным нарушением, включая в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток, или у млекопитающего с подозрением этого нарушения.
В одном из аспектов предоставлен способ диагностики клеточного пролиферативного нарушения, ассоциированного с увеличенной экспрессией CD22, где способ включает приведение тестируемой клетки в контакт с любым из указанных выше антител; определение уровня экспрессии CD22 посредством определения связывания антитела с CD22; и сравнения уровня экспрессии CD22 тестируемой клеткой с уровнем экспрессии CD22 контрольной клеткой, где более высокий уровень экспрессии CD22 тестируемой клеткой по сравнению с контрольной клеткой указывает на наличие клеточного пролиферативного нарушения, ассоциированного с увеличенной экспрессией CD22. В одном из вариантов осуществления тестируемая клетка представляет собой клетку пациента с подозрением на наличие клеточного пролиферативного нарушения, такого как B-клеточное пролиферативное нарушение. В одном из вариантов осуществления клеточное пролиферативное нарушение выбрано из B-клеточных нарушений, включающих в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток. В одном из вариантов осуществления способ включает определение уровня экспрессии CD22 на поверхности тестируемой клетки и сравнение уровня экспрессии CD22 на поверхности тестируемой клетки с уровнем экспрессии CD22 на поверхности контрольной клетки.
В одном из аспектов предоставлен способ диагностики клеточного пролиферативного нарушения, ассоциированного с увеличением количества клеток, таких как B-клетки, экспрессирующие CD22, где способ включает приведение тестируемых клеток в биологическом образце в контакт с любым из указанных выше антител; определение уровня антитела, связанного с тестируемыми клетками в образце посредством определения связывания антитела с CD22; и сравнение с уровнем антитела, связанного с клетками в контрольном образце, где уровень связанного антитела в тестируемом и контрольном образцах нормализован на количество экспрессирующих CD22 клеток и где более высокий уровень связанного антитела в тестируемом образце по сравнению с контрольным образцом указывает на наличие клеточного пролиферативного нарушения, ассоциированного с клетками, экспрессирующими CD22.
В одном из аспектов предоставлен способ определения растворимого CD22 в крови или сыворотке, где способ включает приведение тестируемого образца крови или сыворотки млекопитающего с подозрением на наличие B-клеточного пролиферативного нарушения в контакт с антителом к CD22 по изобретению и определение увеличения растворимого CD22 в тестируемом образце относительно контрольного образца крови или сыворотки нормального млекопитающего. В определенном варианте осуществления способ определения пригоден в качестве способа диагностики B-клеточного пролиферативного нарушения, ассоциированного с увеличением растворимого CD22 в крови или сыворотке млекопитающего.
В одном из аспектов антитела по изобретению включают модифицированные цистеином антитела, где одна или несколько аминокислот исходного антитела замещены аминокислотой свободного цистеина, как описано в WO 2006/034488 (включенной в настоящий документ в качестве ссылки в полном объеме). Так можно модифицировать, т.е. подвергнуть мутации, любую форму антитела к CD22. Например, можно модифицировать исходный Fab-фрагмент антитела так, чтобы получить модифицированный цистеином Fab, обозначенный в настоящем документе как "ThioFab". Подобным образом можно модифицировать исходное моноклональное антитело с получением "ThioMab". Следует отметить, что вследствие димерной природы антитела IgG одноучастковая мутация в тиофаб дает один полученный в результате конструирования цистеиновый остаток, тогда как одноучастковая мутация в тиомаб дает два полученных в результате конструирования цистеиновых остатка. Модифицированные цистеином антитела к CD22 по изобретению включают моноклональные антитела, гуманизированные или химерные моноклональные антитела и антигенсвязывающие фрагменты антител, слитые полипептиды и аналоги, которые предпочтительно связывают связанные с клетками полипептиды CD22. Модифицированное цистеином антитело может альтернативно содержать антитело, содержащее цистеин в описываемом в настоящем документе положении в антителе или Fab, полученный в результате конструирования последовательности и/или отбора антитела, без обязательного изменения исходного антитела, такого как посредством конструирования и отбора антитела посредством фагового дисплея или посредством конструирования каркасных последовательностей и константных областей легких цепей и/или тяжелых цепей de novo. Модифицированное цистеином антитело содержит одну или несколько аминокислот свободного цистеина со значением реакционноспособности тиоловых групп в диапазонах от 0,6 до 1,0; 0,7 до 1,0 или 0,8 до 1,0. Аминокислота свободного цистеина представляет собой остаток цистеина, полученный в результате конструирования в исходном антителе и не являющийся частью дисульфидного мостика. Модифицированные цистеином антитела пригодны для присоединения цитотоксических и/или визуализирующих соединений в участке встроенного цистеина, например, посредством малеимида или галогенацетила. Нуклеофильная реакционноспособность тиоловой функциональной группы остатка Cys по отношению к малеимидной группе приблизительно в 1000 раз больше, чем у любой другой функциональной группы аминокислот в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Специфичная для тиолов функциональная группа в йодацетильных и малеимидных реагентах может реагировать с аминогруппами, но необходимы более высокий pH (>9,0) и более длительное время реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
В одном из вариантов осуществления модифицированное цистеином антитело к CD22 по изобретению содержит полученный в результате конструирования цистеин в любом из следующих положений, где положение представляет собой номер по Kabat et al. в легкой цепи (см. Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и по нумерации EU в тяжелой цепи (включая Fc-область) (см. Kabat et al., (1991), выше), где константная область легкой цепи, обозначенная подчеркиванием на фиг.17A, начинается в положении 108 (нумерация Kabat), а константная область тяжелой цепи, обозначенная подчеркиванием на фиг.17B и 17C, начинается в положении 118 (нумерация EU). Положение также можно указать в виде его положения в последовательной нумерации аминокислот полноразмерных легкой цепи или тяжелой цепи, представленных на фиг.17A-17C. По одному из вариантов осуществления изобретения антитело к CD22 содержит полученный в результате конструирования цистеин в LC-V205C (нумерация Kabat: Val 205; последовательный номер 210 на фиг.17A модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в легкой цепи на фиг.17A показан полужирным шрифтом с двойным подчеркиванием. По одному из вариантов осуществления антитело к CD22 содержит полученный в результате конструирования цистеин в HC-A118C (номер EU: Ala 118; последовательный номер 121 на фиг.17B модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в тяжелой цепи приведен полужирным шрифтом с двойным подчеркиванием на фиг.17B. По одному из вариантов осуществления антитело к CD22 содержит полученный в результате конструирования цистеин Fc-S400C (номер EU: Ser 400; последовательный номер 403 на фиг.17C модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в Fc-области тяжелой цепи приведен на фиг.17C полужирным шрифтом с двойным подчеркиванием. В других вариантах осуществления полученный в результате конструирования цистеин тяжелой цепи (включая Fc-область) находится в любом из указанных положений: (по нумерации EU): 41, 88, 116, 118, 120, 171, 282, 375 или 400. Таким образом, изменения аминокислот в этих положениях в исходном антителе к CD22 по изобретению представляют собой: A41C, A88C, S116C, A118C, T120C, A171C, V282C, S375C или S400C. В других вариантах осуществления полученный в результате конструирования цистеин легкой цепи находится в любом из указанных положений (по нумерации Kabat): 15, 43, 110, 144, 168, 205. Таким образом, изменения аминокислот в этих положениях в исходном антителе к CD22 по изобретению представляют собой: V15C, A43C, V110C, A144C, S168C или V205C.
Модифицированное цистеином антитело к CD22 содержит одну или несколько аминокислот свободного цистеина, где модифицированное цистеином антитело к CD22 связывается с полипептидом CD22 и получено способом, включающим замену одного или нескольких аминокислотных остатков исходного антитела к CD22 цистеином, где исходное антитело содержит, по меньшей мере, одну последовательность HVR, выбранную из
(a) последовательности HVR-L1 RSSQSIVHSNGNTFLE (SEQ ID NO: 9) или последовательности HVR-L1 RSSQSIVHSVGNTFLE (SEQ ID NO: 10) (фиг.2B);
(b) последовательности HVR-L2 KVSNRFS SEQ ID NO: 12 (фиг.2B);
(c) последовательности HVR-L3 FQGSQFPYT (SEQ ID NO: 14) (фиг.2B);
(d) последовательности HVR-H1 GYEFSRSWMN (SEQ ID NO: 2) (фиг.2A);
(e) последовательности HVR-H2 GRIYPGDGDTNYSGKFKG (SEQ ID NO: 4 (фиг.2A) и
(f) последовательности HVR-H3 DGSSWDWYFDV (SEQ ID NO: 6) (фиг.2A).
В определенном аспекте изобретение относится к модифицированному цистеином антителу к CD22, содержащему аминокислотную последовательность, по меньшей мере, приблизительно с 80% идентичностью аминокислотных последовательностей, альтернативно, по меньшей мере, приблизительно с 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью аминокислотных последовательностей с модифицированным цистеином антителом с полноразмерной аминокислотной последовательностью, как описано в настоящем документе, или с аминокислотной последовательностью модифицированного цистеином антитела без сигнального пептида, как описано в настоящем документе.
В еще одном дополнительном аспекте изобретение относится к выделенному модифицированному цистеином антителу к CD22, содержащему аминокислотную последовательность, кодируемую нуклеотидной последовательностью, гибридизующейся с комплементарной молекулой ДНК, кодирующей (a) модифицированное цистеином антитело с полноразмерной аминокислотной последовательностью, как описано в настоящем документе, (b) аминокислотную последовательность модифицированного цистеином антитела без сигнального пептида, как описано в настоящем документе, (c) внеклеточный домен белка трансмембранного модифицированного цистеином антитела, с сигнальным пептидом или без него, как описано в настоящем документе, (d) аминокислотную последовательность, кодируемую любой из последовательностей нуклеиновой кислоты, описываемых в настоящем документе, или (e) любой другой конкретно определенный фрагмент полноразмерной аминокислотной последовательности модифицированного цистеином антитела, как описано в настоящем документе.
В конкретном аспекте изобретение относится к выделенному модифицированному цистеином антителу к CD22 без N-концевой сигнальной последовательности и/или без инициирующего метионина и кодируемому нуклеотидной последовательностью, кодирующей такую аминокислотную последовательность, как описано в настоящем документе. Способы их получения также описаны в настоящем документе, где эти способы включают культивирование клетки-хозяина, содержащей вектор, содержащий соответствующую кодирующую молекулу нуклеиновой кислоты, в условиях, подходящих для