Замещенные производные фенилметанона
Иллюстрации
Показать всеИзобретение относится к новым производным фенилметанона формулы I:
где R1 означает -OR1', гетероцикл, такой как морфолинил, пирролидинил, тетрагидропиранил, фенил, гетероарил, такой как пиразолил, которые не замещены или замещены С1-6алкилом, галогеном; R1' означает C1-6алкил, C1-6алкил, замещенный галогеном, или означает -(СН2)о-насыщенныйС3-6циклоалкил; R2 означает -S(O)2-C1-6алкил, -S(O)2NH-С1-6алкил, NO2 или CN; R3 означает пиридинил, замещенный C1-6алкилом, замещенным галогеном, или фенил, который не замещен или замещен одним-тремя заместителями, выбранными из группы, состоящей из С1-6алкила, C1-6алкокси, CN, NO2, галогена, С1-6алкила, замещенного галогеном, C1-6алкокси, замещенного галогеном, фенила, сульфонамида; Х означает -CH2-, -NH-, -CH2O- или -ОСН2-; n означает 1, 2; m означает 1, 2; о означает 0 или 1; и их фармацевтически приемлемые соли присоединения кислоты. Соединения обладают ингибированием обратного захвата глицина (mGlyT-1b), что позволяет использовать их для получения фармацевтической композиции. 3 н. и 6 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к соединениям общей формулы
где R1 представляет собой -OR1', гетероциклоалкил, арил или гетероарил, которые не замещены или замещены низшим алкилом или галогеном;
R1' представляет собой низший алкил, низший алкил, замещенный галогеном, или представляет собой -(CH2)o-циклоалкил;
R2 представляет собой -S(O)2-низший алкил, -S(O)2NH-низший алкил, NO2 или CN;
R3 представляет собой арил или гетероарил, которые не замещены или замещены одним - тремя заместителями, выбранными из группы, состоящей из низшего алкила, низшего алкокси, CN, NO2, галогена, низшего алкила, замещенного галогеном, низшего алкокси, замещенного галогеном, арила или сульфонамида;
Х представляет собой связь, -СН2-, -NH-, -CH2O- или -ОСН2-;
n представляет собой 1 или 2;
m представляет собой 1 или 2;
о представляет собой 0 или 1;
и к их фармацевтически приемлемым солям присоединения кислоты.
Настоящее изобретение относится к соединениям общей формулы I, к фармацевтическим композициям, содержащим их, и к их применению при лечении неврологических и психоневрологических заболеваний. Неожиданно было обнаружено, что соединения общей формулы I являются хорошими ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают хорошей селективностью в отношении ингибиторов глицинового переносчика 2 (GlyT-2).
Шизофрения представляет собой прогрессирующее и изнуряющее неврологическое заболевание, характеризующееся эпизодическими позитивными симптомами, такими как бред, галлюцинации, расстройства мышления и психоз, и стойкими негативными симптомами, такими как притупленный аффект, нарушение внимания и социальная самоизоляция, и когнитивными нарушениями (Lewis DA and Lieberman JA, Neuron, 28: 325-33, 2000). В течение нескольких десятилетий исследование было сконцентрировано на гипотезе "дофаминергической гиперактивности", что привело к терапевтическим вмешательствам, включающим блокаду дофаминергической системы (Vandenberg RJ and Aubrey KR., Exp. Opin. Ther. Targets, 5 (4): 507-518, 2001; Nakazato A and Okuyama S, et al., Exp. Opin. Ther. Patents, 10 (1): 75-98, 2000). Этот фармакологический подход плохо соответствует негативным и когнитивным симптомам, которые являются лучшими показателями функционального результата (Sharma Т., Br.J. Psychiatry, 174 (suppl. 28): 44-51, 1999).
В середине 1960-х годов была предложена дополнительная модель шизофрении, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственным агентам (кетамину), которые являются неконкурентными антагонистами NMDA-рецептора. Интересно, что у здоровых волонтеров РСР-индуцированное психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию и, таким образом, сильно напоминает шизофрению у пациентов (Javitt DC et al., Biol. Psychiatry, 45: 668-679, 1999). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни NMDAR1-субъединицы, проявляют аномалии в поведении, подобные тем, которые наблюдают в фармакологически индуцированных моделях шизофрении, что подтверждает модель, в которой уменьшение активности NMDA-рецептора приводит к шизофреническому поведению (Mohn AR et al., Cell, 98: 427-236, 1999).
Глутаматная нейротрансмиссия, в частности активность NMDA-рецептора, играет ключевую роль в синаптической пластичности, обучении и памяти, а именно NMDA-рецепторы, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порогового значения синаптической пластичности и формирования памяти (Wiley, NY; Bliss TV и Collingridge GL, Nature, 361: 31-39, 1993). Трансгенные мыши, сверхэкспрессирующие NR2В-субъединицу NMDA, проявляют повышенную синаптическую пластичность, лучшие способности к обучению и лучшую память (Tang JP et al., Nature, 401: 63-69, 1999).
Таким образом, если патофизиология шизофрении включает дефицит глутамата, можно ожидать, что увеличение глутаматной трансмиссии, в частности, посредством активации NMDA-рецептора будет вызывать как антипсихотические эффекты, так и эффекты повышения когнитивной функции.
Известно, что в ЦНС аминокислота глицин имеет по меньшей мере две важные функции. Связываясь со стрихнин-чувствительными глициновыми рецепторами, она действует как тормозная аминокислота, а действуя в качестве основного коагониста глутамата на функцию рецептора N-метил-D-аспартата (NMDA), она также оказывает влияние на возбудительную активность. В то время как глутамат высвобождается из синаптических окончаний зависимым от активности образом, глицин, вероятно, присутствует на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор для его ответа на глутамат.
Один из наиболее эффективных путей контроля синаптических концентраций нейромедиатора состоит в том, чтобы воздействовать на его обратный захват в синапсах. Переносчики нейромедиаторов действуют путем удаления нейромедиаторов из внеклеточного пространства и могут контролировать их внеклеточное время жизни и тем самым модулировать параметры синаптической передачи (Gainetdinov RR et al, Trends в Pharm. Sci., 23 (8): 367-373, 2002).
Глициновые переносчики, которые принадлежат натрий- и хлорид-зависимому семейству переносчиков нейромедиаторов, играют важную роль в терминации постсинаптических глицинергических воздействий и поддержании низкой внеклеточной концентрации глицина путем обратного захвата глицина в пресинаптических нервных окончаниях и в близлежащих тонких глиальных отростках.
Из головного мозга млекопитающих были клонированы два разных гена глициновых переносчиков (GlyT-1 и GlyT-2), которые дают начало двум переносчикам примерно с 50% гомологией аминокислотной последовательности. GlyT-1 представлен четырьмя изоформами, являющимися результатом альтернативного сплайсинга и альтернативного использования промоторов (1а, 1b, 1с и 1d). Только две из этих изоформ были найдены в головном мозге грызунов (GlyT-1а и GlyT-1b). GlyT-2 также показывает некоторую степень гетерогенности. В головном мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализуется в ЦНС и в периферических тканях, тогда как GlyT-2 является специфичным для ЦНС. GlyT-1 имеет преимущественно глиальное распределение, и его находят не только в областях, соответствующих стрихнин-чувствительным глициновым рецепторам, но также за пределами этих областей, где, как предполагается, он участвует в модуляции функции NMDA-рецептора (Lopez-Corcuera В et al., Mol. Mem. Biol, 18: 13-20, 2001). Соответственно, один из способов повышения активности NMDA-рецептора состоит в увеличении концентрации глицина в локальном микроокружении синаптических NMDA-рецепторов путем ингибирования GlyT-1-переносчика (Bergereon R. et al., Proc. Natl. Acad. Sci. USA, 95: 15730-15734, 1998; Chen L et al., J. Neurophysiol.. 89 (2): 691-703, 2003).
Ингибиторы глициновых переносчиков подходят для лечения неврологических и психоневрологических расстройств. Большинство связанных с ними болезненных состояний представляют собой психозы, шизофрению (Armer RE and Miller DJ, Exp. Opin. Ther. Patents, 11 (4): 563-572, 2001), психотические расстройства настроения, такие как большое депрессивное расстройство тяжелого типа, расстройства настроения, связанные с психотическими расстройствами, такими как острый маниакальный синдром или депрессия, связанная с биполярными расстройствами, и расстройства настроения, связанные с шизофренией (Pralong ET et al., Prog. Neurobiol., 67: 173-202, 2002), аутистические расстройства (Carlsson ML, J. Neural Transm. 105: 525-535, 1998), когнитивные расстройства, такие как деменции, включая возрастную деменцию и сенильную деменцию Альцгеймеровского типа, нарушения памяти у млекопитающих, включая человека, синдромы дефицита внимания и боль (Armer RE and Miller DJ, Exp. Opin. Ther. Patents, 11 (4): 563-572, 2001).
Соответственно, увеличение активации NMDA-рецепторов посредством ингибирования GlyT-1 может привести к агентам, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предметами настоящего изобретения являются соединения формулы I по существу, применение соединений формулы I и их фармацевтически приемлемых солей для изготовления лекарств для лечения заболеваний, относящихся к активации NMDA-рецепторов посредством ингибирования GlyT-1, их изготовление, лекарства, основанные на соединении согласно этому изобретению, и их производство, а также применение соединений формулы I для лечения или предотвращения болезней, таких как психозы, дисфункция памяти и обучения, шизофрения, слабоумие и другие заболевания, при которых нарушены когнитивные процессы, такие как синдромы дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями применения соединений настоящего изобретения являются шизофрения, когнитивное нарушение и болезнь Альцгеймера.
Кроме того, изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры.
Как используется здесь, термин «низший алкил» означает насыщенную группу с нормальной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и подобные. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Как используется здесь, термин «циклоалкил» означает насыщенное кольцо, содержащее от 3 до 6 атомов углерода.
Как используется здесь, термин «низший алкокси» означает насыщенную группу с нормальной или разветвленной цепью, содержащую от 1 до 6 атомов углерода, как описано выше, которая присоединена через атом кислорода.
Термин «галоген» означает хлор, йод, фтор и бром.
Термин «арил» означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного или двух конденсированных колец, в котором по меньшей мере одно кольцо является ароматическим по природе, например фенил, бензил, нафтил или бифенил.
Термин «гетероарил» означает одновалентный ароматический карбоциклический радикал из одного или двух конденсированных колец, которые содержат по меньшей мере один гетероатом, например пиридил, пиразинил, пиримидинил, пиридазинил, пиразолил или 1,3,5-триазинил.
Термин «гетероциклоалкил» означает неароматический углеводородный радикал из одного или двух конденсированных колец, которые содержат по меньшей мере один гетероатом, например оксетанил, тетрагидрофуранил, тетрагидропиранил, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил или тиоморфолинил.
Термин «алкил, замещенный галогеном» означает, например, следующие группы: CF3, CHF2, CH2F, CH2CF3, CH2CHF2, CH2CH2F, CH2CH2CF3, CH2CH2CH2CF3, CH2CH2Cl, CH2CF2CF3, CH2CF2CHF2, CF2CHFCF3, С(СН3)2CF3, СН(СН3)CF3 или CH(CH2F)CH2F.
Термин «фармацевтически приемлемые соли присоединения кислоты» включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, пара-толуолсульфоновая кислота и подобные.
Предпочтительные соединения настоящей заявки представляют собой соединения формулы I, где Х является связью и R3 представляет собой фенил, который не замещен или замещен одним - тремя заместителями, выбранными из группы, состоящей из низшего алкила, низшего алкокси, CN, NO2, галогена, низшего алкила, замещенного галогеном, низшего алкокси, замещенного галогеном, арила или сульфонамида, например следующее соединение рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[3-(4-трифторметил-фенил)-пирролидин-1-ил]-метанон.
Предпочтительные соединения настоящей заявки представляют собой, кроме того, те, где Х представляет собой -СН2- и R3 представляет собой фенил, который не замещен или замещен одним - тремя заместителями, выбранными из группы, состоящей из низшего алкила, низшего алкокси, CN, NO2, галогена, низшего алкила, замещенного галогеном, низшего алкокси, замещенного галогеном, арила или сульфонамида, например следующие соединения:
рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[3-(4-трифторметил-бензил)-пирролидин-1-ил]-метанон,
рац-[5-метансульфонил-2-(2,2,3,3,3-пентафтор-пропокси)-фенил]-[3-(4-трифторметил-бензил)-пирролидин-1-ил]-метанон,
рац-(4'-фтор-4-метансульфонил-бифенил-2-ил)-[3-(4-трифторметил-бензил)-пирролидин-1-ил]-метанон,
рац-(2-циклобутилметокси-5-метансульфонил-фенил)-[3-(4-трифторметил-бензил)-пирролидин-1-ил]-метанон или
рац-(2-циклопентилокси-5-метансульфонил-фенил)-[3-(4-трифторметил-бензил)-пирролидин-1-ил]-метанон.
Предпочтительные соединения настоящей заявки представляют собой, кроме того, те, где Х представляет собой -ОСН2- и R3 представляет собой фенил, который не замещен или замещен одним - тремя заместителями, выбранными из группы, состоящей из низшего алкила, низшего алкокси, CN, NO2, галогена, низшего алкила, замещенного галогеном, низшего алкокси, замещенного галогеном, арила или сульфонамида, например следующие соединения:
рац-[3-(4-хлор-феноксиметил)-пирролидин-1-ил]-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-метанон,
рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-(3-п-толилоксиметил-пирролидин-1-ил)-метанон,
рац-[3-(бифенил-4-илоксиметил)-пирролидин-1-ил]-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-метанон,
рац-4-{1-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-бензоил]-пирролидин-3-илметокси}-бензонитрил,
рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[3-(4-нитро-феноксиметил)-пирролидин-1-ил]-метанон,
рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[3-(4-трифторметокси-феноксиметил)-пирролидин-1-ил]-метанон,
рац-[3-(3,4-дихлор-феноксиметил)-пирролидин-1-ил]-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-метанон или
рац-[5-метансульфонил-2-((S)-2,2,2-трифтор-1-метил-этокси)-фенил]-[3-(3-метокси-феноксиметил)-пирролидин-1-ил]-метанон.
Другое воплощение настоящего изобретения представляет собой соединения, где Х представляет собой -NH- или -СН2О-.
Настоящие соединения формулы 1 и их фармацевтически приемлемые соли можно получить известными в данной области способами, например описанными ниже способами (а)-(в), согласно которым:
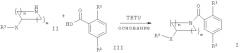
а) подвергают взаимодействию соединение формулы
с соединением формулы
в присутствии активирующего вещества, такого как TBTU 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат) до соединения формулы
где заместители R1, R2 и R3 являются такими, как определено выше, и m и n независимо друг от друга представляют собой 1 или 2;
б) подвергают взаимодействию соединение формулы
с соединением формулы
в условиях реакции Мицунобу в присутствии фосфина до соединения формулы
где заместители R1, R2 и R3 являются такими, как определено выше, Х представляет собой -ОСН2-, и m и n независимо друг от друга представляют собой 1 или 2;
в) подвергают взаимодействию соединение формулы
с соединением формулы
R3-CH2-Hal,
где Hal представляет собой атом галогена, подобный хлору, брому, йоду, в присутствии основания, такого как трет-бутилат натрия, до соединения формулы
где заместители R1, R2 и R3 являются такими, как определено выше, Х представляет собой -CH2O-, и m и n независимо друг от друга представляют собой 1 или 2;
и при желании переводят полученные соединения в фармацевтически приемлемые соли присоединения кислоты.
Соединения формулы 1 могут быть получены согласно вариантам способа (а)-(в) и следующим схемам 1-3. Исходные вещества или имеются в продаже, или же известны из химической литературы, либо могут быть получены в соответствии с хорошо известными в данной области способами.
Схема 1
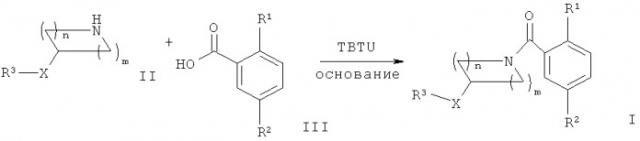
Соединения общей формулы I можно получить в ходе взаимодействия аминных производных формулы II с соответствующе замещенной кислотой формулы III в присутствии активирующего вещества, подобного TBTU (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборату), и основания, такого как N-этилдиизопропиламин (Схема 1).
Аминные соединения формулы II либо имеются в продаже, либо же известны из химической литературы, либо могут быть получены с использованием ряда способов, хорошо известных в данной области.
Кислоты формулы III либо известны из химической литературы, либо могут быть получены с использованием ряда способов, хорошо известных в данной области.
Схема 2
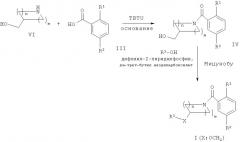
Соединения общей формулы I также можно получить альтернативными способами, как показано на Схеме 2. Например, соединения формулы I (X: OCH2) можно получить в ходе взаимодействия гидрокси-соединения формулы IV со спиртом формулы R3-OH в условиях реакции Мицунобу в присутствии фосфина, подобного трифенилфосфину или дифенил-2-пиридилфосфину, и диалкилазадикарбоксилата, подобного ди-трет-бутил азодикарбоксилату или диэтилазадикарбоксилату. Соединения формулы IV можно получить в ходе взаимодействия аминов формулы VI с соответствующе замещенной кислотой формулы III в присутствии активирующего агента, подобного TBTU (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборату), и основания, такого как N-этилдиизопропиламин.
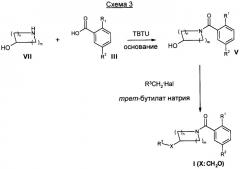
Соединения общей формулы I также можно получить альтернативными способами, как показано на Схеме 3. Например, соединения формулы I (X: СН2О) можно получить в ходе взаимодействия гидрокси-соединения формулы V с алкилирующим агентом формулы R3CH2-Hal, где Hal представляет собой атом галогена, подобный хлору, брому, йоду, в присутствии основания, подобного трет-бутилату натрия. Соединения формулы V можно получить в ходе взаимодействия аминов формулы VII с соответствующе замещенной кислотой формулы III в присутствии активирующего агента, подобного TBTU (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборату), и основания, такого как N-этилдиизопропиламин.
Выделение и очистка соединений
Выделение и очистку соединений и промежуточных соединений, описанных здесь, можно осуществить, если требуется, с помощью любой подходящей процедуры разделения или очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления, или путем комбинации этих процедур. Конкретные иллюстрации подходящих процедур разделения и выделения могут быть даны посредством ссылки на получения и примеры, приведенные ниже. Однако также могут быть использованы, конечно, и другие равноценные процедуры разделения или выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной ВЭЖХ.
Соли соединений формулы I
Соединения формулы I могут быть основными, например, в тех случаях, когда остаток R3 содержит основную группу, такую как группировка алифатического или ароматического амина. В таких случаях соединения формулы I можно превратить в соответствующую соль присоединения кислоты.
Превращение осуществляют, обрабатывая по меньшей мере со стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в диапазоне от 0°С до 50°С. Полученная в результате соль выпадает в осадок спонтанно или может быть выделена из раствора с менее полярным растворителем.
Соли присоединения кислоты основных соединений формулы I можно превратить в соответствующие свободные основания при обработке по меньшей мере со стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п.
Соединения формулы I и их фармацевтически приемлемые соли присоединения обладают полезными фармакологическими свойствами. Конкретно, найдено, что соединения по настоящему изобретению являются хорошими ингибиторами глицинового переносчика I (GlyT-1).
Соединения исследовали согласно тесту, приведенному далее.
Растворы и вещества
Полная среда DMEM: питательная смесь F-12 (Gibco Life-technologies), эмбриональная телячья сыворотка (FBS) 5%, (Gibco life technologies), пенициллин/стрептомицин 1% (Gibco life technologies), гигромицин 0,6 мг/мл (Gibco life technologies), глутамин 1 мМ (Gibco life technologies).
Буфер для обратного захвата (UB): 150 мМ NaCl, 10 мМ Hepes (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота)-Tris, pH 7,4, 1 мМ CaCl2, 2,5 мМ KCl, 2,5 мМ MgSO4, 10 мМ (+) D-глюкоза.
Клетки Flp-in™-CHO (Invitrogen, Кат. № R758-07), стабильно трансфицированные mGlyT1b кДНК.
Анализ ингибирования обратного захвата глицина (mGlvT-1b)
В первый день клетки млекопитающего (Flp-in™-CHO), трансфицированные mGlyT-1b кДНК, засевали с плотностью 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. На второй день среду отсасывали и клетки дважды промывали буфером для обратного захвата (UB). Затем клетки инкубировали в течение 20 мин при 22°С либо без потенциального ингибитора (1), либо с 10 мМ нерадиоактивным глицином (2), либо с потенциальным ингибитором в какой-либо концентрации (3). Для того чтобы получить данные для вычисления концентрации ингибитора, приводящей к 50%-ному ингибированию (например ИК50, концентрации конкурирующего соединения, обеспечивающей 50%-ное ингибирование обратного захвата глицина), использовали диапазон концентраций потенциального ингибитора. Сразу после этого добавляли раствор, содержащий 60 нМ [3H]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при мягком покачивании, и реакцию останавливали путем отсасывания смеси и промывания (три раза) охлажденным до 0°С UB. Клетки лизировали сцинтилляционной жидкостью, покачивали в течение 3 часов, и радиоактивность клеток подсчитывали с использованием сцинтилляционного счетчика.
Предпочтительные соединения показывают ИК50 (мкМ) для GlyT-1 в диапазоне 0,09-0,50, как показано в таблице ниже.
| Пример № | ИК50 (мкМ) | Пример № | ИК50 (мкМ) | Пример № | ИК50 (мкМ) |
| 2 | 0,22 | 16 | 0,32 | 33 | 0,17 |
| 11 | 0,11 | 29 | 0,20 | 35 | 0,13 |
| 13 | 0,09 | 30 | 0,27 | 36 | 0,13 |
| 14 | 0,50 | 31 | 0,45 | 37 | 0,17 |
| 15 | 0,24 | 32 | 0,21 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарств, например, в форме фармацевтических препаратов. Данные фармацевтические препараты могут быть введены перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако также может быть сделано ректальное введение, например, в форме суппозиториев, или парентеральное введение, например, в форме растворов для инъекций.
Для изготовления фармацевтических препаратов соединения формулы I могут быть использованы вместе с фармацевтически инертными неорганическими или органическими носителями. Например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул может быть использована лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и тому подобное. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. Однако в зависимости от природы активного вещества в случае мягких желатиновых капсул носители обычно не требуются. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизирующие агенты, увлажняющие агенты, эмульгаторы, подсластители, красящие вещества, корригенты, соли для регулирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать еще и другие терапевтически полезные вещества.
Лекарства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются предметом настоящего изобретения, как и способ их изготовления, который включает доведение одного или более соединения формулы I и/или фармацевтически приемлемых солей присоединения кислоты и, если требуется, одного или более другого терапевтически полезного вещества до формы галенова препарата вместе с одним или более чем одним терапевтически инертным носителем.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают расстройства центральной нервной системы, например лечение или предотвращение шизофрении, когнитивного нарушения и болезни Альцгеймера.
Дозировку можно варьировать в широких пределах, и, конечно, в каждом конкретном случае она должна быть подобрана в соответствии с индивидуальными потребностями. В случае перорального введения доза для взрослых может меняться от приблизительно 0,01 мг до приблизительно 1000 мг в сутки соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может быть введена в виде однократной дозы или в виде дробных доз, и, кроме того, также может быть превышен верхний предел, когда для этого имеются показания.
Препарат таблеток (влажная грануляция)
| Пункт | Ингредиенты | мг/таблетку | |||
| 5 мг | 25 мг | 100 мг | 500 мг | ||
| 1. | Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. | Лактоза безводная DTG | 125 | 105 | 30 | 150 |
| 3. | Sta-Rx 1500 | 6 | 6 | 6 | 30 |
| 4. | Микрокристаллическая целлюлоза | 30 | 30 | 30 | 150 |
| 5. | Стеарат магния | 1 | 1 | 1 | 1 |
| Всего | 167 | 167 | 167 | 831 |
Методика изготовления
1. Смешивают вещества 1, 2, 3 и 4 и гранулируют с очищенной водой.
2. Сушат гранулы при 50°С.
3. Пропускают гранулы через подходящее помольное оборудование.
4. Добавляют вещество 5 и перемешивают в течение трех минут; прессуют на подходящем прессе.
Препарат капсул
| Пункт | Ингредиенты | мг/капсулу | |||
| 5 мг | 25 мг | 100 мг | 500 мг | ||
| 1. | Соединение формулы I | 5 | 25 | 100 | 500 |
| 2. | Лактоза водная | 159 | 123 | 148 | - |
| 3. | Кукурузный крахмал | 25 | 35 | 40 | 70 |
| 4. | Тальк | 10 | 15 | 10 | 25 |
| 5. | Стеарат магния | 1 | 2 | 2 | 5 |
| Всего | 200 | 200 | 300 | 600 |
Методика изготовления
1. Смешивают вещества 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют вещества 4 и 5 и смешивают в течение 3 минут.
3. Заполняют подходящую капсулу.
Следующие примеры иллюстрируют изобретение, но предполагается, что они не ограничивают его объем. В примерах использованы следующие аббревиатуры:
TBTU: 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат.
Синтез промежуточных соединений формулы II
Пример А1
рац-3-(4-Трифторметил-фенил)-пирролидин
а) Этиловый эфир рац-3-гидрокси-3-(4-трифторметил-фенил)-пирролидин-1-карбоновой кислоты
364 мг магния суспендировали в 2 мл эфира в атмосфере азота. Добавляли 150 мкл 4-бромбензотрифторида и затем раствор 12,6 ммоль 4-бромбензотрифторида в 1,5 мл эфира добавляли по каплям в течение 10 минут при комнатной температуре. Смесь становилась слегка экзотермической и окрашивалась в красно-коричневый цвет, пока реактив Гриньяра образовывался в течение 1,5 часов перемешивания. Смесь охлаждали до 0°С. Раствор 12,5 ммоль 1-N-этоксикарбонил-3-пирролидона в 14 мл эфира добавляли по каплям. Реакционную смесь оставляли при комнатной температуре и перемешивали в течение 2,5 часов. Добавляли по каплям 20% NH4Cl при 0°С, чтобы погасить реакцию. Смесь нагревали до комнатной температуры. Водный слой экстрагировали 3 раза с эфиром. Объединенные органические фазы промывали водой и солевым раствором, высушивали над Na2SO4 и выпаривали. Остаток очищали на силикагеле (элюент: гептан - этилацетат 1/1), что давало указанное в заголовке соединение (61%) в виде желтого твердого вещества, MS (m/e): 362,2 ([М+59], 100%).
б)рац-3-(4-Трифторметил-фенил)-пирролидин-3-ол
К раствору 1,98 ммоль этилового эфира рац-3-гидрокси-3-(4-трифторметил-фенил)-пирролидин-1-карбоновой кислоты в 15 мл диоксана добавляли 8 мл 2,5 н. раствора КОН в бутаноле. Раствор перемешивали при нагревании с обратным холодильником в течение 2 часов. Растворитель удаляли в вакууме и остаток переносили в воду. Водную фазу экстрагировали 3 раза дихлорметаном. Объединенные органические фазы высушивали над Na2SO4, выпаривали и высушивали. Соединение суспендировали в гексане/эфире (≈2:1), фильтровали и промывали гексаном, что давало указанное в заголовке соединение (57%) в виде светло-коричневого твердого вещества, MS (m/e): 232,1 ([М+1], 100%).
в) 3-(4-Трифторметил-фенил)-2,5-дигидро-1 Н-пиррол
К суспензии 0,43 ммоль рац-3-(4-трифторметил-фенил)-пирролидин-3-ола в 0,4 мл дихлорметана в атмосфере аргона добавляли 0,4 мл ТФУ. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 5 дней и концентрировали. Остаток растворяли в этилацетате и 2 н. NaOH добавляли до рН 9-10. Органические фазы высушивали над Na2SO4 и выпаривали, что давало указанное в заголовке соединение (18%) в виде масла, MS (m/e): 214,2 ([М+1], 100%).
г) 3-(4-Трифторметил-фенил)-пирролидин
0,08 ммоль 3-(4-трифторметил-фенил)-2,5-дигидро-1Н-пиррола растворяли в МеОН и HCl в эфире добавляли до рН 1. После 5 минут перемешивания растворители выпаривали. К раствору этой соли в 0,7 мл метанола в атмосфере аргона добавляли 2 мг 10% Pd/C и смесь гидрировали водородом при атмосферном давлении при комнатной температуре в течение 4 часов. Смесь охлаждали, продували аргоном, разбавляли метанолом, фильтровали и растворитель удаляли в вакууме, что давало указанное в заголовке соединение (64%) в виде масла, MS (m/e): 216,3 ([М+1], 100%).
Пример А2
рац-3-о-Толил-пирролидин
а) трет-Бутиловый эфир рац-3-гидрокси-3-о-толил-пирролидин-1-карбоновой кислоты
Получали по аналогии с Примером А1(а) из N-boc-3-пирролидинона и о-толил-магнийбромида, что давало указанное в заголовке соединение в виде светло-желтого масла. MS (m/e): 278,2 (M+H+, 100%).
б) 3-о-Толил-2,5-дигидро-1Н-пиррол
Получали по аналогии с Примером А1(в) из трет-бутилового эфира рац-3-гидрокси-3-о-толил-пирролидин-1-карбоновой кислоты, что давало указанное в заголовке соединение в виде оранжевого масла. MS (m/e): 160,2 (M+H+, 100%).
в) paц-3-о-Толил-пирролидин
Получали по аналогии с Примером Б3 из 3-о-толил-2,5-дигидро-1H-пиррола, что давало указанное в заголовке соединение в виде желтого масла. MS (m/e): 162,3 (М+Н+, 100%).
Пример A3
рац-3-(4-Трифторметил-бензил)-пирролидин уксусная кислота
Получали по аналогии с Примером А1(г) из 1-бензил-3-(4-трифторметил-бензил)-пирролидина (CAS: 336182-64-0), заменяя HCl уксусной кислотой, что давало указанное в заголовке соединение в виде светло-коричневого масла. MS (m/e): 230,4 (M+H+, 100%).
Пример А4
рац-3-(3-Фтор-бензил)-пирролидин
Получали по аналогии с Примером А1(г) из 1-бензил-3-(3-фтор-бензил)-пирролидина, что давало указанное в заголовке соединение в виде бесцветного масла. MS (m/e): 180 (M+H+, 100%).
Пример А5
рац-Пирролидин-3-ил-(4-трифторметил-фенил)-амин гидрохлорид
Получали по аналогии с Примером А1(г) из (1-бензил-пирролидин-3-ил)-(4-трифторметил-фенил)-амина (CAS: 816468-46-9), что давало указанное в заголовке соединение в виде белого твердого вещества. MS (m/e): 230,9 (М+Н+, 100%).
Пример Б1
4'-Фтор-4-метансульфонил-бифенил-2-карбоновая кислота
Смесь 6,1 ммоль 2-йод-5-метансульфонил-бензойной кислоты (CAS: 845616-08-2), 12,2 ммоль 4-фторбензолбороновой кислоты, 18,4 ммоль карбоната натрия и 0,3 ммоль ацетата палладия (II) в 30 мл воды перемешивали при комнатной температуре в течение 48 часов. Смесь фильтровали и фильтрат подкисляли 37% HCl. Смесь перемешивали при комнатной температуре в течение 30 минут. Твердое вещество отфильтровывали, промывали водой и высушивали, что давало указанное в заголовке соединение (92%). Желтое твердое вещество. MS (m/e): 293,2 ([М-Н], 100%).
Пример Б2
5-Метансульфонил-2-(4-метил-пиразол-1-ил)-бензойная кислота
а) Метиловый эфир 5-метансульфонил-2-(4-метил-пиразол-1-ил)-бензойной кислоты
В стеклянную пробирку последовательно добавляли 0,29 ммоль метилового эфира 2-йод-5-метансульфонил-бензойной кислоты (CAS: 847547-09-5), 0,35 ммоль 4-метилпиразола, 0,59 ммоль карбоната калия, 0,06 ммоль Cul и раствор 0,12 ммоль транс-1,2-диаминоциклогексана в 0,4 мл диоксана (дегазированного). Пробирку наполняли аргоном и закрывали крышкой. Реакционную смесь нагревали при 120°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли дихлорметан и воду. Водную фазу экстрагировали 2 раза дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия и выпаривали. Неочищенное соединение очищали на 10 г Flashpack картриджа. Элюент: гептан/этилацетат, получали указанное в заголовке соединение (57%) в виде светло-желтого масла. MS (m/e): 295,0 ([M+H]+, 100%).
б) 5-Метансульфонил-2-(4-метил-пиразол-1-ил)-бензойная кислота
К 2,08 ммоль метилового эфира 5-метансульфонил-2-(4-метил-пиразол-1-ил)-бензойной кислоты в 2,2 мл ТГФ и 2,2 мл воды добавляли 3,12 ммоль гидроксида лития и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Затем растворитель удаляли в вакууме, остаток переносили в воду и подкисляли, добавляя 3 н. HCl, что давало после фильтрации указанное в заголовке соединение в виде белого твердого вещества (88%). MS (m/e): 279,1 ([M-H], 100%).
Пример Б3
5-Метансульфонил-2-(тетрагидро-пиран-4-ил)-бензойная кислота
К 0,07 ммоль 2-(3,6-дигидро-2H-пиран-4-ил)-5-метансульфонил-