Модифицированные 2- и 3-нуклеозиды и их применение для получения лекарственного средства, обладающего ингибирующей активностью в отношении вируса гепатита с
Иллюстрации
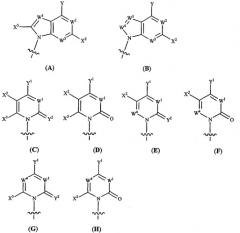
Показать всеНастоящее изобретение относится к новым соединениям формулы (IX)
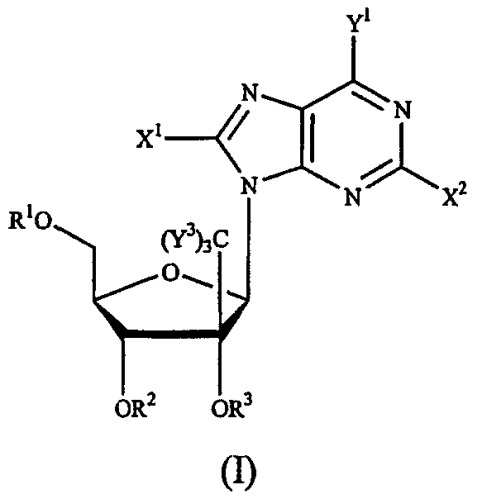
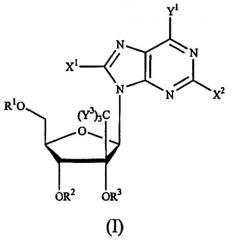
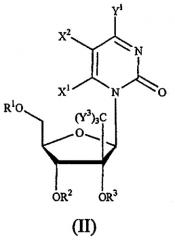
или их фармацевтически приемлемым солям, обладающим ингибирующей активностью в отношении гепатита С, к фармацевтической композиции на их основе и к их применению при получении лекарственного средства. В соединении формулы (IX) R1 и R2 независимо представляют собой Н, фосфат или ацил; Х представляет собой О; основание* представляет собой пуриновое основание; R12 представляет собой С(Y3)3; Y3 представляет собой Н и R13 представляет собой фтор. 3 н. и 27 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США № 60/392350, поданной 28 июня 2002, предварительной заявке на патент США № 60/466194, поданной 28 апреля 2003, и предварительной заявке на патент США № 60/470949, поданной 14 мая 2003, содержание каждой из которых включено здесь в качестве ссылки.
Область изобретения
Данное изобретение относится к области фармацевтической химии, в частности к 2'-и/или 3'-пролекарству 6-модифицированного 1', 2', 3' или 4'-разветвленного пиримидинового нуклеозида или 8-модифицированного 1', 2', 3' или 4'-разветвленного пуринового нуклеозида, предназначенному для лечения инфекции Flaviviridae, такой как вирусная инфекция гепатита С.
Предпосылки создания изобретения
Вирусы Flaviviridae
Семейство Flaviviridae вирусов содержит, по меньшей мере, три определенных рода: пестивирусы, которые вызывают болезнь у крупного рогатого скота и свиней; флавивирусы, которые являются основной причиной таких заболеваний, как лихорадка денге и желтая лихорадка, и гепацивирусы, единственным членом которых является HCV (вирус гепатита С). Род флавивирусов включает в себя более чем 68 членов, разделенных на группы на основе серологического родства (Calisher et al., J. Gen. Virol, 1993, 70, 37-43). Клинические симптомы варьируют и включают в себя лихорадку, энцефалит и геморрагическую лихорадку (Fields Virology, Editors: Fields, B.N., Knipe, D.M., and Howley, P.M., Lippincott-Raven Publishers, Philadelphia, PA, 1996, Chapter 31, 931-959). Флавивирусы глобального значения, которые ассоциируются с заболеванием человека, включают в себя вирусы геморрагической лихорадки денге (DHF), вирус желтой лихорадки, шоковый синдром и вирус японского энцефалита (Halstead, S.B., Rev. Infect. Dis., 1984, 6, 251-264; Halstead, S.B., Science, 239:476-481, 1988; Monath, T.P., New Eng. J. Med., 1988, 319, 641-643).
Род пестивирусов включает в себя вирус бычьей вирусной диареи (BVDV), вирус классической свиной лихорадки (CSFV, называемый также вирусом свиной холеры) и вирус пограничной болезни (BDV) овец (Moennig, V. et al. Adv. Vir. Res. 1992,41,53-98). Пестивирусные инфекции одомашненных животных (крупного рогатого скота, свиней и овец) являются причиной значительных экономических потерь во всем мире. BVDV вызывает болезнь слизистой оболочки у крупного рогатого скота и имеет значительное экономическое значение в промышленности выращивания домашнего скота (Meyers, G. and Thiel, H.-J., Advances in Virus Research, 1996, 47, 53-118; Moennig V., et al., Adv. Vir. Res. 1992, 41, 53-98). Пестивирусы человека не были так экстенсивно охарактеризованы, как пестивирусы животных. Однако серологические исследования указывают на значительное воздействие пестивирусов на человека.
Пестивирусы и гепацивирусы являются близко родственными группами вирусов в семействе Flaviviridae. Другие близко родственные вирусы в этом семействе включают в себя GB-вирус А, агенты, подобные GB-вирусу А, GB-вирус В и GB-вирус С (называемые также вирусом гепатита G, HGV). Группа гепацивирусов (вирус гепатита С; HCV) состоит из ряда близко родственных, но генотипически различающихся вирусов, которые инфицируют людей. Имеется приблизительно 6 генотипов HCV и более чем 50 подтипов. Вследствие сходства между пестивирусами и гепацивирусами в сочетании со слабой способностью гепацивирусов расти эффективно в клеточной культуре вирус бычьей вирусной диареи (BVDV) часто используют в качестве заменителя для изучения вируса HCV.
Генетическая организация пестивирусов и гепацивирусов является очень похожей. Эти РНК-вирусы с позитивной цепью РНК обладают единственной большой открытой рамкой считывания (ORF), кодирующей все вирусные белки, необходимые для вирусной репликации. Эти белки экспрессируются как полипротеин, который со- и послетрансляционно процессируется как клеточными, так и вирускодированными протеиназами, с образованием зрелых вирусных белков. Вирусные белки, ответственные за репликацию вирусного генома РНК, расположены приблизительно в карбокси-концевом положении. Две трети ORF называются неструктурными (NS) белками. Генетическая организация и полипротеиновый процессинг неструктурной белковой части ORF для пестивирусов и гепацивирусов являются очень сходными. Как для пестивирусов, так и гепацивирусов зрелые неструктурные (NS) белки в последовательном порядке от аминоконцевой группы области, кодирующей неструктурный белок, до карбоксиконцевой группы ORF состоят из р7, NS2, NS3, NS4A, NS4B, NS5A и NS5B.
NS-белки пестивирусов и гепацивирусов совместно имеют домены последовательностей, которые являются характеристикой специфических функций белков. Например, белки NS3 вирусов в обеих группах обладают мотивами аминокислотной последовательности, характерными для серинпротеиназ и геликаз (Gorbalenya et al. (1988) Nature 333:32; Bazan and Fletterick (1989) Virology 171:637-639; Gorbalenya et al. (1989) Nuckeic Acid Res. 17.3889-3897). Аналогично этому белки NS5B пестивирусов и гепацивирусов имеют мотивы, характерные для РНК-управляемых РНК-полимераз (Koonin, E.V. and Dolja, V.V. (1993) Crit. Rev. Biochim. Molec. Biol. 28:375-430).
Действительные роли и функции белков NS пестивирусов и гепацивирусов в жизненном цикле вирусов являются прямо аналогичными. В обоих случаях серинпротеаза NS3 является ответственной за весь протеолитический процессинг полипротеиновых предшественников справа от его положения в ORF (Wiskerchen and Collett (1991) Virology 184:341-350; Bartenschlager et al. (1993) J. Virol. 67:3835-3844; Eckart et al. (1993) Biochem. Biophys. Res. Comm. 192:399-406; Grakoui et al. (1993) J. Virol. 67:2832-2843; Grakoui et al. (1993) Proc. Natl. Acad. Sci. USA 90:10583-10587; Hijikata et al. (1993) J. Virol. 67:4665-4675; Tome et al. (1993) J. Virol. 67:4017-4026). Белок NS4F в обоих случаях действует в качестве кофактора с серинпротеазой NS3 (Bartenschlager et al. (1994) J. Virol. 68:5045-5055; Failla et al. (1994) J. Virol. 68: 3753-3760; Lin et al. (1994) 68:8147-8157; Xu et al. (1997) J. Virol. 71:5312-5322). Белок NS3 обоих вирусов действует также, как геликаза (Kim. et al. (1995) Biochem. Biophys. Res. Comm. 215: 160-166; Jin and Peterson (1995) Arch. Biochem. Biophys., 323: 47-53; Warrener and Collett (1995) J. Virol. 69: 1720-1726). Наконец, белки NS5B пестивирусов и гепацивирусов имеют предсказанные активности РНК-управляемых РНК-полимераз (Behrens et al. (1996) EMBO J. 15:12-22; Lchmannet al. (1997) J. Virol. 71:8416-8428; Yuan et al. (1997) Biochem. Biophys. Res. Comm. 232:231-235; Hagedorn, PCT WO 97/12033; Zhong et al. (1988) J. Virol. 72.9365-9369).
Вирус гепатита С
Вирус гепатита С (HCV) является основной причиной хронического заболевания печени во всем мире (Boyer, N. et al. J. Hepatol. 32: 98-112, 2000). HCV вызывает медленно развивающуюся вирусную инфекцию и является основной причиной цирроза и гепатоклеточной карциномы (Di Besceglie, A.M. and Bacon, B.R., Scientific American, Oct.: 80-85, (1999); Boyer, N. et al. J. Hepatol. 32:98-112, 2000). Подсчитано, что во всем мире 170 миллионов человек инфицировано HCV (Boyer, N. et al. J. Hepatol. 32:98-112, 2000). Цирроз, вызванный хронической инфекцией гепатита С, является причиной 8000-12000 смертей в год в Соединенных Штатах, и инфекция HCV является основным показателем для трансплантации печени.
Известно, что HCV вызывает, по меньшей мере, 80% послетрансфузионного гепатита и значительную часть случайного острого гепатита. Предварительные данные также подразумевают участие HCV во многих случаях «идиопатического» хронического гепатита, «криптогенного» цирроза и, вероятно, гепатоклеточной карциномы, не связанной с другими вирусами гепатита, такими как вирус гепатита В (HBV). Оказалось, что небольшая часть здоровых людей являются хроническими носителями HCV, причем эта часть изменяется в зависимости от географического места жительства и других эпидемиологических факторов. Число их может по существу превысить число больных с HBV, хотя информация является все же предварительной; сколько этих персон имеют субклиническое хроническое заболевание печени, является неясным (The Merck Manual. ch. 69, p. 901, 16th ed., (1992)).
HCV является вирусом с оболочкой, содержащим геном позитивной смысловой одноцепочечной РНК приблизительно с 9,4 т.п.н. Вирусный геном состоит из 5'-нетранслированной области (UTR), длинной открытой рамки считывания, кодирующей предшественник полипротеина приблизительно с 3011 аминокислотами, и короткой 3'-UTR. 5'-UTR является наиболее консервированной частью генома HCV и важной для инициации и регуляции трансляции полипротеина. Трансляция генома HCV инициируется кэп-независимым механизмом, известным как внутренний вход рибосомы. Этот механизм включает в себя связывание рибосом с РНК-последовательностью, известной как сайт входа внутренней рибосомы (IRES). Недавно было установлено, что структура псевдоузла РНК является существенным структурным элементом IRES HCV. Вирусные структурные белки включают в себя нуклеокапсидный коровий белок (С) и два гликопротеина оболочки, Е1 и Е2. HCV кодирует также две протеиназы, цинк-зависимую металлопротеиназу, кодируемую областью NS2-NS3, и серинпротеазу, кодируемую в области NS3. Эти протеиназы необходимы для расщепления специфических областей полипротеина-предшественника с образованием зрелых пептидов. Карбоксильная половина неструктурного белка 5, NS5B, содержит РНК-зависимую РНК-полимеразу. Функция остальных неструктурных белков, NS4A и NS4B, и функция NS5A (аминоконцевая половина неструктурного белка 5) остается неизвестной.
Значительная часть современного антивирусного исследования направлена на разработку усовершенствованных способов лечения хронических инфекций HCV у людей (Di Besceglie, A.M. and Bacon, B.R. Scientific American, Oct.: 80-85 (1999)).
Лечение инфекции HCV интерфероном
Интерфероны (IFNs) были коммерчески доступными для лечения хронического гепатита в течение почти десятилетия. IFNs являются гликопротеинами, продуцируемыми иммунными клетками в ответ на вирусную инфекцию. IFNs ингибируют репликацию ряда вирусов, в том числе HCV, и при использовании в качестве единственного средства для лечения инфекции гепатита С IFN могут в некоторых случаях подавлять содержание HCV-РНК в сыворотке до уровней, не поддающихся измерению. Кроме того, IFN может нормализовать уровни аминотрансферазы в сыворотке. К сожалению, влияние IFN является временным, и длительная реакция имеет место только у 8%-9% пациентов, хронически инфицированных HCV (Gary L. Davis. Gastroenterology 118:S104-S114, 2000). У большинства пациентов, однако, лечение интерфероном трудно переносится, оно вызывает тяжелые, подобные гриппу симптомы, потерю массы и упадок энергии и жизнеспособности.
В ряде патентов описано лечение Flaviviridae, в том числе HCV, с использованием терапий на основе консенсусного интерферона. Например, в патенте США № 5980884, Blatt et al., описаны способы повторного лечения пациентов, пораженных HCV, с использованием интерферона согласованности. В патенте США № 5942223, Bazer et al., описана терапия против HCV с использованием овечьего или бычьего интерферона-тау. В патенте США № 5928636, Alber et al., описана комбинационная терапия интерлейкином-12 и интерфероном альфа для лечения инфекционных заболеваний, в том числе вызванных HCV. В патенте США № 5849696, Chretien et al., описано использование тимозина, отдельно или в сочетании с интерфероном, для лечения инфекции HCV. В патенте США № 5830455, Valtuena et al., описана комбинационная терапия для лечения инфекции HCV, в которой используют интерферон и улавливатель свободных радикалов. В патенте США № 5738845, Imakawa, описано использование белков, интерферона тау человека для лечения инфекции HCV. Другие способы лечения инфекции HCV на основе интерферона описаны в патенте США № 5676942, Testa et al., патенте США № 5372808, Blatt et al., и патенте США № 5849696. В ряде патентов описаны также пэгилированные формы интерферона, например в патентах США № 5747646, 5792834 и 5834594, Hoffmann-La Roche Inc.; публикация РСТ № WO 99/32139 и WO 99/32140, Enzon; WO 95/13090 и патенты США № 5738846 и 5711944, Shering, и патент США № 5908621, Glue et al.
Интерферон альфа-2а и интерферон альфа-2b в настоящее время одобрены в качестве монотерапии для лечения инфекции HCV. Роферон® (Roche) является рекомбинантной формой интерферона альфа-2а. Пегасис® (Roche) является пэгилированной (т.е. модифицированной полиэтиленгликолем) формой интерферона альфа-2а. Интрон® А (Schering Corporation) является рекомбинантной формой интерферона альфа-2b и ПЭГ-интрон® (Schering Corporation) является пэгилированной формой интерферона альфа-2b.
Другие формы интерферона альфа, а также интерферона бета, гамма, тау и омега в настоящее время находятся в клинической разработке для лечения инфекции HCV. Например, на стадии разработки находятся инферген (интерферон альфакон-1), разрабатываемый InterMune, омниферон (природный интерферон), разрабатываемый Viragen, альбуферон, разрабатываемый Human Genome Sciences, ребиф (интерферон бета-1а), разрабатываемый Ares-Serono, омега интерферон, разрабатываемый BioMedicine, пероральный интерферон альфа, разрабатываемый Amarillo Biosciences, и интерферон гамма, интерферон тау и интерферон гамма-1b, разрабатываемые InterMune.
Рибавирин
Рибавирин (1-β-D-рибофуранозил-1-1,2,4-триазол-3-карбоксамид) является синтетическим, неиндуцирующим интерферон, антивирусным аналогом нуклеозида широкого спектра действия, продаваемым под торговым названием Virazole (The Merck Index, 11th edition, Editor: Budavari, S., Merck & Co., Inc., Rahway, NJ, p.1304, 1989). В патенте Соединенных Штатов № 3798209 и RE 29835 описан и заявлен рибавирин. Рибавирин является структурно похожим на гуанозин и обладает in vitro активностью против нескольких ДНК- и РНК-вирусов, в том числе Flaviviridae (Gary L. Davis. Gastroenterology 118:S104-S114, 2000).
Рибавирин снижает уровни аминотрансферазы в сыворотке до нормальных уровней у 40% пациентов, но он не снижает уровни HCV-РНК (Gary L. Davis. Gastroenterology 118:S104-S114, 2000). Таким образом, взятый отдельно рибавирин не является эффективным в снижении уровней вирусных РНК. Кроме того, рибавирин имеет значительную токсичность и известно, что он вызывает анемию.
Рибавирин не одобрен для монотерапии против HCV. Он одобрен в сочетании с интерфероном альфа-2а или интерфероном альфа-2b для лечения инфекции HCV.
Сочетание интерферона и рибавирина
Современным стандартом для лечения хронического гепатита С является комбинационная терапия с альфа-интерфероном и рибавирином. Описано, что сочетание интерферона и рибавирина для лечения инфекции HCV является эффективным при лечении пациентов, не подвергавшихся лечению интерфероном (Battaglia, A.M. et al., Ann. Pharmacother. 34:487-494, 2000), а также для лечения пациентов, когда имеется гистологическое заболевание (Berenguer, M. et al. Antivir. Ther. 3 (Suppl. 3): 125-136, 1998). Исследования показали, что большее число пациентов с гепатитом С восприимчиво к комбинационной терапии с комбинацией пэгилированный интерферон-альфа/рибавирин, чем к комбинационной терапии с непэгилированным интерфероном альфа. Однако, как в случае монотерапии, в процессе комбинационной терапии развиваются значительные побочные эффекты, в том числе гемолиз, подобные гриппу симптомы, анемия и утомление (Gary L. Davis. Gastroenterology 118:S104-S114, 2000).
Для комбинационной терапии с ПЭГ-Интроном® (пэгинтерферон альфа-2b) и Рибетолом® (Ribavirin, USP) используют капсулы, доступные от фирмы Schering Corporation. Рибетол® (Schering Corporation) был одобрен также в комбинации с Интроном® А (интерферон альфа-2b, рекомбинантный, Schering Corporation). Пегасис® (пэгилированный интерферон альфа-2а) от фирмы Roche и Копегус® (рибавирин) также одобрены для лечения инфекции HCV.
В публикациях РСТ № WO 99/59621, WO 00/37110, WO 01/81359, WO 02/32414 и WO 03/024461, Shering Corporation, описано применение комбинационной терапии с пэгилированным интерфероном альфа и рибавирином для лечения инфекции HCV. В публикациях РСТ № WO 99/15194, WO 99/64016 и WO 00/24355, Hoffmann-La Roche Inc., также описано использование пэгилированного интерферона альфа и рибавирина в комбинационной терапии для лечения инфекции HCV.
Дополнительные способы лечения инфекций Flaviviridae
В настоящее время осуществляется разработка новых антивирусных агентов для инфекций Flaviviridae, особенно гепатита С. Разрабатываются специфические ингибиторы происходящих из HCV ферментов, такие как ингибиторы протеазы, геликазы и полимеразы. Разрабатываются также лекарственные средства, которые ингибируют другие стадии репликации HCV, например лекарственные средства, которые блокируют продуцирование антигенов HCV из РНК (ингибиторы IRES), лекарственные средства, которые предотвращают нормальный процессинг белков HCV (ингибиторы гликозилирования), лекарственные средства, которые блокируют вход HCV в клетки (блокированием его рецептора), и неспецифические цитозащитные агенты, которые блокируют повреждение клетки, вызванное вирусной инфекцией. Кроме того, разрабатываются также молекулярные подходы для лечения гепатита С, например рибозимы, которые являются ферментами, которые разрушают специфические вирусные молекулы РНК, и исследуются антисмысловые олигонуклеотиды, которые являются небольшими комплементарными сегментами ДНК, которые связываются с вирусной РНК и ингибируют вирусную репликацию. Несколько способов лечения инфекции HCV указаны в обзоре Bymock et al. в Antiviral Chemistry & Chemotherapy, 11:2; 79-95 (2000) и De Francesco et al. в Antiviral Research, 58: 1-16 (2003).
Примеры классов лекарственных средств, которые разрабатываются для лечения инфекций Flaviviridae, включают в себя:
(1) Ингибиторы протеазы
Исследуются ингибиторы протеазы NS3 на основе субстрата (Attwood et al., Antiviral peptide derivatives, PCT WO 98/22496, 1998; Attwood et al, Antiviral Chemistry and Chemotherapy 1999, 10, 259-273; Attwood et al, Preparation and use of amino acid derivatives as anti-viral agents, German Patent Pub. DE 19914474; Tung et al. Inhibitors of serine proteases, particularly hepatitis С virus NS3 protease, PCT WO 98/17679), включающие в себя альфа-кетоамиды и гидразиномочевины, и ингибиторы, которые имеют в концевом положении электрофил, такой как бороновая кислота или фосфонат (Llinas-Brunet et al, Hepatitis C inhibitor peptide analogues, PCT WO 99/07734).
Исследуются также ингибиторы протеазы NS3 не на основе субстрата, такие как производные 2,4,6-тригидрокси-3-нитробензамида (Sudo K. et al., Biochemical and Biophysical Research Communications, 1997, 238, 643-647; Sudo K. et al. Antiviral Chemistry and Chemotherapy, 1998, 9, 186), в том числе RD3-4082 и RD3-4078, причем первый замещен у амида цепью из 14 атомов углерода и последний имеет пара-феноксифенильную группу.
Sch 68631, фенантренхинон, является ингибитором протеазы HCV (Chu M. et al., Tetrahedron Letters 37: 7229-7232, 1996). В другом примере теми же авторами Sch 351633, выделенный из грибов Penicillium griseofulvum, был идентифицирован в качестве ингибитора протеазы (Chu M. et al., Bioorganic and Medicinal Chemistry Letters 9:1949-1952). Наномолярная активность против фермента протеаза NS3 HCV была достигнута разработкой селективных ингибиторов на основе макромолекулярного эглина с. Эглин с, выделенный из пиявок, является сильнодействующим ингибитором нескольких серинпротеаз, таких как протеазы А и В S. griseus, α-химотрипсин, химаза и субтилизин. Qasim M.A. et al., Biochemistry 36:1598-1607, 1997.
В нескольких патентах США описаны ингибиторы протеазы для лечения инфекции HCV. В патенте США № 6004933, Spruce et al., описан класс ингибиторов цистеинпротеазы для ингибирования эндопептидазы 2 HCV. В патенте США № 5990276, Zhang et al., описаны синтетические ингибиторы протеазы NS3 вируса гепатита С. Ингибитором является последовательность субстрата протеазы NS3 или субстрата кофактора NS4A. Использование ферментов рестрикции для лечения инфекции HCV описано в патенте США № 5538865, Reyes at al. Пептиды в качестве ингибиторов серинпротеазы NS3 HCV описаны в WO 02/008251, Corvas International, Inc., и WO 02/08187 и WO 02/008256, Schering Corporation. Трипептидные ингибиторы HCV описаны в патентах США № 6534523, 6410531 и 6420380, Boehringer Ingelheim, и WO 02/060926, Bristol Myers Squibb. Диарилпептиды в качестве ингибиторов серинпротеазы NS3 HCV описаны в WO 02/48172, Schering Corporation. Имидазолиндиноны в качестве ингибиторов серинпротеазы NS3 HCV описаны в WO 02/08198, Schering Corporation, и WO 02/48157, Bristol Myers Squibb. В WO 98/17679, Vertex Pharmaceuticals, и WO 02/48116, Bristol Myers Squibb, также описаны ингибиторы протеазы HCV.
(2) Производные тиазолидина, которые проявляют приемлемое ингибирование в анализе ВЭЖХ с обращенной фазой со слитым белком NS3/4A и субстратом NS5A/5B (Sudo K. et al., Antiviral Research, 1996, 32, 9-18), особенно соединение RD-1-6250, имеющее конденсированную циннамоильную часть, замещенную длинной алкильной цепью, RD4 6205 и RD4 6193.
(3) Тиазолидины и бензанилиды, идентифицированные Kakiuchi N. et al., J. EBS Letters 421, 217-220; Takeshita N. et al. Analytical Biochemistry, 1997, 247, 242-246.
(4) Фенантренхинон, обладающий активностью против протеазы в SDS-PAGE и авторадиографическом анализе, выделенный из бульона культуры ферментации Streptomyces sp., Sch 68631 (Chu M. et al., Tetrahedron Letters, 1996, 37, 7229-7232), и Sch 351633, выделенные из грибов Penucillium griseofulvum, которые демонстрируют активность в сцинтилляционном приближенном анализе (Chu M. et al., Bioorganic and Medicinal Chemistry Letters, 9, 1949-1952).
(5) Ингибиторы геликазы (например, Diana G.D. et al, Compounds, compositions and methods for treatment of hepatitis C, U.S. Pat. No. 5,633,358; Diana G.D. et al., Piperidine derivatives, pharmaceutical compositions thereof and their use in the treatment of hepatitis С, РСТ WO 97/36554).
(6) Нуклеотидные ингибиторы полимеразы и глиотоксин (Ferrari R. et al. Journal of Virilogy, 1999, 73, 1649-1654) и природный продукт церуленин (Lohmann V. et al., Virology, 1998, 249, 108-118).
(7) Антисмысловые фосфоротиоатные олигодезоксинуклеотиды (S-ODN), комплементарные участкам последовательности в 5'-некодирующей области (NRC) вируса (Alt M. et al., Hepatology, 1995, 22, 707-717), или нуклеотиды 326-348, содержащие 3'-конец NCR, и нуклеотиды 371-388, расположенные в коровой кодирующей области РНК HCV (Alt M. et al., Archives of Virology, 1997, 142, 589-599; Galderisi U. et al., Journal of Cellular Physiology, 1999, 181, 251-257).
(8) Ингибиторы IRES-зависимой трансляции (Ikeda N et al., Agent for the prevention and treatment of hepatitis C, публикация патента Японии JP-08268890; Kai Y. et al. Prevention and treatment of viral diseases, публикация патента Японии, JP-10101591).
(9) Рибозимы, такие как нуклеаза-устойчивые рибозимы (Maccjak, D.J. et al., Hepatology, 1999, 30, abstract 995), и рибозимы, описанные в патенте США № 6043077, Barber et al., и патентах США № 5869253 и 5610054, Draper et al.
(10) Аналоги нуклеозидов, которые также были разработаны для лечения инфекций Flaviviridae.
Idenix Pharmaceutical описал использование разветвленных нуклеозидов при лечении флавивирусов (включая HCV) и пестивирусов в публикации Международных патентов № WO 01/90121 и WO 01/92282. Конкретно, способ лечения инфекции гепатита С (и флавивирусов и пестивирусов) у людей и других животных-хозяев описан в публикациях Idenix, которые включают в себя введение эффективного количества биологически активных 1',2',3' или 4'-разветвленных β-D- или β-L-нуклеозидов или их фармацевтически приемлемых солей или производных, введенных либо отдельно, либо в комбинации с другим антивирусным агентом, необязательно, в фармацевтически приемлемом носителе.
Другие заявки на патенты, описывающие использование некоторых аналогов нуклеозидов для лечения инфекции вируса гепатита С, включают в себя РСТ/СА00/01316 (WO 01/32153, поданную 3 ноября 2000) и РСТ/СА01/00197 (WO 01/60315, поданную 19 февраля 2001), поданную BioChem Pharma, Inc. (теперь Shire Biochem, Inc.); PCT/US02/01531 (WO 02/057424, поданную 18 января 2002) и РСТ/US02/03086 (WO 02/057287; поданную 18 января 2002), поданную Merck & Co., Inc., PCT/EP01/09633 (WO 02/18404; опубликованную 21 августа, 2001), поданную Roche, и публикации РСТ № WO 01/79246 (поданной 13 апреля 2001), WO 02/32920 (поданной 18 октября 2001) и WO 02/48165, Pharmasset, Ltd.
В публикации РСТ № WO 99/43691, Emory University, озаглавленной «2'-фторнуклеозиды», описано использование некоторых 2'-фторнуклеозидов для лечения инфекции HCV.
Eldrup et al. (Oral Session V. Hepatitis C Virus, Flaviviridae; 16th International Conference on Antiviral Research (April 27, 2003, Savannah, Ga.)) описали связь структур 2'-модифицированных нуклеозидов с активностью для ингибирования HCV.
Bhat et al. (Orall Session V. Hepatitis C Virus, Flaviviridae, (Oral Session V, Hepatitis C Virus, Flaviviridae; 16th International Conference on Antiviral Research (April 27, 2003, Savannah, Ga.) p.A75) описали синтез и фармакокинетические свойства аналогов нуклеозидов как возможных ингибиторов репликами РНК HCV. Авторы указали, что 2'-модифицированные нуклеозиды демонстрируют сильную ингибирующую активность в анализах репликона на клеточной основе.
Olsen et al. (Orall Session V. Hepatitis C Virus, Flaviviridae; 16th International Conference on Antiviral Research (April 27, 2003, Savannah, Ga.) p.A76) также описали влияние 2'-модифицированных нуклеозидов на репликацию РНК HCV.
(11) Другие разнообразные соединения, включающие 1-аминоалкилциклогексаны (патент США № 6034134, Gold et al.), алкиллипиды (патент США № 5922757, Chojkier et al.), витамин Е и другие антиоксиданты (патент США № 5992757, Chojkier et al.), сквален, амантадин, желчные кислоты (патент США № 5846964, Ozeki et al.), N-(фосфоноацетил)-L-аспарагиновая кислота (патент США № 5830905, Diana et al.), бензолдикарбоксамиды (патент США № 5633388, Diana et al.), производные полиадениловой кислоты (патент США № 5496546, Wang et al.), 2',3'-дидеоксиинозин (патент США № 5026687, Yarchoan et al.), бензимидазолы (патент США № 5891874, Colacino et al.), экстракты растений (патент США № 5837257, Tsai et al, патент США № 5725869, Omer et al, и патент США № 6056961) и пиперидины (патент США № 5830905, Diana et al.).
(12) Другие соединения, в настоящее время находящиеся в доклинической или клинической разработке для лечения, вызванного вирусом гепатита С, включают: интерлейкин-10 фирмы Schering-Plough, IP-501 фирмы Interneuron, меримебодиб (VX-497) фирмы Vertex, амантадин® (Symmetrel) фирмы Endo Labs Solvay, гептазим® фирмы RPI, IDN-6556 фирмы Idun Pharma., XTL-002 фирмы XTL., HCV/MF59 фирмы Chiron, цивацир® (иммунный глобулин гепатита С) фирмы NABI, левовирин® фирмы ICN/Ribapharm, вирамидин® фирмы ICN/Ribapharm, задаксин® (тимозин альфа-1) фирмы Sci Clone, тимозин плюс пэгилированный интерферон фирмы Sci Clone, цеплен® (дигидрохлорид гистамина) фирмы Maxim, VX 950/LY 570310 фирмы Vertex/Eli Lilly, ISIS 14803 фирмы Isis Pharmaceutical/Elan, IDN-6556 фирмы Idun Pharmaceuticals, Inc., JTK 003 фирмы AKROS Pharma, BILN-2061 фирмы Boehringer Ingelheim, CellCept (микофенолят мофетил) фирмы Roche, T67, ингибитор β-тубулина фирмы Tularik, терапевтическая вакцина, направленная к Е2 фирмы Innogenetics, FK788 фирмы Fujisawa Healthcare, Inc., IdB 1016 (силифос, пероральный силибин-фосфатидилхолин фитосом), ингибиторы репликации РНК (VP50406) фирмы ViroPharma/Wyeth, терапевтическая вакцина фирмы Intercell, терапевтическая вакцина фирмы Epimmune/Genencor, ингибитор IRES фирмы Anadys, ANA 245 и ANA 246 фирмы Anadys, иммунотерапия (терапор) фирмы Avant, ингибитор протеазы фирмы Corvas/Schering, ингибитор геликазы фирмы Vertex, ингибитор слияния фирмы Trimeris, терапия Т-клеток фирмы CellExSys, ингибитор полимеразы фирмы Biocryst, химические соединения, «нацеленные» на РНК фирмы PTC Therapeutics, дикатион фирмы Immtech, Int., ингибитор протеазы фирмы Agouron, ингибитор протеазы фирмы Chiron/Medivir, антисмысловая терапия фирмы AVI BioPharma, антисмысловая терапия фирмы Hybridon, гемопурифиер фирмы Aethlon Medical, терапевтическая вакцина фирмы Merix, ингибитор протеазы фирмы Bristol-Myers Squibb/Axys, ChronVacC, терапевтическая вакцина фирмы Tripep, UT 231B фирмы United Therapeutics, ингибиторы протеазы, геликазы и полимеразы фирмы Genelabs Technologies, ингибиторы IRES фирмы Immusol, R803 фирмы Rigel Pharmaceuticals, инферген® (интерферон альфакон-1) фирмы InterMune, омниферон (природный интерферон) фирмы Viragen, албуферон® фирмы Human Genome Sciences, ребиф® (интерферон бета-1а) фирмы Ares-Serono, омега интерферон фирмы BioMedicine, пероральный интерферон альфа фирмы Amarillo Biosciences, интерферон гамма, интерферон тау и интерферон гамма-1b фирмы InterMune.
Пролекарства нуклеозидов ранее были описаны для лечения других форм гепатита. В WO 00/09531 (подан 10 августа 1999) и WO 01/96353 (подан 15 июня 2001), Idenix Pharmaceuticals, описаны 2'-деокси-β-L-нуклеозиды и их 3'-пролекарства для лечения инфекции HCV. В патенте США № 4957924, Beauchamp, описаны различные терапевтические сложные эфиры ацикловира.
В свете того факта что инфекция HCV достигла эпидемических уровней во всем мире и вызывает трагические последствия у инфицированного пациента, остается острая потребность в обеспечении новыми эффективными фармацевтическими средствами для лечения гепатита С, которые обладали бы низкой токсичностью для хозяина.
Кроме того, при существовании возрастающей угрозы других инфекций flaviviridae сохраняется острая потребность в обеспечении новыми эффективными фармацевтическими агентами, которые обладали бы низкой токсичностью для хозяина.
Таким образом, целью настоящего изобретения является разработка соединения, способа и композиции для лечения хозяина, инфицированного вирусом гепатита С.
Другой целью настоящего изобретения является разработка способа и композиции, подходящей для лечения пациентов, инфицированных пестивирусами, флавивирусами или гепацивирусами.
Сущность изобретения
2'- и 3'-пролекарства 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов или их фармацевтически приемлемые соли или фармацевтически приемлемые препараты, содержащие эти соединения, могут быть использованы для профилактики и лечения инфекций Flaviviridae и других родственных состояний, таких как состояния с положительной реакцией на антитела против Flaviviridae и Flaviviridae-положительные состояния, хроническое воспаление печени, вызванное HCV, цирроз, острый гепатит, скоротечный гепатит, хронический персистирующий гепатит и переутомление. Эти соединения или препараты могут быть также использованы профилактически для предотвращения или замедления развития клинического расстройства у пациентов, которые имеют антитела против Flaviviridae, или имеют положительную реакцию на антиген Flaviviridae, или которые подвергались воздействию Flaviviridae.
Описан также способ лечения вирусной инфекции Flaviviridae у хозяина, в том числе у человека, который включает в себя введение эффективного количества 2'- или 3'-пролекарства биологически активного 1', 2', 3' или 4'-разветвленного β-D- или β-L-нуклеозида или его фармацевтически приемлемой соли, введенного либо отдельно, либо в сочетании или последовательно с другим агентом против Flaviviridae, необязательно, в фармацевтически приемлемом носителе. Термин 2'-пролекарство, используемый здесь, относится к 1', 2', 3' или 4'-разветвленному β-D- или β-L-нуклеозиду, который имеет биологически отщепляемую часть в 2'-положении, включающую, но не ограничивающуюся указанным, ацил и в одном варианте осуществления природную или синтетическую D- или L-аминокислоту, предпочтительно, L-аминокислоту. Термин 3'-пролекарство, используемый здесь, относится к 1', 2', 3' или 4'-разветвленному β-D- или β-L-нуклеозиду, который имеет биологически отщепляемую часть в 3'-положении, включающую, но не ограничивающуюся указанным, ацил и в одном варианте осуществления природную или синтетическую D- или L-аминокислоту, предпочтительно, L-аминокислоту.
Фармацевтически приемлемые соли включают тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, α-кетоглутарат и α-глицерофосфат, формиат, фумарат, пропионат, гликолят, лактат, пируват, оксалат, малеат, салицилат, сульфат, сульфонат, нитрат, бикарбонат, гидробромат, гидробромид, гидройодид, карбонат и соли фосфорной кислоты. Особенно предпочтительным вариантом осуществления является моно- или дигидрохлоридная соль.
В одном варианте осуществления 1', 2', 3' или 4'-разветвленный β-D- или β-L-нуклеозид включает в свой состав биологически отщепляемые остатки в 2'- и/или 5'-положениях. Предпочтительными остатками являются эфиры природных или синтетических D- или L-аминокислот, в том числе D- или L-валил, более предпочтительными являются эфиры L-аминокислот, такие как L-валил, и алкиловые эфиры, в том числе ацетил. Таким образом, данное изобретение, в частности, включает в себя 2'-эфир D- или -L-аминокислоты и 2',5'-эфир D- или -L-диаминокислоты, предпочтительно, эфир L-аминокислоты, 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов с любым требуемым пуриновым или пиримидиновым основанием, где исходное лекарственное средство необязательно имеет EC50 меньше чем 15 микромолей и, даже более предпочтительно, меньше чем 10 микромолей; 2'-(алкиловый или ариловый) эфир или 2',5'-ди(алкиловый или ариловый) эфир 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов с любым требуемым пуриновым или пиримидиновым основанием, где исходное лекарственное средство необязательно имеет EC50 меньше чем 10 или 15 микромолей, и пролекарства 2',5'-диэфиры 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов, где (i) 2'-эфир является эфиром природной или синтетической D- или L-аминокислоты, более предпочтительно, эфиром L-аминокислоты, 5'-эфир является алкиловым или ариловым эфиром; (ii) оба эфира являются, независимо, эфирами природной или синтетической D- или L-аминокислоты, более предпочтительно оба являются эфирами L-аминокислоты; (iii) оба эфира являются независимо алкиловыми или ариловыми эфирами и (iv) 2'-эфир является независимо алкиловым или ариловым эфиром и 5'-эфир является эфиром природной или синтетической D- или L-аминокислоты, более предпочтительно эфиром L-аминокислоты, где исходное лекарственное средство необязательно имеет EC50 меньше чем 10 или 15 микромолей.
Примерами пролекарств, входящими в объем изобретения, являются 2'-D- или L-валиновый эфир β-D-2',6-диметилцитидина; 2'-L-валиновый эфир β-D-2',6-диметилтимидина; 2'-L-валиновый эфир β-D-2',8-диметиладенозина, 2'-L-валиновый эфир β-D-2',8-диметилгуанозина; 2'-L-валиновый эфир β-D-2',6-диметил-5-фторцитидина; 2'-L-валиновый эфир β-D-2',6-диметилуридина; 2'-ацетиловый эфир β-D-2',6-диметилцитидина; 2'-ацетиловый эфир β-D-2',6-диметилтимидина; 2'-ацетиловый эфир β-D-2',8-диметиладенозина, 2'-ацетиловый эфир β-D-2',8-диметилгуанозина; 2'-ацетиловый эфир β-D-2',6-диметил-5-фторцитидина; и сложные 2'-эфиры β-D-2',6-диметил(цитидина, 5-фторурацила, уридина или тимидина) или сложные 2'-эфиры β-D-2',8-диметил(гуанозина, аденозина или инозина), где (i) 2'-эфир является эфиром аминокислоты или (ii) 2'-эфир является алкиловым или ариловым эфиром.
Дополнительными примерами пролекарств, входящими в объем изобретения, являются 2',5'-L-дивалиновый эфир β-D-2',6-диметилцитидина (dival-2',6-diMe-L-dC); 2',5'-L-дивалиновый эфир β-D-2',6-диметилтимидина; 2',5'-L-дивалиновый эфир β-D-2',8-диметиладенозина; 2',5'-L-дивалиновый эфир β-D-2',8-диметилгуанозина; 2',5'-L-дивалиновый эфир β-D-2',6-диметил-5-фторцитидина; 2',5'-L-дивалиновый эфир β-D-2',6-диметилуридина; 2',5'-диацетиловый эфир D-2',6-диметилцитидина; 2',5'-диацетиловый эфир β-D-2',6-диметилтимидина; 2',5'-диацетиловый эфир β-D-2',8-диметиладенозина; 2',5'-диацетиловый эфир β-D-2',8-диметилгуанозина; 2',5'-диацетиловый эфир β-D-2',6-диметил-5-фторцитидина и сложные 2',5'-диэфиры β-D-2',6-диметил(цитидина, 5-фторцитидина, уридина или тимидина) или сложные 2',5'-диэфиры β-D-2',8-диметил(гуанозина, аденозина или инозина), где (i) 2'-эфир является эфиром аминокислоты и 5'-эфир является алкиловым или ариловым эфиром; (ii) оба эфира являются эфирами аминокислот, (iii) оба эфира являются независимо алкиловыми или ариловыми эфирами или (iv) 2'-эфир является алкиловым или ариловым эфиром и 5'-эфир является эфиром аминокислоты.
В другом варианте осуществления 3'-пролекарство 1', 2', 3' или 4'-разветвленного β-D- или β-L-нуклеозида включает в свой состав биологически отщепляемые остатки в 3'- и/или 5'-положениях. Предпочтительными остатками являются эфиры природных или синтетических D- или L-аминокислот, такие как валил, более предпочтительны эфиры L-аминокислот, такие как L-валил, и алкиловые эфиры, в том числе ацетил. Таким образом, данное изобретение, в частности, включает эфир 3'-L-аминокислоты и эфир 3',5'-L-диаминокислоты 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов с любым требуемым пуриновым или пиримидиновым основанием, где исходное лекарственное средство необязательно имеет EC50 меньше чем 15 микромолей и, даже более предпочтительно, меньше чем 10 микромолей; 3'-(алкиловый или ариловый) эфир или 3',5'-L-ди(алкиловый или ариловый) эфир 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов с любым требуемым пуриновым или пиримидиновым основанием, где исходное лекарственное средство необязательно имеет EC50 меньше чем 10 или 15 микромолей, и пролекарства 3',5'-диэфиров 1', 2', 3' или 4'-разветвленных β-D- или β-L-нуклеозидов, где (i) 3'-эфир является эфиром природной или синтетической D- или L-аминокислоты и 5'-эфир является алкиловым или ариловым эфиром; (ii) оба эфира являются, независимо, эфирами природной или синтетической
D- или L-аминокислоты; (iii) оба эфира являются независимо алкиловыми или ариловыми эфирами и (iv) 3'-эфир является независимо алкиловым или ариловым эфиром и 5'-эфир является эфиром природной или синтетической D- или L-аминокислоты, где исходное лекарственное средство необязательно имеет EC50 меньше чем 10 или 15 микромолей.
Примерами пролекарств, находящихся в пределах изобретения, являются 3'-L-валиновый эфир β-D-2',6-диметилцитидина; 3'-L-валиновый эфир β-D-2',6-диметилтимидина; 3'-L-валиновый эфир β-D-2',8-диметиладенозина, 3'-L-валиновый эфир β-D-2',8-диметилгуанозина; 3'-L-валиновый эфир β-D-2',6-диметил-5-фторцитидина; 3'-L-валиновый эфир β-D-2',6-диметилуридина; 3'-ацетиловый эфир β-D-2',6-диметилцитидина; 3'-ацетиловый эфир β-D-2',6-диметилтимидина; 3'-ацетиловый эфир β-D-2',8-диметиладенозина, 3'-ацетиловый эфир β-D-2',8-диметилгуанозина; 3'-ацетиловый эфир β-D-2',6-диметил-5-фторцитидина; и сложные 3'-эфиры β-D-2',6-диметил(цитидина, 5-фторурцитидина, уридина или тимидина) или сложные 3'-эфиры β-D-2',8-диметил(гуанозина, аденозина или инозина), где (i) 3'-эфир является эфиром аминокислоты или (ii) 3'-эфир является алкиловым или ариловым сложным эфиром.
Дополнительными примерами пролекарств, входящими в объем изобретения, являются 3',5'-L-дивалиновый эфир β-D-2',6-диметилцитидина (dival-2',6-diMe-L-dC); 3',5'-L-дивалиновый эфир β-D-2',6-диметилтимидина; 3',5'-L-дивалиновый эфир β-D-2',8-диметиладенозина; 3',5'-L-дивалиновый эфир β-D-2',8-диметилгуанозина; 3',5'-L-дивалиновый эфир β-D-2',6-диметил-5-фторцитидина; 3',5'-L-дивалиновый эфир β-D-2',6-диметилуридина; 3',5'-диацетиловый эфир D-2',6-диметилцитидина; 3',5'-диацетиловый эфир β-D-2',6-диметилтимидина; 3',5'-диацетиловый эфир β-D-2',8-диметиладенозина; 3',5'-диацетиловый эфир β-D-2',8-диметилгуанозина; 3',5'-диацетиловый эфир β-D-2',6-диметил-5-фторцитидина и сложные 3',5'-диэфиры β-D-2',6-диметил(цитидина, 5-фторцитидина, уридина или тимидина) или сложные 3',5'-диэфиры β-D-2',8-диметил(гуанозина, аденозина или инозина), где (i) 3'-эфир является эфиром аминокислоты и 5'-эфир является алкиловым или ариловым эфиром; (ii) оба эфира являются эфирами аминокислот, (iii) оба эф