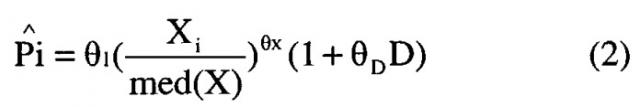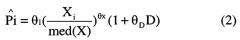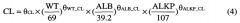Введение фиксированных доз her-антител
Иллюстрации
Показать всеИзобретение относится к медицине и предназначена для лечения злокачественной опухоли у больного человека. Вводят по меньшей мере одну фиксированную дозу пертузумаба. Фиксированная доза выбрана из группы в примерно 420 мг, 525 мг, 840 мг, 1050 мг. Изобретение позволяет упростить выбор дозы для пациента, снизить затраты на индивидуальный подбор дозы пертузумаба. 2 н. и 7 з.п. ф-лы, 4 табл., 14 ил.
Реферат
Родственные заявки
Настоящая заявка является непредварительной заявкой, поданной согласно 37 CFR 1.53(b), по которой испрашивается приоритет согласно 35 USC §119(e) на основании предварительной заявки 60/645697, поданной 21 января 2005, содержание которой включено в данное описание в виде ссылки.
Область техники, к которой относится изобретение
Изобретение относится к введению фиксированных доз HER-антител, таких как пертузумаб.
Уровень техники
HER-рецепторы и антитела против них
Представители семейства рецепторных тирозинкиназ HER являются важными медиаторами клеточного роста, дифференцировки и жизнеспособности. Семейство рецепторов включает четыре отдельных представителя, в том числе рецептор эпидермального фактора роста (EGFR, ErbB1 или HER1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2).
EGFR, кодируемый геном erbB1, причинно вовлечен в развитие злокачественных новообразований у человека. В частности, повышенную экспрессию EGFR наблюдали в злокачественной опухоли молочной железы, мочевого пузыря, легкого, головы, шеи и желудка, а также при глиобластомах. Повышенная экспрессия рецептора EGFR часто связана с повышенной продукцией лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), некоторыми опухолевыми клетками, приводящей к активации рецептора посредством аутокринного пути стимуляции. Baselga and Mendelsohn, Pharmac. Ther. 64:127-154 (1994). Моноклональные антитела, направленные против EGFR или его лигандов, TGF-α и EGF, оценивали в качестве терапевтических средств при лечении таких злокачественных заболеваний. См., например, Baselga and Mendelsohn, выше; Masui et al. Cancer Research 44 1002-1007 (1984) и Wu et al. J. Clin. Invest. 95:1897-1905 (1995).
Второй представитель семейства HER, p185neu, исходно идентифицировали в качестве продукта трансформирующего гена из нейробластом химически обработанных крыс. Активированная форма протоонкогена neu возникает в результате точечной мутации (валин на глутаминовую кислоту) в трансмембранной области кодируемого белка. Амплификацию гомолога neu человека наблюдали при раке молочной железы и яичника, что коррелировало с плохим прогнозом (Slamon et al., Science, 235:177-182 (1987); Slamon et al., Science, 244:707-712 (1989); и патент США №4968603). До настоящего времени не сообщалось о точечной мутации, аналогичной точечной мутации в протоонкогене neu, для опухолей человека. Сверхэкспрессию HER2 (часто, но не всегда вследствие амплификации гена) также наблюдали в других карциномах, включая карциномы желудка, эндометрия, слюнной железы, легкого, почки, ободочной кишки, щитовидной железы, поджелудочной железы и мочевого пузыря. См. наряду с другими публикациями King et al., Science, 229:974 (1985); Yokota et al., Lancet: 1:765-767 (1986); Fukushige et al., Mol Cell Biol., 6:955-958 (1986); Guerin et al., Oncogene Res., 3:21-31 (1988); Cohen et al., Oncogene, 4:81-88 (1989); Yonemura et al., Cancer Res., 51:1034 (1991); Borst et al., Gynecol. Oncol., 38:364 (1990); Weiner et al., Cancer Res., 50:421-425 (1990); Kern et al., Cancer Res., 50:5184 (1990); Park et al., Cancer Res., 49:6605 (1989); Zhau et al., Mol. Carcinog., 3:254-257 (1990); Aasland et al. Br. J. Cancer 57:358-363 (1988); Williams et al., Pathobiology 59:46-52 (1991); и McCann et al., Cancer, 65:88-92 (1990). HER2 может быть сверхэкспрессирован в злокачественной опухоли простаты (Gu et al., Cancer Lett. 99:185-9 (1996); Ross et al., Hum. Pathol. 28:827-33 (1997); Ross et al., Cancer 79:2162-70 (1997); и Sadasivan et al., J. Urol. 150:126-31 (1993)).
Описаны антитела, направленные против белковых продуктов p185neu крысы и HER2 человека.
Drebin с соавторами получили антитела против продукта гена neu крысы, p185neu. См., например, Drebin et al., Cell 41:695-706 (1985); Myers et al., Meth. Enzym. 198:277-290 (1991); и WO 94/22478. В публикации Drebin et al. Oncogene 2:273-277 (1988) сообщается, что смеси антител, взаимодействующих с двумя разными областями p185neu, приводят к синергистическому противоопухолевому воздействию на neu-трансформированные клетки NIH-3T3, имплантированные мышам nude. См. также патент США №5824311, опубликованный 20 октября 1998.
В публикации Hudziak et al., Mol. Cell. Biol. 9(3):1165-1172 (1989), описано создание панели антител к HER2, которые характеризовали с использованием линии клеток опухоли молочной железы человека SK-BR-3. Относительную пролиферацию клеток SK-BR-3 после воздействия антител определяли окрашиванием монослоя кристаллическим фиолетовым через 72 часа. Используя такой анализ, максимальное ингибирование получали с использованием антитела, названного 4D5, которое ингибировало пролиферацию клеток на 56%. Другие антитела в панели при данном анализе снижали пролиферацию клеток в меньшей степени. Кроме того, обнаружено, что антитело 4D5 сенсибилизировало линии опухолевых клеток молочной железы, сверхэкспрессирующие HER2, к цитотоксическому действию TNF-α. См. также патент США №5677171, опубликованный 14 октября 1997. HER2-антитела, обсуждаемые в работе Hudziak et al., дополнительно охарактеризованы в публикациях Fendly et al. Cancer Research 50:1550-1558 (1990); Kotts et al. In Vitro 26(3):59A (1990); Sarup et al. Growth Regulation 1:72-82 (1991); Shepard et al. J. Clin. Immunol. 11(3):117-127 (1991); Kumar et al. Mol. Cell. Biol. 11(2):979-986 (1991); Lewis et al. Cancer Immunol. Immunother. 37:255-263 (1993); Pietras et al. Oncogene 9:1829-1838 (1994); Vitetta et al. Cancer Research 54:5301-5309 (1994); Sliwkowski et al. J. Biol. Chem. 269(20):14661-14665 (1994); Scott et al. J. Biol. Chem. 266:14300-5 (1991); D'souza et al. Proc. Natl. Acad. Sci. 91:7202-7206 (1994); Lewis et al. Cancer Research 56:1457-1465 (1996) и Schaefer et al. Oncogene 15:1385-1394 (1997).
Рекомбинантный гуманизированный вариант мышиного HER2-антитела 4D5 (huMAb4D5-8, rhuMAb HER2, трастузумаб или HERCEPTIN®; патент США №5821337) является клинически активным у пациентов со злокачественными опухолями молочной железы, сверхэкспрессирующими HER2, которые получали всестороннюю предварительную противоопухолевую терапию (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Трастузумаб был разрешен для реализации управлением по контролю за продуктами питания и лекарствами 25 сентября 1998 для лечения пациентов с метастатическим раком молочной железы, опухоли у которых сверхэкспрессируют белок HER2.
Другие HER2-антитела с различными свойствами описаны в публикациях Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et al. Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); патент США №5783186 и Klapper et al. Oncogene 14:2099-2109 (1997).
Скрининг гомологии привел к идентификации двух других представителей семейства рецепторов HER; HER3 (патенты США №5183884 и 5480968, а также Kraus et al., PNAS (USA) 86:9193-9197 (1989)) и HER4 (заявка на выдачу патента EP №599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); и Plowman et al., Nature, 366:473-475 (1993)). Оба указанных рецептора проявляют повышенную экспрессию по меньшей мере в некоторых линиях клеток рака молочной железы.
Рецепторы HER обычно обнаруживают в клетках в различных комбинациях и считают, что гетеродимеризация увеличивает разнообразие клеточных ответов на множество лигандов HER (Earp et al. Breast Cancer Research and Treatment 35: 115-132 (1995)). EGFR связывается шестью разными лигандами; эпидермальным фактором роста (EGF), трансформирующим фактором роста альфа (TGF-α), амфирегулином, связывающим гепарин эпидермальным фактором роста (HB-EGF), бетацеллюлином и эпирегулином (Groenen et al. Growth Factors 11:235-257 (1994)). Семейство белков херегулинов, образуемых в результате альтернативного сплайсинга одного гена, являются лигандами для HER3 и HER4. Семейство херегулинов включает альфа-, бета- и гамма-херегулины (Holmes et al., Science, 256:1205-1210 (1992); патент США №5641869 и Schaefer et al. Oncogene 15:1385-1394 (1997)); факторы дифференцировки neu (NDF), глиальные факторы роста (GGF); активность, индуцирующую рецептор ацетилхолина (ARIA); и фактор, полученный из сенсорных и мотонейронов (SMDF). Обзор см. в публикации Groenen et al. Growth Factors 11:235-257 (1994); Lemke, G. Molec. and Cell. Neurosci. 7:247-262 (1996) и Lee et al. Pharm. Rev. 47:51-85 (1995). Недавно идентифицированы три дополнительных лиганда HER; нейрегулин-2 (NRG-2), который, как сообщается, связывает либо HER3, либо HER4 (Chang et al. Nature 387:509-512 (1997) и Carraway et al. Nature 387:512-516 (1997)); нейрегулин-3, который связывает HER4 (Zhang et al. PNAS (USA) 94(18):9562-7 (1997)); и нейрегулин-4, который связывает HER4 (Harari et al. Oncogene 18:2681-89 (1999)). HB-EGF, бетацеллюлин и эпирегулин также связываются с HER4.
Хотя EGF и TGFα не связывают HER2, EGF стимулирует EGFR и HER2 к образованию гетеродимера, который активирует EGFR и приводит к трансфосфорилированию HER2 в гетеродимере. Димеризация и/или трансфосфорилирование, по-видимому, активируют тирозинкиназу HER2, см. Earp et al., выше. Подобным образом, когда HER3 коэкспрессируется с HER2, образуется активный комплекс передачи сигнала, и антитела, направленные против HER2, способны разрушать такой комплекс (Sliwkowski et al., J. Biol. Chem., 269(20):14661-14665 (1994)). Кроме того, аффинность HER3 по отношению к херегулину (HRG) повышается до состояния более высокой аффинности в случае коэкспрессии с HER2. См. также Levi et al., Journal of Neuroscience 15:1329-1340 (1995); Morrissey et al., Proc. Natl. Acad. Sci. USA 92:1431-1435 (1995); и Lewis et al., Cancer Res., 56:1457-1465 (1996), в отношении комплекса белков HER2-HER3. HER4, подобно HER3, образует активный комплекс передачи сигнала с HER2 (Carraway and Cantley, Cell 78:5-8 (1994)).
Патентные публикации, относящиеся к HER-антителам, включают: US 5677171, US 5720937, US 5720954, US 5725856, US 5770195, US 5772997, US 6165464, US 6387371, US 6399063, US 2002/0192211 A1, US 6015567, US 6333169, US 4968603, US 5821337, US 6054297, US 6407213, US 6719971, US 6800738, US 2004/0236078 A1, US 5648237, US 6267958, US 6685940, US 6821515, WO 98/17797, US 6127526, US 6333398, US 6797814, US 6339142, US 6417335, US 6489447, WO 99/31140, US 2003/0147884 A1, US 2003/0170234 A1, US 2005/0002928 A1, US 6573043, US 2003/0152987 A1, WO 99/48527, US 2002/0141993 A1, WO 01/00245, US 2003/0086924, US 2004/0013667 A1, WO 00/69460, WO 01/00238, WO 01/15730, US 6627196 B1, US 6632979 B1, WO 01/00244, US 2002/0090662 A1, WO 01/89566, US 2002/0064785, US 2003/0134344, WO 04/24866, US 2004/0082047, US 2003/0175845 A1, WO 03/087131, US 2003/0228663, WO 2004/008099 A2, US 2004/0106161, WO 2004/048525, US 2004/0258685 A1, US 5985553, US 5747261, US 4935341, US 5401638, US 5604107, WO 87/07646, WO 89/10412, WO 91/05264, EP 412116 B1, EP 494135 B1, US 5824311, EP 444181 B1, EP 1006194 A2, US 2002/0155527A1, WO 91/02062, US 5571894, US 5939531, EP 502812 B1, WO 93/03741, EP 554441 B1, EP 656367 A1, US 5288477, US 5514554, US 5587458, WO 93/12220, WO 93/16185, US 5877305, WO 93/21319, WO 93/21232, US 5856089, WO 94/22478, US 5910486, US 6028059, WO 96/07321, US 5804396, US 5846749, EP 711565, WO 96/16673, US 5783404, US 5977322, US 6512097, WO 97/00271, US 6270765, US 6395272, US 5837243, WO 96/40789, US 5783186, US 6458356, WO 97/20858, WO 97/38731, US 6214388, US 5925519, WO 98/02463, US 5922845, WO 98/18489, WO 98/33914, US 5994071, WO 98/45479, US 6358682 B1, US 2003/0059790, WO 99/55367, WO 01/20033, US 2002/0076695 A1, WO 00/78347, WO 01/09187, WO 01/21192, WO 01/32155, WO 01/53354, WO 01/56604, WO 01/76630, WO 02/05791, WO 02/11677, US 6582919, US 2002/0192652 A1, US 2003/0211530 A1, WO 02/44413, US 2002/0142328, US 6602670 B2, WO 02/45653, WO 02/055106, US 2003/0152572, US 2003/0165840, WO 02/087619, WO 03/006509, WO 03/012072, WO 03/028638, US 2003/0068318, WO 03/041736, EP 1357132, US 2003/0202973, US 2004/0138160, US 5705157, US 6123939, EP 616812 B1, US 2003/0103973, US 2003/0108545, US 6403630 В1, WO 00/61145, WO 00/61185, US 6333348 В1, WO 01/05425, WO 01/64246, US 2003/0022918, US 2002/0051785 A1, US 6767541, WO 01/76586, US 2003/0144252, WO 01/87336, US 2002/0031515 A1, WO 01/87334, WO 02/05791, WO 02/09754, US 2003/0157097, US 2002/0076408, WO 02/055106, WO 02/070008, WO 02/089842 и WO 03/86467.
Диагностика
Пациентов, подвергаемых лечению HER2-антителом трастузумабом, отбирали для терапии на основании сверхэкспрессии/амплификации HER2. См., например, WO 99/31140 (Paton et al.), US 2003/0170234A1 (Hellmann, S.) и US 2003/0147884 (Paton et al.); а также WO 01/89566, US 2002/0064785 и US 2003/0134344 (Mass et al.). См. также патент US 2003/0152987, Cohen et al., касающийся иммуногистохимии (IHC) и флуоресцентной гибридизации in situ (FISH) для выявления сверхэкспрессии и амплификации HER2.
WO 2004/053497 (Bacus et al.) относится к определению или прогнозированию ответа на терапию HERCEPTIN®. US 2004/013297 A1 (Bacus et al.) касается определения или прогнозирования ответа на терапию EGFR-антителом ABX0303. WO 2004/000094 (Bacus et al.) относится к определению ответа на GW572016, малую молекулу, ингибитор тирозинкиназы EGFR-HER2. WO 2004/063709, Amler et al., относится к биомаркерам и способам определения чувствительности к ингибитору EGFR, эрлотинибу·HCl. US 2004/0209290, Cobleigh et al., относится к маркерам экспрессии генов для прогнозирования рака молочной железы.
Пациентов, подвергаемых лечению пертузумабом, можно отбирать для терапии на основании активации или димеризации HER. Патентные публикации, касающиеся пертузумаба и отбора пациентов для терапии пертузумабом, включают: WO 01/00245 (Adams et al.); US 2003/0086924 (Sliwkowski, M.); US 2004/0013667 A1 (Sliwkowski, M.); а также WO 2004/008099 A2 и US 2004/0106161 (Bossenmaier et al.).
Cronin et al., Am. J. Path. 164(1):35-42 (2004), описывает измерение экспрессии генов в архивных залитых в парафин тканях. Ma et al. Cancer Cell 5:607-616 (2004) описывает получение генных профилей посредством генных олигонуклеотидных микрочипов с использованием выделенной РНК из срезов опухолевых тканей, взятых из архивных первичных биопсий.
Дозирование противоопухолевых лекарственных средств и HER-антител
Публикации, в которых обсуждается дозирование противораковых лекарственных средств, включают: Egorin, M. J. Clin Oncol 2003; 21:182-3 (2003); Baker et al. J. Natl. Cancer Inst. 94:1883-8 (2002); Felici et al. Eur. J. Cancer 38:1677-84 (2002); Loos et al. Clin. Cancer Res. 6:2685-9(2000); de Jongh et al. J. Clin. Oncol. 19:3733-9(2001); Mathijssen et al. J. Clin. Oncol. 20:81-7 (2002) и de Jong et al. Clin Cancer Res 10:4068-71 (2004).
Обычно коммерчески доступные гуманизированные моноклональные IgG-антитела (например, трастузумаб и бевацизумаб, Genentech Inc., South San Francisco, и гемтузумаб озогомицин, Wyeth Pharmaceuticals, Philadelphia) и цитотоксические низкомолекулярные лекарственные средства в онкологии вводили способом дозирования на основе массы (мг/кг) или на основе площади поверхности тела (BSA).
Цетуксимаб (ERBITUX®) представляет собой антитело, которое связывает рецептор EGF и которое одобрено для терапии рака прямой и ободочной кишки. При раке прямой и ободочной кишки 400 мг/м2 цетуксимаба вводят в качестве ударной дозы внутривенной инфузией в течение 2 часов. После этого один раз в неделю вводят поддерживающие дозы 250 мг/м2 в течение 1 часа. См. указания по применению цетуксимаба.
Трастузумаб (HERCEPTIN®) вводят пациентам с метастатическим раком молочной железы в виде ударной дозы 4 мг/кг, затем в виде еженедельных доз 2 мг/кг. См. указания по применению трастузумаба.
См. также WO 99/31140; US 2003/0147884 A1; US 2003/0170234 A1; US 2005/0002928 A1; WO 00/69460; WO 01/15730 и патент США №6627196 B1, относящийся к дозированию трастузумаба.
Пертузумаб (также известный как рекомбинантное моноклональное антитело человека 2C4; OMNITARG™, Genentech, Inc, South San Francisco) является первым представителем в новом классе средств, известных как ингибиторы димеризации HER (HDI), и функционирует, ингибируя способность HER2 образовывать активные гетеродимеры с другими рецепторами HER (такими как EGFR/HER1, HER3 и HER4), и является активным независимо от уровней экспрессии HER2. См., например, Harari and Yarden Oncogene 19:6102-14 (2000); Yarden and Sliwkowski, Nat. Rev. Mol. Cell Biol. 2:127-37 (2001); Sliwkowski Nat. Struct. Biol. 10:158-9 (2003); Cho et al. Nature 421:756-60 (2003); и Malik et al. Pro. Am. Soc. Cancer Res. 44:176-7 (2003).
Показано, что блокада пертузумабом формирования гетеродимеров HER2-HER3 в опухолевых клетках ингибирует важную передачу сигнала в клетках, что приводит к сниженной пролиферации и жизнеспособности опухоли (Agus et al. Cancer Cell 2:127-37 (2002)).
Пертузумаб подвергали тестированию в качестве отдельного средства в клиническом испытании фазы Ia у пациентов со злокачественными опухолями на поздней стадии и в испытаниях фазы II у пациентов с раком яичника и раком молочной железы, а также раком легкого и простаты. В исследовании фазы I пациентов с неизлечимыми, местно распространенными, рецидивными или метастатическими солидными опухолями, которые прогрессировали во время или после стандартной терапии, лечили пертузумабом, вводимым внутривенно один раз в 3 недели. Пертузумаб обычно был хорошо переносимым. Уменьшения опухоли достигали у 3 из 20 пациентов, у которых оценивали ответ. У двух пациентов были подтверждены частичные ответы. Стабильное заболевание, продолжающееся более 2,5 месяцев, наблюдали у 6 из 21 пациента (Agus et al. Pro. Am. Soc. Clin. Oncol. 22:192 (2003)). В дозах 2,0-15 мг/кг фармакокинетика пертузумаба была линейной, и средний клиренс находился в диапазоне от 2,69 до 3,74 мл/сутки/кг, а средний конечный период полувыведения фазы элиминации находился в диапазоне от 15,3 до 27,6 суток. Антитела к пертузумабу не были выявлены (Allison et al. Pro. Am. Soc. Clin. Oncol. 22:197 (2003)). Дозирование пертузумаба осуществляли на основе массы (мг/кг) в фазе I испытания. Испытания в фазе II инициировали, используя фиксированную дозу.
Сущность изобретения
Настоящее изобретение относится к первой критической оценке воздействия и применимости введения фиксированных доз гуманизированного моноклонального IgG1-антитела на фармакокинетику и концентрации целевого лекарственного средства. Основными целями данного анализа HER-антитела пертузумаба были: 1) оценка популяционных фармакокинетических и прогностических ковариат для пертузумаба у онкологических пациентов и 2) исследование вариабельности минимальных устойчивых концентраций и воздействий после введения фиксированной дозы или введения доз на основе массы тела и площади поверхности тела (BSA).
Соответственно, в первом аспекте изобретение относится к способу лечения злокачественной опухоли, включающему в себя введение одной или нескольких фиксированных доз HER-антитела больному человеку в количестве, эффективном для лечения злокачественной опухоли.
В другом аспекте изобретение относится к способу лечения злокачественной опухоли у больного человека, включающему в себя введение по меньшей мере одной фиксированной дозы пертузумаба пациенту, где фиксированная доза выбрана из группы, состоящей из примерно 420 мг, примерно 525 мг, примерно 840 мг и примерно 1050 мг пертузумаба.
Изобретение также относится к изделию производства, состоящему из флакона, содержащего фиксированную дозу HER-антитела, где фиксированная доза выбрана из группы, состоящей из примерно 420 мг, примерно 525 мг, примерно 840 мг и примерно 1050 мг HER-антитела.
Краткое описание чертежей
На фиг.1 представлена схема структуры белка HER2 и аминокислотные последовательности доменов I-IV (SEQ ID No. 19-22, соответственно) его внеклеточного домена.
На фиг.2A и 2B изображены выравнивания аминокислотных последовательностей вариабельного домена легкой цепи (VL) (фиг.2A) и вариабельного домена тяжелой цепи (VH) (фиг.2B) мышиного моноклонального антитела 2C4 (SEQ ID No. 1 и 2, соответственно); доменов VL и VH гуманизированного варианта 2C4 574 (SEQ ID No. 3 и 4, соответственно) и консенсусных каркасов VL и VH человека (hum κ1, подгруппа I легкой цепи каппа; humIII, подгруппа III тяжелой цепи) (SEQ ID No. 5 и 6, соответственно). Звездочки указывают различия между гуманизированным вариантом 2C4 574 и мышиным моноклональным антителом 2C4 или между гуманизированным вариантом 2C4 574 и каркасом антитела человека. Определяющие комплементарность области (CDR) показаны в квадратных скобках.
На фиг.3A и 3B показаны аминокислотные последовательности легкой цепи и тяжелой цепи пертузумаба (SEQ ID No. 13 и 14, соответственно). CDR показаны жирным шрифтом. Рассчитанные молекулярные массы легкой цепи и тяжелой цепи составляют 23526,22 Да и 49216,56 Да (цистеины в восстановленной форме). Углеводный остаток присоединен к Asn 299 тяжелой цепи.
На фиг.4 схематично изображено связывание 2C4 в сайте связывания HER2 в гетеродимере, таким образом, предотвращающее гетеродимеризацию с активированным EGFR или HER3.
На фиг.5 изображено сопряжение HER2/HER3 с путями MAPK и Akt.
На фиг.6 приведено сравнение различных активностей трастузумаба и пертузумаба.
На фиг.7A и 7B показаны аминокислотные последовательности легкой цепи трастузумаба (фиг.7A; SEQ ID No. 15) и тяжелой цепи трастузумаба (фиг.7B; SEQ ID No. 16), соответственно.
На фиг.8A и 8B изображена последовательность варианта легкой цепи пертузумаба (фиг.8A; SEQ ID No. 17) и последовательность варианта тяжелой цепи пертузумаба (фиг.8B; SEQ ID No. 18), соответственно.
Фиг.9A и 9B являются типичными профилями ФК-данных для одного субъекта, подогнанных с использованием однокамерной (фиг.9A) или двухкамерной (фиг.9B) модели. Не заштрихованные кружки показывают наблюдаемую концентрацию. Сплошная и пунктирная линии показывают рассчитанную для популяции и индивидуально рассчитанную концентрацию, соответственно.
На фиг.10A и 10B представлены смоделированные диагностические графики. На фиг.10A изображены наблюдаемые концентрации против рассчитанных концентраций. Сплошная линия представляет собой линию совпадения. На фиг.10B изображены взвешенные остатки против рассчитанных концентраций пертузумаба. Пунктирная линия представляет сглаживание данных с использованием функции LOESS.
На фиг.11A и 11B изображен случайный эффект (η) для зависимости клиренса (CL) от массы (WT) и объема в центральной камере (Vc) от площади поверхности тела (BSA) для базовой модели (фиг.11A) и конечной модели (фиг.11B).
На фиг.12A-F показана модельная оценка фармакокинетической популяционной модели для пертузумаба с использованием апостериорной проверки модели. Прогностическое апостериорное распределение и наблюдаемые значения статистики, лежащей в основе критерия: фиг.12A - 2,5-й; фиг.12B - 5-й; фиг.12C - 50-й, фиг.12D - 90-й, фиг.12E - 95-й, фиг.12F - 97,5-й перцентиль. Вертикальная линия на каждой гистограмме означает наблюдаемое значение статистики критерия.
На фиг.13 показана рассчитанная минимальная устойчивая концентрация пертузумаба (84 день) после введения фиксированной, основанной на массе (WT) или основанной на BSA дозы для 1000 моделируемых субъектов, вводимой бутстреп-методом из исходного набора фармакокинетических (ФК) данных согласно конечной модели.
На фиг.14A и 14B показана рассчитанная минимальная устойчивая концентрация пертузумаба (84 день) после введения фиксированной, основанной на массе (WT) или основанной на BSA дозы для популяций пациентов со значениями WT≤10-му (50,4 кг) (фиг.14A) или ≥90-му перцентилю (88,5 кг) (фиг.14B).
Подробное описание предпочтительных вариантов
I Определения
«Фиксированная» или «единая» доза терапевтического средства в данном описании относится к дозе, которую вводят больному человеку независимо от массы (WT) или площади поверхности тела (BSA) пациента. Поэтому фиксированная или единая доза не приводится в виде дозы в мг/кг или в виде дозы в мг/м2, а приводится в абсолютном количестве терапевтического средства.
«Ударная» доза в данном описании обычно включает начальную дозу терапевтического средства, вводимого пациенту, и за ней следует одна или несколько поддерживающих доз терапевтического средства. Обычно вводят одну ударную дозу, но в данном случае рассматриваются и многократные ударные дозы. Обычно количество вводимой ударной дозы (доз) превышает количество вводимой поддерживающей дозы (доз), и/или ударную дозу (дозы) вводят чаще, чем поддерживающую дозу (дозы), так чтобы достичь требуемой устойчивой концентрации терапевтического средства раньше, чем ее можно достичь в случае поддерживающей дозы (доз).
«Поддерживающая» доза в данном описании относится к одной или нескольким дозам терапевтического средства, вводимого пациенту в течение периода лечения. Обычно поддерживающие дозы вводят с интервалами в лечении, такими как примерно через неделю, примерно через 2 недели, примерно через 3 недели или примерно через 4 недели.
«HER-рецептор» является рецепторной протеинтирозинкиназой, относится к семейству HER-рецепторов и включает рецепторы EGFR, HER2, HER3 и HER4. HER-рецептор как правило будет содержать внеклеточный домен, который может связывать лиганд HER и/или димеризоваться с другой молекулой HER-рецептора; липофильный трансмембранный домен; консервативный внутриклеточный тирозинкиназный домен и находящийся на карбоксильном конце домен передачи сигнала, несущий несколько остатков тирозина, которые могут быть фосфорилированы. HER-рецептор может представлять собой HER-рецептор с «нативной последовательностью» или с «вариантом аминокислотной последовательности». Предпочтительно HER-рецептор является HER-рецептором человека с нативной последовательностью.
Термины «ErbB1», «HER1», «рецептор эпидермального фактора роста» и «EGFR» используют в данном описании взаимозаменяемо, и они относятся к EGFR, который описан, например, в публикации Carpenter et al. Ann. Rev. Biochem. 56:881-914 (1987), включая его встречающиеся в природе мутантные формы (например, делеционный мутант EGFR, который описан в публикации Humphrey et al. PNAS (USA) 87:4207-4211 (1990)). erbBI относится к гену, кодирующему белковый продукт EGFR.
Выражения «ErbB2» и «HER2» используют в данном описании взаимозаменяемо, и они относятся к белку HER2 человека, описанному, например, в публикациях Semba et al., PNAS (USA) 82:6497-6501 (1985), и Yamamoto et al. Nature 319:230-234 (1986) (номер доступа в Genebank X03363). Термин «erbB2» относится к гену, кодирующему ErbB2 человека, и «neu» относится к гену, кодирующему p185neu крысы. Предпочтительный HER2 представляет собой HER2 человека с нативной последовательностью.
Внеклеточный домен HER2 содержит четыре домена: «домен I» (аминокислотные остатки примерно от 1 до 195; SEQ ID NO:19), «домен II» (аминокислотные остатки примерно от 196 до 319; SEQ ID NO:20), «домен III» (аминокислотные остатки примерно от 320 до 488: SEQ ID NO:21) и «домен IV» (аминокислотные остатки примерно от 489 до 630; SEQ ID NO:22) (нумерация остатков без сигнального пептида). См. Garrett et al. Mol. Cell. 11:495-505 (2003), Cho et al. Nature 421:756-760 (2003), Franklin et al. Cancer Cell 5:317-328 (2004) и Plowman et al. Proc. Natl. Acad. Sci. 90:1746-1750 (1993), а также фиг.1 в данном описании.
«ErbB3» и «HER3» относятся к полипептиду рецептора, который описан, например, в патентах США №№5183884 и 5480968, а также Kraus et al. PNAS (USA) 86:9193-9197 (1989).
Термины «ErbB4» и «HER4»в данном описании относятся к полипептиду рецептора, который описан, например, в заявке на выдачу патента EP No 599274; Plowman et al., Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); и Plowman et al., Nature, 366:473-475 (1993), включая его изоформы, которые описаны, например, в WO 99/19488, опубликованной 22 апреля 1999.
Под «лигандом HER» подразумевают полипептид, который связывается и/или активирует рецептор HER. Лиганд HER, представляющий особый интерес согласно настоящему изобретению, является лигандом HER человека с нативной последовательностью, таким как эпидермальный фактор роста (EGF) (Savage et al., J. Biol. Chem. 247:7612-7621 (1972)); трансформирующий фактор роста альфа (TGF-α) (Marquardt et al., Science 223:1079-1082 (1984)); амфирегулин, также известный как аутокринный фактор роста шванномы и кератиноцитов (Shoyab et al. Science 243:1074-1076 (1989); Kimura et al. Nature 348:257-260 (1990) и Cook et al. Mol. Cell. Biol. 11:2547-2557 (1991)); бетацеллюлин (Shing et al., Science 259:1604-1607 (1993); и Sasada et al. Biochem. Biophys. Res. Commun. 190:1173 (1993)); гепарин-связывающий эпидермальный фактор роста (HB-EGF) (Higashiyama et al., Science 251:936-939 (1991)); эпирегулин (Toyoda et al., J. Biol. Chem. 270:7495-7500 (1995); и Komurasaki et al. Oncogene 15:2841-2848 (1997)); херегулин (см. ниже); нейрегулин-2 (NRG-2) (Carraway et al., Nature 387:512-516 (1997)); нейрегулин-3 (NRG-3) (Zhang et al., Proc. Natl. Acad. Sci. 94:9562-9567 (1997)); нейрегулин-4 (NRG-4) (Harari et al. Oncogene 18:2681-89 (1999)) и cripto-(CR-1) (Kannan et al. J. Biol. Chem. 272(6):3330-3335 (1997)). Лиганды HER, которые связывают EGFR, включают EGF, TGF-α, амфирегулин, бетацеллюлин, HB-EGF и эпирегулин. Лиганды HER, которые связывают HER3, включают херегулины. Лиганды HER, способные связывать HER4, включают бетацеллюлин, эпирегулин, HB-EGF, NRG-2, NRG-3, NRG-4 и херегулины.
«Херегулин» (HRG) при использовании в данном описании относится к полипептиду, кодируемому продуктом гена херегулина, который описан в патенте США №5641869 или Marchionni et al., Nature, 362:312-318 (1993). Примеры херегулинов включают херегулин-α, херегулин-β1, херегулин-β2 и херегулин-β3 (Holmes et al., Science, 256:1205-1210 (1992), и патент США №5641869); фактор дифференцировки neu (NDF) (Peles et al. Cell 69:205-216 (1992)); активность, индуцирующую рецептор ацетилхолина (ARIA) (Falls et al. Cell 72:801-815 (1993)); глиальные факторы роста (GGF) (Marchionni et al., Nature, 362:312-318 (1993)); фактор, полученный из сенсорных нейронов и мотонейронов (SMDF) (Ho et al. J. Biol. Chem. 270:14523-14532 (1995)); γ-херегулин (Schaefer et al. Oncogene 15:1385-1394 (1997)).
«Димер HER» в данном описании означает нековалентно связанный димер, содержащий по меньшей мере два HER-рецептора. Такие комплексы могут образовываться, когда на клетку, экспрессирующую два или более HER-рецепторов, воздействует лиганд HER, и они могут быть выделены иммунопреципитацией и проанализированы при помощи SDS-ПААГ, как описано, например, в публикации Sliwkowski et al., J. Biol. Chem., 269(20):14661-14665 (1994). Примеры таких димеров HER включают гетеродимеры EGFR-HER2, HER2-HER3 и HER3-HER4. Кроме того, димер HER может содержать два или более HER2-рецепторов, объединенных с другим HER-рецептором, таким как HER3, HER4 или EGFR. С димером могут быть связаны другие белки, такие как субъединица рецептора цитокина (например, gp130).
«Ингибитор HER» представляет собой агент, который препятствует активации или функционированию HER. Примеры ингибиторов HER включают антитела к HER (например, антитела к EGFR, HER2, HER3 или HER4); направленные к EGFR лекарственные средства; низкомолекулярные антагонисты HER; ингибиторы тирозинкиназы HER; двойные ингибиторы тирозинкиназы HER2 и EGFR, такие как лапатиниб/GW572016; антисмысловые молекулы (см., например, WO 2004/87207) и/или средства, которые связываются или мешают функционированию последующих молекул в каскаде передачи сигнала, таких как MAPK или Akt (см. фиг.5). Предпочтительно ингибитором HER является антитело или малая молекула, которая связывается с рецептором HER.
«HER-антитело» является антителом, которое связывается с рецептором HER. Необязательно, HER-антитело дополнительно препятствует активации или функционированию HER. Предпочтительно HER-антитело связывается с рецептором HER2. HER2-антителом, представляющим особый интерес согласно настоящему изобретению, является пертузумаб. Другим примером HER2-антитела является трастузумаб. Примеры EGFR-антител включают цетуксимаб и ABX0303.
«Активация HER» относится к активации или фосфорилированию любого одного или нескольких рецепторов HER. Как правило, активация HER приводит к трансдукции сигнала (например, трансдукции сигнала, вызванной внутриклеточным киназным доменом HER-рецептора, фосфорилирующим остатки тирозина в HER-рецепторе или полипептиде субстрата). Активация HER может быть опосредована связыванием лиганда HER с димером HER, содержащим представляющий интерес рецептор HER. Связывание лиганда HER с димером HER может активировать киназный домен одного или нескольких HER-рецепторов в димере и, тем самым, приводить к фосфорилированию остатков тирозина в одном или нескольких HER-рецепторах и/или к фосфорилированию остатков тирозина в дополнительных субстратных полипептидах, таких как внутриклеточные киназы Akt или MAPK. См., например, фиг.5.
«Фосфорилирование» относится к добавлению одной или нескольких фосфатных групп к белку, такому как HER-рецептор или его субстрат.
Антитело, которое «ингибирует димеризацию HER», представляет собой антитело, которое ингибирует или препятствует образованию димера HER. Предпочтительно такое антитело связывается с HER2 в его сайте связывания в гетеродимере. Наиболее предпочтительным ингибирующим димеризацию антителом согласно настоящему изобретению является пертузумаб или MAb 2C4. Связывание 2C4 с сайтом связывания HER2 в гетеродимере показано на фиг.4. Другие примеры антител, которые ингибируют димеризацию HER, включают антитела, которые связываются с EGFR и ингибируют его димеризацию с одним или несколькими другими HER-рецепторами (например, моноклональное EGFR-антитело 806, MAb 806, которое связывается с активированным или «несвязанным» EGFR; см. Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)); антитела, которые связываются с HER3 и ингибируют его димеризацию с одним или несколькими другими HER-рецепторами; и антитела, которые связываются с HER4 и ингибируют его димеризацию с одним или несколькими другими HER-рецепторами.
Антитело, которое «ингибирует димеризацию HER более эффективно, чем трастузумаб», является антителом, которое уменьшает количество или устраняет димеры HER более эффективно (например, по меньшей мере примерно в 2 раза более эффективно), чем трастузумаб. Предпочтительно такое антитело ингибирует димеризацию HER2 по меньшей мере примерно так же эффективно, как антитело, выбранное из группы, состоящей из мышиного моноклонального антитела 2C4, Fab-фрагмента мышиного моноклонального антитела 2C4, пертузумаба и Fab-фрагмента пертузумаба. Ингибирование димеризации HER можно оценить, исследуя димеры HER непосредственно или оценивая активацию HER или передачу сигнала ниже по течению, которая является результатом димеризации HER, и/или оценивая сайт связывания антитело-HER2 и т.д. Анализы для скрининга антител, обладающих способностью ингибировать димеризацию HER более эффективно, чем трастузумаб, описаны в публикации Agus et al. Cancer Cell 2:127-137 (2002) и WO 01/00245 (Adams et al.). Только в качестве примера можно провести анализ ингибирования димеризации HER, оценивая например ингибирование образования димеров HER (см., например, фиг.1A и B в Agus et al. Cancer Cell 2:127-137 (2002) и WO 01/00245); уменьшение активации лигандом HER клеток, которые экспрессируют димеры HER (например, WO 01/00245 и фиг.2A и B в Agus et al. Cancer Cell 2:127-137 (2002)); блокирование связывания лиганда HER с клетками, которые экспрессируют димеры HER (например, WO 01/00245 и фиг.2E в Agus et al. Cancer Cell 2:127-137 (2002)); ингибирование клеточного роста раковых клеток (например, клеток MCF7, MDA-MD-134, ZR-75-1, MD-MB-175, T-47D), которые экспрессируют димеры HER в присутствии (или в отсутствие) лиганда HER (например, WO 01/00245 и фиг.3A-D в Agus et al. Cancer Cell 2:127-137 (2002)); ингибирование передачи сигнала ниже по течению (например, ингибирование HRG-зависимого фосфорилирования AKT или ингибирование HRG- или TGFα-зависимого фосфорилирования MAPK) (см., например, WO 01/00245 и фиг.2C и D в Agus et al. Cancer Cell 2:127-137 (2002)). Также можно оценить, ингибирует ли антитело димеризацию HER, исследуя сайт связывания антитело-HER2, например, путем оценки структуры или модели, такой как кристаллическая структура, антитела, связанного с HER2 (см., например, Franklin et al. Cancer Cell 5:317-328 (2004)).
«Сайт связывания в гетеродимере» HER2 относится к области во внеклеточном домене HER2, которая контактирует или служит местом связывания с областью во внеклеточном домене EGFR, HER3 или HER4 при образовании с ними димера. Область обнаружена в домене II HER2. Franklin et al. Cancer Cell 5:317-328 (2004).
HER2-антитело может «ингибировать HRG-зависимое фосфорилирование AKT» и/или ингибировать «HRG- или TGFα-зависимое фосфорилирование MAPK» более эффективно (например, по меньшей мере в 2 раза более эффективно), чем трастузумаб (в качестве примера см. Agus et al. Cancer Cell 2:127-137 (2002) и WO 01/00245).
HER2-антитело может представлять собой антитело, которое «не ингибирует отщепление эктодомена HER2» (Molina et al. Cancer Res. 61:4744-4749(2001)).
HER2-антитело, которое «связывается с сайтом связывания в гетеродимере» HER2, связывается с остатками в домене II (и необязательно также связывается с остатками в других доменах внеклеточного домена HER2, таких как домены I и III) и может стерически затруднять, по меньшей мере в некоторой степени, образование гетеродимера HER2-EGFR, HER2-HER3 или HER2-HER4. Franklin et al. Cancer Cell 5:317-328 (2004) охарактеризовали кристаллическую структуру HER2-пертузумаб, депонированную в RCSB Protein Data Bank (ID-код IS78), иллюстрируя типичное антитело, которое связывается с сайтом связывания HER2 в гетеродимере.
Антитело, которое «связывается с доменом II» HER2, связывается с остатками в домене II и необязательно с остатками в другом домене(ах) HER2, таких как домены I и III. Предпочтительно антитело, которое связывается с доменом II, связывается с местом соединения между доменами I, II и III HER2.
Полипептид с «нативной последовательностью» означает полипептид, который имеет такую же аминокислотную последовательность, как и полипептид (например, HER-рецептор или лиганд HER), полученный из природного источника. Такие полипептиды с нативной последовательностью можно выделить из природного источника и можно получить способами рекомбинации или синтеза. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность встречающегося в природе полипептида человека, полипептида мыши или полипептида любого другого вида млекопитающих.
Термин «антитело» в данном описании используют в самом широком смысле, и термин специально охватывает интактные моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител при условии, что они проявляют требуемую биологическую активность.
Термин «моноклональное антитело» в используемом в данном описании смысле относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп (эпитопы), за исключением возможных вариантов, которые могут возникать во время получения моноклонального антитела, такие варианты обычно присутствуют в минорных количествах. Такое моноклональное антитело обычно включает антитело, содержащее полипептидную последовательность, которая связывает мишень, при этом связывающую мишень полипептидную последовательность получали способом, который заключается в отборе одной связывающей мишень полипептидной последовательности из множества полипептидных последовательностей. Например, процесс отбора может представлять собой отбор уникального клона из множества клонов, например из пула клонов гибридом, фаговых клонов или клонов рекомбинантной ДНК. Следует понимать, что отобранная связывающая мишень последовательность может быть дополнительно изменена, например, чтобы улучшить аффинность по отношению к мишени, гуманизировать связывающую мишень последовательность, повысить ее продукцию в культуре клеток, уменьшить ее иммуногенность in vivo, создать полиспецифичное антитело и т.д., и что антитело, содержащее измененную связывающую мишень последовательность, также является моноклональным антителом согласно настоящему изобретению. Моноклональные антитела являются высокоспецифичными, направленными против одного антигена. В отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов