Способ выделения повторно свернутого рекомбинантного белка из культуры прокариотических клеток (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для выделения рекомбинантного фактора роста эндотелия сосудов (VEGF) из культуры прокариотических клеток. Проводят стадии выделения рекомбинантного белка VEGF из культуры клеток и растворения в первом буферном растворе, рН более 9, который содержит в конечной концентрации: 1 М мочевину, 300 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, рН 11, или 1 М мочевину, 300 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, рН 11. Затем осуществляют рефолдинг растворенного белка во втором буферном растворе с добавлением воздуха, рН>9, но ≤11, который содержит в конечной концентрации: 1 М мочевину, 15 мМ цистеин, 2 мМ DTT, 100 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, рН 10, или 1 М мочевину, 15 мМ цистеин, 0,5-2 мМ DTT, 100 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, рН 10, и выделяют повторно свернутый рекомбинантный белок. Как вариант возможно проведение растворения и рефолдинга указанного белка в комбинированном буферном растворе, рН>9, но ≤11, с добавлением воздуха или кислорода, где комбинированный буферный раствор содержит в конечной концентрации: 1 М мочевину, 15 мМ цистеин, 2 мМ DTT, 100 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, рН 10, или 1 М мочевину, 15 мМ цистеин, 0,5-2 мМ DTT, 100 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, рН 10. Изобретение позволяет выделять повторно свернутый рекомбинантный белок VEGF из культуры прокариотических клеток. 2 н. и 14 з. п. ф-лы, 10 ил.
Реферат
РОДСТВЕННАЯ ЗАЯВКА
Данная заявка испрашивает приоритет и преимущество предварительной заявки США серийного № 60/830831, поданной 14 июля 2006 года, описание которой приведено здесь в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способам получения гетерологичных рекомбинантных белков, производимых в клеточной культуре. Изобретение включает способы выделения и очистки повторно свернутых рекомбинантных белков, которые были произведены в прокариотических клетках-хозяевах и присутствуют в этих клетках, как правило, в периплазматическом или внутриклеточном пространстве. Рекомбинантные белки, произведенные в прокариотических клетках-хозяевах, также можно обнаружить в виде растворимых белков или в виде смеси растворимых и нерастворимых белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Много относящихся к терапии рекомбинантных белков производится множеством организмов-хозяев. Большинство белков можно экспрессировать в их нативной форме в эукариотических клетках, таких как клетки CHO. Культура клеток животных, как правило, требует продолжительных времен роста для достижения максимальной плотности клеток и, в конечном счете, достигает меньшей плотности, чем культуры прокариотических клеток (Cleland, J. (1993) ACS Symposium Series 526, Protein Folding: In Vivo and In Vitro, American Chemical Society). Кроме того, культуры клеток животных зачастую требуют дорогостоящих сред, содержащих компоненты роста, которые могут препятствовать очистке целевого белка. Системы экспрессии на основе бактерий-хозяев предоставляют рентабельную альтернативу получения в промышленном масштабе рекомбинантных белков. Существуют многочисленные патенты США по общей бактериальной экспрессии рекомбинантных белков, включая патенты США № 4565785, 4673641, 4795706 и 4710473. Основным преимуществом способа получения является возможность легко отделять продукт от клеточных компонентов путем центрифугирования или микрофильтрации. Смотри, например, Kipriyanov and Little, (1999) Molecular Biotechnology, 12:173-201; и Skerra and Pluckthun, (1988) Science, 240:1038-1040.
Однако бактериальные системы экспрессии, такие как E. coli, не имеют клеточных механизмов, способствующих правильному рефолдингу белков, и, как правило, не приводят к секреции крупных белков в культуральную среду. Рекомбинантные белки, экспрессированные в бактериальных клетках-хозяевах, зачастую обнаруживаются в виде телец включения, состоящих из плотных масс частично свернутого и неправильно свернутого восстановленного белка. Смотри, например, Baneyx, (1999) Current Opin. Biotechnology 10:411-421; и Villaverde and Carrio, (2003) Biotech. Letts. 25:1385-1395. Белки также можно экспрессировать без образования телец включения. Смотри, например, Id. Как правило, рекомбинантный белок в тельцах включения в основном неактивен.
Кроме того, рефолдинг часто приводит к образованию неправильно свернутых и соединенных дисульфидными связями димеров, тримеров и мультимеров (Morris et al., (1990) Biochem. J., 268:803-806; Toren et al., (1988) Anal. Biochem., 169:287-299). Этот феномен ассоциации является довольно обычным при рефолдинге белков, особенно при более высоких концентрациях белка, и, как представляется, часто включает ассоциацию посредством гидрофобного взаимодействия частично свернутых интермедиатов (Cleland and Wang, (1990) Biochemistry. 29:11072-11078).
Неправильное сворачивание происходит либо в клетке при ферментации, либо в ходе процедуры выделения. Белки, выделенные из периплазматического или внутриклеточного пространства, необходимо растворить и растворимый белок повторно свернуть в нативное состояние. Смотри, например, Rudolph, Renaturation of Recombinant, Disulfide-Bonded Proteins From «Inclusion Bodies» в Modern Methods in Protein - and Nucleic Acid Research (Walter de Gruyter New York, 1990), p. 149-172. Способы рефолдинга белков in vitro в правильную, биологически активную конформацию являются существенными для получения функциональных белков. Обычная последующая обработка белков, выделяемых из телец включения, включает растворение телец включения при высокой концентрации денатурирующего средства, такого как мочевина, с последующим разведением денатурирующего средства, чтобы дать возможность произойти рефолдингу (смотри патенты США № 4512922, 4511502 и 4511503). Смотри также, например, Rudolph and Lilie, (1996) FASEB J. 10:49-56; Fischer et al., (1993), Biotechnology and Bioengineering, 41:3-13; Misawa & Kumagai, (1999) Biopolymers 51:297-307; и Clark, (1998) Current Opinion in Biotechnology, 9:157-163; и Tsumoto et al., (2003) Protein Expression and Purification 28:1-8. Такие способы выделения рассматриваются как повсеместно применимые, с незначительными модификациями, для выделения биологически активных рекомбинантных белков из телец включения. Эти способы были применены для гепаринсвязывающего белка (HBP), такого как VEGF (Siemeister et al. (1996), выше). Этими способами добиваются элиминации случайных дисульфидных связей перед переводом рекомбинантного белка в его биологически активную конформацию посредством других его стабилизирующих сил, и можно не удалять неправильно свернутые интермедиаты, получать гомогенные популяции правильно свернутого продукта или получать достаточные количества правильно свернутого продукта.
Обращенные мицеллы или ионообменную хроматографию использовали для облегчения рефолдинга денатурированных белков путем заключения отдельного белка внутри мицелл или выделения их на смоле, и затем удаляя денатурирующее средство (Hagen et al., (1990) Biotechnol. Bioeng. 35:966-975; Creighton (1985) в Protein Structure Folding and Design (Oxender, DX. Ed.), p.249-251, New York: Alan R. Liss, Inc.). Эти способы были пригодны для предотвращения агрегации белка и облегчения правильного рефолдинга. Для изменения скорости или степени рефолдинга осуществляли специфичный по отношению к конформации рефолдинг с лигандами и антителами к нативной структуре белка (Cleland and Wang, (1993), в Biotechnology, (Rehm H. J., and Reed G. Eds.), p.528-555, New York, VCH). Например, креатинкиназу повторно сворачивали в присутствии антител к нативной структуре (Morris et al., (1987) Biochem. J. 248:53-57). В дополнение к антителам для усиления рефолдинга были использованы лиганды и кофакторы. Эти молекулы могут преимущественно взаимодействовать со сворачивающимся белком после образования нативного белка. Таким образом, равновесие фолдинга можно «сдвинуть» к нативному состоянию. Например, скорость рефолдинга феррицитохрома была увеличена при помощи внешнего лиганда к осевому положению железа гема (Brems and Stellwagon, (1983) J. Biol. Chem. 258:3655-3661). Для облегчения белкового фолдинга также были использованы белки-шапероны и катализаторы фолдинга. Смотри, например, Baneyx, (1999) Current Opinion in Biotechnology, 10:411-421; & Carrio & Villaverde, (2003) FEBS Letters 537:215-221. Впрочем, эти способы не всегда эффективны или достаточны для количественного выхода белкового продукта.
Существует необходимость в новых и более эффективных способах фолдинга и/или выделения рекомбинантных белков из культуры клеток-хозяев, например, для эффективного и экономичного получения рекомбинантных белков в культуре бактериальных клеток. Эти новые и более эффективные способы обеспечивают улучшенное выделение высокоочищенного, биологически активного, правильно повторно свернутого белка и, в общем, применимы для получения белков в промышленном масштабе. Изобретение относится к этим и другим потребностям, как будет ясно при ознакомлении со следующим описанием.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу выделения и очистки повторно свернутых рекомбинантных белков из культуры клеток. В частности, изобретение относится к способу выделения рекомбинантного белка из прокариотических клеток-хозяев, например бактериальных клеток. Способы по изобретению широко применимы для рекомбинантных белков. В некоторых вариантах осуществления рекомбинантный белок представляет собой фактор роста, например фактор роста эндотелия сосудов (VEGF). В одном из вариантов осуществления фактор роста представляет собой VEGF165.
В одном из вариантов осуществления способ включает: (a) выделение указанного рекомбинантного белка из культуры прокариотических клеток; (b) растворение указанного белка в первом буферном растворе, pH более 9, содержащем первое хаотропное средство; (c) рефолдинг указанного растворенного белка во втором буферном растворе, pH>9, но ≤11, содержащем второе хаотропное средство, два или более восстанавливающих средств, и добавление воздуха или кислорода в течение такого времени и при таких условиях, при которых происходит рефолдинг рекомбинантного белка; и (d) выделение указанного повторно свернутого рекомбинантного белка. В одном из вариантов осуществления первый буферный раствор и/или второй буферный раствор дополнительно содержит аргинин. В одном из вариантов осуществления первый буферный раствор в конечной концентрации содержит 1 M мочевину, 300 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, pH 11. В другом варианте осуществления первый буферный раствор содержит в конечной концентрации 1 M мочевину, 300 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, pH 11. В одном из вариантов осуществления второй буферный раствор содержит два или более восстанавливающих средств, например DTT и цистеин. В одном из вариантов осуществления второй буферный раствор в конечной концентрации содержит 1 M мочевину, 15 мМ цистеин, 2 мМ DTT, 100 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, pH 10. В другом варианте осуществления второй буферный раствор содержит в конечной концентрации 1 M мочевину, 15 мМ цистеин, 0,5-2 мМ DTT, 100 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, pH 10.
В одном из вариантов осуществления способ включает: (a) выделение указанного рекомбинантного белка из культуры прокариотических клеток; (b) растворение и рефолдинг указанного белка в комбинированном буферном растворе, pH>9, но ≤11, с добавлением воздуха или кислорода; и (c) выделение указанного рекомбинантного белка. В одном из вариантов осуществления комбинированный буферный раствор в конечной концентрации содержит 1 M мочевину, 15 мМ цистеин, 2 мМ DTT, 100 мМ аргинин, 10 мМ CHES, 5 мМ EDTA, pH 10. В другом варианте осуществления комбинированный буферный раствор в конечной концентрации содержит 1 M мочевину, 15 мМ цистеин, 0,5-2 мМ DTT, 100 мМ аргинин, 10 мМ ТРИС, 5 мМ EDTA, pH 10.
Кислород или воздух для реакции рефолдинга можно предоставить посредством источника воздуха или источника обогащенного кислородом сжатого газа. В одном из вариантов осуществления применяют kLa 0,004 мин-1, например ту, которая соответствует скорости перемешивания 200-400 об/мин и скорости барботирования 0,3 куб. см/мин/л во флаконе на 2,5 л, содержащем импеллер морского типа. В других вариантах осуществления для получения повторно свернутого белка применяют kLa = 0,01 мин-1 или 0,1 мин-1.
Растворение и/или рефолдинг можно проводить при различных температурах. В одном из вариантов осуществления температура инкубации для растворения и/или рефолдинга представляет собой комнатную температуру. Время инкубации может варьировать согласно тому, как происходит восстановление и рефолдинг рекомбинантного белка. В одном из вариантов осуществления рекомбинантный белок инкубируют в первом буферном растворе в течение, по меньшей мере, 1 часа или от 1 до 2 часов. В одном из вариантов осуществления растворенный белок инкубируют во втором буферном растворе в течение от приблизительно 3 до 24 часов. В одном из вариантов осуществления выделенный рекомбинантный белок инкубируют в комбинированном буферном растворе в течение от 3 до 24 часов.
Кроме того, изобретение относится к процессам и способам рефолдинга рекомбинантных белков либо самим по себе, либо в связи с выделением рекомбинантного белка, как описано здесь. В конкретном варианте осуществления способы очистки включают осветление раствора, содержащего рекомбинантный белок, и приведение указанного повторно свернутого рекомбинантного белка в осветленном растворе в контакт с носителем комбинированного типа, катионным хроматографическим носителем, первым хроматографическим носителем для гидрофобного взаимодействия и, необязательно, вторым гидрофобным хроматографическим носителем или ионообменным носителем; и селективное выделение или элюирование повторно свернутого рекомбинантного белка с каждого носителя. В одном из вариантов осуществления осветление раствора включает добавление детергента до конечной концентрации 1%, доведение pH до приблизительно 8,5-9,5, инкубирование раствора в течение от 1 до 10 часов при 25-30°C, центрифугирование раствора; и фильтрование жидкости, полученной на стадии центрифугирования. В одном из вариантов осуществления pH составляет приблизительно 8,7. В другом варианте осуществления pH составляет приблизительно 9,0. Предполагается, что стадии для стадий выделения можно проводить в любом порядке, например последовательно или изменяя порядок хроматографических носителей. В некоторых вариантах осуществления изобретения предоставлены способы выделения и очистки повторно свернутых рекомбинантных белков из клеточной культуры производственного или промышленного масштаба.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
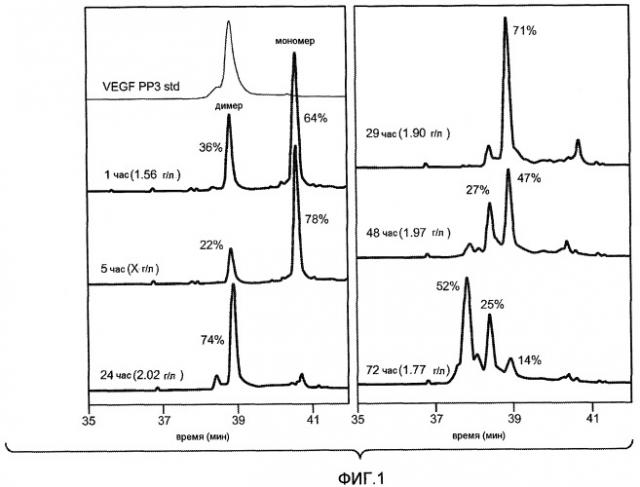
Фиг. 1 иллюстрирует пример исследования с течением времени процесса рефолдинга, как описано здесь, который оценивали путем хроматографии rpHPLC.
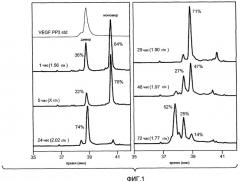
Фиг. 2 иллюстрирует хроматограмму для VEGF, полученную при нанесении на колонку CaptoMMCTM бактериального штамма W3110. Колонку уравновешивают 25 мМ HEPES, pH 9,0. VEGF элюируют с колонки MMC изократически в 1 M аргинине/25 мМ HEPES, pH 6-9.
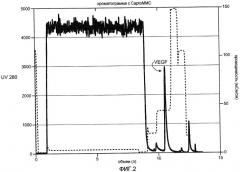
Фиг. 3 иллюстрирует хроматограмму для VEGF, полученную при нанесении на колонку SPHP бактериального штамма W3110. Например, колонку SPHP уравновешивают 50 мМ HEPES, pH 7,5. Колонку элюируют с использованием линейного градиента с 0,0-1,2 M ацетата натрия в 50 мМ HEPES, pH 7,5, в 1 объеме колонки. Элюант контролируют при 280 нм. Белок выделяют из фракций с наибольшим поглощением при 280 нм (макс OD при ~42 мСм/см), которые обычно содержат >90% VEGF, их собирают для дальнейшей обработки.
Фиг. 4 иллюстрирует хроматограмму для VEGF, полученную при нанесении на колонку HiPropyl бактериального штамма W3110.
Фиг. 5 иллюстрирует хроматограмму для VEGF, полученную при нанесении на колонку с фенилсефарозой бактериального штамма W3110.
Фиг. 6 иллюстрирует эффект мочевины и аргинина на условия рефолдинга.
Фиг. 7 иллюстрирует эффект N2 на стабилизацию повторно свернутого пула вплоть до 48 часов в виде оценки с помощью rpHPLC с течением времени, когда N2 добавляли через 6 часов после начала рефолдинга.
Фиг. 8 иллюстрирует эффект варьирования скорости воздушного барботирования на условия рефолдинга.
Фиг. 9 иллюстрирует анализ на колонке, где для анализа повторно свернутого VEGF применяют катионообменную HPLC.
Фиг. 10 иллюстрирует аминокислотную последовательность VEGF165 с отмеченными дисульфидными связями.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Как применяют здесь, «полипептид» относится, как правило, к пептидам и белкам из любого источника клеток, имеющим более чем приблизительно десять аминокислот. «Гетерологичные» полипептиды представляют собой полипептиды, чужеродные используемой клетке-хозяину, такие как белок человека, вырабатываемый в E. coli. Несмотря на то что гетерологичный полипептид может быть прокариотическим или эукариотическим, он является предпочтительно эукариотическим, более предпочтительно полипептидом млекопитающего и более предпочтительно человека. В некоторых вариантах осуществления изобретения его получают рекомбинантно (например, рекомбинантный полипептид или рекомбинантный белок).
Примеры полипептидов млекопитающего включают молекулы, такие как, например, фактор роста; гепаринсвязывающий фактор роста; фактор роста эндотелия сосудов (VEGF), например VEGF-A (изоформы), VEGF-B, VEGF-C и VEGF-D; рецептор и антитело к VEGF, такие как rhuFab V2 и бевацизумаб, ранибизумаб; антитело к рецепторам VEGF; реннин; гормон роста, включая гормон роста человека (hGH); бычий гормон роста; рилизинг-фактор гормона роста; гормон паращитовидной железы; тиреотропный гормон; липопротеины; 1-антитрипсин; А-цепь инсулина; B-цепь инсулина; проинсулин; тромбопоэтин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; рецепторы гормона роста; высвобождающий белок для гормона роста (GHRP); LIV-1 (EP 1263780); TRAIL; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; фактор VIII; B домен фактора VIII; противотканевой фактор; факторы, препятствующие свертыванию крови, такие как белок C; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или мочевой или тканевой активатор плазминогена человека (t-PA) и их варианты; бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли альфа и бета; антитела к домену(ам) ErbB2, энкефалиназа; сывороточный альбумин, такой как сывороточный альбумин человека; ингибирующее вещество Мюллера; A-цепь релаксина; B-цепь релаксина; прорелаксин; гонадотропин-ассоциированный пептид мыши; микробный белок, такой как бета-лактамаза; ДНКаза; ингибин; активин; рецепторы для гормонов или факторов роста; интегрин; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как нейротрофический фактор мозгового происхождения (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нервов, такой как NGF; кардиотрофины (фактор кардиальной гипертрофии), такие как кардиотрофин-1 (CT-1); фактор роста тромбоцитов (PDGF) (A, B, C или D); фактор роста фибробластов, такой как aFGF и bFGF; фактор роста эпидермиса (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-1, TGF-2, TGF-3, TGF-4 или TGF-5; инсулиноподобный фактор роста I и II (IGF-I и IGF-II) и их рецепторы, такие как IGFBP-1-IGFBP-6; des(1-3)-IGF-I (IGF-I мозга), белки, связывающие инсулиноподобный фактор роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; белок морфогенеза костей (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; сывороточный альбумин, такой как сывороточный альбумин человека (HSA) или бычий сывороточный альбумин (BSA); колониестимулирующие факторы (CSF), например M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например IL-1-IL-10; антитело анти-HER-2; лиганд Apo2; супероксиддисмутаза; анти-CD20; херегулин, анти-IgE, анти-CD11a, анти-CD18; фактор некроза опухолей (TNF) и антитела к нему, рецептор TNF и соответствующие антитела, IgG к TNF-рецептору, факторы, связанные с рецептором TNF (TRAF), и их ингибиторы, T-клеточные рецепторы; поверхностные мембранные белки; стимулятор гемолиза; анти-TGF, такие как анти-TGF-бета; анти-активин; анти-ингибин; антитела анти-Fas; ингибитор лиганда Apo-2; рецептор Apo-2; Apo-3; апоптические факторы; Ced-4; DcR3; рецептор смерти и агонистические антитела (DR4, DR5); лимфотоксин (LT); пролактин; рецептор пролактина; белки SOB; WISP (wnt-индуцированные секретированные белки); анти-NGF; ДНКаза; антиген гепатита; антиген простого герпеса; лептин; белок Toll, лиганды TIE, CD40 и анти-CD40, иммуноадгезины, субтилизин, фактор роста гепатоцитов (HGF), тромбопоэтин (TPO); простатоспецифичный раковый антиген (PSCA); вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; домашние рецепторы; адрессины; регуляторные белки; антитела; и фрагменты любых вышеперечисленных полипептидов. Термин «антитело» применяется здесь в самом широком смысле и, в частности, охватывает интактные моноклональные антитела, поликлональные антитела, поливалентные антитела (например, бивалентные антитела), образованные, по меньшей мере, из двух интактных антител, и фрагменты антител, до тех пор пока они проявляют требуемую биологическую активность. В некоторых вариантах осуществления изобретения рекомбинантный полипептид представляет собой фактор роста. В одном из вариантов осуществления рекомбинантный полипептид является полипептидом VEGF млекопитающего. В другом варианте осуществления рекомбинантный полипептид представляет собой VEGF человека (например, VEGF165). В одном из вариантов осуществления рекомбинантный полипептид не является ангиостатином. В одном из вариантов осуществления рекомбинантный полипептид не является IGF-1.
Как применяют здесь, «фактор роста эндотелия сосудов» или «VEGF» относится к фактору роста млекопитающего, полученному первоначально из гипофизарных фолликулярных клеток быка, обладающему аминокислотной последовательностью, описанной в Castor, C. W., et al., (1991) Methods in Enzymol. 198:391-405, вместе с его функциональными производными, обладающими качественной биологической активностью соответствующего нативного VEGF, включая в качестве неограничивающих примеров аминокислотную последовательность VEGF человека, как сообщено в Houck et al., (1991) Mol. Endocrin. 5:1806-1814. Смотри также Leung et al. (1989) Science. 246:1306, Robinson & Stringer, (2001) Journal of Cell Science. 144(5):853-865, патент США № 5332671. Его также обозначают как VEGF-A. Другие члены семейства отмечены буквенным символом в конце VEGF, например VEGF-B, VEGF-C или VEGF-D. Преобладающая форма VEGF, или VEGF-A, представляет собой 165-аминокислотный гомодимер, обладающий шестнадцатью остатками цистеина, которые образуют 7 внутримолекулярных дисульфидных связей и две межмолекулярные дисульфидные связи. Альтернативный сплайсинг принимает участие в образовании множественных полипептидов VEGF человека, состоящих из 121, 145, 165, 189 и 206 аминокислот, при этом вариант VEGF121 не содержит гепаринсвязывающий домен других вариантов. Все изоформы VEGF имеют часть общего аминоконцевого домена, но отличаются длиной карбоксиконцевой части молекулы. Предпочтительная активная форма VEGF, VEGF165, содержит дисульфидные связи между аминокислотными остатками Cys26-Cys68; Cys57-Cys104; Cys61-Cys102; Cys117-Cys135; Cys120-Cys137; Cys139-Cys158; Cys146-Cys160 в каждом мономере. Смотри Фиг. 10. Смотри также, например, Keck et al., (1997) Archives of Biochemistry and Biophysics 344(1):103-113. Молекула VEGF165 состоит из двух доменов: аминоконцевого рецепторсвязывающего домена (аминокислоты 1-110 связанного дисульфидными связями гомодимера) и карбоксиконцевого гепаринсвязывающего домена (остатки 111-165). Смотри, например, Keyt et al., (1996) J. Biol. Chem., 271(13):7788-7795. В некоторых вариантах осуществления изобретения выделенный и очищенный VEGF165 не гликозилирован по остатку 75 (Asn). Смотри, например, Yang et al., (1998) Journal of Pharm. & Experimental Therapeutics, 284:103-110. В некоторых вариантах осуществления изобретения выделенный и очищенный VEGF165 по существу не диамидирован по остатку Asn10. В некоторых вариантах осуществления изобретения выделенный и очищенный VEGF165 представляет собой смесь диамидированного (по остатку Asn10) и недиамидированного белка, как правило, с преобладанием недиамидированного белка. Поскольку VEGF165 представляет собой гомодимер, диаминирование может иметь место на одной или обеих полипептидных цепях.
Термин «гепаринсвязывающий белок», как применяют здесь, относится к полипептиду, способному связывать гепарин (как определено здесь). Определение включает зрелую, пре-, препро- и проформы нативных и рекомбинантно получаемых гепаринсвязывающих белков. Типичными примерами гепаринсвязывающих белков являются «гепаринсвязывающие факторы роста», включающие в качестве неограничивающих примеров фактор роста эпидермиса (EGF), фактор роста тромбоцитов (PDGF), основный фактор роста фибробластов (bFGF), кислотный фактор роста фибробластов (aFGF), фактор роста эндотелия сосудов (VEGF), фактор роста гепатоцитов (HGF) (также известный как рассеивающий фактор, SF) и фактор роста нервов (NGF), IL-8, и т.д.
«Гепарин» (также обозначаемый как гепариновая кислота) представляет собой гетерогенную группу высокосульфатируемых, анионных мукополисахаридов с прямой цепью, называемых гликозаминогликанами. Хотя другие сахара могут присутствовать, основными сахарами в гепарине являются: α-L-идуроновая кислота-2-сульфат, 2-дезокси-2-сульфамино-α-глюкоза-6-сульфат, β-D-глюкуроновая кислота, 2-ацетамидо-2-дезокси-α-D-глюкоза и L-идуроновая кислота. Эти и, необязательно, другие сахара присоединены при помощи гликозидных связей, образуя полимеры различных размеров. Благодаря наличию у него ковалентно связанных сульфатных и карбоксильных кислотных групп гепарин является сильно кислым. Молекулярная масса гепарина варьирует от приблизительно 3000 до приблизительно 20000 дальтон, в зависимости от источника и способа определения. Нативный гепарин является компонентом различных тканей, особенно печени и легкого, и клеток молочной железы у некоторых видов млекопитающих. Гепарин и соли гепарина (гепарин-натрий) коммерчески доступны и используются, главным образом, в виде антикоагулянтов в различных клинических ситуациях.
Как применяют здесь, «правильно свернутый» или «биологически активный» VEGF или другой рекомбинантный белок и т.п. относится к молекуле с биологически активной конформацией. Квалифицированный специалист признает, что неправильно свернутые интермедиаты и интермедиаты с неправильными дисульфидными связями могут обладать биологической активностью. В таком случае правильно свернутый или биологически активный VEGF или рекомбинантный белок соответствует нативному характеру фолдинга VEGF (описанного выше) или другого рекомбинантного белка. Например, правильно свернутый VEGF обладает отмеченными выше дисульфидными парами, в дополнение к двум межмолекулярным дисульфидным связям в димерной молекуле, однако другие интермедиаты могут быть получены при помощи бактериальной клеточной культуры. Для правильно свернутого VEGF имеют место две межмолекулярные дисульфидные связи между теми же остатками, Cys51 и Cys60, каждого мономера. Смотри, например, WO98/16551. Биологические активности VEGF включают в качестве неограничивающих примеров активацию сосудистой проницаемости, стимулирование роста эндотелиальных клеток сосудов, связывание с рецептором VEGF, связывание и передачу сигналов через рецептор VEGF (смотри, например, Keyt et al., (1996) Journal of Biological Chemistry, 271(10):5638-5646), индуцирование ангиогенеза и т.д.
Термины «очищенный» или «чистый рекомбинантный белок» и т.п. относятся к материалу, свободному от веществ, которые в норме сопровождают его, как обнаружено при его рекомбинантном получении и особенно в прокариотической или бактериальной культуре клеток. Поэтому термины относятся к рекомбинантному белку, который свободен от загрязнений ДНК, белками клетки-хозяина или другими молекулами, связанными с его окружением in situ. Термины относятся к степени чистоты, которая составляет, по меньшей мере, приблизительно 75%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95% или, по меньшей мере, приблизительно 98% или более.
Термины «тельца включения» или «преломляющие тельца» относятся к плотным внутриклеточным массам представляющих интерес агрегированных полипептидов, которые составляют значительную часть общего клеточного белка, включая все клеточные компоненты. В некоторых случаях, но не во всех случаях, эти агрегаты полипептидов можно обнаружить в виде ярких пятен, видимых внутри очертания клеток под фазово-контрастным микроскопом при увеличении ниже чем 1000-кратное.
Как применяют здесь, термин «неправильно свернутый» белок относится к преципитированным или агрегированным полипептидам, которые содержатся в преломляющих тельцах. Как применяют здесь, «нерастворимый» или «неправильно свернутый» VEGF или другой рекомбинантный белок относится к преципитированному или агрегированному VEGF или рекомбинантному белку, который содержится внутри периплазмы или внутриклеточного пространства прокариотических клеток-хозяев, или иным способом ассоциированному с прокариотической клеткой-хозяином и принимает биологически неактивную конформацию с неправильно образованными или несформированными дисульфидными связями. Нерастворимый рекомбинантный белок, как правило, но необязательно, содержится в преломляющих тельцах, т.е. он может или не может быть визуализирован в фазово-контрастный микроскоп.
Как применяют здесь, «хаотропное средство» относится к соединению, которое в соответствующей концентрации в водном растворе способно изменить пространственную конфигурацию или конформацию полипептидов посредством изменений на их поверхности таким образом, чтобы сделать полипептид растворимым в водной среде. Изменения могут происходить путем изменения, например, характера гидратации окружающего растворителя или взаимодействия растворителя с поверхностью. Концентрация хаотропного средства будет непосредственно влиять на его силу и эффективность. Сильно денатурирующий хаотропный раствор содержит хаотропное средство в высоких концентрациях, которое в растворе будет эффективно разворачивать присутствующий в растворе полипептид, эффективно элиминируя вторичную структуру белков. Разворачивание должно быть относительно обширным, но обратимым. Умеренно денатурирующий хаотропный раствор содержит хаотропное средство, которое в достаточных концентрациях в растворе обеспечивает частичное сворачивание полипептида из любой нарушенной конформации, принятой полипептидом, через интермедиаты, растворимые в растворе, в пространственную конформацию, в которой он существует при функционировании в активной форме при эндогенных или гомологичных физиологических условиях. Примеры хаотропных средств включают гидрохлорид гуанидина, мочевину и гидроксиды, такие как гидроксид натрия или калия. Хаотропные средства включают сочетания этих средств, такие как смеси гидроксида с мочевиной или гидрохлоридом гуанидина.
Как применяют здесь, «восстанавливающее средство» обозначает соединение, которое в подходящей концентрации в водном растворе сохраняет свободные сульфгидрильные группы таким образом, что интра- или межмолекулярные дисульфидные связи химически разрываются. Репрезентативные примеры подходящих восстанавливающих средств включают дитиотреитол (DTT), дитиоэритрит (DTE), бета-меркаптоэтанол (BME), цистеин, цистамин, тиогликолят, глутатион и борогидрид натрия.
Как применяют здесь, «буферный раствор» обозначает раствор, который устойчив к изменениям pH путем действия своих спаренных компонентов кислота-основание.
«Бактерии» для целей настоящего описания включают эубактерии и архебактерии. В некоторых вариантах осуществления изобретения эубактерии, включая грамположительные и грамотрицательные бактерии, применяют в описанных здесь способах и процессах. В одном из вариантов осуществления изобретения применяют грамотрицательные бактерии, например Enterobacteriaceae. Примеры бактерий, принадлежащих к Enterobacteriaceae, включают Escherichia, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella. Другие типы подходящих бактерий включают Azotobacter, Pseudomonas, Rhizobia, Vitreoscilla и Paracoccus. В одном из вариантов осуществления изобретения применяют E. coli. Подходящие хозяева E. coli включают E. coli W3110 (ATCC 27325), E. coli 294 (ATCC 31446), E. coli B и E. coli X1776 (ATCC 31537). Эти примеры являются скорее иллюстративными, чем ограничивающими, и W3110 представляет собой один из примеров. Можно также использовать мутантные клетки любой из вышеупомянутых бактерий. Конечно, необходимо отбирать подходящие бактерии, принимая во внимание воспроизводимость репликона в клетках бактерии. Например, виды E. coli, Serratia или Salmonella можно соответствующим образом использовать в качестве хозяина, в котором используют в качестве источника репликона хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Смотри далее относительно примеров подходящих бактериальных клеток-хозяев.
Как применяют здесь, выражения «клетка», «клеточная линия», «штамм» и «клеточная культура» используют взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичную из рассматриваемых клеток и культуры, полученные из нее безотносительно к количеству пассажей. Также понятно, что все потомство не может являться в точности идентичными по содержанию ДНК вследствие преднамеренных или случайных мутаций. Включается мутантное потомство, которое обладает той же самой функцией или биологической активностью, как и те, поиск которых осуществляли в исходной трансформированной клетке. Там, где предполагаются различные обозначения, это станет ясно из контекста.
Комбинированный тип колонки обозначает колонку со смолой, которая обладает как катионообменными свойствами, так и гидрофобными взаимодействиями.
Рекомбинантные белки
Рекомбинантные белки, например факторы роста, такие как кислый фактор роста фибробластов, основный фактор роста фибробластов и фактор роста эндотелия сосудов, были выделены и очищены из ряда источников, включая бактерии (Salter D.H. et al., (1996) Labor. Invest. 74(2):546-556 (VEGF); Siemeister et al., (1996) Biochem. Biophys. Res. Commun. 222(2):249-55 (VEGF); Cao et al., (1996) J. Biol. Chem. 261(6):3154-62 (VEGF); Yang et al., (1994) Gaoiishu Tongxun. 4:28-31 (VEGF); Anspach et al., (1995) J. Chromatogr. A 711(1):129-139 (aFGF и bFGF); Gaulandris (1994) J Cell. Physiol. 161(1):149-59 (bFGF); Estape and Rinas (1996) Biotech. Tech. 10(7):481-484 (bFGF); McDonald et al., (1995) FASEB J. 9(3):A410 (bFGF)). Например, преобладающая активная форма VEGF представляет собой гомодимер двух 165-аминокислотных полипептидов (VEGF-165). В этой структуре каждая субъединица содержит 7 пар внутрицепочечных дисульфидных связей и две дополнительные пары, которые образуют ковалентную связь двух субъединиц (Ferrara et al., (1991) J. Cell. Biochem. 47:211-218). Нативная конформация включает сильно основный домен, который, как показано, легко связывается с гепарином (Ferrara et al. (1991), выше). В то время как ковалентная димеризация VEGF необходима для эффективного связывания рецептора и биологической активности (Potgens et al., (1994) J. Biol. Chem. 269:32879-32885; Claffey et al., (1995) Biochim. et Biophys. Acta 1246:1-9), бактериальный продукт потенциально содержит несколько неправильно свернутых интермедиатов и интермедиатов с неправильно сформированными дисульфидными связями. Предложены способы, которые пригодны при выделении, очистке и реактивации белков, которые образуются в клетках-хозяевах в форме «преломляющих телец», а также растворимых белков.
Выделение рекомбинантного белка
Нерастворимый, неправильно свернутый рекомбинантный белок выделяют из прокариотических клеток-хозяев, экспрессирующих белок с помощью любого из ряда общепринятых в области способов. Например, нерастворимый рекомбинантный белок выделяют в подходящем буфере для выделения, помещая клетки в буфер с подходящей ионной силой для растворения большинства белков хозяина, но в котором рассматриваемый белок по существу нерастворим, или разрушая клетки таким образом, чтобы высвободить тельца включения или белок из периплазматического или внутриклеточного пространства и сделать их доступными для выделения, например, центрифугированием. Этот способ хорошо известен и описан, например, в патенте США № 4511503. В Kleid et al. описана очистка преломляющих телец путем гомогенизации с последующим центрифугированием (Kleid et al., (1984) в Developments in Industrial Microbiology, (Society for Industrial Microbiology, Arlington, VA) 25:217-235). Смотри также, например, Fischer et al., (1993) Biotechnology and Bioengineering 41:3-13.
В патенте США № 5410026 описан типичный способ выделения белка из телец включения, и он суммирован, как описано далее. Прокариотические клетки суспендируют в подходящем буфере. В основном буфер состоит из буферного вещества, подходящего для забуферивания pH между 5 и 9 или приблизительно 6-8, и соли. Любая подходящая соль, включая NaCl, пригодна для поддержания достаточной ионной силы в буферном растворе. В основном используют ионную силу приблизительно 0,01-2 M или от 0,1 до 0,2 M. Клетки, при суспендировании в этом буфере, разрушают или лизируют с использованием общепринятых способов, таких как, например, механические способы, например гомогенизатор (пресс Manton-Gaulin, Microfluidizer или Niro-Soavi), французский пресс, шаровая мельница или звуковой осциллятор, или путем химических или ферментативных способов.
Примеры химических или ферментативных способов разрушения клеток включают сферопластирование, которое влечет использование лизоцима для лизирования бактериальной стенки (H. Neu et al., (1964) Biochem. Biophys. Res. Comm., 17:215), и осмотический шок, который предусматривает обработку живых клеток гипертоническим раствором и промывку гипотонической холодной водой для высвобождения полипептидов (H. Neu et al., 1965 J. Biol. Chem. 240(9):3685-3692). Обработку ультразвуком, как правило, используют для разрушения бактерий, содержащихся в объемах среды для ферментации аналитических масштабов. При более крупных масштабах в основном используют гомогенизацию при высоком давлении.
После того как клетки разрушены, суспензию обычно центрифугируют при низкой скорости, как правило, например, в районе от 500 до 15000×g, например в одном из вариантов осуществления изобретения используют приблизительно 12000×g, в общепринятой центрифуге в течение времени, достаточном для осаждения по существу всего нерастворимого белка. Такие периоды времени можно легко определить, и они зависят от центрифугиру