Стимулирование пероральной толерантности гликозилированными белками
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики. Способ стимулирования пероральной толерантности млекопитающих к молочным сывороточным белкам включает энтеральное введение млекопитающему гликозилированных форм сывороточных белков молока. Смесь для питания младенцев содержит гликозилированные сывороточные белки молока. Смесь для питания младенцев для стимулирования пероральной толерантности к негликозилированным белкам содержит гликозилированные формы сывороточных белков молока. Способ производства смеси для питания младенцев, заключающийся в том, что входящие в состав смеси сывороточные молочные белки предварительно подвергают процессу гликации в твердом состоянии. Группа изобретений позволяет значительно повысить пероральную толерантность млекопитающих к молочным сывороточным белкам. 4 н. и 7 з.п. ф-лы, 2 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу стимулирования у животного пероральной толерантности, включающему введение животному гликозилированных белков; гликозилированным белкам для применения при стимулировании пероральной толерантности у животного; пищевому продукту, содержащему гликозилированные белки, для аналогичного применения, и способу изготовления указанного пищевого продукта.
Уровень техники
Материнское молоко рекомендуется для всех младенцев. Однако в некоторых случаях грудное вскармливание бывает недостаточным или безуспешным или нецелесообразным по медицинским причинам или мать отказывается от кормления грудью. Для таких случаев разработаны смеси для питания младенцев. Большинство смесей для питания младенцев основано на коровьем молоке. Однако у младенцев часто встречается аллергия на коровье молоко или гиперчувствительность к молоку. Обычно к возрасту двух или трех лет она исчезает, но иногда может продолжаться всю жизнь. Это наиболее обычное заболевание у младенцев, имеющее частоту проявления от 0,5 до 3% среди доношенных детей и 3-5% среди недоношенных детей. Эта аллергия может вызвать высыпания, крапивницу, покраснение кожи вокруг рта, слизисто-водянистые выделения из носа, чихание, колики, диарею, рвоту, анафилаксию или расстройства желудка в более общем смысле. Это может быть также связано с некоторыми случаями синдрома внезапной смерти внешне здорового младенца.
Гиперчувствительность к молоку следует отличать от непереносимости лактозы, которая представляет собой интолерантность к молоку вследствие врожденного дефицита фермента лактазы.
Аллергия к коровьему молоку в большинстве случаев вызывается реакцией на белки α-лактальбумин и β-лактоглобулин в сывороточной фракции. Это также может вызываться казеином и/или альбумином, которые являются потенциально аллергенными молочными белками, также присутствующими в коровьем молоке. На ранних месяцах жизни иммунная система находится в состоянии развития и может оказаться не в состоянии распознавать и переносить такие пищевые белки. Результатом оказывается то, что ребенок относится к пищевому белку как к чужеродному веществу и вырабатывает к нему аллергию. Дети могут также вырабатывать аллергии к другим пищевым белкам, если их иммунная система не распознает и не переносит эти белки.
Существуют иммунные реакции двух типов: клеточно-опосредованная (или Th1), которая важна в случае нападения бактерий и вирусов, и гуморальная (или Th2), которая непосредственно связана с аллергическими реакциями. До рождения ребенка его организм стерилен, и Th1-путь неактивен. Th2-путь, однако, активен и до рождения, поскольку необходимо предотвращение вызова иммунного ответа ребенка его матери. Сразу же после рождения ребенок подвергается воздействию многочисленных бактерий, как неопасных, так и вредных, и путь Th1 активизируется для того, чтобы справляться с этим нападением. Как только в кишечнике обнаруживается какое-либо новое потенциально чужеродное вещество, оно поглощается ассоциированной с кишечником лимфоидной тканью через М-клетки и сталкивается с нативными Т-лимфоцитами. Если Th1-путь функционирует правильно, то организм будет генерировать иммунный ответ, состоящий из специфичных антител или специфично сенсибилизированных Т-лимфоцитов. Эти Т-лимфоциты, ставшие специализированными для безвредных пищевых антигенов, в дальнейшем будут действовать как сдерживающий механизм для предотвращения аллергии, развивающейся через Th2-путь. Этот механизм известен как оральная толерантность.
Однако если генерируемое иммунным ответом антитело является антителом IgE, то оно ответит на дальнейший контакт с антигеном генерированием воспалительной реакции, которая является аллергией. Механизм аллергии этого типа может быть объяснен следующим образом: антитела IgE появляются на поверхности клеток, включая циркулирующие базофилы. Когда происходит взаимодействие аллерген/IgE, клетки, представляющие пару IgE/аллерген, генерируют и выделяют химические медиаторы, включая гистамин. Это явление ведет к патологическим эффектам, таким как местная или системная вазодилятация (расширение кровеносных сосудов).
Th1-путь стимулируется наличием бактерий. Если новорожденный или совсем маленький ребенок не встречается с достаточным количеством бактерий, как это может происходить в развитых странах с высоким уровнем гигиенических норм, Th1-путь может не функционировать так, как следует. В таких случаях единственной реакцией иммунной системы будет реакция Th2, и к данному антигену разовьется аллергия. Это только одна из причин нарушения развития пероральной толерантности; могут быть и другие. Разумеется, рассматривается и генетическая предрасположенность.
Таким образом, феномен пероральной толерантности является способностью, с помощью которой введение антигенов пероральным путем может предотвращать последующие системные иммунные ответы на тот же самый антиген, данные в иммуногенной форме. Полагают, что подобный механизм предотвращает гиперчувствительные реакции на обычную бактериальную флору кишечника, которая является существенной для жизнедеятельности, а также представляет источник безвредных антигенов. Если механизм пероральной толерантности не развивается у младенца достаточным образом или если имеются нарушения в физиологическом состоянии устойчивости к определенным антигенам, это может приводить к развитию реакций гиперчувствительности.
Обычно гиперчувствительность к молоку появляется, когда восприимчивый младенец впервые сталкивается с коровьим молоком. С точки зрения режима питания есть два способа лечения развившейся аллергии: необходимо либо полностью избегать пищевых продуктов, содержащих аллерген, либо пищевые продукты нужно обрабатывать, чтобы снижать их аллергенность, например подвергать гидролизу. И смесь для детского питания, и крупы, содержащие сильно гидролизованные белки (пептиды, состоящие из не больше чем пяти аминокислот), производятся для этой последней цели.
Однако существует потребность в продуктах, которые помогают снижать риск развития аллергии и стимулировать развитие переносимости к необработанным белкам, в частности, у детей, которые считаются подверженными такому риску (например, если у них есть, по меньшей мере, один страдающий от аллергии член семьи). Например, для индуцирования (стимулирования) пероральной толерантности у младенцев было предложено кормление частично гидролизованными белками. Дополнительный вариант для индуцирования и поддержания пероральной толерантности описан в WO 03/099037, а именно использование пищевых продуктов, содержащих пробиотические бактерии. Примеры пробиотических бактерий включают различные виды Lactobacilli и Bifidobacteria. Найдено, что введение пробиотиков может помочь вызывать пероральную толерантность у младенцев.
Цель настоящего изобретения заключается в предоставлении дальнейшего подхода к стимулированию пероральной толерантности.
Смеси для питания младенцев часто содержат сывороточные белки, которые являются особенно интересными с пищевой точки зрения, содержат все незаменимые аминокислоты и являются легко и быстро усвояемыми.
Когда сывороточные белки нагреваются в присутствии редуцирующих сахаров, свободные аминогруппы белков реагируют с сахаром, приводя к гликации белков. Если позволить таким реакциям проходить беспрепятственно, результатом может быть существенное снижение пищевой ценности, а также может наблюдаться некоторое потемнение. Сложный ряд могущих происходить при этом реакций в совокупности известен как реакция Майяра. Даже считается, что фактически реакции типа реакции Майяра могут протекать, хотя и очень медленно, в пищевых продуктах, содержащих необходимые химические группы, при комнатной температуре. Хотя, как правило, реакция Майяра считается нежелательной и поэтому предпринимаются меры для ее контролирования в ходе обработки соответствующих продуктов питания, совсем недавно стало понятно, что тщательно контролируемая гликация сывороточных белков могла бы предложить возможность воздействия на свойства белков различными способами.
Первый стойкий продукт, получающийся при неферментативном взаимодействии гликозильной группы и α- или ε-аминогрупп белков, известен как соединение Амадори. Будучи подвергнутыми кислотному гидролизу, все соединения Амадори выделяют фурозин, и соответственно был изобретен способ контроля динамики гликации молочных белков, основанный на оценке продуцирования фурозина. С помощью этого инструмента и последующей разработки масс-спектрометрических методик появилась теоретическая возможность контроля протекания реакции Майяра. Гликация может осуществляться в растворе или в твердом состоянии.
WO 00/18249 описывает способ твердофазной гликации сухой сыворотки белковосодержащих материалов, содержащий регулирование активности воды порошка в пределах величины 0,3-0,8 и обеспечение прохождения гликации при температуре 30-75°С во временном интервале между 1 часом и 80 днями. Заявлено, что получающийся порошок усиливает такие функциональные свойства, как повышенная термостабильность, эмульгирующая активность, противоокислительная активность и способность связывания энтеротоксина. Порошок может использоваться в качестве добавки для увеличения функциональности и пищевой ценности продуктов питания.
Сущность изобретения
В одном аспекте изобретение относится к способу стимулирования пероральной толерантности млекопитающего к белкам, содержащему введение млекопитающему гликозилированных форм указанных белков. Гликозилированные белки вводятся энтерально, например, включением в пищевой продукт. Такой продукт прост в производстве и во введении и обладает пищевой ценностью.
В другом аспекте изобретение относится к гликозилированным белкам, используемым для стимулирования у млекопитающего пероральной толерантности к негликозилированным белкам.
В третьем аспекте изобретение относится к пищевому продукту, содержащему гликозилированные белки, используемые для стимулирования у млекопитающего пероральной толерантности к негликозилированным белкам.
Предпочтительно гликозилированные белки являются гликозилированными сывороточными белками. Примером пищевого продукта, содержащего гликозилированные сывороточные белки, является смесь для питания детей или младенцев.
В качестве варианта пищевой продукт может быть сухим, влажным или жидким кормом для домашних животных, содержащим гликозилированные белки.
Предпочтительно гликозилированные сывороточные белки содержат гликозилированный β-лактоглобулин, и предпочтительно гликация является лактозилированием, то есть редуцирующим сахаром является лактоза. Так как эти компоненты присутствуют во многих компонентах пищевого продукта, например, в изоляте сывороточного белка, концентрате сывороточного белка или в сухом обезжиренном молоке, приспособление способов производства этих продуктов для включения этапа лактозилирования не является сложным. Все из этих сывороточных белковосодержащих продуктов широко используются в качестве компонентов пищевого продукта, ценимых как за функциональные свойства их белков, так и за хорошие питательные свойства.
В еще одном аспекте изобретение относится к описанному выше способу производства пищевого продукта, включающему подвергание содержавшихся в продукте белков процессу гликации. Гликация может осуществляться либо в растворе, либо в твердом состоянии.
В дополнительном аспекте изобретение относится к смеси для питания младенцев, содержащей гликозилированные белки, предпочтительно гликозилированные сывороточные белки.
Краткое описание фигур
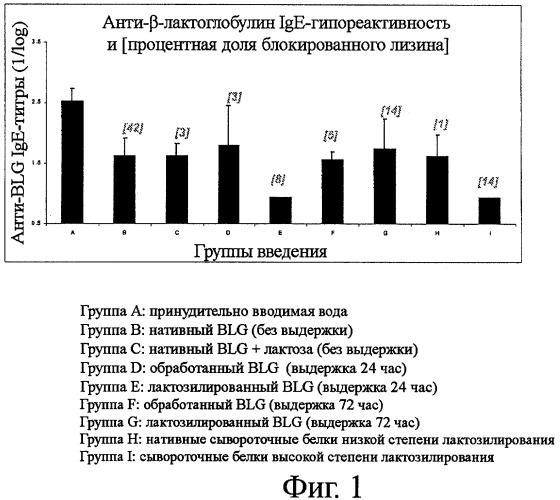
Фигура 1 показывает анти-β-лактоглобулин IgE-гипореактивность в девяти группах мышей, получавших с кормом сывороточный белок различных типов, или β-лактоглобулин различной степени лактозилирования;
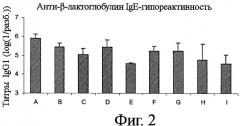
Фигура 2 показывает анти-β-лактоглобулин IgG1-гипореактивность в тех же девяти группах мышей, что и на фиг.1;
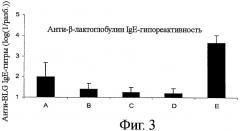
Фигура 3 показывает анти-β-лактоглобулин IgE-гипореактивность в пяти группах мышей, получавших с кормом сывороточный белок различных типов, или β-лактоглобулин различной степени лактозилирования.
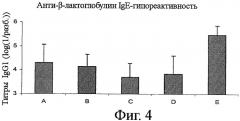
Фигура 4 показывает анти-β-лактоглобулин IgG1-гипореактивность в тех же пяти группах мышей, что и на фиг.3.
Раскрытие изобретения
Согласно изобретению, такие белки как сывороточный белок β-лактоглобулин, являющиеся антигенами, к которым могут развиваться аллергии, могут гликозилироваться и вводиться млекопитающему для стимулирования пероральной толерантности к указанным антигенам. Другие белки, которые могут использоваться, включают сывороточный белок α-лактальбумин, казеин и альбумин.
Под стимулированием пероральной толерантности подразумевается как индуцирование, так и поддержание пероральной толерантности, вместе или по отдельности.
Наиболее распространенной пищевой аллергией или гиперчувствительностью является аллергия на коровье молоко или гиперчувствительность к коровьему молоку, так как в большинстве случаев оно оказывается первым пищевым продуктом, с которым сталкиваются младенцы. Соответственно обсуждение здесь главным образом сосредоточено на этой аллергии. Однако объем настоящей патентной заявки не ограничивается этой аллергией, а предназначен, чтобы касаться стимулирования пероральной толерантности в отношении других пищевых белков, таких как белки орехов (например, арахиса), пшеницы и яичных белков, которые также обычно связываются с аллергией у детей. Например, согласно изобретению млекопитающему могут вводиться гликозилированные белки пшеницы для стимулирования пероральной толерантности к белкам пшеницы, гликозилированные белки яиц могут вводиться млекопитающему для стимулирования пероральной толерантности к яичным белкам и гликозилированные белки орехов могут вводиться млекопитающему для стимулирования пероральной толерантности к белкам орехов.
Гликозилированные белки предпочтительно готовятся, подвергая белки процессу гликации, предпочтительно процессу гликации в твердом виде. Согласно Morgan (J Agric Пища Chem (1999) 47 (11):4543-8) твердофазные процессы приводят к меньшему конформационному изменению молекулы белка. Кроме того, твердофазные процессы легче контролируются и управляются, что делает возможным предупреждение нежелательных эффектов, таких как агрегирование белка и глубокое протекание реакции Майяра.
Процесс гликации может содержать легкую тепловую обработку (50-80°С) порошков белок/сахар с величиной AW, отрегулированной до уровня 0,2-0,7, в течение до около 72 часов. Весь процесс очень прост, хорошо адаптирован к имеющемуся промышленному оборудованию и экономичен с точки зрения энергозатрат. Процесс в целом может содержать регулирование и приведение в равновесное состояние активности воды (AW) в порошках, тепловую обработку увлажненного порошка и, возможно, охлаждение и/или сушку порошка.
В предпочтительном объекте изобретения гликозилированные белки включаются в пищевой продукт. В контексте настоящего изобретения термин «пищевой продукт» предназначается для охвата любых пригодных к употреблению веществ. Следовательно, это может быть продукт, предназначенный для употребления людьми, в частности, смесь для питания младенцев, смесь для детского питания, состав для последующего прикармливания младенцев и детей и т.п.
В соответствии со Статьей 1.2 Директивы Европейской комиссии 91/321/EEC от 14 мая 1991 г. о смесях для питания младенцев и составах для последующего прикармливания ребенок младше 12 месяцев рассматривается как «младенец». «Смесь для питания младенцев» является пищевым продуктом, предназначенным для сбалансированного питания младенцев в течение первых шести месяцев жизни.
Однако гликозилированные белки могут также включаться в пищевые продукты, не предназначаемые специально для кормления младенцев или детей, но, тем не менее, потребляемые этой группой, например, молоко, йогурт, творог, сыр, кисломолочные продукты, ферментированные продукты на основе молока, мороженое, ферментированные крупяные продукты или, среди прочих, продукты на молоке.
Термин «пищевой продукт» также охватывает продукты, которые потребляются другими млекопитающими, например, такими домашними животными, как собаки, кошки, кролики, морские свинки, мыши, крысы или другими одомашненными млекопитающими, таким скотом, как, например, крупный рогатый скот, лошади, свиньи, овцы, козы, буйволы, верблюды и т.д. В этом отношении предпочтительны домашние животные, являющиеся животными-компаньонами. Соответственно вышеупомянутые гликозилированные белки могут также включаться в пищевые продукты для домашних животных для стимулирования пероральной толерантности. Подходящие пищевые продукты для домашних животных включают продукты в виде кусочков, крокетов, продуктов для жевания, увлажненные продукты, такие как баночные консервы, и жидкие составы, такие как молоко для котят или щенков.
Корм для домашних животных является пищей, подходящей для употребления домашними животными, и предпочтительно пищевыми продуктами, которые являются подходящими для сбалансированного питания домашних животных.
По определению с повышением степени гликации прогрессивно снижается питательное качество гликозилированного белка.
Для сывороточных белков это может быть оценено измерением процентной доли блокированного лизина. Ограниченная гликация этих белков не приводит к заметным отрицательным воздействиям на их пищевую ценность, но степень гликации и доля используемого в конкретном продукте гликозилированного белка при разработке рецептуры продукта должны быть приняты во внимание. Например, смесь для питания младенцев предпочтительно не должна содержать больше чем около 15% блокированного лизина. Если в рецептуре используются гликозилированные белки, эта цель соблюдения итогового показателя по блокированному лизину может быть достигнута либо проведением гликации всех белков до этой максимальной желательной степени, либо посредством использования смеси более высокогликозилированных белков и необработанных белков.
Согласно дополнительному аспекту изобретения обеспечивается способ производства такого пищевого продукта, включающий подвергание белка процессу гликации, предпочтительно процессу гликации в твердом состоянии.
Изобретение также обеспечивает смесь для питания младенцев, содержащую гликозилированные белки, такие как гликозилированные сывороточные белки. Смесь для питания младенцев может иметь стандартную композицию с белками, изначально в ней гликозилированными, или замещенными на гликозилированные белки в качестве альтернативы. Как отмечалось выше, смесь для питания младенцев, содержащая гликозилированные сывороточные белки, предпочтительно не должна содержать больше чем около 15% блокированного лизина, и эта цель соблюдения итогового показателя по блокированному лизину может быть достигнута либо проведением гликации всех белков до этой максимальной желательной степени, либо посредством использования смеси более высокогликозилированных белков и необработанных белков.
До тех пор пока толерантность к белку не установится, в качестве заменителя негликозилированного белка предпочтительно должны потребляться гликозилированные белки. Например, пока не установится толерантность к яичному белку, потребляться должны только гликозилированные белки яиц, после чего без опасения относительно аллергической реакции могут употребляться и обычные яйца. Аналогичным образом, содержащая гликозилированные белки смесь для питания младенцев должна даваться ребенку до полного отлучения от груди и до тех пор, пока ребенок не достигнет возраста употребления обычных пищевых продуктов, например, между 3 и 5 годами.
Примеры
Следующие примеры являются показательными для продуктов и способов их изготовления, подпадающих под объем настоящего изобретения. Ни в коем случае их не следует рассматривать в качестве ограничивающих изобретение. В отношении изобретения могут делаться изменения и модификации. То есть специалист в данной области признает в этих примерах много возможных вариантов, охватывающих широкий диапазон композиций, ингредиентов, способов обработки и смесей, и сможет приспособить естественные уровни соединений изобретения для различных применений.
Пример 1: Гликация сывороточных белков в жидком состоянии
β-Лактоглобулин (BLG) был получен от Davisco (США). Чистота (90%) была определена с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC). Лактоза была получена от Fluka.
BLG концентрации 4% (приблизительно 2,2 ммоль) и моногидрат лактозы концентрации 7% (приблизительно 200 ммоль) были растворены в фосфатном буфере (20 ммоль), рН 6,8. После фильтрования на 0,22 мм ацетатно-целлюлозных фильтрах (Millipore) смеси белка и лактозы помещались в плотно закупоренные колбы и нагревалось на водяной бане при 60°С в течение 0,24 или 72 часов для достижения лактозилирования невысоких уровней, не оказывающих значимых отрицательных воздействий на пищевую ценность белков. Теоретически эти условия сделали возможным связывание по 2-3 молекулы лактозы с каждым мономером β-лактоглобулина в общей сложности на 14 возможных остатках лизина (Morgan и др., 1999, J.Agri. Food Chem. 47, 83-91). Все эксперименты проводились в анаэробных и стерильных условиях при уменьшении свободного пространства в 300 мл колбе до 1-2 мл. После нагревания различные фракции не подвергались диализу, но немедленно лиофилизовались для предотвращения желирования.
Контрольный нативный β-лактоглобулин (контрольный BLG) в течение 6 часов гидратировался при комнатной температуре, охлаждался на водяной бане со льдом, а затем добавлялась лактоза для достижения такой же концентрации в 7%, как и в случае гликозилированного BLG.
В качестве дополнительного контроля раствор того же самого очищенного BLG выдерживался без лактозы, охлаждался, а затем добавлялся и растворялся порошок лактозы до достижения концентрации в 7%. Непосредственно за этим раствор лиофилизовался.
Кроме того, были подвергнуты испытанию два изолята сывороточного белка(WPI):
- Davisco WPI BIPRO с фактически отсутствующим содержанием лактозил-β-лактоглобулина (контролировалось масс-спектрометрией), и
- Lacprodan 80 от Aria Foods, который содержал высокий уровень лактозил-β-лактоглобулиновых форм (по данным масс-спектрометрии).
Блокированный лизин определялся по пробе на фурозин. Аликвота белка (приблизительно 20 мг белка) в течение 24 часов при 110°С гидролизовалась в дефлегматоре с 60 мл 6 М соляной кислоты. После количественного перенесения в 100 мл объем воды была отобрана и выпарена досуха 10 мл аликвота, а затем ресуспендирована в 3 мл 0,02 М НСl. Затем был проведен анализ впрыскиванием 10 мкл в аминокислотный анализатор Hitachi L-8500 с натриево-цитратными буферными растворами, оснащенный колонкой для анализа белкового гидролизата. Лизин и фурозин количественно определялись на одной и той же хроматограмме в сравнении с внешними стандартами после постколоночной дериватизации нингидридрином. Процентная доля блокированного лизина вычислялась по содержанию в кислотных гидролизатах лизина и фурозина в допущении, что в ходе гидролиза около 40% ε-деоксифруктозолизина (блокированный лизин) повторно преобразовывалось в лизин, часть превращалась в пиридозин и около 32% в фурозин (Finot и др. (1981) Prog. Food Nutr. Sci. 5, 345-355). Все результаты являются средними величинами, полученными по двум независимьм измерениям.
Результаты представлены в нижеследующей таблице 1.
| Таблица 1 | ||
| По группе+ | Белок | % блокированного лизина |
| В | Контрольный BLG, лиофилизованный с лактозой | 42* |
| С | BLG + лактоза Т 0 | 3 |
| D | Контрольный BLG, 24-часовое выдерживание, затем лиофилизация с лактозой | 3 |
| Е | BLG + лактоза, 24-часовое выдерживание, затем лиофилизация | 8 |
| F | Контрольный BLG, 72-часовое выдерживание, затем лиофилизация с лактозой | 5 |
| G | BLG + лактоза, 72-часовое выдерживание, затем лиофилизация | 14 |
| Н | Коммерческий продукт WPI 95 Bipro | 1 |
| I | Коммерческий продукт Lacprodan 80 | 14 |
| +Группа мышей, которым скармливался белок в примере 2. | ||
| *Это слишком высокое значение - следствие возникших при лиофилизации проблем. |
Пример 2: Индуцирование пероральной толерантности у мышей
При исследовании индукции пероральной толерантности использовался стандартный регламент проведения испытаний на мышах, описанный Pecquet и др. (1999, Immunology 96: 278-285). Мышам скармливались различные типы сывороточных белков или BLG, лактозилированных или нет так, как описано в примере 1. Пять дней спустя была выполнена провокация подкожными инъекциями мышам BLG (100 мг β-лактоглобулина на мышь), разбавленного в растворе Al(ОН)3. Три недели спустя мыши умерщвлялись и отбирались образцы крови для оценки индуцирования пероральной толерантности в различных группах определением титров BLG-специфичного IgE и IgG1.
Мыши подвергались обработке согласно следующим группам:
Группа А: Вода
Группа В: Контрольный BLG, лиофилизованный с лактозой (без выдержки)
Группа С: BLG + лактоза Т 0
Группа D: Контрольный BLG, 24-часовое выдерживание, затем лиофилизация с лактозой
Группа Е: BLG + лактоза, 24-часовое выдерживание, затем лиофилизация
Группа F: Контрольный BLG, 72-часовое выдерживание, затем лиофилизация с лактозой
Группа G: BLG + лактоза, 72-часовое выдерживание, затем лиофилизация
Группа Н: WPI (изолят сывороточного белка) невысокой степени лактозилирования (Bipro)
Группа I: WPI высокой степени лактозилирования (Lacprodan)
Представленные на фиг.1 результаты показывают, что кормление мышей лактозилированным BLG (группа Е) и сывороточными белками высокой степени лактозилирования (группа I) дополнительно улучшает специфичную анти-BLG IgE-гипореактивность по сравнению с группами, которым скармливался нативный BLG (группа В) и сывороточные белки низкой степени лактозилирования (группа Н), обе группы В и Н имели подтверждающий контроль.
Известно, что группа В (42% блокированного лизина) не дала самого лучшего ответа, несмотря на скармливания белков с самой высокой степенью лактозилирования. Объяснение этому может состоять в том, что реакция лактозилирования не контролировалась. Кроме того, это могло быть следствием того, что избыточное лактозилирование маскирует антигенные детерминанты белка. Аналогично результаты группы G не лучше, чем результаты группы I, несмотря на одинаковый уровень блокированного лизина в белках, скармливаемых обеим этим группам. Это может быть из-за того, что лактозилирование BLG, задаваемого группе G, было выполнено в жидком состоянии и поэтому достаточным образом не контролировалось. Лактозилирование в жидком состоянии, будучи трудно контролируемым, может приводить к появлению некоторых нежелательных явлений, включая агрегирование белка и глубокую степень протекания реакции Майяра. С другой стороны, лактозилирование сывороточных белков, задаваемых группе I, производилось в сухом состоянии с лучшим контролем (только неглубокая реакция Майяра).
Аналогичный профиль наблюдался и с анти-BLG-специфичным IgG1, еще одним изотипом, который продуцируется под управлением клеток Th1, что указывает на анергию этих клеток вследствие индуцирования пероральной толерантности. Как показано на фиг.2, группы Е и I представляют самый низкий титр анти-BLG IgG1, указывающий, что лактозилирование белков в этих двух группах улучшает гипореактивность по сравнению с группами, которые получали те же самые белки с более низкой степенью лактозилирования, то есть группами В и Н соответственно.
Пример 3: Гликация в сухом состоянии
Концентрат сывороточного белка (WPC) Prolacta 75 был приобретен в Lactalis Industrie (Retiers, Франция). Согласно изготовителю он содержит 76,4% белка, 15,3% лактозы, 3,2% золы, 0,42% кальция и 5% воды.
WPC был лактозилирован посредством гликации в твердом состоянии. Не вдаваясь в подробности, активность воды (AW) была отрегулирована до величины около 0,44 размещением порошка в закрытой камере с насыщенным K2CO3. В течение этой фазы контролировались водопоглощение и AW. По достижении необходимой AW порошок запечатывался в непрозрачные мешки. Затем порошок выдерживался в течение по меньшей мере 48 часов при 15°С, чтобы дать возможно воде прийти в равновесное состояние в связующем веществе. Гликация белка была вызвана выдерживанием порошка при 60°С в течение 3 час и 8 час в закупоренных пробирках из нержавеющей стали (внутренний диаметр 16 мм, ~30 г порошка) в самостоятельно изготовленном нагревательном приборе для пробирок. Активность воды проверялась в конце периода гликации и никаких изменений не наблюдалось. Затем порошок сохранялся в герметично закупоренном состоянии при 15°С.
Для обнаружения лактозилированных форм белков и определения среднего количества лактозы, связывающейся с каждым мономером белка в Prolacta 75 (негликозилированным и гликозилированным), использовалась масс-спектрометрия (MALDI).
Степень гликации оценивалась определением свободных аминогрупп, как описывалось выше.
Свободные аминогруппы определялись с помощью орто-фтальдиальдегидного способа (ОРА). Определение ОРА проводилось смешиванием 200 мл раствора белка (1,5 г/л в 50 ммоль/л натриево-фосфатном буфере с рН 7,8), 2 мл восстановительного раствора (480 мг N-ацетил-L-цистеин, диспергированный в 200 мл 0,1 моль/л натриево-боратного буфера с рН 9,3) и 50 мл 20 масс.% раствора додецилсульфата натрия (SDS). После смешивания и выдерживания в течение 10 минут при 50°С были добавлены 50 мл реактива ОРА (приготовленного диспергированием 170 мг ОРА в 5 мл метанола). Далее смесь выдерживалась 30 минут при 50°С и затем охлаждалась 30 минут при комнатной температуре перед снятием показаний по светопоглощению при 340 нм на спектрофотометре Uvikon 810 (Flowspek, Базель, Швейцария). С использованием стандарта L-лейцина была получена калибровочная кривая в диапазоне концентраций конечной смеси 10-200 ммоль/л. Для получения сигнала реакции были вычтены сигналы двух контрольных проб. Контрольный сигнал 1 (сигнал белка) был получен с метанолом вместо реактива ОРА. Контрольный сигнал 2 был получен при замене раствора белка натриево-фосфатным буфером. Используемые продукты и реактивы были соответственно: борная кислота, N-ацетил-L-цистеин, ОРА от Fluka (Chemie GmbH, Buchs, Швейцария), моногидрат дигидрофосфата натрия, метанол, гидроксид натрия от Merck (Дармштадт, Германия) и L-лейцин от Sigma (Сан-Луис, МО, США).
Для проверки наличия агрегированного белка в Prolacta 75 (негликозилированного и гликозилированного) использовалась гель-хроматография. Образцы белка разбавлялись элюирующим буфером, добавляемым исходя из начальной концентрации белка в количестве, необходимом для получения концентрации белка эквивалентной 1 г/л. Колонка TSK 2000SW (Tosohaas) элюировалась 0,1М фосфатным буферным раствором с рН 6,8+0,15М NaCl со скоростью 0,5 мл/мин. Оптическая плотность регистрировалась на 214 или 280 нм. Колонка калибровалась со стандартами MW, содержащими нативный α-лактальбумин и β-лактоглобулин.
Результаты по этим химическим характеристикам показаны в нижеследующей таблице 2.
| Таблица 2 | |||||
| Образец | NH2/N общ. ОРА | Блокированный лизин (фурозин) | Среднее количество лактозы, связанной с каждым мономером белка (MALDI-MS) | ||
| BLGA | BLGB | α-LA | |||
| Prolacta 75 негликозилированный | 8,6% | 5% | 0,8 | 0,8 | 0,3 |
| Prolacta 75 гликация 3 час | 6,2% | 19,7% | 3,4 | 3,6 | 2,6 |
| Prolacta 75 гликация 8 час | 5,5% | 31,0% | 5,4 | 5,7 | 3,4 |
Между различными используемыми для оценки лактозилирования белка способами была найдена хорошая корреляция. Условия, используемые для лактозилирования белка (гликация в сухом состоянии), не приводили к образованию агрегатов белка (как показано гель-хроматографией).
Пример 4: Индуцирование оральной толерантности у мышей
Для оценки эффекта лактозилирования было проведено индуцирование оральной толерантности на описанной выше модели с использование мышей. Мышам скармливались различные приготовленные в примере 3 препараты белков негликозилированного и гликозилированного Prolacta. Затем выполнялась провокация системным введением мышам β-лактоглобулина (BLG), и три недели спустя определялось индуцирование оральной толерантности оценкой уровня BLG-специфичного IgE и IgG1 в сыворотке крови мышей.
Мыши подвергались обработке согласно следующим группам:
Группа A: Lacprodan
Группа В: Негликозилированный Prolacta 75
Группа С: Гликозилированный Prolacta 75 (блокированный лизин 19%)
Группа D: Гликозилированный Prolacta 75 (блокированный лизин 31%)
Группа Е: Контроль (вода)
Результаты представлены на фиг.3. Так же, как и из результатов, представленных в примере 2, можно видеть, что мыши, подвергнутые толеризации (приобретение толерантности) лактозилированным Prolacta (группы С и D), показывают лучшую BLG-специфичную IgE-гипореактивность, чем группы, получавшие нелактозилированный Prolacta или получавшие Lacprodan. Показанные на фиг.4 анти-BLG титры IgG1 обозначают тот же самый тип толерогенного ответа, при этом титры групп С и D являются самыми низкими.
В заключение следует отметить, что эти данные показывают, что лактозилирование сывороточных белков улучшает специфичную толерогенную гипореактивность (IgE и IgG1) по сравнению с нелактозилированными белками.
Пример 5: Смесь для питания младенцев, содержащая гликозилированные сывороточные белки
Композиции смеси для питания младенцев представлена ниже.
| Питательное вещество | на 100 ккал | на литр |
| Энергетическая ценность (ккал) | 100 | 670 |
| Белок (г) | 1,83 | 12,3 |
| Жиры (г) | 5,3 | 35,7 |
| Линолевая кислота (г) | 0,79 | 5,3 |
| α-Линоленовая кислота (мг) | 101 | 675 |
| Лактоза (г) | П,2 | 74,7 |
| Минеральные вещества (г) | 0,37 | 2,5 |
| Na (мг) | 23 | 150 |
| К (мг) | 89 | 590 |
| Сl (мг) | 64 | 430 |
| Ca (мг) | 62 | 410 |
| P (мг) | 31 | 210 |
| Mg (мг) | 7 | 50 |
| Mn (мкг) | 8 | 50 |
| Se (мкг) | 2 | 13 |
| Витамин А (мкг, ретиноловый эквивалент (RE)) | 105 | 700 |
| Витамин D (мкг) | 1,5 | 10 |
| Витамин Е (мг, токоферольный эквивалент (ТЕ)) | 0,8 | 5,4 |
| Витамин К1 (мкг) | 8 | 54 |
| Витамин С (мг) | 10 | 67 |
| Витамин В1 (мг) | 0,07 | 0,47 |
| Витамин В2 (мг) | 0,15 | 1,0 |
| Ниацин (мг) | 1 | 6,7 |
| Витамин В6 (мг) | 0,075 | 0,50 |
| Фолиевая кислота (мкг) | 9 | 60 |
| Пантотеновая кислота (мг) | 0,45 | 3 |
| Витамин В12 (мкг) | 0,3 | 2 |
| Биотин (мкг) | 2,2 | 15 |
| Холин (мг) | 10 | 67 |
| Fe (мг) | 1,2 | 8 |
| I (мкг) | 15 | 100 |
| Сu (мг) | 0,06 | 0,4 |
| Zn (мг) | 0,75 | 5 |
Источником белка является концентрат сывороточного белка Prolacta 75, гликозилированный описанным в примере 3 способом до содержания блокированного лизина в 11%. Смесь для питания младенцев готовилась смешиванием источника белка, источника углеводов и источника жиров. Если желательно, в смесь могут включаться эмульгаторы. Затем для получения жидкой смеси примешивалась подвергнутая обработке обратным осмосом вода.
Жидкая смесь подвергалась термической обработке для снижения бактериальной нагрузки быстрым нагреванием до температуры в диапазоне от около 80°С до около 110°С и от около 5 секунд до около 5 минут. Затем жидкая смесь охлаждалась в охладителе затопленного типа до температуры между 60°С и 85°С. После чего жидкая смесь гомогенизировалась в две стадии, сначала при от около 7 МПа до около 40 МПа и затем при от около 2 МПа до около 14 МПа на второй стадии. Гомогенизированная смесь дополнительно охлаждалась и добавлялись чувствительные к нагреванию витамины и минеральные вещества. Величина рН и содержание су