Термообработанные бактерины и эмульсионные вакцины, полученные из таких термообработанных бактеринов
Иллюстрации
Показать всеИзобретение относится к области ветеринарии и касается термообработанных бактеринов и эмульсионных вакцин, полученных из таких термообработанных бактеринов. Сущность изобретения включает эмульсионную вакцину, содержащую термобработанный бактерии, уровень липазной активности которого составляет 50% или менее, чем уровень липазной активности до термообработки, включающий в себя суспензию убитых бактерий, в котором убитые бактерии представляют собой виды Leptospira Bratislava, и от 1 до 13 вирусов, вызывающих заболевания свиней, выбранных из группы, состоящей из свиного аденовируса, свиного цирковируса, вируса свиного герпеса, вируса псевдобешенства, вируса классической чумы свиней, вируса эпидемической диарреи свиней, вируса гемаглютинирующего энцефаломиелита свиней, свиного парвовируса, свиного респираторного коронавируса, свиного репродуктивного и респираторного вируса, свиного гриппа, вируса инфекционного гастроэнтерита и вируса везикулярного стоматита, где вакцина дополнительно включает в себя лецитин в масляном препарате. Преимущество изобретения заключается в создании вакцины, обладающей повышенной иммуногенной активностью и сниженными раздражающими факторами. 3 з.п. ф-лы, 5 табл.
Реферат
Описание
Область техники, к которой относится изобретение
Это изобретение относится в целом к области вакцин и к способам стабилизации эмульсионных вакцин. А именно, это изобретение относится к термообработанным бактеринам, к способу получения термообработанных бактеринов и к свиным эмульсионным вакцинам, полученным из таких термообработанных бактеринов.
Уровень техники изобретения
Вакцинация все больше и больше применяется для обеспечения контроля над инфекционными заболеваниями у животных. Адъюванты часто применяют в вакцинах, потому что они способны усиливать гуморальный и/или клеточный иммунный ответ на воздействие антигена. Вакцины часто вырабатывают в виде эмульсий, потому что эмульсия может играть роль адъюванта и обладает свойством удерживать антиген как бы в депо в месте инъекции. Эмульгирующие вещества обычно применяют в эмульсионных вакцинах. Помимо использования эмульгирующих веществ, стабильность эмульсионных вакцин также может быть достигнута путем уменьшения размера капли эмульсии механическими методами.
Патент США No. 5,084,269 относится к разработке состава адъюванта, содержащего лецитин в комбинации с минеральным маслом, который создает меньшее раздражение в организме животного и в то же самое время вызывает повышенный системный иммунитет. Композиции, в соответствии с патентом США 5,084,269, представляют собой коммерчески используемые под торговым наименованием AMPHIGEN® товарный знак Pfizer, Inc.
Как правило, бактериальные антигены нестабильны при нагревании и даже кратковременное воздействие повышенных температур может снижать активность антигенов. Например, существующая ныне противосибиреязвенная вакцина может потерять всю биологическую активность за 48 часов при 37°C (S. Sing, N. Ahuja, V. Chauhan, E. Rajasekaran, W. S. Mohsin, R. Bhat, and R. Bhatnagar; Bioche. Biophys. Res. Commun. 2002 Sep. 6; 295(5): 1058-62).
Сущность изобретения
Это изобретение относится к термообработанным бактеринам, к способу получения термообработанных бактеринов и к свиным эмульсионным вакцинам, полученным из таких термообработанных бактеринов. Способ включает в себя нагревание бактерина до температуры, приблизительно, от 35 до, приблизительно 80°C с образованием термообработанного бактерина.
Подробное описание
Определения
Приемлемая антигенная активность - термин "приемлемая антигенная активность" обозначает способность вызывать защитный иммунный ответ у вакцинированных животных, после того как они были проверены или путем прохождения классификационного теста для оценки активности вакцины на гомологичном живом организме.
Бактерин - термин " бактерин" обозначает суспензию убитых бактерий, которую можно применять в качестве компонента вакцины.
Эмульгирующее вещество - термин "эмульгирующее вещество" обозначает вещество, применяемое, чтобы сделать эмульсию более стабильной.
Эмульсия - термин "эмульсия" обозначает композицию из двух несмешивающихся жидкостей, в которой маленькие капли одной жидкости суспендированы в однородной дисперсионной фазе другой жидкости.
Термообработанный бактерин - термин "термообработанный бактерин" обозначает бактерин, который был термообработан и у которого есть липазная активность, составляющая 50% или менее от липазной активности до термообработки, и имеющий приемлемую антигенную активность.
Обращенная эмульсия - термин "обращенная эмульсия" обозначает эмульсию воды в масле.
Липаза - термин "липаза" обозначает ферменты, эстеразы, липазы и фосфолипазы, которые могут вызывать разрушение эмульгирующего вещества в эмульсионной вакцине.
Нормальная эмульсия - термин "нормальная эмульсия" обозначает эмульсию масла в воде.
Эмульсия масла в воде - термин "эмульсия масла в воде" обозначает эмульсию, в которой маленькие капли масла суспендированы в однородной дисперсионной водной фазе.
Комнатная температура - термин "комнатная температура " обозначает температуру от 18 до 25°C.
Эмульсия воды в масле - термин "эмульсия воды в масле" обозначает эмульсию, в которой капли воды суспендированы в однородной дисперсионной масляной фазе.
Описание
Изобретение относится к бактеринам с пониженной липазной активностью, к свинным эмульсионным вакцинам, полученным из таких бактеринов, и к способу снижения липазной активности бактеринов. Помимо антигенных компонентов некоторые бактерины обладают липазной активностью. В случае, когда бактерины с липазной активностью включают в эмульсию, липаза может разрушать эмульгирующие вещества, применяемые для создания эмульсии. Эмульсионные вакцины, которые содержат бактерины, имеющие высокую липазную активность, обычно характеризуются нестабильными эмульсиями, и те эмульсионные вакцины, которые содержат бактерины, имеющие низкие уровни содержания липазы, обычно характеризуются стабильностью. Примеры бактерий, которые могут в случае, когда они убиты, образовывать бактерины, имеющие липазную активность, включают Erysipelothrix rhusiopathieae, Listeria monocytogenes, Escherichia coli, Mycoplasma hyopneumoniae и Leptospira species, такие, как известные патогенные микроорганизмы Leptospira canicola, Leptospira grippotyposa, Leptospira hardjo, Leptospira icterohaemorrhagiae, Leptospira bratislava и Leptospira pomona. Эти бактерии могут вызывать заболевания у свиней, и вакцинация для предотвращения этих заболеваний желательна. Бактерины на основе Leptospira представляют собой наиболее перспективные с обладанием высокой липазной активностью, в то время как бактерин на основе Erysipelothrix rhusiopathieae может иметь низкую, более поддающуюся контролированию липазную активность.
Липаза, которая может разрушать эмульгирующие вещества, применяемая для создания эмульсии и, таким образом, приводящая к нестабильности и разрушению эмульсии, может включать в себя один или несколько разрушающих эмульсию ферментов, таких как эстеразы, липазы и фосфолипазы. В совокупности эти ферменты, эстеразы, липазы и фосфолипазы обозначают как липаза. Липазную активность бактерина можно измерить, используя синтетический субстрат, называемый О-пивалоилоксиметил умбеллиферон (C-POM). Скорость гидролиза, вызываемого липазой, представляет собой меру липазной активности. Скорость реакции гидролиза, вызываемого липазой, в этой реакции измеряется по увеличению интенсивности флуоресценции продукта липазной активности. Скорость реакции зависит от выбранных точных условий тестирования гидролиза, поэтому и сравнения уровней липазной активности, и измерения скоростей гидролиза следует проводить, используя данные, полученные при одинаковых условиях тестирования. Литературные методы раскрыты в нескольких статьях, включая Kurioka S., Matsuda M. (1976) Ana. Biochem. 75: 281-289, De Silva N.S., Quinn P.A (1987) J. Clin. Microbiol. 25: 729-731 и Grau A., Ortiz A. (1998) Chem. Phys. of Lipids. 91: 109-118.
В эмульсионной вакцине разрушение эмульсии вызывает разделение фаз компонентов. Это является нежелательным, потому что при наличии разделения фаз индивидуальные дозы, отобранные из контейнера, могут не содержать одинаковые уровни дозировки компонентов вакцины. Кроме того, утрата эмульсии может привести к утрате адъювантной активности эмульгирующего вещества и привести к снижению антигенного эффекта вакцины.
Ослабленные живые вирусы часто включают в вакцины совместно с бактеринами. Такие вакцины пригодны к использованию, потому что единичные вакцины могут применяться для создания иммунитета к различным заболеваниям с помощью одной вакцины. Если липазная активность присуща бактерину, он будет вызывать высвобождение эмульгирующего вещества из эмульсии. Это свободное эмульгирующее вещество может разрушать и инактивировать живые вирусы вакцины, что, как следствие, приводит к потере вирусной инвазионной способности.
Бактерин, пригодный к применению в вакцинах, может быть получен путем культивирования представляющей интерес бактерии и последующего получения убитой бактерии с целью изготовления бактерина, содержащего ряд разнообразных бактериальных компонентов, включая компоненты клеточной стенки. Бактерии могут быть убиты путем различных методов, включающих воздействие на них соединения, такого как мертиолат, формалин, формальдегид, диэтиламин, бинарный этиленамин (binary ethylenamine, BEI), бета-пропиолактон (beta propiolactone, BPL) и глутаральдегид. Могут применяться комбинации этих соединений. Кроме того, убить бактерию можно путем стерилизующего облучения.
В настоящее время установлено, что липазную активность бактерина, имеющего такую липазную активность, можно понизить термообработкой. А именно, липазную активность бактерина можно понизить путем нагревания бактерина до температуры, приблизительно, от 35 до, приблизительно, 80°C, получая термообработанный бактерин, который имеет приемлемую антигенную активность. Термообработку проводят в течение периода времени, достаточного для того, чтобы липазная активность термообработанного бактерина составляла 50% или менее от той, которая была определена для бактерина до термообработки. Для хорошей стабильности эмульсионной вакцины совсем не нужно снижать липазную активность до нуля. Мы установили, что вакцины, имеющие хорошую сохранность, могут быть получены из термообработанных бактеринов, обладающих таким уровнем липазной активности, что он составляет 50% или менее от того уровня липазной активности, который был до термообработки.
В том случае, когда скорость гидролиза тестируемого субстрата используется для измерения липазной активности бактерина, тогда скорость гидролиза тестируемого субстрата до термообработки сравнивают со скоростью гидролиза после термообработки. Термообработку проводят таким образом, чтобы снизить скорость гидролиза до 50% или менее от той скорости гидролиза, которую наблюдали для свежего бактерина.
Точный метод измерения уровня липазной активности не особо важен при условии, что тот же самый метод применятся для измерения активности до термообработки и для измерения активности после термообработки. Например, если скорость гидролиза тестируемого субстрата измеряется с использованием одного субстрата, то другой субстрат может давать другую скорость. Однако, если тот же самый субстрат применяется для определения начальной активности и для определения активности после обработки, то относительные скорости все же будут показывать эффект термообработки.
Существуют систематизированные тесты определения антигенной активности для бактерина на основе Leptospira Pomona (9 CFR §113.101), бактерина на основе Leptospira lcterohaemorrhagiae (9 CFR §113.102), бактерина на основе Leptospira Canicola (9 CFR §113.103), бактерина на основе Leptospira Grippotyphosa (9 CFR §113.104) и для бактерина на основе Leptospira Hardjo (9 CFR §113.105) (9 CFR §113.101, §113.102, §113.103, §113.104 и §113.105). Для этих образцов приемлемая антигенная активность может быть определена как способность индуцировать защитный иммунный ответ у вакцинированных хомяков, такой же, как вызывается у хомяков гомологичными живыми бактериями, по крайней мере, 75% вакцинированных хомяков выжили в модельном эксперименте, в котором, по крайней мере, 80% невакцинированных хомяков не выжили. В случае антигена Leptospira hardjo, приемлемая антигенная активность может быть определена как способность вакцины вызывать серологическую агглютинацию при среднем геометрическом значении титра против воздействия Leptospira hardjo у ≥40 телят, которые были вакцинированы вакциной, в сравнении с бактериальным антигеном Leptospira hardjo. Для других бактеринов приемлемая антигенная активность определяется как способность индуцировать защитный иммунный ответ у вакцинированных животных после их проверки или путем прохождения теста на активность с гомологичным живым организмом.
Термообработку можно проводить в пределах диапазона температур и в течение различного по продолжительности времени. Как правило, нагревание может осуществляться при температурах от, приблизительно, 35 до, приблизительно, 80°C в течение, приблизительно, от 20 минут до, приблизительно, 24 часов. В том случае, когда бактерин нагревают до более высокой температуры, такой как, приблизительно, от 75 до, приблизительно, 80°C, время нагревания является краткосрочным в пределах временного диапазона. В том случае, когда нагревание осуществляют при более низкой температуре, нагревают в течение более длительного периода времени. Другая комбинация температуры и времени представляет собой нагревание при температуре, приблизительно, от 60 до, приблизительно, 70°C в течение от, приблизительно, 9 до, приблизительно, 10 часов. Другая комбинация температуры и времени представляет собой нагревание при температуре, приблизительно, от 65 до, приблизительно, 70°C в течение от, приблизительно, 5 до, приблизительно, 8 часов. Другая комбинация температуры и времени представляет собой нагревание при температуре, приблизительно, от 65 до, приблизительно, 70°C в течение, приблизительно, одного часа. Другая комбинация температуры и времени представляет собой нагревание при температуре, приблизительно, от 55 до, приблизительно, 65°C в течение от, приблизительно, 5 до, приблизительно, 8 часов.
Бактерины после термообработки имеют более низкую липазную активность в сравнении со свежеполученными бактеринами, но в иных случаях могут быть выработаны с такой же характеристикой действия, как и свежеполученные бактерины. Таким образом, термообработанные бактерины могут быть введены в состав вакцин обычными способами, используемыми при получении вакцин. Эти способы хорошо известны из уровня техники.
Эмульсионные вакцины могут быть созданы путем комбинирования требуемого бактерина с масляной фазой и с эмульгирующим веществом или эмульгирующими веществами. Комбинацию затем подвергают интенсивному встряхиванию для образования эмульсии. Удобные для применения способы встряхивания включают гомогенизацию с последующим микросуспендированием. Консерванты и эксципиенты также могут быть включены в комбинацию перед эмульсификацией.
Вакцины могут включать в себя как бактерины, так и вирусные антигены. При получении вакцины, которая включает в себя бактерины и вирусные антигены, бактерины, какие-либо подлежащие включению вирусные антигены, эмульгирующее вещество или эмульгирующие вещества, и, не обязательно, консерванты и эксципиенты комбинируют с масляной фазой и эмульсифицируют. После образования эмульсии значение pH составленной композиции может быть доведено до оптимального pH путем использования либо растворов NaOH, либо растворов HCl. При использовании вакцин, как правило, желательно, чтобы pH был близок к нейтральному, чтобы избежать раздражения в месте инъекции. Обычным является значение pH от, приблизительно, 7,0 до, приблизительно, 7,3.
Удобные для использования масляные фазы при получении эмульсионной вакцины включают в себя неметаболизируемые масла и метаболизируемые масла. Неметаболизируемые масла включают в себя минеральные масла, такие как белое минеральное масло и светлое минеральное масло. Метаболизируемые масла включают в себя растительные масло, рыбные масла и синтетические глицериды жирных кислот.
Примеры эмульгирующих веществ, которые могут использоваться при получении эмульсионных вакцин этого изобретения, представляют собой фосфолипиды, сложные эфиры сорбитана, сложные эфиры полиэтоксилированного сорбитана и производные маннитола, которые являются обычно применяемыми для вакцин эмульгирующими веществами. Фосфолипидные эмульгирующие вещества включают в себя лецитин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилсерин и лецитин, (напр., такие как AMPHIGEN®). Сложные эфиры сорбитана как эмульгирующие вещества включают в себя монолауринат сорбитана (напр., Span® 20 и Arlacel® 20), моноолеат сорбитана (напр., Span® 80 и Arlacel® 80), монопальмитат сорбитана (напр., Span® 40 и Arlacel® 40) и моностеарат сорбитана (напр., Span® 60 и Arlacel® 60). Сложные эфиры полиэтоксилированного сорбитана включают в себя polyethoxy sorbitan монолауринат полиэтоксисорбитана (напр., Tween® 20 и Tween® 21), моноолеат полиэтоксисорбитана (напр., Tween® 80), монопальмитат полиэтоксисорбитана (напр., Tween® 40) моностеарат полиэтоксисорбитана (напр., Tween® 60). Производные маннитола как эмульгирующие вещества включают в себя простые эфиры маннитола и октадекановой кислоты. Span®, Arlacel® и Tween® представляют собой товарные знаки ICI Americas. AMPHIGEN® представляет собой товарный знак Pfizer, Inc. Generally, вакцины вырабатывают в виде нормальных эмульсий масла в воде, хотя возможно получение обращенных эмульсий воды в масле.
Разнообразные адъюванты, такие как Quil A, холестерин, фосфат алюминия и гидроксид алюминия, и консерванты, такие как мертиолат, могут применяться в вакцинах. Quil A представляет собой очищенную смесь сапонинов килайи, экстрагированных из коры южноамериканского дерева Quillaja Saponaria Molina. Quil A действует непосредственно на иммунную систему, активируя общее состояние чувствительности. При этом он индуцирует как гуморальный, так и клеточно-опосредованный ответы. Липофильная цепь обеспечивает взаимодействие антигена и адъюванта, доставляемых в цитозоль для преобразования в эндогенном пути метаболизма. Quil A часто применяется с холестерином, потому что холестерин устраняет нежелательные побочные эффекты при его добавлении в подходящих пропорциях. Холестерин образует нерастворимые комплексы с Quil A, которые формируют спиралеподобные структуры за счет связывания холестерина с Quil A, таким образом оставляя открытыми сахаросодержащие фрагменты молекул, что помогает стимулировать иммунный ответ.
Общеизвестным является добавление свиных вирусных антигенов к вакцинам, содержащим бактерины. Одно из положительных качеств этого подхода заключается в том, что одна такая вакцина может применяться для создания иммунитета к нескольким заболеваниям вместо требуемых доз нескольких различных вакцин для достижения такого же результата. Как убитые вирусы, так и ослабленные живые вирусы могут использоваться в вакцинах. В число тех вирусов, вызывающих свиные заболевания, которые могут применятся, входят свиной аденовирус, свиной цирковирус, вирус свиного герпеса, вирус псевдобешенства, вирус классической чумы свиней, вирус эпидемической диарреи свиней, вирус гемаглютинирующего энцефаломиелита свиней, свиной парвовирус, свиной респираторный коронавирус, свиной репродуктивный и респираторный вирус, свиной грипп, вирус инфекционного гастроэнтерита и вирус везикулярного стоматита.
Если липазная активность присутствует в бактерине, она может вызывать высвобождение эмульгирующего вещества из эмульсии. Это свободное эмульгирующее вещество может разрушать оболочку живого вируса и инактивировать живые вакцинные вирусы, что в результате приводит к потере вирусной инфицирующей способности. В соответствии с этим, термообработка бактерина служит для стабилизации эмульсии и сохраняет ее адъювантное действие, а также сохраняет вирусную инфицирующую способность вирусов.
Нижеприведенные примеры предоставлены с целью дополнительной иллюстрации и не предназначены для ограничения объема притязаний формулы изобретения.
Методы
Метод 1. Определение мутности
Мутность определяют в нефелометрических единицах (NU) с помощью метода светорассеяния. Интенсивность света, рассеянного образцом при определенных условиях, сравнивают с интенсивностью света, рассеянного стандартной контрольной суспензией. Более высокая интенсивность рассеянного света соответствует более высокой мутности образца. Источник света направляют на образец и светорассеяние измеряют под углом 90° к направлению света от источника.
Прибор калибровали путем измерения светорассеяния суспензией формазина.
Калибровка прибора Нефелометра
Ультрафильтрованную воду готовили фильтрованием дистиллированной воды через мембранный фильтр, имеющий размер пор 0,2 мкм. Первый раствор готовили путем растворения 1,00 г гидразинсульфата, (NH2)H2SO4, в ультрафильтрованной воде и разбавления ультрафильтрованной водой до 100 мл в мерной колбе. Второй раствор готовили путем растворения 10,00 г гексаметилентетрамина в ультрафильтрованной воде и разбавления ультрафильтрованной водой до 100 мл, в мерной колбе. Суспензию формазина готовили путем смешивания 5,0 мл первого раствора с 5,0 мл второго раствора. Смесь оставляли для выдерживания в течение 24 часов при температуре, приблизительно, 24°C. Смесь разбавляли до 100 мл ультрафильтрованной водой с образованием базовой мутной суспензии, имеющей мутность 400 NU. Суспензию формазина с мутностью 40 NU готовили путем разбавления 10,00 мл базовой мутной суспензии до 100 мл ультрафильтрованной водой. Дополнительные калибровочные растворы готовили путем разбавления базового раствора.
Измерение мутности
Измеряемый образец разбавляли ультрафильтрованной водой таким образом, чтобы мутность попадала в пределы калибровочного диапазона нефелометра. Мутность измеряли и исходную мутность расчитывали, используя нижеприведенное уравнение:
Исходная мутность в NU=[MЧ(D+O)]/O,
где: M представляет собой мутность разбавленного образца в NU,
D представляет собой объем воды для разбавления, в мл,
O представляет собой исходный объем образца, в мл.
Метод 2. Анализ липаз
Липазную активность определяли, используя O-пивалоксиметилумбеллиферон в качестве флуорогенного субстрата. Липаза катализирует гидролиз этого нефлуоресцирующего субстрата, давая гидроксиметиловый эфир, который нестабилен в водных условиях. Разложение настабильного гидроксиметилового эфира дает формальдегид и флуоресцентный продукт умбеллиферон. Регистрация интенсивности флуоресценции полученного умбеллиферона в зависимости от времени обеспечивает высокочувствительное кинетическое измерение ферментативной активности липазы.
O-пивалоксиметилумбеллиферона (Molecular Probes продукт no. P35901) растворы готовили в чистом DMSO, в базовой концентрации 5 мМ; неиспользованный раствор хранили при -20°C, защищенным от света. Раствор O-пивалоксиметилумбеллиферона 5 мМ разбавляли до 750 мкМ, используя 58 мМ Трис-HCl буфер (pH 8,0), и полученный в результате раствор предварительно нагревали до 37°C. Образец бактерина или контрольные буфер/среда центрифугировали в течение 10 минут при комнатной температуре при 6500 g осадка в центрифужной пробирке и супернатанта. Реакции осуществляли путем объединения 15 мкл 100 мМ Трис-HCl буфера (pH 8,0) с 15 мкл супернатанта при комнатной температуре из образца бактерина или контрольного буфер/среда в аналитических лунках малого объема 96-луночных планшет (Corning 3393, черная полистирольная несвязывающая поверхность, половина площади); преинкубируя в течение 10 минут при 37°C; затем инициируя реакцию путем добавления 20 мкл из 750 мкМ O-пивалоксиметилумбеллиферона или контрольного буфер/среда. Полученные в результате реакционные смеси содержали 53 мМ Трис-HCl буфера (pH 8,0) и 0 или 300 мкМ O-пивалоксиметилумбеллиферона. Интенсивность флуоресценции измеряли с 30-45 секундными интервалами в течение периода времени, равного одному часу (Spectramax Gemini XS, 37°C, λвозб.=360 нм, λисп.=460 нм, чувствительность фотоэлектронного умножителя (PMT) устанавливали в положение 'среднее', 6 снятых показаний на ячейку). Скорость реакции определяли по наклону полученной в результате линии графического отображения прохождения процесса.
Метод 3. Измерение мутности препарата Erysipelothrix rhusiopathieae
Мутность препарата Erysipelothrix rhusiopathieae измеряли спектрофотометрически при длине волны 600 нм. Результат представляли в единицах оптической плотности (optical units (OU)).
Примеры
Пример 1. Снижение липазной активности путем термообработки
Пул убитых мертиолатом клеток лептоспиры, содержащий следующие виды Leptospira canicola, Leptospira icterohaemorrhagiae, Leptospira grippotyphosa, Leptospira hardjo и Leptospira Pomona, был получен для формирования единичных бактеринов. Шесть образцов комбинированных бактеринов выдерживали в течение ночи (приблизительно 12 часов) при 4°C, 37°C, 45°C, 56°C, 65°C и 80°C. Образец, выдержанный при 4°C, служил в качестве необработанного контрольного. Образцы, выдержанные в течение 12 часов при 37°C, 45°C, 56°C, 65°C и 80°C, были термообработанными образцами. После выдерживания измеряли скорость, с которой гидролизуется тестируемый субстрат в присутствии каждого бактерина, в соответствии со способом, изложенном в Методе 2. Скорость гидролиза образца, деленая на скорость гидролиза образца, выдержанного при 4°C, умноженная на 100, представляет собой выраженную в процентах липазную активность от начального каждого бактерина, который сохраняется после выдерживания. В нижеприведенной таблице показаны температура выдерживания и процент липазной активности от начальной, которая сохраняется после выдерживания.
| Температура выдерживания(12 часов) | 4°C | 37°C | 45°C | 56°C | 65°C | 80°C |
| Процент от начальной липазной активности | 100% | 55,4% | 32,5% | 15,7% | 10,8% | 8,4% |
Две серии образцов Leptospira Bratislava готовили. Серии инактивировали с помощью мертиолата и затем подвергали термообработке при 65°C в течение 8 часов. Образцы извлекали перед обработкой и каждые два часа во время обработки. Липазную активность определяли в каждый момент времени в соответствии со способом Метода 2. Для взятого образца измеряли скорость, с которой гидролизуется тестируемый субстрат в присутствии каждого образца. Скорость гидролиза для образца, деленая на начальную скорость гидролиза, умноженная на 100, представляет собой процент от начальной липазной активности каждого бактерина, который остается после термообработки. В нижеприведенной таблице показаны время для образца и среднее значение процента от начальной липазной активности, который остается на данный момент времени.
| Время для образца (часы) | Начальный момент | 2 | 4 | 6 | 8 |
| Процент от начальной липазной активности | 100% | 41% | 34% | 28% | 24% |
Пример 2. Получение экспериментальных препаратов вакцины
Культуры Leptospira canicola, Leptospira icterogorrhagiae, Leptospira grippotyphosa, Leptospira hardjo, Leptospira pomona, Leptospira Bratislava, Erysipelothrix rhusiopathieae и свиной парвовирус выращивали. Мутность каждой культуры Leptospira измеряли в нефелометрических единицах (NU). Мутность культуры Erysipelothrix rhusiopathieae измеряли в оптических единицах (OU). Бактерии убивали мертиолатом, получая бактерины. Каждый бактерин на основе Leptospira был термообработан при 65°C в течение 8 часов для снижения липазной активности. Бактерин на основе Erysipelothrix rhusiopathieae не был подвергнут термообработке. Бактерины на основе Leptospira комбинировали с убитым свиным парвовирусом и убитой Erysipelothrix rhusiopathieae, затем смешивали с AMPHIGEN®, адъювантами, консервантами и разбавляющим буфером таким образом, чтобы каждая 2 мл доза вакцины содержала компоненты, далее помещенные в нижеприведенной таблице.
Концентрации антигенов
| Компонент | Концентрация компонента/Доза |
| L. canicola | 1200 NU/2 мл доза |
| L. icterogorrhagiae | 1200 NU/2 мл доза |
| L. grippotyphosa | 1200 NU/2 мл доза |
| L. hardjo | 2400 NU/2 мл доза |
| L. pomona | 1200 NU/2 мл доза |
| L. Bratislava | 1200 NU/2 мл доза |
| Erysipelothrix rhusiopathieae | 14 OU/2 мл доза |
| Свиной парвовирус | 17,920 НА/0,5 мл |
Пример 3. Тестирование эффективности на хомяках и свиньях
Вакцину Примера 2 вводили хомякам и кроликам для тестирования эффективности используя стандартные лабораторные животные модели. Тестируемых хомяков затем проверяли воздействием дозы Leptospira canicola, Leptospira icterohaemorrhagiae, Leptospira grippotyphosa, Leptospira Bratislava или Leptospira Pomona, чтобы протестировать эффективность вакцин. Определяли количество выживших в качестве показателя эффективности. Титры микроаглютинации для кроликов определяли в сравнении с Leptospira hardjo для выявления эффективности этой фракции вакцины. В нижеприведенной таблице представлено, что вакцины, полученные из термообработанных бактеринов на основе Leptospira, способны вызывать антигенный ответ, который проходит по показателю эффективности.
| Leptospira, прошедшая термообработку | Выжившие хомяки | Серология для кроликов | ||||
| Canicola | Bratislava | Ictero | Grippo | Pomona | Hardjo | |
| 65°C (8 часов) | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | проходит |
| необработанная | 10/10 | 10/10 | 10/10 | 10/10 | 10/10 | проходит |
Erysipelothrix rhusiopathieae тестировали на кроликах в сравнении серологического титра вакцины с титром стандартного образца вакцины. Вакцина имела значение RP (relative potency; относительная эффективность), равное 3,0. PPV тестировали в испытаниях на гемаглютинацию и она имела титр HA, равный 1024 HA/05 мл. Значение титра 320 HA/05 мл является приемлемой величиной для вакцины.
Пример 4. Физиохимическое тестирование вакцин
Вакцину готовили с термообработанными бактеринами на основе Leptospira и другими компонентами в соответствии с составом по списку Примера 2. Аналогичная вакцина была получена из нетермообработанных бактеринов на основе Leptospira в соответствии со способом Примера 2. Оба препарата вакцин выдерживали при 4°C в течение периода времени 0, 6, 12, 15 и 18 месяцев. Анализы размера частиц выполняли для каждой вакцины в каждый момент времени, используя лазерный дифрактометр.
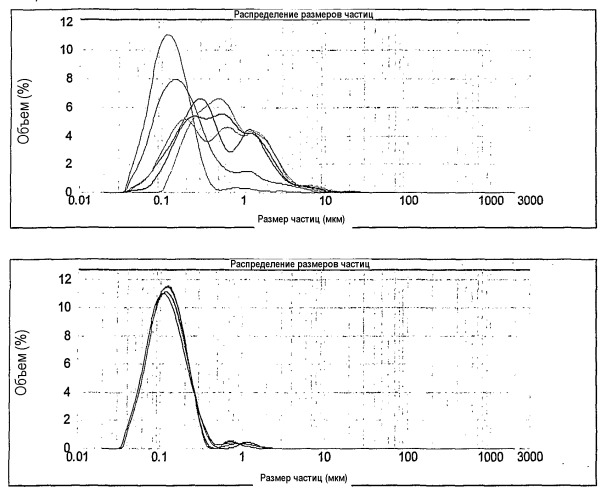
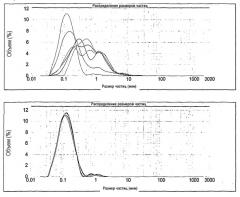
Графики, показанные ниже, отображают распределения размеров частиц для каждой вакцины через несколько месяцев контроля (0, 6, 12, 15 и 18 месяцев).
Анализ размеров частиц свежеполученной вакцины, содержащей термообработанные бактерины на основе Leptospira, день 0
Вакцина, полученная из нетермообработанных бактеринов на основе Leptospira (верхний график), показала возрастание размера частиц, указывающее на разрушение эмульсии. Вакцина, полученная из термообработанных бактеринов на основе Leptospira (нижний график) показала сохранение размера частиц на протяжении периода 18 месяцев, указывающее на стабильность эмульсии.
Пример 5. PPV испытания гемаглютинации (Hemaglutination Assay (HA))
Препараты вакцин по списку Примера 2 (вакцины в списке Примера 2 содержали все перечисленные антигены - одни и те же вакцины для проведения всей работы), полученные из нетермообработанных бактеринов на основе Leptospira и из термообработанных бактеринов на основе Leptospira, вначале тестировали на титр HA и титр гемолиза. Стабильность титров HA в различные моменты времени. Испытания HA осуществляли, доводя для образца значения pH до 11-11,2 при экстракции PPV (Свиной парвовирус) вируса из геля гидроксида алюминия. Образец затем центрифугировали и супернатант отбирали для использования в испытаниях. Эритроциты морской свинки добавляли в 96-луночный планшет, чтобы они служили индикатором агглютинации. Образец супернатанта разбавляли в 2 раза по всем аналогичным рядам с начальным разбавлением 1:5. Планшет инкубировали при 5 ± 3°C в течение 16-24 часов. Степень гемаглютинации оценивали в баллах 0-4 для каждой лунки. Титр отмечали как последнее разбавление, оцененное на 2 или выше. В процессе тестирования вакцин, которые были нетермообработанными, наблюдали, что вакцина вызывала 10 гемолизов. Титр гемолиза был наибольшим разбавлением, при котором гемолиз наблюдали. Термообработанные вакцины не вызывали гемолиз.
Нижеприведенная таблица показывает средние величины титров HA и титров гемолиза с течением времени. CTC представляет собой вакцину с термообработанными бактеринами на основе Leptospira. OOP представляет собой вакцину без термообработанных бактеринов на основе Leptospira.
1. Вакцина, включающая в себя эмульсию, термообработанный бактерин, у которого уровень липазной активности составляет 50% или менее, чем уровень липазной активности до термообработки, включающая в себя суспензию убитых бактерий, в котором убитые бактерии представляют собой виды Leptospira Bratislava, и от 1 до 13 вирусов, вызывающих заболевания свиней, выбранных из группы, состоящей из свиного аденовируса, свиного цирковируса, вируса свиного герпеса, вируса псевдобешенства, вируса классической чумы свиней, вируса эпидемической диарреи свиней, вируса гемаглютинирующего энцефаломиелита свиней, свиного парвовируса, свиного респираторного коронавируса, свиного репродуктивного и респираторного вируса, свиного гриппа, вируса инфекционного гастроэнтерита и вируса везикулярного стоматита, где вакцина дополнительно включает в себя лецитин в масляном препарате.
2. Вакцина по п.1, дополнительно включающая в себя препарат лецитина и адъювант на основе алюминиевых квасцов.
3. Вакцина по п.1, дополнительно включающая в себя термообработанные бактерины, включающие в себя суспензию убитых бактерий, в котором убитые бактерии представляют собой от одного до шести бактериальных видов, выбранных из группы, состоящей из Leptospira canicola, Leptospira icterohaemorrhagiae, Leptospira grippotyphosa, Leptospira hardjo, Leptospira Pomona и Erysipelothrix rhusiopathieae.
4. Вакцина по п.3, дополнительно включающая в себя препарат лецитина и адъювант на основе алюминиевых квасцов.