Способ получения энантиомерно обогащенных комплексов циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов с хиральным центром на zr
Иллюстрации
Показать всеИзобретение относится к способу получения новых энантиомерно обогащенных комплексов циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов общей формулы 1а, б (где R=Et, n-Bu). Способ включает взаимодействие циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий дихлорида (π-комплекс) с алкиллитием RLi, где R - упомянутые выше, при мольном соотношении π-комплекс:RLi=1:(0,8-1,2) в аргоне при -78°С, в толуоле, с последующим повышением температуры до комнатной и перемешивании в течение 20 минут. Технический результат заключается в получении новых энантиомерно обогащенных комплексов циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов с хиральным центром на атоме циркония, которые могут быть использованы в качестве компонента каталитических систем. 1 табл.
Реферат
Изобретение относится к способу получения новых энантиомерно обогащенных π-комплексов с хиральным центром на атоме циркония, конкретно к способу получения циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов общей формулы (1а, б):
где R=Et, n-Bu.
Указанное соединение может найти применение в качестве компонента каталитических систем в процессах стереоселективной поли- и олигомеризации непредельных соединений, а также в тонком органическом и металлорганическом синтезе. ([1] Kromm, K., Osburn, P.L., Gladysz J.А., Organometallics, 2002, 21 (20), p.4275-4280; [2] Goldstein A.S., Beer, R.H., Drago, R.S., J. Am. Chem. Soc, 1994, 116 (6), p.2424-2429; [3] Fontecave, M., Hamelin O., Munage S., Top Organomet. Chem., 2005, 15, p.271-288).
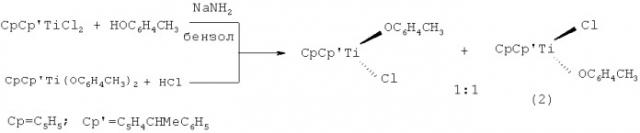
Известен способ ([4] Le Moigne F., Dormond A., Leblanc J.C., Moise C., Tirouflet J., J. Organomet. Chem., 1973, v.54, p.C13-C16) получения рацемической смеси диастереомерных монофеноксизамещенных комплексов (2) с хиральным центром на атоме титана в реакции титаноцендихлорида с о-метилфенолом в присутствии NaNH2 в среде бензола или в реакции дифеноксититаноцена с HCl согласно следующей схеме:
Известный способ не позволяет получать энантиомерно обогащенные комплексы циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлориды (1а, б) с хиральным центром на атоме циркония.
Известен способ ([5] Renaut P., Tainturier G., Gautheron В., J. Organomet. Chem., 1978, v.148, p.43-51) получения рацемической смеси бензилхлоридных комплексов (3) с хиральным центром на атоме циркония в соотношении 1:1 в реакции цирконоцендихлорида с бензилмагнийхлоридом при комнатной температуре в диэтиловом эфире в течение 14 часов по схеме:
В качестве побочного продукта образуется до 20% дибензилцирконоцена (4).
Известный способ не позволяет получать энантиомерно обогащенные комплексы циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлориды (1а, б) с хиральным центром на атоме циркония.
Известен способ ([6] Alcock N.W., Clase H.J., Duncalf D.J., Hart S.L., McCamley A., McCormack P.J., Taylor P.C., J. Organomet. Chem., 2000, v.605, p.45-54) получения рацемической смеси энантиомеров π-комплексов циркония (5) с хиральным центром на атоме циркония (1:1) в реакции циклопентадиенилинденилцирконоцен дихлорида с дизамещенным комплексом Zr в присутствии каталитических количеств LiCl в течение 15 часов при нагревании до 40°C в тетрагидрофуране по схеме:
Известным способом не могут быть получены энантиомерно обогащенные комплексы циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлориды (1а, б) с хиральным центром на атоме циркония.
Известен способ ([7] Sergeeva Е., Kopilov J., Goldberg I., Moshe K. J. Inorg. Chem., 2009, v.48, p.8075-8077) получения энантиомерно чистых октаэдрических комплексов циркония (7) с хиральным центром на атоме металла при взаимодействии замещенных 2,2'-бипирролидиновых лигандов (6) с Zr(O-t-Bu)4 в течение 2 часов при комнатной температуре в диэтиловом эфире по схеме:
Известным способом не могут быть получены энантиомерно обогащенные π-комплексы циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлориды (1а, б) с хиральным центром на атоме циркония.
Таким образом, в литературе отсутствуют сведения по синтезу энантиомерно обогащенных циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов с хиральным центром на цирконии общей формулы (1а, б).
Предлагается способ получения новых энантиомерно обогащенных циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов (1а, б) с хиральным центром на атоме циркония.
Сущность способа заключается во взаимодействии циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий дихлорида (π-комплекс) с алкиллитием RLi (R=Et, n-Bu), взятых в мольном соотношении π-комплекс:RLi=1:(0,8-1,2). Реакцию проводят при перемешивании в толуоле, в атмосфере аргона. Смешивание реагентов осуществляется при охлаждении до -78°C. Затем температуру в реакторе доводят до комнатной и перемешивают еще в течение 20 минут. Растворитель упаривают досуха. Сухой остаток растворяют в толуоле и центрифугируют. Отбирают верхний прозрачный слой раствора и анализируют. Выход целевого продукта составляет 91-95% с энантиомерной чистотой 79-80%.
Реакция протекает по схеме:
Реакция сопровождается выделением эквимольного количества LiCl. Целевой продукт (1а, б) образуется только лишь при участии в качестве исходного реагента циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий дихлорида (CpCp'ZrCl2). Реакцию проводили при перемешивании, в толуоле. Смешивание реагентов осуществляли при температуре -78°C. При температуре смешивания выше -78°C - возрастает скорость протекания побочных реакций, например, увеличивается содержание диалкильных производных, а также уменьшается оптическая чистота получаемых комплексов, при меньшей температуре (например, -85°C) существенно снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения содержания RLi по отношению к циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий дихлориду значительно снижает выход целевых продуктов (1а, б) за счет образования диалкильных производных. Уменьшение содержания RLi по сравнению с циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий дихлоридом уменьшает выход алкилхлоридных комплексов (1а, б). Применение другого металлорганического соединения, например, реактива Гриньяра (RMgBr) приводило к снижению энантиомерного избытка продукта.
Существенные отличия предлагаемого способа.
1. Предлагаемый способ базируется на использовании в качестве исходных реагентов циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий дихлорида (CpCp'ZrCl2) и RLi, взятых в соотношениях 1:1. В известных способах в качестве исходных реагентов используются CpCp'TiCl2 (Ср'=C5H6CHMeC6H5) и НОС6Н4СН3, CpCp'Ti(OC6H4CH3)2 и HCl, CpCp'ZrCl2 (Ср'=СрСНМе2) и PhCH2MgCl, CpIndZrCl2 и CpIndZrR2 (R=Ph, SPh, CH2SiMe3), 2,2'-бипирролидиновые лиганды (6) и Zr(O-t-Bu)4.
Предлагаемый способ обладает следующими преимуществами.
1. Способ позволяет получать энантиомерно обогащенные комплексы циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденил цирконий алкилхлориды с хиральным центром на атоме циркония общей формулы (1а, б), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
Пример 1. В стеклянный реактор объемом 5 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 0,05 ммоль (24 мг) циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий дихлорида и 1 мл толуола. Смесь охлаждают до -78°C и по каплям добавляют 0,05 ммоль (170 мкл) EtLi (0,3 М раствор в Et2O). Затем температуру в реакторе доводят до комнатной и перемешивают еще в течение 20 минут. Растворитель упаривают досуха. Сухой остаток растворяют в толуоле и центрифугируют. Отбирают верхний прозрачный слой раствора и анализируют. Выход 1а составляет 91% с энантиомерной чистотой 79%.
Спектральные характеристики 1a:
CpCp'ZrEtCl (1a). ЯМР 1H (C6D5CD3) δ - 0.01 (д.кв, 2JHH=12.4 Гц; 3JHH=7.6 Гц, 1Н, ZrCHH); 0.98-1.05 (м, 1Н, ZrCHH); 1.53 (т, 3H, 3JHH=7.6 Гц, ZrCH2CH 3); 0.47 (д, 3H, 3JHH=6.8 Гц, CH 3CHCH3); 0.84 (д, 3H, 3JHH=6.8 Гц, CH3CHCH 3); 0.92 (д, 3H, 3JHH=6.0 Гц, CH 3CH); 0.87-0.95 (м, 1H, CH2CHHCHCH3), 1.71-1.82 (м, 1H, CH2CHHCHCH3); 1.05-1.11 (м, 1H, CHCHHCH), 1.56-1.61 (м, 1H, CHCHHCH); 1.34-1.39 (м, 1H, CHCHCH); 1.43-1.52 (м, 2Н, CH2CH 2CHCH); 1.42-1.50 (м, 2Н, CCH2CH 2), 1.59-1.71 (м, 2Н, CCH2CH 2); 1.61-1.71 (м, 2Н, CH3CHCH3, CH3CH); 2.41-2.50, 2.50-2.66 (м, 2Н, ССН2); 2.50-2.66, 2.95-3.05 (м, 2Н, ССН2); 2.89-2.95 (м, 1H, CHCHCHCH2); 4.86 (д, AX, 3JHH=3.0 Hz, 1H, СН (Cp')); 5.49 (д, AX, 3JHH=3.0 Гц, 1H, СН (Ср')); 5.99 (c, 5Н, Cp). ЯМР 13С (C6D5CD3) δ 17.9 (к, ZrCH2 CH3), 21.8 (к, С19), 22.6, 21.8 (т, С6, С7), 23.0 (т, С12), 23.7, 17.8 (к, C17, С18), 24.9, 23.6 (т, С5, С8), 28.7 (д, C14), 29.2 (д, С16), 34.0 (т, С13), 36.4 (д, C10), 40.1 (т, С15), 47.8 (д, C11), 54.4 (т, ZrCH2), 103.1, 105.5 (д, С2, С3), 111.5 (д, Cp), 132.7, 129.6, 127.0 (c, C1, С4, С9).
Пример 2. В стеклянный реактор объемом 5 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 0,05 ммоль (24 мг) циклопентадиенил-1-неометил-4,5,6,7-тетрагидроинденилцирконий дихлорида и 1 мл толуола. Смесь охлаждают до -78°C и по каплям добавляют 0,05 ммоль (25 мкл) BuLi (2 М раствор в гексане). Затем температуру в реакторе доводят до комнатной и перемешивают еще в течение 20 минут. Растворитель упаривают досуха. Сухой остаток растворяют в толуоле и центрифугируют. Отбирают верхний прозрачный слой раствора и анализируют. Выход 1б составляет 95% с энантиомерной чистотой 80%.
Спектральные характеристики 1б:
CpCp'ZrBuCl (1б). ЯМР 1H (C6D5CD3) δ 0.23 (д.т, 2JHH=12.4 Гц; 3JHH=7.6 Гц, 1Н, ZrCHH); 1.07-1.16 (м, 1H, ZrCHH); 1.63-1.77 (м, 2Н, ZrCH2CH 2); 1.35-1.46 (м, 2Н, ZrCH2CH2CH 2); 1.03 (т, 3JHH=7.6 Гц, 3H, СН3); 0.46 (д, 3H, 3JHH=6.8 Гц, CH 3CHCH3); 0.84 (д, 3H, 3JHH=6.8 Гц, СН3СНCH 3); 0.94 (м, 3H, СH 3СН); 1.58-1.77 (м, 2Н, СН3СHСH3, CH3CH); 0.86-0.99 (м, 1Н, CH2CHHCHCH3), 1.71-1.83 (м, 1H, CH2CHHCHCH3); 1.05-1.16 (м, 1Н, CHCHHCH), 1.55-1.66 (м, 1Н, CHCHHCH); 1.35-1.46 (м, 1Н, CHCHCH); 1.42-1.52 (м, 2Н, CH2CH 2CHCH); 1.59-1.69 (м, 2Н, CCH2CH 2); 1.77-1.88 (м, 2Н, CCH2CH 2); 2.41-2.51, 2.52-2.66 (м, 2Н, ССН2), 2.52-2.66, 2.64-2.76 (м, 2Н, ССН2); 2.87-2.96 (м, 1Н, CHCHCHCH2); 4.85 (д, AX, 3JHH=2.8 Hz, 1Н, СН (Ср')), 5.61 (д, AX, 3JHH=2.8 Гц, 1H, СН (Cp')), 5.98 (c, 5Н, Ср). ЯМР 13С (C6D5CD3) δ 13.7 (к, СН3), 21.8 (т, С12), 21.9 (к, С19), 22.7, 23.0 (т, С6, С7), 23.7, 17.8 (к, С17, С18), 24.2, 23.8 (т, С5, С8), 28.7 (д, C14), 29.3 (д, С16), 29.7 (т, ZrCH2CH2 CH2), 34.2 (т, C13), 36.2 (т, ZrCH2 CH2), 36.3 (д, C10), 40.1 (т, C5), 47.8 (д, C11), 59.5 (т, ZrCH2), 111.5 (д, Cp), 106.1, 103.0 (д, С2, С3), 132.3, 129.1, 126.7 (c, C1, С4, С9).
Другие примеры, подтверждающие способ, приведены в таблице.
| № п/п | Соотношение исходных реагентов, ммоль CpCp'ZrCl2:RLi (RMgBr) | RLi (RMgBr) | Растворитель | Температура в момент смешивания, °C | Выход 1а, б, % (ee, %) |
| 1 | 1:1 | EtLi | C6H5CH3 | -78 | 91 (79) |
| 2 | 1:1 | BuLi | C6H5СН3 | -78 | 95 (80) |
| 3 | 1:0.8 | EtLi | C6H5CH3 | -78 | 73 (79) |
| 4 | 1:1.2 | EtLi | C6H5CH3 | -78 | 70 (78) |
| 5 | 1:0.8 | BuLi | C6H5CH3 | -78 | 76 (80) |
| 6 | 1:1.2 | BuLi | С6Н5СН3 | -78 | 72 (79) |
| 7 | 1:1 | EtLi | C6H5СH3 | -51 | 75 (55) |
| 8 | 1:1 | BuLi | C6H5СH3 | -51 | 74 (69) |
| 9 | 1:1 | EtMgBr | C6H5СH3 | -78 | 58(35) |
Способ получения новых энантиомерно обогащенных комплексов циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий алкилхлоридов общей формулы (1а, б) где R - Et, n-Bu,отличающийся тем, что циклопентадиенил-1-неоментил-4,5,6,7-тетрагидроинденилцирконий дихлорид (π-комплекс) взаимодействует с алкиллитием RLi, где R - упомянутые выше, при мольном соотношении π-комплекс: RLi=1:(0,8-1,2) в аргоне при -78°С, в толуоле, с последующим повышением температуры до комнатной и перемешивании в течение 20 мин.