Ненасыщенные жирные гидроксикислоты и их применение в дерматокосметологии
Иллюстрации
Показать всеИзобретение относится к новым соединениям - ненасыщенной жирной гидроксикислоте общей формулы (I), где Rn=R1=R=H и 10≤n≤14, за исключением 16-гидрокси-2-гексадеценовой кислоты и 15-гидрокси-2-пентадеценовой кислоты; или где Rn=R=H, R1=F, Cl или Br и 5≤n≤14. Эти ненасыщенные жирные гидроксикислоты пригодны для получения антирадикальной, противовоспалительной, противозудной дерматокосметологической композиции, и/или для лечения расстройств, связанных с кератинизацией и пигментацией, и/или для ускорения заживления ран. Ненасыщенные жирные гидроксикислоты общей формулы (I) также применяются для изготовления дерматокосметологической композиции, для лечения псориаза, зуда и/или атопического дерматита. 5 н. и 6 з.п. ф-лы, 2 табл.
Реферат
Предметом настоящего изобретения являются новые ненасыщенные жирные гидроксикислоты и их применение в дерматокосметологии.
Многочисленные ненасыщенные жирные гидроксикислоты хорошо известны и описаны в литературе благодаря их биологическим свойствам и, в частности, благодаря их косметическим и фармакологическим свойствам. Например, основным липидным компонентом маточного молочка пчел является ненасыщенная жирная гидроксикислота, а именно гидрокси-10-2(транс)деценовая кислота (Edward E. Smissman et al., 1964. JOU. 29 3517-3520).
В различных документах современного уровня техники описаны способы получения ненасыщенных жирных гидроксикислот и их сложных эфиров (Lee et al., 1993, J. Org. Chem., vol.58, pages 2918-2919; Hurd et Saunders, 1952, J. Am. Chem. Soc., vol.74, pages 5324-5328; Krishnamurthy et al., 1989, Indian J. Chem. Sect. A, vol.28, pages 288-291; Plettener et al., 1995, J. Chem. Ecol., vol.21, pages 1017-1030).
Более конкретно, настоящее изобретение относится к ненасыщенным жирным гидроксикислотам, соответствующим общей формуле (I):
где Rn=R1=R=Н и 10≤n≤14,
за исключением 16-гидрокси-2-гексадеценовой кислоты и 15-гидрокси-2-пентадеценовой кислоты.
В частных случаях осуществления изобретения предложены ненасыщенные жирные гидроксикислоты с общей формулой (I), где Rn=R1=R=H и n=10.
Согласно другому аспекту изобретения предложены ненасыщенные жирные гидроксикислоты с общей формулой (I)
,
где Rn=R=Н, R1=F, Cl или Br и 5≤n≤14.
В частных случаях осуществления изобретения предложены ненасыщенные жирные гидроксикислоты с общей формулой (I), где R1=F и n=10 и R1=F и n=8.
Согласно настоящему изобретению производные ненасыщенных жирных гидроксикислот с общей формулой (I), определенной выше, могут быть использованы в качестве активных ингредиентов в сочетании с подходящим наполнителем для получения дерматокосметологических композиций с антирадикальной, противовоспалительной, противозудной активностью, и/или для использования в лечении расстройств, связанных с кератинизацией и пигментацией, и/или для ускорения заживления.
В соответствии с изобретением предложена дерматокосметологическая композиция, имеющая антирадикальную, противовоспалительную, противозудную активность, содержащая ненасыщенную жирную гидроксикислоту общей формулы (I)
где Rn=H, R1=H, F, Cl или Br, R=H и 5≤n≤14, за исключением 10-гидрокси-2-деценовой кислоты, в качестве активного ингредиента и дерматологически приемлемый наполнитель.
В одном из вариантов осуществления изобретения предложена дерматокосметологическая композиция, содержащая ненасыщенную жирную гидроксикислоту общей формулы (I), где Rn=R1=R=H и n=10.
Кроме того, предложено применение ненасыщенной жирной гидроксикислоты общей формулы (I)
,
где Rn=H, R1=H, F, Cl или Вr, R=H и 5≤n≤14, за исключением 10-гидрокси-2-деценовой кислоты, для изготовления дерматокосметологической композиции, обладающей модулирующей активностью на меланогенез, и/или на пигментацию кожи, и/или на кератинизацию кожи, и/или на заживление.
В одном из вариантов осуществления изобретения предложено применение ненасыщенной жирной гидроксикислоты общей формулы (I), определенной выше, для лечения старения кожи и белых или коричневых возрастных пятен.
В другом из вариантов осуществления изобретения предложено применение ненасыщенной жирной гидроксикислоты общей формулы (I), определенной выше, для отбеливания кожи.
Ненасыщенные жирные гидроксикислоты с общей формулой (I) особенно хорошо подходят для использования в композициях, предназначенных для лечения псориаза, зуда и/или атопического дерматита. Поэтому в одном из вариантов осуществления изобретения предложено применение ненасыщенной жирной гидроксикислоты
где Rn=H, R1=H, F, Cl или Br, R=Н и 5≤n≤14, для изготовления дерматокосметологической композиции для лечения псориаза, зуда и/или атопического дерматита.
Благодаря их антирадикальной активности ненасыщенные жирные гидроксикислоты с общей формулой (I) также пригодны для предотвращения или ограничения ранних стадий фотоканцерогенеза кожи, и поэтому их можно использовать для профилактики и лечения различных опухолевых заболеваний кожи.
Ненасыщенные жирные гидроксикислоты с общей формулой (I) можно получить:
- посредством проведения реакции Виттига-Хорнера, а именно реакции фосфоната формулы (III):
в которой:
- R1 является таким, как определено выше в формуле (I);
- R2 представляет собой алкильную группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, которая предпочтительно является этильной или метильной группой, причем группы R2 могут образовывать цикл с атомами кислорода групп OR2 и с соседним атомом фосфора; и
- R4 представляет собой алкильную группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, и предпочтительно является этильной группой;
- или, если R1=Н, посредством реакции Дебнера-Кневенагеля, а именно реакции производного малоновой кислоты формулы R4OOC-CH2COOR, где R является таким, как определено выше в формуле (I), с лактолом формулы (II):
где Rn и n являются такими же, как определено выше,
с получением сложного гидроксиэфира формулы (IV):
в которой n, R и R1 являются такими же, как определено выше,
и, возможно, если R представляет собой группу R4, определенную выше, реакции сапонификации сложного гидроксиэфира формулы (IV), с получением соответствующего производного гидроксикислоты формулы (I).
Настоящее изобретение будет проиллюстрировано примерами синтеза, приведенными ниже.
Пример 1
Процедура синтеза DHА (деценовой гидроксикислоты)
1. Стадия 1: Получение оксонан-2-она
43,5 г (345 ммоль) циклооктанона растворяют в 430 мл дихлорэтана. Затем к раствору добавляют 170 г (985 ммоль) мета-хлорпербензойной кислоты. Эту среду нагревают до 80°С в течение 48 часов. При комнатной температуре добавляют 400 мл насыщенного раствора Na2S2O5 и NaHCO3 (1/1; объем/объем). Среду энергично перемешивают в течение 18 часов. Органическую фазу отделяют и обрабатывают Kl и Н2O в течение 6 часов. Органическую фазу отделяют и промывают насыщенным раствором Na2S2O3, насыщенным раствором NaCl, затем сушат над MgSO4, фильтруют и концентрируют под вакуумом с получением 36 г неочищенного продукта.
Лактон очищают посредством концентрирования в пентане (60 мл), затем посредством фильтрации осадка мета-хлорбензойной кислоты, выход - 26,6 г (54%).
Полученный лактон представляет собой соединение формулы:
Определение характеристик:
ТСХ (тонкослойная хроматография): Rf=0,3 (гептан/этилацетат 7/3)
1Н ЯМР (300 МГц, CDCl3): δ 1,42-1,49 (m, 4Н), 1,65-1,75 (m, 6Н), 2,30 (t, J=5,4 Гц, 2Н), 4,30 (t, J=5,7 Гц, 2Н).
2. Стадия частичного восстановления до лактола
26,6 г (187,2 ммоль) лактона разводят в 210 мл толуола в атмосфере азота. Среду охлаждают до -78°С и добавляют по каплям 156,4 мл (189,1 ммоль) диизобутилалюминия гидрида (Dibal-H) в виде раствора в толуоле с концентрацией 20%, поддерживая температуру, равную -78°С. Смесь перемешивают в течение 2 часов при -78°С. При -78°С добавляют 200 мл насыщенного раствора соли Розена. После 18 часов энергичного перемешивания при комнатной температуре двухфазную смесь фильтруют через целит, затем экстрагируют этилацетатом. Органические фазы промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют под вакуумом с получением 26 г неочищенного продукта (25% которого составляет диольное производное, то есть выход составляет примерно 72%). Поэтому лактол, в котором уравновешены открытая и циклическая формы, используется без дополнительной очистки.
Определение характеристик:
ТСХ: Rf=0,4 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,34-1,68 (m, 10Н), 2,45 (t, J=5,4 Гц, 2Н), 3,66 (t, J=6,6 Гц, 2Н), 9,78 (t, J=1,8 Гц, 1Н).
3. Стадия 3: Реакция Виттига-Хорнера
19 г (131,8 ммоль) лактола растворяют в 250 мл этанола. К среде добавляют 31,4 мл (158,1 ммоль) триэтилфосфонацетата в присутствии 27,3 г (197,5 ммоль) карбоната калия. Реакционную среду нагревают до 40°С в течение 18 часов. При комнатной температуре реакционную среду гидролизуют 200 мл дистиллированной воды и экстрагируют этилацетатом. Органические фазы промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют под вакуумом с получением 20 г неочищенного продукта.
Полученный сложный эфир очищают посредством хроматографии с элюированием смесью гептана/этилацетата в соотношении 7/3; получают 15 г продукта (выход 53%).
Полученный сложный эфир является соединением формулы:
Определение характеристик:
ТСХ: Rf=0,4 (гептан/этилацетат 7/3)
1Н ЯМР (300 МГц, CDCl3): δ 1,24-1,38 (m, 9Н), 1,43-1,50 (m, 2Н), 1,51-1,57 (m, 2Н), 2,15-2,21 (q, 2Н), 3,60-3,64 (t, 2Н), 4,14-4,20 (t, 2Н), 5,77-5,82 (d, J=15,6 Гц, 1Н), 6,91-6,98 (dt, J=15,6 Гц, 1Н).
4. Стадия 4: Реакция сапонификации
0,60 г (2,81 ммоль) сложного гидроксиэфира растворяют в 10 объемах тетрагидрофурана. Медленно добавляют 3,4 мл (6,75 ммоль) 2М раствора гидроксида натрия. Среду нагревают до 65°С в течение 3 часов. По окончании реакции среду гидролизуют посредством добавления 3М раствора хлористоводородной кислоты до получения рН 2. Смесь концентрируют досуха и затем экстрагируют водную фазу этилацетатом. Органические фазы промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют под вакуумом с получением 0,6 г неочищенного продукта.
Ожидаемое производное ненасыщенной гидроксикислоты получают в форме белого твердого вещества посредством перекристаллизации из ацетонитрила на холоде, выход - 0,37 г (71%).
Полученное производное гидроксикислоты является соединением формулы:
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,33-1,37 (m, 6Н), 1,45-1,49 (m, 2Н), 1,55-1,58 (m, 2Н), 2,20-2,25 (q, 2Н), 3,62-3,66 (t, 2Н), 5,79-5,84 (d, J=15,6 Гц, 1Н), 7,03-7,10 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 209 (расчетное значение 186).
Температура плавления: 62,5°С±1°С.
Пример 2
Процедура синтеза α-фторированного производного 10-гидрокси-2-фтордеценовой кислоты: (R1=F, n=6)
Модифицирована только стадия 3: начиная с лактола (0,89 г, 7,7 ммоль), проводят реакцию Виттига-Хорнера в присутствии метилдиэтилфосфонфторацетата (2,1 г, 9,2 ммоль) и карбоната калия (1,6 г, 11,5 ммоль) в этаноле (9 мл) при 40°С. Стадию 4 проводят согласно ранее описанному протоколу. Продукт, полученный после перекристаллизации, имеет форму цис/транс-смеси.
Полученное производное гидроксикислоты является соединением формулы:
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,36-1,62 (m, 20Н), 2,27-2,30 (m, 2Н, цис-форма), 2,50-2,58 (m, 2Н, транс-форма), 3,69 (m, 4Н), 6,05 (dt, J=21,6 Гц, 1 Н, транс-форма) и 6,25 (dt, J=40,8 Гц, 1Н, цис-форма).
Масс-спектроскопия: [M-Na]+ 227 (расчетное значение 204).
Пример 3
Процедура синтеза 9-гидрокси-2t-ноненовой кислоты
Протокол синтеза DHA применяется к циклопентанону для получения 9-гидрокси-2t-ноненовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,36-1,61 (m, 8Н), 2,22-2,27 (m, 2Н), 3,67 (t, J=6,3 Гц, 2Н), 5,84 (dt, J=15,6 Гц, 1Н), 7,09 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 195 (расчетное значение 172).
Пример 4
Процедура синтеза 11-гидрокси-2t-ундеценовой кислоты
Протокол синтеза DHA применяется к циклононанону для получения 11-гидрокси-2t-ундеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,33-1,61 (m, 12Н), 2,20-2,28 (m, 2Н), 3,66 (t, J=6,0 Гц, 2Н), 5,84 (dt, J=15,9 Гц, 1Н), 7,09 (dt, J=15,9 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 223 (расчетное значение 200).
Пример 5
Процедура синтеза 12-гидрокси-2t-додеценовой кислоты
Протокол синтеза DHA применяется к циклодеканону для получения 12-гидрокси-2t-додеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,35-1,56 (m, 14Н), 2,20-2,27 (m, 2Н), 3,55 (t, J=6,6 Гц, 2Н), 5,80 (dt, J=15,6 Гц, 1Н), 6,96 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 237 (расчетное значение 214).
Пример 6
Процедура синтеза 12-гидрокси-2-фтор-2t-додеценовой кислоты
Протокол синтеза DHA, фторированного в положении 2 (Пример 2), применяется к циклодеканону для получения 12-гидрокси-2-фтор-2-додеценовой кислоты в форме цис/транс-смеси.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,34-1,56 (m, 14Н), 2,24-2,27 (m, 2Н цис-форма) или 2,49-2,54 (m, 2Н транс-структура), 3,55 (t, J=6,6 Гц, 2Н), 5,97 (dt, J=21,9 Гц, 1Н транс-структура) или 6,10 (dt, J=55,2 Гц, 1Н, цис-форма).
Масс-спектроскопия: [M-Na]+ 255 (расчетное значение 232).
Пример 7
Процедура синтеза 13-гидрокси-2t-тридеценовой кислоты
Протокол синтеза DHA применяется к оксациклододекан-2-ону для получения 13-гидрокси-2t-тридеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,27-1,63 (m, 16Н), 2,21-2,28 (m, 2Н), 3,64 (t, J=3,6 Гц, 2Н), 5,84 (dt, J=15,6 Гц, 1Н), 7,09 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 251 (расчетное значение 228).
Пример 8
Процедура синтеза 14-гидрокси-2t-тетрадеценовой кислоты
Протокол синтеза DHA применяется к оксациклотридекан-2-ону для получения 14-гидрокси-2t-тетрадеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4)
1Н ЯМР (300 МГц, CDCl3): δ 1,29-1,35 (m, 14Н), 1,46-1,61 (m, 4Н), 2,21-2,29 (m, 2Н), 3,66 (t, J=6,6 Гц, 2Н), 5,84 (dt, J=15,6 Гц, 1Н), 7,09 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 265 (расчетное значение 242).
Пример 9
Процедура синтеза 14-гидрокси-2-фтор-тетрадеценовой кислоты
Протокол синтеза DHA, фторированного в положении 2 (Пример 2), применяется к оксациклотридекан-2-ону для получения 14-гидрокси-2-фтор-тетрадеценовой кислоты в форме цис/транс-смеси.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4).
1Н ЯМР (300 МГц, CDCl3): δ 1,29 (m, 28Н), 1,42-1,62 (m, 8Н), 2,27-2,31 (m, 2Н, цис-форма), 2,51-2,56 (m, 2Н, транс-форма), 3,68 (t, J=6,6 Гц, 2Н), 3,70 (t, J=6,6 Гц, 2Н), 6,04 (dt, J=21,3 Гц, 1Н, транс-форма), 6,27 (dt, J=33,0 Гц, 1Н, цис-форма).
Масс-спектроскопия: [M-Na]+ 283 (расчетное значение 260).
Пример 10
Процедура синтеза 17-гидрокси-2t-гептадеценовой кислоты
Протокол синтеза DHA применяется к циклопентадеканолиду для получения 17-гидрокси-2t-гептадеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4).
1Н ЯМР (300 МГц, CDCl3): δ 1,27-1,32 (m, 20Н), 1,46-1,61 (m, 4Н), 2,20-2,29 (m, 2Н), 3,67 (t, J=6,6 Гц, 2Н), 5,84 (dt, J=15,6 Гц, 1Н), 7,08 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+307 (расчетное значение 284).
Пример 11
Процедура синтеза 17-гидрокси-2-фтор-гептадеценовой кислоты
Протокол синтеза DHA, фторированного в положении 2 (Пример 2), применяется к циклопентадеканолиду для получения 17-гидрокси-2-фтор-гептадеценовой кислоты в форме цис/транс-смеси.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4).
1Н ЯМР (300 МГц, CDCl3): δ 1,27 (m, 40Н), 1,45-1,62 (m, 8Н), 2,24-2,32 (m, 2Н, цис-форма), 2,50-2,58 (m, 2Н, транс-форма), 3,69 (t, J=6,6 Гц, 4Н), 6,05 (dt, J=21,6 Гц, 1Н, трансформа) и 6,26 (dt, J=40,8 Гц, 1Н, цис-форма).
Масс-спектроскопия: [М-Н]- 301 (расчетное значение 302).
Температура плавления: 77°С±1°С.
Пример 12
Процедура синтеза 18-гидрокси-2t-октадеценовой кислоты: (R1=Н, n=14)
Протокол синтеза DHA применяется к гексациклодеканолиду для получения 18-гидрокси-2t-октадеценовой кислоты.
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4).
1Н ЯМР (300 МГц, CDCl3): δ 1,27-1,65 (m, 26Н), 2,19-2,39 (m, 2Н), 3,67 (t, J=6,6 Гц, 2Н), 5,83 (dt, J=15,6 Гц, 1Н), 7,09 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 321 (расчетное значение 298).
Пример 13
Определение характеристик 16-гидрокси-2t-гексадеценовой кислоты
Определение характеристик:
ТСХ: Rf=0,1 (гептан/этилацетат 6/4).
1Н ЯМР (300 МГц, CDCl3): δ 1,27-1,32 (m, 18Н), 1,46-1,61 (m, 4Н), 2,21-2,28 (m, 2Н), 3,66 (t, J=6,6 Гц, 2Н), 5,85 (dt, J=15,6 Гц, 1Н), 7,09 (dt, J=15,6 Гц, 1Н).
Масс-спектроскопия: [M-Na]+ 293 (расчетное значение 270).
Пример реакции Дебнера-Кневенагеля с использованием оксациклотридеканола
1,4 г (7,0 ммоль) оксациклотридеканола (полученного согласно протоколу частичного восстановления лактола) растворяют под потоком азота в 4 объемах пиридина в присутствии 1,09 г (10% моль) малоновой кислоты и 0,11 мл пиперидина. Реакционную смесь нагревают до 80°С в течение 1 часа 30 минут, затем нагревают с дефлегматором в течение 2 часов. При комнатной температуре раствор выливают на 3М раствор HCl (50 мл). Отфильтрованное твердое вещество промывают водой, затем перекристаллизовывают в ацетонитриле (с получением 1,2 г, что соответствует выходу, равному 70%).
Производные ненасыщенных жирных гидроксикислот согласно настоящему изобретению стали объектом многочисленных экспериментов, которые продемонстрировали их достоинства как активных ингредиентов дерматологических и/или косметических композиций.
Исследование антирадикального эффекта на активированных формах кислорода (АФK)
В ходе нормального метаболизма клеток во время эпизодического воздействия на кожу стрессовых агентов или во время патологических изменений кожи образуются химически активные формы кислорода, которые также называют Активированными Формами Кислорода (АФК) (Y.M.W. Janssen et al., 1993). Эти АФК, описанные как очень химически активные метаболиты, играют важную роль во многих процессах, таких как воспаление, старение и опухолевый рост.
АФК считаются «вторичными мессенджерами» во внутриклеточных сигнальных процессах, относящихся к окислительному стрессу, и, следовательно, ранними медиаторами воспаления (A.Van Der Vliet and A.Bast, 1992).
Их избыточная продукция приводит к существенным нарушениям в клетке. Поэтому некоторые клеточные компоненты являются основными мишенями окислительного стресса: могут повреждаться липидные компоненты плазматической мембраны (перекисное окисление липидов), белки (денатурация и деградация) и генетический материал или ДНК (мутации). Клетки способны ограничивать эти окислительные повреждения за счет различных систем антирадикальной защиты (ферментных и неферментных антиоксидантов) (B.P.Yu, 1994; Н.Stelling et al., 1999).
Тем не менее, в определенных условиях АФК образуются в таких количествах, что внутриклеточной антиоксидантной активности недостаточно; поэтому такие АФК становятся факторами, индуцирующими воспалительные нарушения и старение тканей (Y.Miyachi et al., 1986; М.Kress et al., 1995).
Существуют различные химические вещества (например, Н2O2) или физические факторы (например, УФ-А), способные создавать окислительный стресс in vitro. Продуцируемые АФК повреждают различные клеточные мишени (мембраны, ДНК или белки), и это повреждение можно анализировать с использованием широко используемых биохимических методик, таких как анализ субстратов тиобарбитуровой кислоты (TBARS) в случае перекисного окисления липидов или анализ in vitro внутриклеточных АФК с помощью зонда H2DCF-DA.
Мы разработали модель для исследования in vitro окислительного стресса, вызываемого системой Н2O2/железо, поскольку Н2O2 генерирует большое количество внутриклеточных АФК в результате цепной реакции, запускаемой окислением мембранных липидов.
Этот способ основан на использовании флуоресцентного зонда - 6-карбокси-2',7'-дихлордигидрофлуоресцеина диацетата диацетоксиметилового эфира (H2DCF-DA), который после проникновения в клетку дезацетилируется внутриклеточными эстеразами и образует H2DCF. Этот продукт окисляется внутриклеточными АФК до ярко флуоресцирующего соединения - 2',7'-дихлорфлуоресцеина (DCF) (Suematsu М. Et al., 1996, Free Radicals Practical Approach, Punchard ed., p.83-99).
Материалы и методы, использованные для анализа in vitro внутриклеточных АФК, указаны ниже.
а) Клеточный материал
Фибробластные клетки кожи мыши линии L929.
б) Материал:
- Микропланшет с 96 лунками с плоским основанием.
- Цитофлуориметр Cytofluor II: см. PERCEPTIVE BIOSYSTEMS.
в) Реагенты
Реагенты для культивирования клеток:
- Культуральная среда Игла в модификации Дульбекко (DMEM)
- Фетальная сыворотка телят (ФСТ)
- Фосфатный буфер (PBS) с рН 7
- Трипсин-ЭДТА(1Х)
Флуоресцентный зонд:
- 6-карбокси-2',7'-дихлордигидрофлуоресцеина диацетата диацетоксиметиловый эфир (РМ. 675,43)
Продукты для стимуляции клеток:
- Перекись водорода (Н2O2) 3%: см. GIFRER (Gifrer Barbezat Laboratory)
- Двойной сульфат аммония и двухвалентного железа (Fe2+)
- Двойной сульфат аммония и трехвалентного железа (Fe3+)
г) Исследованные продукты:
Исследованные концентрации не являются цитотоксичными концентрациями. Цитотоксичность определяли с использованием способа с нейтральным красным после инкубации продукта в течение 3 часов.
Антирадикальным продуктом сравнения является витамин Е или α-токоферол (РМ: 430.7) (SIGMA, см.: Т-1539).
Маточный раствор готовят в концентрации 400 мг/мл в ДМСО и хранят при -20°С. Раствор для предварительной обработки готовят непосредственно перед опытом в концентрации 400 мкг/мл в культуральной среде без фетальной сыворотки телят.
Для оценки производных ненасыщенных жирных гидроксикислот раствор готовят на свежеприготовленной культуральной среде с концентрациями в диапазоне 0,02, 0,2, 2 и 20 нг/мл.
е) Протокол:
Посев клеток:
Клетки-фибробласты линии L929 засевали на микропланшеты с 96 лунками и плоским основанием в 100 мкл DMEM с добавлением 10% фетальной сыворотки телят, затем их инкубировали в течение ночи при 37°С во влажной атмосфере с 5%-ным содержанием СO2.
Контрольный планшет без клеток оценивали по 6 лункам.
Предварительная обработка клеток:
Разведения продуктов, подлежащих испытанию, и молекул сравнения производили с использованием культуральной среды без ФСТ, затем наносили их 7 лунок в количестве 100 мкл на лунку.
Затем клетки инкубировали в течение 3 часов при 37°С во влажной атмосфере, содержавшей 5% СO2.
«Холостые» (естественная флуоресценция клеток), «контрольные» (базальная продукция АФК) и «стимулированные» (продукция АФК после окислительной обработки) покрывали 100 мкл DMEM.
«Контрольные» клетки инкубировали с зондом, но не производили ни предварительной обработки, ни обработки.
«Стимулированные» клетки инкубировали с зондом и производили обработку, но не предварительную обработку.
«Холостые» клетки не подвергали предварительной обработке, не инкубировали с зондом и не обрабатывали.
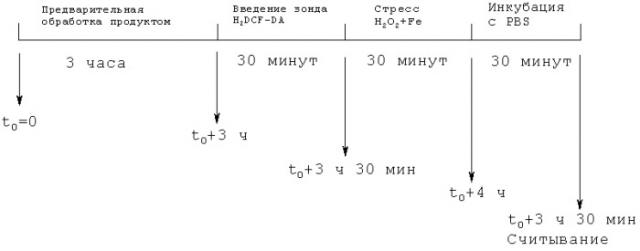
Инкубация клеток с зондом и окислительным стрессом:
Клетки промывали PBS 1Х в количестве 100 мкл на ячейку. Затем их инкубировали в течение 30 минут при 37°С во влажной атмосфере, содержавшей 5% СO2, с 50 мкл зонда H2DCF-DA в концентрации 5 мкМ.
После 30 минут контакта с зондом клетки инкубировали в течение 30 минут при 37°С во влажной атмосфере, содержавшей 5% СO2, с добавлением 25 мкл Н2O2 в концентрации 800 мкМ и 25 мкл раствора трехвалентного железа и двухвалентного железа в концентрации 8 мМ с получением конечной концентрации Н2O2, равной 200 мкМ, и концентрации трехвалентного и двухвалентного железа, равной 2 мМ.
Затем клетки промывали PBS 1Х в количестве 100 мкл на ячейку, после чего инкубировали их в течение 30 минут при 37°С во влажной атмосфере, содержавшей 5% СO2, со 100 мкл PBS 1Х.
Эта инкубация в течение 1 часа 30 минут при 37°С дает возможность внутриклеточным эстеразам дезацетилировать зонд до H2DCF, который может быть окислен АФК до DCF - флуоресцирующего соединения, образование которого пропорционально содержанию внутриклеточных АФК.
Интенсивность флуоресценции определяют с помощью цитофлуориметра при λвозбуждения=485 нм и λиспускания=530 нм. Она отражает количество образовавшихся внутриклеточных АФК.
Схема протокола опыта:
Расчет % защиты против продукции внутриклеточных АФК.
Приведенное ниже отношение позволяет рассчитать для каждой исследованной концентрации продукта % защиты против продукции внутриклеточных АФК (поскольку интенсивность флуоресценции (ИФ) отражает выделение внутриклеточных АФК).
Значения, приведенные в таблице ниже, представляют собой проценты ингибирования внутриклеточной продукции АФК после экзогенного окислительного стресса по сравнению с «холостыми» клетками (100%) и «стимулированными» клетками (0%).
Средние проценты защиты для 13 молекул, исследованных в 4 концентрациях на клетках линии L929, представлены в Таблице 1 ниже.
| Таблица 1 | ||
| Анализ защиты против внутриклеточной продукции АФК для 13 молекул, являющихся производными ненасыщенных жирных гидроксикислот: Ингибирование внутриклеточной продукции АФК в процентах. | ||
| Витамин Е 400 мкг/мл | 47% |
| Соединение формулы I | Дозы | ||||||
| n | R | Rn | R1 | 0,02 нг/мл | 0,2 нг/мл | 2 нг/мл | 20 нг/мл |
| 3 | Н | Н | F | 3 | -3 | -32 | -51 |
| 3 | Н | Н | H | 21 | 15 | 11 | 14 |
| 4 | Н | Н | F | 10 | 6 | -4 | -36 |
| 4 | Н | Н | Н | 17 | 9 | 9 | 0 |
| 5 | Н | Н | H | 56 | 47 | 46 | 36 |
| 6 | Н | Н | F | 15 | 4 | 5 | -9 |
| 6 | Н | Н | H | 33 | |||
| 9 | Н | Н | Н | 9 | 10 | 6 | -22 |
| 10 | Н | Н | F | 29 | 16 | 0 | -19 |
| 10 | Н | Н | H | 11 | 4 | -20 | -34 |
| 13 | Н | Н | F | 36 | 28 | 14 | -9 |
| 13 | Н | Н | Н | 3 | 13 | -1 | -10 |
| 14 | Н | Н | F | 6 | -17 | -26 | -42 |
Предварительная инкубация: 3 часа.
Количество испытаний = 3 для всех соединений.
Количество испытаний = 18 для витамина Е.
In vitro на клеточном уровне экзогенный стресс, вызванный H2O2/Fe2+-Fe3+, способен индуцировать продукцию внутриклеточных АФК, выявляемую с помощью флуоресцентного зонда.
В заключение следует отметить, что нефторированные производные ненасыщенных жирных гидроксикислот к короткими цепями (С9 и С10), по-видимому, особенно эффективны в отношении антирадикальной защиты клеток.
Исследование антирадикального эффекта. Анализ перекисного окисления липидов.
Кроме того, в ходе нормального метаболизма клеток во время случайного воздействия на кожу стрессовых агентов или во время патологических изменений кожи образуются химически активные формы кислорода, которые также называют Свободными Радикалами Кислорода (СРК) (Y.M.W.Janssen et al., 1993). Эти СРК, описанные как очень химически активные метаболиты, играют важную роль во многих процессах, таких как воспаление, старение и опухолевый рост.
СРК считаются «вторичными мессенджерами» во внутриклеточных сигнальных процессах, относящихся к окислительному стрессу, и, следовательно, ранними медиаторами воспаления (A.Van Der Vliet and A.Bast, 1992).
Их избыточная продукция приводит к существенным нарушениям в клетке. Поэтому некоторые клеточные компоненты являются основными мишенями окислительного стресса: могут повреждаться липидные компоненты плазматической мембраны (перекисное окисление липидов), белки (денатурация и деградация) и генетический материал или ДНК (мутации). Клетки способны ограничивать эти окислительные повреждения за счет различных систем антирадикальной защиты (ферментных и неферментных антиоксидантов) (В.Р.Yu, 1994; Н.Stelling et al., 1999).
Тем не менее, в определенных условиях СРК образуются в таких количествах, что внутриклеточной антиоксидантной активности недостаточно; поэтому такие СРК становятся факторами, индуцирующими воспалительные нарушения и старение тканей (Y.Miyachi et al., 1986; М.Kress et al., 1995).
С целью оценки антирадикальной активности различных гидроксилированных производных согласно настоящему изобретению мы проанализировали их способность обеспечивать защиту против нарушений клеточных мембран, вызванных окислительным (химическим) стрессом, по сравнению со стандартным антиоксидантом - витамином Е.
Плазматическая мембрана является основной и первичной мишенью СРК, и, поскольку в ней содержится много липидов, она является местом усиленного перекисного окисления (A.W.Girotti, 1985). Перекиси, образующиеся в ходе этого окисления липидов, также являются очень химически активными и способны разрушать белковый и генетический материал.
Для оценки повреждений мембран мы измеряли перекисное окисление липидов посредством количественного анализа in vitro комплексов, состоящих из продуктов окисления липидов и тиобарбитуровой кислоты. Такие комплексы называются TBARS (субстратами тиобарбитуровой кислоты) и дали анализу название: анализ на TBARS.
Для имитации химического окислительного стресса мы обрабатывали клетки-фибробласты линии L929 комплексом, состоявшим из перекиси водорода (Н2O2) и железа (Fe2+/Fe3+), воспроизводя таким образом реакцию Фентона, являющуюся источником СРК и, в частности, гидроксильного радикала (ОН') (D.A.Vessey et al., 1992):
Н2O2+Fe2+→ОН'+ОН-+Fe3+
Продукты оценивали на клетках-фибробластах мыши линии L929. Клетки проходили предварительную обработку различными концентрациями продуктов в течение 16 часов, а затем их стимулировали комплексом Н2O2- Fe2+/Fe3+ (200 мкМ-1 мМ) в течение 1 часа.
Маточные растворы: 100 мг/мл в этаноле при 4°С.
Конечные растворы: 0,02 нг/мл.
Перекисное окисление мембранных липидов анализировали посредством измерения TBARS (см. Протокол PLN°2 согласно Morliere et al., 1991).
Принцип анализа:
В кислой среде при 95°С образуются комплексы, называемые TBARS (реакционно-способное вещество тиобарбитуровой кислоты), между продуктами окисления липидов (малоновым диальдегидом, или МДА) и тиобарбитуровой кислотой (ТБК), которые можно анализировать по их флуоресценции, путем сравнения со стандартным диапазоном флуоресценции МДА. Результаты анализа TBARS выражают в пмоль/мкг белка. Белки и TBARS анализируют во внутриклеточной среде.
Расчет процента защиты клеточных мембран:
По результатам расчета TBARS в пмоль/мкг белка мы рассчитали эффективность защиты против окисления мембранных липидов для различных продуктов.
Было выполнено четыре независимых эксперимента. В ходе этих экспериментов были оценены различные соединения (анализ не позволял оценивать более 10 молекул одновременно). Соединения, оценивавшиеся несколько раз, были выбраны по результатам, полученным в другом анализе, в котором также измерялась антирадикальная активность (количественный анализ на активированные формы кислорода, АФК).
Использованная в данном эксперименте модель (реакция Фентона) индуцирует значительное перекисное окисление липидов в фибробластах L929. Это массивное выделение гидроксильного радикала ОН' вызывает на клеточном уровне окислительный стресс, в частности на уровне мембран. Однако в этом типе окислительной реакции продукты перекисного окисления липидов находятся в клетках, и поэтому содержание TBARS количественно определяется во внутриклеточной среде.
Витамин Е в дозе 400 мкг/мл снижает перекисное окисление липидов, вызванное комплексом Н2O2-Fe2+/Fe3+, и очень эффективно защищает клеточные мембраны.
В Таблице II представлены результаты 4 экспериментов.
Очевидно, что гидроксилированные производные обладают стабильной и воспроизводимой антиоксидантной активностью. Это относится, в частности, к производным с короткой углеродной цепью.
| Таблица II | ||||||
| Защита мембранных липидов различными гидроксилированными производными | ||||||
| Защита мембранных липидов в % | ||||||
| Исследованные молекулы | № эксперимента | Среднее значение | Стандартное отклонение | |||
| Вит. Е 400 мкг/мл | 4 | 44,66 | 25,85 | |||
| Соединение формулы I | ||||||
| n | R | Rn | R1 | |||
| 6 | Н | Н | Н | 3 | 52,91 | 8,81 |
| 6 | Н | Н | F | 3 | 40,65 | 16,83 |
| 4 | Н | Н | F | 3 | 36,54 | 41,69 |
| 13 | Н | Н | Н | 1 | 22,10 | |
| 3 | Н | Н | F | 1 | 38,14 | |
| 13 | Н | Н | F | 3 | 7,39 | 16,23 |
| 10 | Н | Н | Н | 1 | 27,18 | |
| 4 | Н | СН3 | Н | 2 | 57,75 | 3,15 |
| 10 | Н | Н | F | 3 | 13,13 | 13,37 |
| 14 | Н | Н | F | 1 | 35,30 | |
| 4 | Н | Н | Н | 2 | 37,88 | 26,28 |
| 9 | Н | Н | Н | 3 | 8,72 | 48,78 |
| 3 | Н | Н | Н | 2 | 15,7 | 29,93 |
Модель in vitro, представленная в данном исследовании, отражает последствия воздействия значительного окислительного стресса на основную клеточную мишень, которой является плазматическая мембрана. Поэтому количественный анализ перекисного окисления липидов является хорошим маркером окислительного стресса и обеспечивает возможность оценки антиоксидантного действия активных ингредиентов на гидроксильные радикалы на уровне клеточной мембраны.
Витамин Е, антиоксидантная молекула, обеспечивает возможность подтверждения правильности этой модели и эффективности защиты клеточных мембран против окислительного стресса.
Дифференциация кератиноцитов
Эпидермис участвует в основной функции кожи, которой является устойчивость к влияниям окружающей среды и защита от них. Это многослойный плоский ороговевающий эпителий, который постоянно обновляется. Гомеостаз и регенерация тканей основаны на клетках-кератиноцитах, опорных клетках и растворимых факторах, которые в непосредственной близости от клеток способствуют межклеточным взаимодействиям и взаимодействиям клеток с межклеточным матриксом.
Роговой слой, последняя стадия дифференциации эпидермиса, образуется в результате трех основных процессов: образования кератиновых филаментов, «ороговения» кератиноцитов и образования межклеточного липидного цемента, организованного в виде пластинчатых структур.
Внутри эпидермиса состав и природа липидов варьируют в зависимости от стадии дифференциации, в которой находятся кератиноциты. Так, во время движения базальных слоев клеток к клеткам рогового слоя, наблюдается значительное снижение содержания фосфолипидов, которые в слоях живых клеток отвечают за целостность плазматических мембран; параллельно отмечается повышение содержания нейтральных липидов (свободных жирных кислот и триглицеридов) и стеролов (холестерина), а также очень значительное увеличение содержания сфиголипидов и, в частности, церамидов. На уровне рогового слоя обнаруживается 40-50% сфинголипидов, 20-27% холестерина и 9-26% свободных жирных кислот. Церамиды связаны ковалентными связями с остатками глутаминовой кислоты инволюкрина - предшественника роговой оболочки. Жирные кислоты благодаря своей гидрофобной природе участвуют в регуляции непроницаемости кожи, холестерин участвует в регуляции текучести мембран.
Многочисленные специфические белки рогового слоя (или stratum corneum) (слоя, придающего барьерную функцию эпидермису) образуются на уровне зернистого слоя, состоящего из последних кератиноцитов, обладающих способностью к транскрипции и трансдукции, прежде чем произойдет лизис ядра, сопровождающий ороговение.
Программа дифференциации кератиноцитов основана, главным образом, на эволюции структурных белков, которыми являются кератины и которые способствуют архитектурной целостности эпидермиса. Их экспрессия варьирует в зависимости от степени зрелости эпидермапьных клеток. В супрабазальных слоях появляются основной кератин 1 и кислый кератин 10, так называемые кератины терминальной дифференциации.
Вблизи рогового слоя кератины взаимодействуют с белками с высоким содержанием гистидина с образованием относительно гомогенной смеси, которая заполняет корнеоциты. Эти белки являются производными