Применение 2-имидазолов для лечения расстройств цнс
Иллюстрации
Показать всеНастоящее изобретение относится к применению соединений формулы I, R1 представляет собой атом водорода, атом трития, гидрокси, низший алкил, низший алкокси, атом галогена, нитро, амино или низший алкил, замещенный атомом галогена; R представляет собой атом водорода, гидрокси или низший алкил; X представляет собой N и Y представляет собой СН, или СН2, или СН-низший алкил, или X представляет собой СН и Y представляет собой N; Q представляет собой СН2, О, NH, N-алкил, N-SO2-алкил или N-SO2-толуол-4-ил; W представляет собой СН2 или связь; m, n независимо друг от друга имеют значения 1, 2 или 3; когда m имеет значение 2 или 3, R могут быть одинаковыми или разными; когда n имеет значение 2 или 3, R1 могут быть одинаковыми или разными; каждая пунктирная линия независимо от другой пунктирной линии может представлять собой связь или не являться связью; и их фармацевтически активных солей, рацемических смесей, энантиомеров, оптических изомеров и таутомерных форм соединений формулы I в приготовлении лекарств для лечения биполярного расстройства, шизофрении, болезни Паркинсона, болезни Альцгеймера, эпилепсии, расстройств приема пищи, диабетических осложнений, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма. Также изобретение относится к применению соединения формулы IA, к соединению формулы I и лекарству на основе соединения формулы I. Технический результат: получены новые производные 2-имидазолов. обладающие полезными биологическими свойствами. 2 табл., 5 н. и 30 з.п. ф-лы.
Реферат
Настоящее изобретение относится к применению соединений формулы
где
R1 представляет собой атом водорода, атом трития, гидрокси, низший алкил,
низший алкокси, атом галогена, нитро, амино или низший алкил,
замещенный атомом галогена;
R2 представляет собой атом водорода, гидрокси или низший алкил;
Х представляет собой N и Y представляет собой СН, или СН2, или СН-низший алкил, или
Х представляет собой СН и Y представляет собой N;
Q представляет собой CH2, О, NH, N-алкил, или N-SO2-алкил, или
N-SO2-толуол-4-ил;
W представляет собой СН2 или связь;
m, n независимо друг от друга имеют значения 1, 2 или 3; когда m имеет значение 2 или 3, R2 могут быть одинаковыми или разными, когда n имеет значение 2 или 3, R1 могут быть одинаковыми или разными;
каждая пунктирная линия независимо от другой пунктирной линии может представлять собой связь или не является связью;
и их фармацевтически активных солей, рацемических смесей, энантиомеров, оптических изомеров и таутомерных форм соединений формулы 1 в приготовлении лекарств для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности, расстройств, связанных со стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых заболеваний
Некоторые соединения формулы I являются известными соединениями и описаны, например, в нижеприведенных ссылках или внесены в общедоступные базы данных по химическим соединениям Соединения примеров 1-14, 26-55 и 57-74 являются новыми
Установлено, что соединения формулы I обладают высокой аффинностью к рецепторам, ассоциированным со следовыми аминами (trace amine associated receptors, TAAR), особенно к TAAR1.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрина, допамин, гистамин) как нейромедиаторы играют важную роль в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения строго регулируются Известно, что дисбаланс уровней биогенных аминов является ответственным за изменение функции мозга при многих патологических состояниях [2-5]. Соединения, образующие второй класс эндогенных аминов, так называемые следовые амины (trace amines, ТА), очень схожи с классическими биогенными аминами по своей структуре, метаболизму и субклеточной локализации. ТА включают паратирамин, β-фенилэтиламин, триптамин и октопамин, и их уровень в нервной системе млекопитающих существенно ниже уровня классических биогенных аминов [6]
Нарушение их регуляции связано с различными психическими заболеваниями, такими как шизофрения и депрессия [7], и другими состояниями, такими как синдром дефицита внимания и гиперактивности, головная боль типа мигрени, болезнь Паркинсона, злоупотребление веществами, вызывающими зависимость, и расстройства приема пищи [8, 9]
В течение долгого времени существование ТА-специфических рецепторов являлось всего лишь гипотезой, основанной на присутствии в ЦНС (центральной нервной системе) человека и других млекопитающих анатомически дискретных сайтов связывания, обладающих высокой аффинностью к ТА [10, 11]. Соответственно, считалось, что фармакологическое действие ТА опосредовано тем же известным механизмом, что и действие классических биогенных аминов, то есть либо сигналом, вызывающим их высвобождение, либо ингибированием их обратного захвата, либо "перекрестным связыванием" с их рецепторной системой [9, 12, 13]. В последнее время данная точка зрения претерпела значительные изменения в связи с идентификацией нескольких членов нового семейства GPCR (G-белок-сопряженных рецепторов), рецепторов, ассоциированных со следовыми аминами (trace amine associated receptors, TMR) [7, 14]. Обнаружено 9 TAAR-генов в геноме человека (включая 3 псевдогена) и 16 генов в геноме мыши (включая 1 псевдоген). TAAR-гены не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и расположены рядом на одном хромосомном сегменте. Филогенетическое родство генов этих рецепторов, находящееся в соответствии с высокой степенью их сходства с GPCR-фармакофором и в соответствии с фармакологическими данными, дает возможность предположить, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 относится к первому подклассу, состоящему из четырех генов (TAAR1-4), которые представлены в геномах человека и грызунов высококонсервативными последовательностями. ТА активируют TAAR1 через Gα. Показано, что нарушение регуляции ТА связано с этиологией различных заболеваний, таких как депрессия, психоз, синдром дефицита внимания и гиперактивности, злоупотребление веществами, вызывающими зависимость, болезнь Паркинсона, головная боль типа мигрени, расстройства приема пищи, метаболические расстройства, и поэтому использование TAAR1-лигандов в лечении данных заболеваний может являться весьма перспективным.
Поэтому получение новых знаний о рецепторах, ассоциированных со следовыми аминами (trace amine associated receptors), весьма актуально.
Список литературы
1. Deutch, A Y. and Roth, R. H. (1999) Neurotransmitters In Fundamental
Neuroscience (2nd edn) (Zigmond, M. J., Bloom, F.E., Landis, S. С., Roberts, J.L, and Squire, L.R., eds), p.193-234, Academic Press.
2. Wong, M. L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351.
3. Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Anna. Rev. Pharmacol. Toxicol. 41, 237-260.
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson′s disease. Expert Opin Investig Drugs 12,1335-1352.
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-
deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci 3, 617-628.
6. Usdin, E. and Sandier, M. eds. (1984), Trace Amines and the brain, Dekker.
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281.
8. Branchek, T. A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97.
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. NatI Acad Sci. U. S. A. 98, 9474-9475.
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291.
11. McCormack, J. К. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci 6, 94-101.
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat stnatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156.
13. Parker, E.M. and Cubeddu, L X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp.Ther. 245,199-210.
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Целью настоящего изобретения являются новые соединения формулы I и применение соединений формулы I и их фармацевтически приемлемых солей, рацемических смесей, энантиомеров, оптических изомеров или таутомерных форм в изготовлении лекарств для лечения заболеваний, связанных с аффинностью к рецепторам, ассоциированным со следовыми аминами (trace amine associated receptors), новые специфические соединения в объеме формулы I, их получение, лекарства на основе соединения по изобретению и их изготовление, а также применение соединений формулы I для контроля над заболеваниями, такими как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания и гиперактивности, расстройства, вызванные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, гипертензия, злоупотребление веществами, вызывающими зависимость, метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройства и нарушения температурного гомеостаза, нарушения сна и циркадного ритма и сердечнососудистые заболевания, или для предупреждения перечисленных заболеваний. Другой целью настоящего изобретения является применение меченых соединений формулы 1 в качестве радиолиганда в анализе связывания с рецепторами, ассоциированными со следовыми аминами (trace amine associated receptors).
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, тревожность и синдром дефицита внимания и гиперактивности (ADHD).
Изобретение относится также к новым соединениям формулы 1
где
R1 представляет собой атом водорода, атом трития, гидрокси, низший алкил, низший алкокси, атом галогена, нитро, амино или низший алкил, замещенный атомом галогена,
R2 представляет собой атом водорода, гидрокси или низший алкил,
Х представляет собой N и Y представляет собой СН, или СН2, или СН-низший алкил, или
Х представляет собой СН и Y представляет собой N;
Q представляет собой СН2, О, NH, N-алкил, или N-SO2-алкил, или N-SO2-толуол-ил;
W представляет собой СН2 или связь;
m, n независимо друг от друга имеют значения 1, 2 или 3, когда m имеет значение 2 или 3, R2 могут быть одинаковыми или разными; когда n имеет значение 2 или 3, R1 могут быть одинаковыми или разными;
каждая пунктирная линия независимо от другой пунктирной линии может
представлять собой связь или не являться связью;
и к их фармацевтически активным солям, рацемическим смесям, энантиомерам,
оптическим изомерам и таутомерным формам, за исключением следующих соединений.
рац-2-(1,2,3,4-тетрагидро-1-нафтил)-2-имидазолина,
рац-2-(7-метил-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(6-метил-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(6-хлор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(5-хлор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(7-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(6-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-2-(5-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазола,
рац-5-(4,5-дигидро-1Н-имидазол-2-ил)-5,6,7,8-тетрагидро-нафталин-2-ола,
рац-4-(1,2,3,4-тетрагидро-нафталин-1-ил)-1Н-имидазола,
рац-5-(4,5-дигидро-1Н-имидазол-2-ил)-5,6,7,8-тетрагидро-нафталин-2,3-диола или
рац-5-(4,5-дигидро-1Н-имидазол-2-ил)-5,6,7,8-тетрагидро-нафталин-1,2-диола.
Эти новые соединения формулы I также можно применять в качестве радиолиганда в анализе связывания с рецепторами, ассоциированными со следовыми аминами (trace amine associated receptors).
В контексте данного описания термин "низший алкил" означает группу с насыщенной нормальной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
В контексте данного описания термин "низший алкокси" означает группу, где алкильный остаток, такой как определено выше, присоединен через атом кислорода.
В контексте данного описания термин "низший алкил, замещенный атомом галогена" означает алкильную группу, такую как определено выше, где по меньшей мере один атом водорода заменен на атом галогена, например CF3, CHF2, CH2F, СН2СF3, CH2CF2CF3 и тому подобное.
Термин "атом галогена" означает атом хлора, иода, фтор и брома.
Термин "фармацевтически приемлемые соли присоединения кислот" включает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
Одно из воплощений изобретения представляет собой применение соединений формулы
где
R1 представляет собой атом водорода, атом трития, гидрокси, низший алкил, низший алкокси, атом галогена или низший алкил, замещенный атомом галогена;
Q представляет собой СН2 или О;
n имеет значение 1, 2 или 3; когда n имеет значение 2 или 3, R1 могут быть одинаковыми или разными,
пунктирная линия может представлять собой связь или не являться связью;
и их фармацевтически активных солей, рацемических смесей, энантиомеров, оптических изомеров и таутомерных форм соединений формулы 1А в приготовлении лекарств для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности, расстройств, связанных со стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых заболеваний.
Предпочтительными соединениями формулы I в соответствии с вышеописанным применением являются те соединения формулы I, где Х представляет собой N.
Предпочтительными соединениями в данной группе являются те соединения, где Q представляет собой CH2 и R1 представляет собой атом галогена, например следующие соединения:
рац-2-(5-бром-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол,
рац-2-(7-хлор-5-фтор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол,
рац-2-(6-хлор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол или
рац-2-(5-хлор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол.
Предпочтительными соединениями формулы I в соответствии с вышеописанным применением являются те соединения формулы I, где Q представляет собой СН; и R1 представляет собой низший алкил, например следующие соединения:
рац-2-(5,7-диметил-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол
или
рац-2-(5,7-диметил-1,2,3,4-тетрагидро-нафталин-1-ил)-1Н-имидазол.
Предпочтительными соединениями формулы I в соответствии с вышеописанным применением являются те соединения формулы I, где Q представляет собой СН2 и R1 представляет собой низший алкокси, например следующие соединения:
рац-2-(7-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол,
рац-2-(6-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол или
рац-2-(5-метокси-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол.
Предпочтительными соединениями формулы I в соответствии с вышеописанным применением являются те соединения формулы I, где Q представляет собой О или NH и R1 представляет собой атом водорода или атом галогена, например
рац-2-(6,8-дихлор-хроман-4-ил)-1Н-имидазол или
рац-4-(1 Н-имидазол-2-ил)-1,2,3,4-тетрагидро-хинолин.
Предпочтительными соединениями формулы I в соответствии с вышеописанным применением являются те соединения формулы I, где Х представляет собой СН.
Предпочтительными соединениями в данной группе являются те соединения, где Q представляет собой СН2 и R1 представляет собой атом водорода, например следующие соединения:
(4-(3,4-дигидро-нафталин-1-ил)-1Н-имидазол или
рац-4-(1,2,3,4-тетрагидро-нафталин-1-ил)-1Н-имидазол.
Предпочтительными соединениями в данной группе являются те соединения, где Q представляет собой О и R1 представляет собой атом водорода, например следующее соединение:
рац-5-хроман-4-ил-1Н-имидазол гидрохлорид, или таутомер.
Другими предпочтительными соединениями в данной группе являются те соединения, где Q представляет собой О и R1 представляет собой низший алкил, например следующие соединения:
рац-5-(7-метил-хроман-4-ил)-1Н-имидазол, или таутомер, или
рац-5-(5-метил-хроман-4-ил)-1Н-имидазол, или таутомер.
Другими предпочтительными соединениями в данной группе являются те соединения, где Q представляет собой О и R1 представляет собой атом галогена, например следующие соединения:
рац-5-(6-фтор-хроман-4-ил)-1Н-имидазол, или таутомер;
5-(8-хлор-2Н-хромен-4-ил)-1Н-имидазол, или таутомер;
5-(6-хлор-2Н-хромен-4-ил)-1Н-имидазол, или таутомер;
рац-5-(7-фтор-хроман-4-ил)-1Н-имидазол, или таутомер, или
рац-5-(5-фтор-хроман-4-ил)-1Н-имидазол, или таутомер.
Предпочтительными новыми соединениями являются следующие:
- Соединения формулы I, где Х представляет собой N, Q представляет собой СН2 и R1 представляет собой атом галогена, например следующие соединения:
рац-2-(5-бром-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол или
рац-2-(7-хлор-5-фтор-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол.
- Соединения формулы I, где Х представляет собой N, Q представляет собой СН2 и R представляет собой атом трития, например
рац-2-(7-тритио-1,2,3,4-тетрагидро-нафталин-1-ил)-4,5-дигидро-1Н-имидазол.
- Соединения формулы I, где Х представляет собой N и Q представляет собой -О-, например следующие соединения:
рац-2-хроман-4-ил-4,5-дигидро-1Н-имидазол,
рац-2-хроман-4-ил-1Н-имидазол или
рац-2-(6-фтор-хроман-4-ил)-1Н-имидазол.
- Соединения формулы I, где Х представляет собой N, Q представляет собой О или NH и R1 представляет собой атом водорода или атом галогена, например
рац-2-(6,8-дихлор-хроман-4-ил)-1Н-имидазол или
рац-4-(1Н-имидазол-2-ил)-1,2,3,4-тетрагидро-хинолин.
- Соединения формулы I, где Х представляет собой СН, Q представляет собой СН2 и R1 представляет собой атом водорода, например следующее соединение:
(4-(3,4-дигидро-нафталин-1-ил)-1Н-имидазол.
- Соединения формулы I, где Х представляет собой СН, Q представляет собой О и R1 представляет собой атом водорода, например следующее соединение:
рац-5-хроман-4-ил-1Н-имидазол гидрохлорид, или таутомер.
- Соединения формулы I, где Х представляет собой СН, Q представляет собой О и R1 представляет собой низший алкил, например следующие соединения
рац-5-(7-метил-хроман-4-ил)-1Н-имидазол, или таутомер, или рац-5-(5-метил-хроман-4-ил)-1Н-имидазол, или таутомер.
- Соединения формулы I, где Х представляет собой СН, Q представляет собой О и R1 представляет собой атом галогена, например следующие соединения:
рац-5-(6-фтор-хроман-4-ил)-1Н-имидазол, или таутомер;
5-(8-хлор-2Н-хромен-4-ил)-1Н-имидазол, или таутомер;
5-(6-хлор-2Н-хромен-4-ил)-1Н-имидазол, или таутомер;
рац-5-(7-фтор-хроман-4-ил)-1Н-имидазол, или таутомер, или
рац-5-(5-фтор-хроман-4-ил)-1 Н-имидазол, или таутомер.
Соединения по настоящему изобретению формулы I и их фармацевтически приемлемые соли могут быть получены с помощью методик, известных в данной области техники, например, с использованием нижеописанных методик, которые включают
а) взаимодействие соединения формулы
с этилендиамином формулы
Н2NСН2СН2NН2 III
с получением соединения формулы
где R1, R2, Q, m и n являются такими, как определено выше, или
б) восстановление соединения формулы
путем каталитической гидрогенизации в присутствии Pd/C или действием комплексного гидрида
с получением соединения формулы
где R1, R2, Q, m и n являются такими, как определено выше, или
в) восстановление соединения формулы
путем каталитической гидрогенизации в присутствии Pd/C или действием комплексного гидрида
с получением соединения формулы
где R1, R2, Q, m и n являются такими, как определено выше, или 10
г) деблокирование соединения формулы
действием муравьиной кислоты
с получением соединения формулы
где R1, R2, Q, m и n являются такими, как определено выше, или
д) взаимодействие соединения формулы
с ДМСО и оксалилхлоридом в дихлорметане или перманганате, абсорбированном на силикагеле, в ацетонитриле или с Pd/C в толуоле
с получением соединения формулы
где R1, R2, Q, m и n являются такими, как определено выше, или
е) взаимодействие соединения формулы
с NaOH и гидратом гидразина
с получением соединения формулы
где R1, R2, m и n являются такими, как определено выше, или
ж) взаимодействие соединения формулы
с HBr, уксусной кислотой и анизолом
с получением соединения формулы
где R1, R2, m и n являются такими, как определено выше, или
з) взаимодействие соединения формулы
с NaOH и гидратом гидразина
с получением соединени формулы
где R1, R2, m и n являются такими, как определено выше, и Q представляет собой О или СН2, и,
при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислот.
Бициклические замещенные 2-имидазолины, 2-имидазолы и 2-имидазольные соединения, описанные в данной заявке, получали в соответствии с методиками, аналогичными методикам, описанными в литературе, с использованием реакций, приведенных на Схемах 1-6.
Данные методики описаны в следующих ссылках:
[1] J. Med. Chem. 1986, 29, 1413.
[2] Bull. Korean Chem. Soc. 2003, 24,1354.
[3] J. Med. Chem. 1987, 30, 1482.
[4] Chem. Pharm Bull. 1987, 35,1058 и Synthesis 1990, 78.
[5] J. Med. Chem. 1997, 40, 3014.
[6] Tempahedron 2004, 60, 9857.
[7] Synth. Common. 1990, 20, 2483.
[8] Org. Left. 2002,4, 3051.
Все исходные вещества или имеются в продаже, или же описаны в химической литературе, или могут быть получены с помощью методик, хорошо известных в данной области техники.
МЕТОДИКА А
Синтез бициклических замещенных имидазолинов
Схема 1
TMSN - триметилсилилцианид
pTsOH - пара-толуолсульфоновая кислота
rt - комнатная температура
rf - температура дефлегмации.
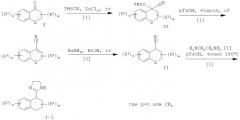
2-Имидазолины формулы I-1 могут быть получены путем взаимодействия нитрила формулы II с этилендиамином формулы III. Циклизация с диамином может быть выполнена путем нагревания диаминовой моносоли пара-толуолсульфоновой кислоты с нитрилом строго в диапазоне температур от 100°С до 250°С, предпочтительно от 140°С до 240°С, в течение нескольких часов, предпочтительно в течение 2-6 часов, или путем нагревания раствора нитрила в этилендиамине или его производном, взятых в избытке, в присутствии каталитического количества серы, предпочтительно от 10 мол.% до 50 мол.%, в герметически закрытой пробирке в микроволноовой печи при температуре до 200°С в течение 10-60 минут, предпочтительно в течение 15-30 минут [2], или путем взаимодействия комплекса, образованного из триметилалюминия и этилендиамина, или его производного, в толуоле при температуре ниже температуры окружающей среды, предпочтительно при температуре от 0°С до 10°С, с нитрилом в толуоле при температуре дефлегмации в течение 4-24 часов, предпочтительно в течение 16-20 часов [3]. В последней методике указанный нитрил может быть заменен соответствующим сложным низшим алкиловым эфиром.
Нитрилы формулы II, являющиеся производными циклических кетонов формулы V, могут быть получены путем трехстадийного синтеза в соответствии с методиками, описанными в литературе. Синтез начинают с добавления синтетического эквивалента цианистого водорода, например триметилсилилцианида, что приводит к образованию О-защищенного циангидрина формулы VI, например триметилсилил-О. Это добавление выполняют в присутствии катализатора, например иодида цинка, строго при температуре окружающей среды с интенсивным перемешиванием в течение 18-часов. Отщепление триметилсиланола в присутствии каталитического количества кислоты, предпочтительно пара-толуолсульфоновой кислоты, в органическом растворителе, таком как бензол, толуол, ксилол и тому подобное, предпочтительно в толуоле, при температуре дефлегмации в течение 1-6 часов, предпочтительно в течение 2-3 часов, приводит к образованию α,β-ненасыщенного нитрила формулы VII. Восстановление двойной связи в данном нитриле комплексным гидридом, предпочтительно боргидридом натрия, в низшем спирте, таком как метанол, этанол, изопропанол, предпочтительно в этаноле, при температуре дефлегмации в течение 0,5-2 часов, предпочтительно в течение 0,5-1 часа, приводит к образованию нитрила формулы II.
МЕТОДИКА Б
Синтез бициклических замещенных имидазолов
Схема 2а: 2-имидазолы. где Q представляет собой О, СН2, N-алкил и N-SO2-арил
где Q=О, СН2, N-алкил, N-SO2-толуол-4-ил
ТГФ - тетрагидрофуран.
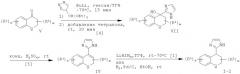
Прямое введение 2-имидазольного остатка выполняют путем взаимодействия арилкетона V с металлированным N-защищенным имидазолом, который сначала получают in situ путем депротонирования N-защищенного имидазола сильным основанием, таким как алкиллитий или ариллитий, предпочтительно н-бутиллитием, в инертном органическом растворителе, например в тетрагидрофуране или диэтиловом эфире, при температуре ниже температуры окружающей среды, предпочтительно при -78°С. Выделяемый основной продукт представляет собой третичный спирт формулы VIII.
α,β-Ненасыщенные 2-имидазолы формулы IV получают из соответствующих третичных спиртов путем отщепления воды в присутствии кислотного катализатора. Предпочтительным катализатором является пара-толуолсульфоновая кислота, реакцию проводят в растворителе, образующем азеотропную смесь, таком как бензол или толуол, предпочтительно в толуоле, при температуре дефлегмации в течение 1-4 часов, предпочтительно в течение 2-3 часов. Данная реакция может быть также выполнена путем добавления соответствующих третичных спиртов к концентрированной серной кислоте, в диапазоне температур от 0°С до температуры окружающей среды, предпочтительно при температуре от 0°С до 10°С, и последующего перемешивания смеси при температуре окружающей среды в течение 5-30 минут, предпочтительно в течение 10-15 минут.
2-Имидазолы формулы 1-2 получают из соответствующих α,β-ненасыщенных 2-имидазолов формулы IV путем восстановления двойной связи либо путем каталитической гидрогенизации в присутствии Pd/C (палладия на углероде) в полярном растворителе, предпочтительно в низшем спирте, либо действием комплексного гидрида, такого как алюмогидрид лития, в апротонном растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре окружающей среды или при повышенной температуре в течение 2-12 часов, предпочтительно в течение 4-8 часов. В том случае, когда Q представляет собой N-SO2-арил, восстановление с использованием алюмогидрида лития при повышенной температуре приводит к образованию смеси соответствующих продуктов формулы I-2, где Q представляет собой N-SO2-арил и Q представляет собой NH. Образованию последнего соединения способствует увеличение времени реакции или повышение температуры реакции.
где Q=CH2 или O, Tr=тратил
ТФУ - трифторуксусная кислота
Прямое введение 4-имидазольного остатка выполняют путем взаимодействия арилкетона формулы V с металлированным N-защищенным имидазолом, который сначала получают in situ из N-защищенного 4-иод-имидазола путем обработки магнийорганическим реагентом, предпочтительно бромидом этилмагния, в инертном органическом растворителе, предпочтительно в смеси дихлорметана и тетрагидрофурана, при температуре окружающей среды. Выделяемый основной продукт представляет собой третичный спирт формулы IX.
α,β-Ненасыщенные и N-деблокированные 4-имидазолы формулы I-3 получают из соответствующих третичных спиртов путем отщепления воды в присутствии кислотного катализатора в соответствии с тем, как описано для 2-имидазолов. Тритильную группу на имидазоле также отщепляют в этих же условиях. Для получения α,β-ненасыщенных и детритилированных 4-имидазолов формулы I-3 наряду с упомянутыми методиками получения α,β-ненасыщенных 2-имидазолов также может быть использовано взаимодействие с 30-80% трифторуксусной кислотой в воде, предпочтительно с 60%, при температуре окружающей среды в течение 12-24 часов, предпочтительн в течение 14-18 часов.
N-деблокированные 4-имидазолы формулы I-5, все еще являющиеся третичными спиртами, получают путем деблокирования соответствующего N-тритил-имидазола в присутствии кислотного катализатора, а имено смесью муравьиная кислота/ТГФ/вода (1:1:0,1).
По аналогии с 2-имидазолами 4-имидазолы формулы I-4 получают из соответствующих α,β-ненасыщенных 4-имидазолов формулы I-3 путем восстановления двойной связи либо путем каталитической гидрогенизации в присутствии Pd/C в полярном растворителе, таком как метанол, этанол, пропанол, изопропанол или этилацетат, предпочтительно в низшем спирте, таком как метанол или этанол, либо путем восстановления с использованием комплексного гидрида, такого как алюмогидрид лития, в апротонном растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре окружающей среды в течение 2-12 часов, предпочтительно в течение 4-8 часов
МЕТОДИКА В (В1 и В2)
Дегидрогенизация имидазолинов до имидазолов
Схема 3
2-Имидазолы формулы I-2 могут быть также получены путем дегидрогенизации соответствующих 2-имидазолинов. Для данного превращения использованы две методики, описанные в литературе, окисление по Сверну и каталитическая дегидрогенизация.
МЕТОДИКА Г
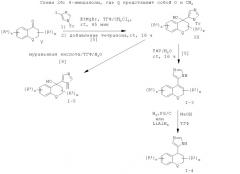
Прямое введение 4-имидазольного остатка также может быть выполнено в соответствии с методикой, аналогичной методике, опубликованной S. Ohta et al. (Synthesis 1990, 78), путем взаимодействия арилкетон формулы V с металлированным N(1)-, С(2)-дизащищенным имидазолом, предпочтительно с 2-(трет-бутил-диметил-силанил)-имидазол-1-сульфоновой кислоты диметиламидом, который депротонируют in situ сильным основанием, таким как алкиллитий или ариллитий, предпочтительно н-бутиллитием, в инертном органическом растворителе, например в тетрагидрофуране или диэтиловом эфире, при температуре ниже температуры окружающей среды, предпочтительно при -78°С. Выделяемый основной продукт представляет собой третичный спирт формулы X.
Нагревание раствора третичного спирта Х в разбавленной неорганической кислоте, предпочтительно в 1-4 н. HCI, при температуре дефлегмации в течение 2-6 часов приводит к образованию α,β-ненасыщенного бициклического продукта формулы 1-3, содержащего деблокированный 4-имидазолильный остаток.
4-Имидазолы формулы I-4 получают из соответствующих α,β-ненасыщенных 2-имидазолов формулы I-3 путем восстановления двойной связи либо путем каталитической гидрогенизации водородом по давлением 50-150 бар (0,5-1,5·107 Па), предпочтительно под давлением 100 бар (107 Па), в присутствии Pd/C в полярном растворителе, таком как метанол, этанол, пропанол, изопропанол или этилацетат, предпочтительно в этилацетате, в диапазоне температур от температуры окружающей среды до 150°С, предпочтительно при температуре 50°С, в течение 12-24 часов, предпочтительно в течение 16-20 часов, или путем восстановления с использованием комплексного гидрида, такого как алюмогидрид лития, в апротонном растворителе, таком как тетрагидрофуран или диэтиловый эфир, при температуре окружающей среды в течение 2-12 часов, предпочтительно в течение 4-8 часов.
МЕТОДИКА Д
Ar представляет собой толуол-4-ил.
2-Имидазольные соединения формулы 1-7, где W представляет собой СН2 и Q представляет собой NH, N-алкил, N-SO2-алкил или N-SO2-толуол-4-ил, могут быть получены в соответствии со Схемой 5. Исходными веществами являются производные 1,2,3,4-тетрагидро-хинолин-4-карбоновой кислоты формулы XI, которые могут быть получены с помощью методик, уже описанных в литературе, например путем восстановления в присутствии никеля Ренея соответствующих производных хинолин-4-карбоновой кислоты, как описано в Khimiya Geterotsiklicheskikh Soedinemi 1988, 77-9. Производные карбоновой кислоты формулы XI превращают в соответствующие производные амида Вайнреба формулы XII путем обработки гидрохлоридом N,O-диметилгидроксиламина и сшивающим реагентом, таким как 1-этил-3-(3′-диметиламинопропил)карбодиимида гидрохлорид (EDCI), в присутствии третичного амина в качестве основания, такого как триэтиламин или N-метилморфолин. Реакцию проводят в галогенированном органическом растворителе, таком как дихлорметан.
После получения производных амида Вайнреба формулы XII атом азота 1,2,3,4-тетрагидро-хинолиновой кольцевой системы защищают, например в виде соответствующего арилсульфонамида, путем обработки арилсульфохлоридом в присутствии третичного амина в качестве основания, такого как триэтиламин, в галогенированном органическом растворителе, таком как дихлорметан или 1,2-дихлорэтан. Данную реакцию можно проводить при комнатной температуре или при температуре дефлегмации используемого растворителя.
Затем амидная группировка Вайнреба, присутствующая в соединениях формулы XIII, может быть подвергнута взаимодействию с металлированным N-защищенным имидазолом, например с 2-(1-диэтоксиметил-1Н-имидазол-2-ил)-литием, который сначала получают in situ путем депротонирования соответствующего N-защищенного имидазола сильным основанием, таким как алкиллитий или ариллитий, предпочтительно н-бутиллитием, в инертном эфирном растворителе, например в тетрагидрофуране или диэтиловом эфире, при температуре ниже температуры окружающей среды, предпочтительно при -78°С. Взаимодействие производного амида Вайнреба формулы XIII и металлированного N-защищенного имидазола проводят в инертном эфирном растворителе, например в тетрагидрофуране или диэтиловом эфире, при температуре ниже температуры окружающей среды, предпочтительно при температуре от -78°С до 0°С. Выделяемый основной продукт представляет собой кетон формулы XIV.
Затем кетон формулы XIV может быть подвергнут восстановлению Вольфа-Кижнера с получением соединения формулы I-6, например с использованием методики, описанной в Arch. Pharm. 1989, 322, 363-367, которая включает обработку гидроксидом натрия и гидратом гидразина в органическом растворителе, имеющем высокую точку кипения, таком как триэтиленгликоль, при повышенной температуре, предпочтительно при температуре от 110°С до 200°С.
В конце защитная группа в соединении формулы I-6 может быть удалена, например, в результате взаимодействия с протонной кислотой, такой как HBr, в уксусной кислоте в присутствии анизола, с получением желаемого соединения формулы I-7.
МЕТОДИКА Е
Исходное вещество, амид Вайнреба формулы XVI, получают из соответствующей карбоновой кислоты формулы XV в соответствии с методиками, известными в данной области техники (сравни со Схемой 5). Прямое введение 2-имидазольного остатка выполняют путем взаимодействия данного амида Вайнреба с металлированным N-защищенным имидазолом, который получают in situ из N-защищенного имидазола действием сильного основания, такого как алкиллитий или ариллитий, предпочтительно действием н-бутиллития, в инертном органическом растворителе, например в тетрагидрофуране или диэтиловом эфире, при температуре ниже температуры окружающей среды, предпочтительно при -78°С. Выделяемый основной продукт представляет собой кетон формулы XVII.
Путем восстановления данного кетона в соответствии с методиками, извес