Ингибитор киназы
Иллюстрации
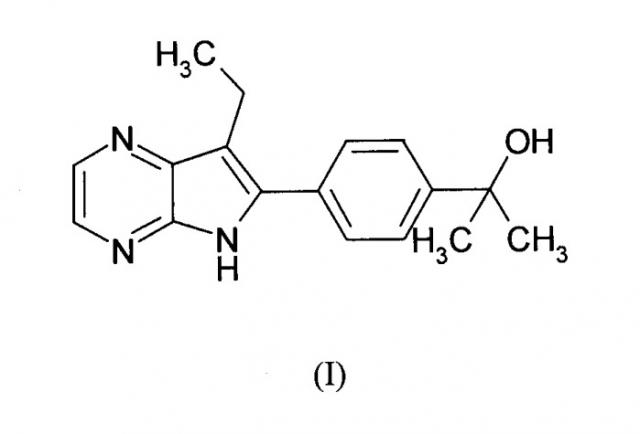
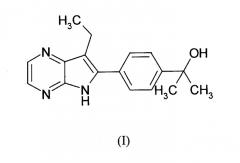
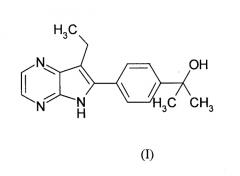
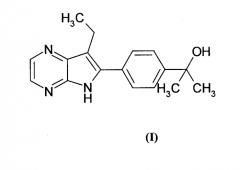
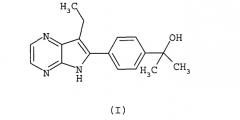
Показать всеИзобретение относится к соединению формулы (I):
его фармацевтически приемлемой соли или сольвату, которые обладают свойствами ингибитора Syk киназы. Изобретение также относится к фармацевтической композиции, содержащей указанное соединение, к способам лечения заболеваний, развитию которых способствует активность рецептора c-kit, таких как воспаление суставов, ревматоидный артрит, опухоль, лимфома из клеток мантийной зоны, а также к способу ингибирования ангиогенеза. 9 н. и 4 з.п. ф-лы, 4 табл., 10 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к замещенным азаиндолам, их получению, содержащим эти соединения фармацевтическим композициям, а также их использованию в лечении патологических состояний, которые можно контролировать ингибированием протеинкиназ.
УРОВЕНЬ ТЕХНИКИ
Протеинкиназы участвуют в сигнальных процессах, которые управляют активацией, ростом и дифференциацией клеток в ответ на сигналы, передаваемые внеклеточными медиаторами, а также на изменения в окружающей среде. В целом такие киназы могут быть отнесены к нескольким группам: те, которые избирательно фосфорилируют сериновые и/или треониновые остатки, и те, которые избирательно фосфорилируют тирозиновые остатки [S.K.Hanks and T.Hunter, FASEB. J., 1995, 9, стр.576-596]. Серин/треонинкиназы включают, например, изоформы протеинкиназы С [A.C.Newton, J. Biol. Chem., 1995, 270, стр.28495-28498] и группу циклин-зависимой киназы, такой как cdc2 [J.Pines, Trends in Biochemical Sciences, 1995, 18, стр.195-l97]. Тирозинкиназы включают мембранные рецепторы фактора роста, такие как рецептор эпидермального фактора роста [S.Iwashita and M.Kobayashi, Cellular Signalling, 1992, 4, стр.123-132], и не содержащие рецептор цитозольные киназы, такие как киназы p56tck, p59fYn, ZAP-70 и csk [C.Chan et. al., Ann. Rev. Immunol., 1994, l2, стр.555-592].
Необычно высокая активность протеинкиназ отмечалась в клинических картинах многих заболеваний, вызванных нарушениями клеточных функций. Прямо или косвенно это могло быть вызвано, например, нарушением соответствующего механизма контроля киназы, связанным, к примеру, с мутацией, сверхпродукцией или нарушением активации фермента, либо избыточной или недостаточной выработкой цитокинов или факторов роста, также участвующих в трансдукции сигналов до или после синтеза киназы. Во всех этих случаях можно ожидать положительного эффекта селективного ингибирования действия киназы.
Syk представляет собой цитоплазматическую протеинтирозинкиназу с молекулярной массой 72 кДа, экспрессия которой осуществляется в различных гематопоэтических клетках, и является важным элементом нескольких каскадов, связывающих рецепторы антигенов с клеточным ответом. Поэтому Syk играет важнейшую роль в передаче сигнала высокоаффинного рецептора IgE, FcεR1 в тучных клетках и в передаче сигнала рецептор-антиген в Т- и В-лимфоцитах. Каналы передачи сигнала в тучных, Т- и В-клетках имеют общие характеристики. Лиганд-связывающий домен рецептора не проявляет активности, присущей тирозинкиназе. Тем не менее, они взаимодействуют с передающими сигнал субъединицами, которые содержат мотивы активации иммуннорецептора на основе тирозина (ITAM) [M.Reth, Nature, 1989, 338, стр.383-384]. Такие мотивы присутствуют в β- и γ-субъединицах FcεR1, в ξ-субъединице рецептора T-клеток (TCR) и в β-субъединицах IgGα и IgG рецептора B-клеток (BCR). [N.S.van Oers and A.Weiss, Seminars in Immunology, 1995, 7, стр.227-236]. После связывания антигена и мультимеризации остатки ITAM фосфорилируются протеинтирозинкиназами семейства Src. Syk относится к уникальному классу тирозинкиназ, обладающих двумя тандемными доменами Src гомологии 2 (SH2) и С-терминальным каталитическим доменом. Эти домены SH2 с высокой аффинностью связываются с ITAM, и такая опосредованная SH2 ассоциация Syk с активированным рецептором стимулирует активность Syk киназы и локализует Syk в плазматической мембране.
У Syk-дефицитных мышей ингибируется дегрануляция тучных клеток, указывая на нее как на значимый объект для разработки стабилизаторов тучных клеток [P.S.Costello, Oncogene, 1996, 13, стр.2595-2605]. Аналогичные исследования продемонстрировали важную роль Syk в передаче сигнала в BCR и TCR [A.M.Cheng, Nature, 1995, 378, стр.303-306, (1995) and D.H.Chu et. al., Immunological Reviews, 1998, 165, стр.167-180]. По-видимому, Syk также задействован в обеспечении выживаемости эозинофилов в ответ на IL-5 и GM-CSF [S.Yousefi et. al., J. Exp. Med., 1996, 183, стр.1407-1414]. Несмотря на ключевую роль Syk в передаче сигнала в тучных клетках, BCR и T-клетках, в литературе имеется мало сведений о механизме, посредством которого Syk передает сигнал последующим эффекторам. Было показано, что два адапторных белка, BLNK (линкерный белок B-клеток, SLP-65) и SLP-76, являются субстратами Syk в B-клетках и тучных клетках, соответственно, и постулировалась их промежуточная роль в цепочке между Syk и последующими эффекторами [M.Ishiai et. al., Immunity, 1999, 10, стр.117-125 and L.R.Hendricks-Taylor et. al., J.Biol. Chem, 1997, 272, стр.1363-1367]. Кроме того, очевидно, что Syk играет важную роль в канале передачи сигнала CD40, который имеет существенное значение для пролиферации В-клеток [M.Faris et. al., J.Exp. Med., 1994, 179, стр.1923-1931].
Syk также участвует в активации тромбоцитов, стимулированной низкоаффинным рецептором IgG (Fc гамма-RIIA) или коллагеном [F.Yanaga et. al., Biochem. J., 1995, 311, (Pt. 2) стр.471-478].
Киназа фокальной адгезии (FAK) относится к нерецепторным тирозинкиназам, задействованным в канале передачи сигнала, опосредованном интегрином. FAK связывается с интегринами в сайтах фокальных контактов, и было показано, что активация FAK и фосфорилирование им тирозина во многих типах клеток зависит от интегринов, связанных с их внеклеточными лигандами. Результаты ряда исследований свидетельствуют в пользу гипотезы о том, что ингибиторы FAK могут использоваться для лечения рака. Например, FAK-дефицитные клетки слабо мигрируют в ответ на хемотактические сигналы, и сверхэкспрессия С-терминального домена FAK блокирует распространение клеток, а также хемотактическую миграцию (Sieg et. al., J. Cell Science, 1999, 112, 2677-2691; Richardson A. and Parsons T., Cell, 1997, 97, 221-231); кроме того, клетки опухоли, обработанные антисенсовыми олигонуклеотидами FAK, утрачивают способность к связыванию и подвергаются апоптозу (Xu et. al., Cell Growth Differ. 1996, 4, 413-418). Сообщалось о сверхэкспрессии FAK в случае рака простаты, молочной железы, щитовидной железы, толстой кишки и легких. Уровень экспрессии FAK напрямую коррелирует с опухолями, проявляющими наиболее агрессивный фенотип.
Ангиогенез, или формирование новых кровеносных сосудов за счет разрастания уже существовавшей сосудистой сети имеет центральное значение для развития эмбриона и органогенеза. Аномальная усиленная неоваскуляризация наблюдается при ревматоидном артрите, диабетической ретинопатии и в процессе развития опухолей (Folkman, Nat. Med., 1995, 1, 27-31.). Ангиогенез представляет собой сложный многоступенчатый процесс, который включает активацию, миграцию, пролиферацию и выживание эндотелиальных клеток. Подробные исследования в области ангиогенеза опухолей в последние два десятилетия позволили выявить ряд терапевтических мишеней, в том числе киназы, протеазы и интегрины, которые привели к открытию многих новых антиангиогенных агентов, в том числе ингибиторов KDR; некоторые из них в настоящее время проходят клинические испытания (Jekunen, et. al. Cancer Treatment Rev. 1997, 23, 263-286.). Ингибиторы ангиогенеза могут использоваться как основные, вспомогательные или даже профилактические препараты против формирования или повторного роста злокачественных образований.
В дрожжах и у дрозофил было выявлено несколько белков, задействованных в разделении хромосом и формировании веретена. Нарушения в функциях этих белков приводят к неверному разделению хромосом и образованию монополярных или разрушенных веретен. К таким киназам относятся Ipl1 и авроракиназы из S.cerevisiae и дрозофилы соответственно, которые необходимы для разделения центросом и сегрегации хромосом. В нескольких лабораториях недавно был клонирован и охарактеризован один человеческий гомолог дрожжевой Ipl1. Эта киназа, получившая название Aurora2, STK15 или BTAK, относится к семейству серин/треонинкиназ. В работе Бишофа (Bischoff) с сотрудниками было показано, что Aurora2 является онкогенной и амплифицируется при колоректальном раке человека (EMBO J, 1998, 17, 3052-3065). Она также была охарактеризована в случае рака с формированием эпителиальных опухолей, например рака молочной железы.
В настоящее время нами обнаружен новый замещенный азаиндол, обладающий ценными фармацевтическими свойствами, в частности, способностью ингибировать протеинкиназы, а точнее, способностью селективно ингибировать Syk киназу. Данное азаиндольное производное подобно соединениям, раскрываемым в патенте США 6770643, однако в указанном патенте отсутствует конкретная информация о нем.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению формулы I:
его фармацевтически приемлемой соли или пролекарству или сольвату такого соединения, его соли или его пролекарству.
Изобретение также относится к фармацевтической композиции, содержащей соединение формулы I, и способу применения соединения формулы I для лечения или профилактики физиологического состояния, связанного с присутствием Syk у пациента.
Изобретение также относится к способу получения соединения, являющегося промежуточным соединением и полезного при получении соединения формулы I.
Еще в одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединения общей формулой (I):
соответствующий N-оксид и пролекарство; и фармацевтически приемлемая соль и сольват (например, гидрат) такого соединения; и N-оксид и пролекарство; вместе с одним или несколькими фармацевтически приемлемыми носителями или наполнителями.
КРАТКОЕ ОПИСАНИЕ ФИГУР
ФИГ.1. Схема реакции получения соединения формулы I.
ФИГ.2. Средний диаметр скакательного сустава крыс после инъекции коллагена типа II из бычьего носового хряща в неполном адъюванте Фройнда и введения A003397769, соединения формулы I (3,0; 10 или 30 мг/кг 2 р/д) со дня 6 по день 21. Средний диаметр скакательного сустава самок крыс LEW, сенсибилизированных подкожной инъекцией коллагена в неполном адъюванте Фройнда (400 мкг/400 мкл/крыса) в дни 0 и 7. Животные получали дозу в период с 6 по 21 день.
ФИГ.3. Анализ костной эрозии (отношение площади кости к ее объему) в пяточной кости крыс CIA, получавших A003397769 (3,0; 10 или 30 мг/кг).
ФИГ.4. Средний диаметр скакательного сустава крыс после инъекции коллагена типа II из бычьего носового хряща в неполном адъюванте Фройнда и введения только A003397769 (3,0 мг/кг) или в сочетании с метотрексатом (0,1 или 0,2 мг/кг) со дня 6 по день 20 или 21 и в сопоставлении с животными, получавшими носитель. Воздействие ингибитора SYK, A003397769, (3,0 мг/кг 2 р/д) на крыс CIA в условиях монотерапии или в сочетании с метотрексатом.
ФИГ.5. Средний диаметр скакательного сустава крыс после инъекции коллагена типа II из бычьего носового хряща в неполном адъюванте Фройнда и введения только A003397769 (10 мг/кг) или в сочетании с метотрексатом (0,1 или 0,2 мг/кг) со дня 6 по день 20 или 21 и в сопоставлении с животными, получавшими носитель. Воздействие ингибитора SYK, A003397769, (10 мг/кг 2 р/д) на крыс CIA в условиях монотерапии или в сочетании с метотрексатом.
ФИГ.6. Анализ костной эрозии (отношение площади кости к ее объему) в пяточной кости крыс CIA, получавших только A003397769 (3,0 или 10 мг/кг) или в сочетании с метотрексатом (0,1 или 0,2 мг/кг).
ФИГ.7. Средний диаметр скакательного сустава крыс после инъекции коллагена типа II из бычьего носового хряща в неполном адъюванте Фройнда и введения A003397769 A (10 или 30 мг/кг 2 р/д) со дня 12 по день 21. Средний диаметр скакательного сустава самок крыс Lewis, сенсибилизированных подкожной инъекцией коллагена в неполном адъюванте Фройнда (400 мкг/400 мкл/крыса) в дни 0 и 7. Среднее для обеих лап.
ФИГ.8. Анализ костной эрозии (отношение площади кости к ее объему) в пяточной кости крыс CIA, получавших A003397769 A (10 или 30 мг/кг 2 р/д).
ФИГ.9. Воздействие соединения формулы I на вес крыс.
ФИГ.10. Воздействие соединения формулы I на концентрацию гемоглобина.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, в одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединения общей формулы (I):
также известным как: 2-[4-(7-этил-5H-пирроло[2,3-b]пиразин-6-ил)-фенил]-пропан-2-ол.
В настоящем описании подразумевается, что термин «соединения настоящего изобретения» и аналогичные выражения включают описанное выше в настоящем документе соединение общей формулы (I), каковое выражение включает пролекарства, фармацевтически приемлемые соли и сольваты, например гидраты, где это допускается контекстом. Точно так же ссылка на промежуточные соединения, вне зависимости от того, являются ли они сами предметом настоящего изобретения, распространяется и на их соли и сольваты, где это допускается контекстом. Для внесения ясности конкретные случаи, если это допускается контекстом, иногда отмечены в тексте, однако эти случаи имеют исключительно иллюстративный характер и не исключают другие случаи, если это допускается контекстом.
Используемые сокращения:
ATP - аденозин трифосфат;
DTT - дитиотреитол;
PBS - физиологический раствор в фосфатном буфере.
Используемые выше и во всем тексте описания изобретения следующие термины, если не указано иначе, имеют следующие значения:
«Пациент» означает человека и других млекопитающих.
«Пролекарство» означает соединение, которое in vivo преобразуется метаболическими путями (например, гидролизом) в соединение с формулой (I), включая его N-оксиды. Например, эфир соединения формулы (I), содержащий гидроксильную группу, может быть преобразован гидролизом in vivo в исходную молекулу. В альтернативном варианте эфир соединения формулы (I), содержащий карбоксильную группу, может быть преобразован гидролизом in vivo в исходную молекулу.
Подходящими эфирами соединений формулы (I), содержащими гидроксильную группу, являются, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хиннаты.
Особенно полезный класс эфиров соединений формулы (I), содержащих гидроксильную группу, может быть получен из кислотных соединений, избранных из описанных в работе Bundgaard et. al., J. Med. Chem., 1989, 32, стр.2503-2507, и включает замещенные (аминометил)-бензоаты, например диалкиламинометилбензоаты, в которых две алкильные группы могут быть объединены вместе и (или) разделены атомом кислорода или возможно замещенным атомом азота, например алкилированным атомом азота, точнее (морфолинометил)бензоаты, например 3- или 4-(морфолинометил)бензоаты, и (4-алкилпиперазин-1-ил)бензоаты, например 3- или 4-(4-алкилпиперазин-1-ил)бензоаты.
Некоторые соединения настоящего изобретения являются основными, и такие соединения полезны в форме свободного основания или в форме фармацевтически приемлемой соли, полученной при добавлении такого соединения.
Соли, образующиеся при присоединении кислот, более удобны при использовании; и на практике использование соли, в сущности, заключается в использовании формы свободного основания. Кислоты, которые могут быть использованы для приготовления солей, включают, предпочтительно, те, которые в результате их реакции со свободным основанием образуют фармацевтически приемлемые соли, то есть соли, анионы которых не токсичны для пациента в фармацевтических дозах солей, и положительный ингибирующий эффект, присущий свободным основанием, не нарушается побочными эффектами, приписываемыми анионам. Несмотря на то, что фармацевтически приемлемые соли указанных основных соединений являются предпочтительными, все соли, образованные при добавлении кислот, полезны в качестве источников форм свободного основания, даже если конкретная соль, как таковая, необходима только в качестве промежуточного продукта, как, например, в случае, когда соль образуется только в целях очистки и идентификации, или когда она используется в качестве промежуточного соединения в приготовлении фармацевтически приемлемой соли путем ионообменных процессов. Фармацевтически приемлемые соли, охватываемые настоящим изобретением, включают соли, полученные из минеральных кислот и органических кислот, и включают гидрогалиды, например гидрохлориды и гидробромиды, сульфаты, фосфаты, нитраты, сульфаматы, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-b-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуотартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хиннаты.
Кроме применения в качестве активных соединений, соли соединений по изобретению могут быть использованы в целях очистки соединений, например на основании разницы растворимостей между солями и исходными соединениями, побочными продуктами и (или) исходными материалами, способами, хорошо известными специалистам в данной области.
Соединения настоящего изобретения имеют полезное фармакологическое действие и, соответственно, вводятся в фармацевтические композиции и используются при лечении пациентов, страдающих определенными медицинскими расстройствами. Таким образом, настоящее изобретение обеспечивает, в соответствии с дальнейшим аспектом, соединения изобретения и составы, содержащие соединения изобретения, для использования в терапии.
Соединения, охватываемые настоящим изобретением, ингибируют или блокируют каталитическую активность киназ, в соответствии с тестами, описанными в литературе, и процедурами in vitro, описанными ниже, результаты которых должны коррелировать с фармакологическим действием в организме человека и других млекопитающих. Таким образом, в еще одном осуществлении настоящего изобретения представлены соединения, составляющие предмет настоящего изобретения и содержащие их составы, которые могут использоваться в лечении пациентов, страдающих заболеваниями или подверженных заболеваниям, которые можно облегчить введением ингибиторов протеинкиназы (например, Syk, FAK, KDR или Aurora2). Например, соединения настоящего изобретения полезны при лечении воспалительных заболеваний, таких как астма; воспалительных дерматозов (например, псориаза, герпетиформного дерматита, экземы, некротического и кожного васкулита, буллезного нарушения); аллергического ринита и аллергического конъюнктивита; воспаления суставов, включая артрит, ревматоидный артрит и прочие артритические состояния, такие как ревматоидный спондилит, подагрический артрит, травматический артрит, краснушный артрит, псориатический артрит и остеоартрит. Указанные соединения также полезны при лечении хронического обструктивного заболевания легких (ХОЗЛ), острого синвоита, аутоиммунного диабета, аутоиммунного энцефаломиелита, колита, атеросклероза, болезни периферических сосудов, сердечно-сосудистого заболевания, рассеянного склероза, рестеноза, миокардита, B-клеточных лимфом, системной красной волчанки, реакции отторжения трансплантата и прочих случаев отторжения трансплантата, различных форм рака и опухолей (таких как колоректальный рак, рак предстательной железы, рак молочной железы, рак щитовидной железы, рак прямой кишки и рак легких) и воспалительной болезни кишечника. Указанные соединения также полезны в качестве антиангиогенных препаратов для лечения опухолей. Кроме того, соединения настоящего изобретения полезны в качестве препаратов для контролирования опухолевых клеток.
Специальным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение воспаления суставов.
Дополнительным специальным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение ревматоидного артрита.
Специальным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение форм рака, опухолей и других пролиферативных расстройств.
Еще одним конкретным применением терапевтических методов, составляющих предмет настоящего изобретения, является лечение рака, сопровождающегося образованием жидких опухолей.
Дополнительным специальным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение лимфомы из клеток мантийной зоны.
Дополнительным специальным осуществлением терапевтических методов, составляющих предмет настоящего изобретения, является лечение расстройств путем ингибирования ангиогенеза.
В соответствии с еще одним пунктом настоящего изобретения предлагается способ лечения пациента (человека или животного), страдающего заболеваниями или подверженного заболеваниям, которые могут быть облегчены введением ингибитора протеинкиназы (например, Syk, FAK, KDR или Aurora2), например состояний, описанных выше, включающий введение пациенту эффективного количества соединения, оставляющего предмет настоящего изобретения, или препарата, содержащего соединение настоящего изобретения. Под «эффективным количеством» подразумевается количество соединения, составляющего предмет настоящего изобретения, которое эффективно в качестве ингибитора каталитической активности протеинкиназы, например Syk, FAK, KDR или Aurora2, и таким образом способно дать желаемый терапевтический эффект.
Включенные в данное описание ссылки на лечение распространяются как на профилактическую терапию, так и на лечение диагностированных патологических состояний.
Настоящее изобретение распространяется также на фармацевтические композиции, включающие соединение, составляющее предмет настоящего изобретения, в сочетании с фармацевтически приемлемым носителем или наполнителем.
Соединение настоящего изобретения может вводиться любым подходящим способом. На практике соединение настоящего изобретения может, в общем случае, вводиться парентерально, местно, ректально, перорально или посредством ингаляции; в особенности, перорально или посредством ингаляции.
В соответствии с настоящим изобретением препараты могут готовиться по общепринятым методам с использованием одного или нескольких фармацевтически приемлемых вспомогательных веществ или наполнителей. К вспомогательным веществам, среди прочего, относятся разбавители, стерильные водные среды и различные нетоксичные органические растворители. Составы могут готовиться в виде таблеток, пилюль, гранул, порошков, водных растворов или суспензий, инъекционных растворов, эликсиров или сиропов, и могут содержать один или несколько агентов, выбираемых из группы, содержащей подсластители, отдушки, красители и стабилизаторы для получения фармацевтически приемлемых препаратов. Выбор носителя и содержание активного вещества в носителе обычно определяется в соответствии с растворимостью и химическими свойствами активного соединения, конкретным способом введения и положениями, которые должны соблюдаться в фармацевтической практике. Например, для приготовления таблеток могут использоваться наполнители, такие как лактоза, цитрат натрия, карбонат кальция, дикальцийфосфат и дезинтегрирующие агенты, такие как крахмал, альгиновая кислота и некоторые сложные силикаты в сочетании со скользящими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк. Для приготовления капсулы удобно использовать лактозу и полиэтиленгликоли с высоким молекулярным весом. При использовании водных суспензий они могут содержать эмульгаторы или вещества, которые способствуют образованию суспензий. Могут также использоваться разбавители, например сахароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин и хлороформ или их смеси.
Для парентерального применения используются эмульсии, суспензии или растворы соединений изобретения в растительных маслах, например в кунжутном, арахисовом или оливковом, или водно-органические растворы, такие как вода и пропиленгликоль, инъецируемые органические эфиры, как, например, этилолеат, наряду со стерильными водными растворами фармакологически приемлемых солей. Солевые растворы соединений, используемых в настоящем изобретении, особенно подходят для введения в виде внутримышечных или подкожных инъекций. Водные растворы, включающие также растворы солей в чистой дистиллированной воде, могут использоваться внутривенно с условием, что их pH доведен до соответствующего уровня, что они забуферены соответствующим образом и сделаны изотонными добавлением достаточного количества глюкозы или хлорида натрия, и что они стерилизованы путем тепловой обработки, облучения или микрофильтрации.
Для местного применения могут использоваться гели (на водной или спиртовой основе), кремы или мази, содержащие соединения изобретения. Соединения изобретения могут также входить в состав геля или матричной основы для применения в пластыре, которые будут обеспечивать контролируемое высвобождение соединения через трансдермальный барьер.
При применении в виде ингаляций соединения изобретения могут быть растворены или приведены в состояние суспензии в подходящем носителе для использования в распылителе или аэрозольном баллончике, или могут быть абсорбированы или адсорбированы на подходящий твердый носитель для использования в сухом порошковом ингаляторе.
Твердые составы для ректального введения включают суппозитории, приготовленные в соответствии с известными методами и содержащие по крайней мере один компонент изобретения.
Процент активного компонента в составах изобретения может различаться, при этом необходимо, чтобы он содержал такую долю, которая обеспечивала бы соответствующую дозировку.
Очевидно, что несколько стандартных лекарственных форм, могут вводиться примерно одновременно. Применяемая доза будет определяться врачом и зависит от желаемого терапевтического эффекта, способа введения и продолжительности лечения, а также состояния пациента. Для взрослых дозы обычно составляют от приблизительно 0,001 до приблизительно 50, предпочтительно от приблизительно 0,001 до приблизительно 5 мг/кг массы тела при введении посредством ингаляций, от приблизительно 0,01 до приблизительно 100, предпочтительно от 0,1 до 70, более точно от 0.5 до 10 мг/кг массы тела в день при пероральном применении, и от приблизительно 0,001 до приблизительно 10, предпочтительно от 0,01 до 1 мг/кг веса тела в день при внутривенном введении. В каждом конкретном случае дозы будут определяться в соответствии с факторами, характерными для проходящего лечение пациента, например возраста, веса, общего состояния здоровья и других особенностей, которые могут влиять на эффективность фармацевтической композиции.
В соответствии с изобретением соединения могут вводиться так часто, как это необходимо для достижения желаемого терапевтического эффекта. Некоторые пациенты могут проявлять быструю ответную реакцию на более высокую или более низкую дозу, и для них могут оказаться достаточными гораздо более слабые дозы. Для других пациентов могут понадобиться долгосрочные курсы лечения с частотой от 1 до 4 доз в день, в соответствии с физиологическими потребностями каждого конкретного пациента. В целом действующее вещество может применяться перорально от 1 до 4 раз в день. Разумеется, для некоторых пациентов потребуется прописать не более одной или двух доз в день.
Соединения настоящего изобретения могут быть получены посредством применения или адаптации известных методов, под которыми подразумеваются методы, использовавшиеся прежде либо описанные в литературе, например, изложенные в работе R.C. Larock, Comprehensive Organic Transformations, VCH publishers, 1989.
В описанных ниже реакциях может возникать необходимость защитить реакционные функциональные группы, например гидроксильные группы, аминогруппы, иминогруппы, тиогруппы или карбоксильные группы, в случаях, когда эти группы необходимы в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Могут использоваться традиционные защитные группы в соответствии с принятой практикой, примеры см. в T.W. Greene and P. G. M. Wuts в "Protective Groups in Organic Chemistry," John Wiley and Sons, 1991.
Очевидно, что соединения, составляющие предмет настоящего изобретения, могут содержать асимметричные центры. Эти асимметричные центры могут независимо друг от друга быть в R- или в S-конфигурации. Для специалиста в области очевидно, что определенные соединения, составляющие предмет данного изобретения, могут также проявлять геометрическую изомерию. Следует понимать, что настоящее изобретение распространяется на отдельные геометрические изомеры и стереоизомеры и их смеси, в том числе рацемические смеси приведенных выше соединений с формулой (I). Такие изомеры можно выделить из их смесей при помощи известных методов или их модификаций, например хроматографических методов или методов перекристаллизации, либо получить отдельно из соответствующих изомеров промежуточных соединений.
Согласно еще одному пункту изобретения, образованные при добавлении кислоты соли соединений, составляющих предмет настоящего изобретения, можно получить в результате реакции свободного основания с соответствующей кислотой при помощи известных способов или их модификаций. Например, образованные при добавлении кислоты соли соединений, составляющих предмет настоящего изобретения, можно получить либо растворением свободного основания в воде, водном растворе спирта или других подходящих растворителях, содержащих соответствующую кислоту, и выделением соли выпариванием раствора, либо в результате реакции свободного основания и кислоты в органическом растворителе, где соль выпадает в осадок или выпаривается из раствора.
Соединения, составляющие предмет настоящего изобретения, можно регенерировать из их солей, образованных при присоединении кислоты, при помощи известных способов или их модификаций. Например, исходные соединения, составляющие предмет настоящего изобретения, можно регенерировать из их солей, полученных при присоединении кислоты, щелочами, например водным раствором бикарбоната натрия или водным раствором аммония.
Соединения, составляющие предмет настоящего изобретения, можно регенерировать из их солей, полученных при присоединении основания, при помощи известных способов или их модификаций. Например, исходные соединения, составляющие предмет настоящего изобретения, можно регенерировать из их солей, полученных при присоединении основания, обработкой кислотой, например соляной кислотой.
Соединения, составляющие предмет настоящего изобретения, могут быть без труда получены или образованы в процессе, составляющем предмет настоящего изобретения, в качестве сольватов (например, гидратов). Гидраты соединений, составляющих предмет настоящего изобретения, могут быть без труда получены путем перекристаллизации из смеси водного/органического растворителя с помощью таких органических растворителей, как диоксан, тетрагидрофуран или метанол.
Согласно еще одному отличительному признаку изобретения, образованные при добавлении основания соли соединений, составляющих предмет данного изобретения, можно получить в результате реакции свободной кислоты с соответствующим основанием при помощи известных способов или их модификаций. Например, образованные при добавлении основания соли соединений, составляющих предмет данного изобретения, можно получить либо растворением свободной кислоты в воде, или водном растворе спирта или других подходящих растворителях, содержащих соответствующее основание, и выделением соли выпариванием раствора, либо в результате реакции свободной кислоты и основания в органическом растворителе, где соль выпадает в осадок или выпаривается из раствора.
Исходные материалы и промежуточные соединения можно получить путем применения или модификации известных способов, например способов, описанных в примере, или их очевидных химических эквивалентов.
Настоящее изобретение далее иллюстрируется, среди прочего, следующим наглядным примером.
Спектры ядерного магнитного резонанса (ЯМР) 300 МГЦ 1H были записаны на приборах Varian Mercury. В спектрах ядерного магнитного резонанса (ЯМР) величины химического сдвига (δ) указаны в миллионных долях (мд) относительно тетраметилсилана. Сокращения имеют следующие значения: «с» = синглет, «д» = дублет; «т» = триплет; «кв» = квартет; «м» = мультиплет, «дд» = дублет дублетов, «ддд» = дублет двойных дублетов.
Эксперименты по жидкостной хроматографии высокого давления и масс-спектрометрии (ЖХМС) для определения времени удерживания (RT) и соответствующих масс ионов проводились с использованием одного из следующих методов. Масс-спектры (МС) записываются на времяпролетном масс-спектрометре Micromass LCT. Метод включает ионизацию электрораспылением положительных ионов и сканирование массы м/z от 100 до 1000. Жидкостная хроматография осуществляется при помощи бинарного насоса и дегазатора Agilent™ серии 1100; неподвижная фаза: колонка Phenomenex Synergi™ 2µ Hydro-RP 20X4,0 мм, подвижная фаза: A=0,1% муравьиная кислота (FA) в воде, B=0,1% FA в ацетонитриле. Объем ввода 5 мкл при помощи системы CTC Analytical PAL. Скорость потока составляет 1 мл/мин. Градиент составляет от 5% B до 90% B за 3 минуты и от 90% B до 100% B за 2 минуты. Вспомогательные детекторы: УФ-детектор Agilent серии 1100, длина волны =220 нм и испарительный детектор светорассеяния (ELS) Sedere SEDEX™ 75, температура детектора =46°C, давление азота= 4 бар.
Времена удерживания тонкослойной хроматографии (ТСХ) RF определялись при помощи планшетов с силикагелем компании Merck™.
ПРИМЕР 1
2-[4-(7-этил-5H-пирроло[2,3-b]пиразин-6-ил)-фенил]-пропан-2-ол
Всего получили 6,0 г 2-[4-(7-этил-5H-пирроло[2,3-b]пиразин-6-ил)фенил]пропан-2-ола (соединение 1) в два этапа из n-пропилпиразина (соединение 2) и 4-ацетилбензонитрила (соединение 3).
Синтез соединения 1 осуществляли следующим образом: сочетание n-пропилпиразина (соединение 2) и 4-ацетилбензонитрила (соединение 3) с бис(триметилсилил)-амидом натрия в тетрагидрофуране при 40°C дало промежуточное соединение 4 с выходом 30%. Реакция соединения 4 с хлоридом метилмагния в тетрагидрофуране при 0°C дало искомое соединение 1 с выходом 74% после рекристаллизации из 2-пропанола. Синтез показан на фиг.1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-[4-(7-этил-5H-пирроло[2,3-b]пиразин-6-ил)фенил]этанон (соединение 4). Раствор n-пропилпиразина (соединение 2, 912 мг, 7,46 ммоль) в тетрагидрофуране (5 мл) добавляли пипеткой в течение семи минут к раствору бис(триметилсилил)амида натрия (2M раствора в THF; 13 мл, 26 ммоль, 3,5 эквив.) при 20°C. Получили раствор темного пурпурно-красного цвета, и температура опустилась до 16,4°C. Раствор 4-ацетилбензонитрила (соединение 3, 1,08 г, 7,4 ммоль) в тетрагидрофуране (5 мл) добавляли в течение 18 минут при 13,3°C. Температура опустилась до 12,6°C, с получением раствора коричневого цвета. Смесь перемешивали при комнатной температуре в течение 1 часа, нагревали приблизительно до 35°C в течение 6 часов, а затем оставили перемешиваться при комнатной температуре в течение приблизительно 60 часов. Смесь влили в насыщенный водный раствор бикарбоната натрия (200 мл) и экстрагировали этилацетатом (2×150 мл). Этилацетат промывали водой (100 мл) и концентрировали на приборе Bbchi при температуре бани 40°C и при давлении от 80 до 10 Торр для получения твердого вещества темно-желтого цвета. Твердое вещество истирали в порошок в диэтиловом эфире (25 мл), отфильтровывали и промывали в эфире (25 мл). Твердое вещество сушили на воздухе для получения 600 мг (30,3%) соединения 4 в виде твердого вещества желтого цвета:
1H ЯМР (300 мГц, CDCl3, фиг.1) δ 8,5 (1H, д, J=2 Гц), 8,15 (2H, д, J=8 Гц), 8,1 (1H, д, J=3 Гц), 7,9 (2H, д, J=8 Гц), 3,1 (2H, кв., J=9 Гц), 2,7 (3H, с), 1,4 (3H, т, J=9 Гц).
1-[4-(7-этил-5H-пирроло[2,3-b]пиразин-6-ил)фенил]пропан-2-ол (соединение 1). К охлажденному (~5°C) раствору хлорида метилмагния (3M в THF; 81,3 мл, 244 ммоль, 10 эквив.) в тетрагидрофуране (116 мл) добавляли раствор соединения 4 (6,5 г, 24,4 ммоль) в тетрагидрофуране (348 мл) пипеткой в течение 90 минут, поддерживая температуру около 0°C по мере добавления раствора. В процессе добавления наблюдалось образование ярко-желтого раствора. По истечении одного часа ТСХ (этилацетат/n-гептан 1/1) не показывала присутствия исходного материала, и новая точка перемещалась при более низком Rf. Партию погасили путем осторожного добавления насыщенного водного раствора бикарбоната натрия (около 660 мл). К полученной густой массе добавили этилацетат (250 мл) и воду (250 мл). Водную фазу удаляли и реэкстрагировали этилацетатом (2×250 мл). Фракции этилацетата объединили, промыли водой (2×200 мл) и сконцентрировали на приборе Bbchi при температуре бани 40°C и при давлении от 80 до 10 Торр для получения 7,5 г (109%) 1 в виде твердого ве