9,10-секопрегнановое производное и фармацевтические средства
Иллюстрации
Показать всеИзобретение описывает новое полезное производное витамина D3, которое имеет отличную активность витамина D3 и по сравнению с обычными производными витамина D3 имеет относительно небольшое воздействие на системный метаболизм кальция. Изобретение включает 9,10-секопрегнановое производное следующей общей формулы [1] и фармацевтическую композицию, содержащую его в качестве активного ингредиента.
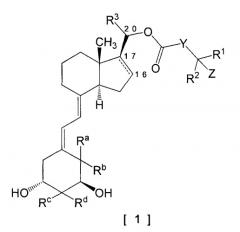
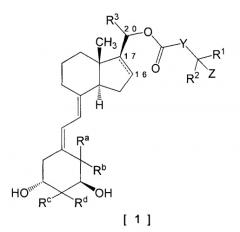
[Формула 1]
В общей формуле [1] следующая часть структуры между 16-положением и 17-положением означает простую связь или двойную связь: Y представляет собой простую связь, алкилен, алкенилен или фенилен; R1 и R2 являются одинаковыми или различными, каждый представляет собой водород, алкил или циклоалкил; или R1 и R2, взятые вместе со смежным атомом углерода, образуют циклоалкил; R3 представляет собой водород или метил; Z представляет собой водород, гидрокси или -NR11R12, где R11 и R12 имеют значения, указанные в формуле изобретения. 8 н. и 6 з.п. ф-лы, 8 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к 9,10-секопрегнановому производному (производному витамина D3) и фармацевтической композиции, содержащей его в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Псориаз, ихтиозный синдром, кератоз ладони и подошвы, гнойничковое высыпание ладони и подошвы, а также волосяной лишай являются дискератозами в широком смысле, демонстрирующими различные характерные кожные симптомы, такие как эритема, мокнутье, гипертрофия, кератинизация и ороговение. Это заболевание является трудноизлечимой хронической болезнью и вызывает значительные ограничения комфортности повседневной жизни пациентов. В соответствии с его патологической первопричиной данное заболевание, как предполагают, основано на нарушении роста и дифференцировки как клеток воспаления, так и клеток кожи.
Псориаз, который является характерным заболеванием с дискератозом, не представляет собой фатальную болезнь, но является малоизученным и сопровождается предубеждением в отношении его появления, а также душевным страданием. Поэтому в большинстве случаев качество жизни (QOL) значительно нарушается.
Большинство терапевтических способов применялось к вышеупомянутому кератозу, такому как псориаз. Однако не существует радикального лечения, проводилась симптоматическая терапия и уход в течение более длительного периода времени. В качестве основного способа лечения широко приняты наружные аппликации из адренокортикостероидных агентов с достижением отличного терапевтического эффекта. Тем не менее существует также серьезное побочное действие и индукция кожной атрофии и эффект рикошета кожных проявлений, которые, в частности, рассматриваются как проблема.
В последние годы широко используют местное применение производных витамина D3, имеющих скелет 9,10-секопрегнана. По сравнению со стероидами этот пригодный для местного применения агент обладает меньшими побочными действиями и обладает эффектом продления безрецидивного периода (см., например, Непатентную Ссылку 1). Предполагают, что производное витамина D3 эффективно при кератозе, включая псориаз, за счет подавляющего действия на рост эпидермальных клеток (см., например, Непатентные Ссылки 2 и 3), стимулирующего действия на дифференцировку эпидермальных клеток (см., например, Непатентные Ссылки 4 и 6), подавляющего действия на продуцирование цитокинов и подавляющего действия на активацию Т-клеток (см., например, Непатентную Ссылку 7) и т.п.
Что касается производного витамина D3, имеющего скелет 9,10-секопрегнана, то, например, известны различные производные, такие как (1S,3R,20S)-20-(3-гидрокси-3-метилбутилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол (международное непатентованное название: Максакальцитол) (его способ синтеза и фармакологическое действие упомянуты, например, в Непатентных Ссылках 8-10), соединения, упомянутые в Патентной Ссылке 2 или Непатентной Ссылке 11, и т.п.
С другой стороны, хорошо известно, что 1α,25(OH)2D3, который является активной формой витамина D, повышает уровень концентрации кальция в сыворотке вместе с уровнем паратиреоидного гормона в сыворотке, посредством которого гомеостаз кальция поддерживается и контролируется. Наиболее тревожные побочные действия производных витамина D3, которые клинически выявляются в настоящее время: сухость во рту, дискомфорт, вялость, анорексия, рвота, боль в животе и мышечная слабость в результате повышения концентрации кальция в сыворотке (гиперкальциемия). Соответственно существует необходимость в периодическом измерении концентрации кальция в крови не только в случае, когда введение производится пациентам, страдающим от гиперкальциемии, но также пациентам, которые не страдают от данного заболевания. Существует также ограничение в его дозе (см., например, Непатентные Ссылки 12 и 13).
Следовательно, существует актуальная потребность в производном витамина D3, которое по сравнению с традиционными производными витамина D3 обладает относительно малым влиянием на системный метаболизм кальция и способно специфически ослаблять дискератоз эпидермальных клеток в качестве терапевтического агента при кератозе, таком как псориаз.
Патентная Ссылка 1: EP-A 0184112
Патентная Ссылка 2: Japanese Patent 2908566
Патентная Ссылка 3: US 6296997
Патентная Ссылка 4: US 5612325
Патентная Ссылка 5: US Application 2004-0019023
Патентная Ссылка 6: JP-A-Hei-10-231284
Непатентная Ссылка 1: Kobayashi J., et al., Nishinihon-hihuka, 60, 882 (1998)
Непатентная Ссылка 2: Kondo S., et al., Arch. Dermatol. Res., 292, 550 (2000)
Непатентная Ссылка 3: Kobayashi T., et al., J. Eur. Acad. Dermatol. Venereol., 5, 132 (1995)
Непатентная Ссылка 4: Kragballe K., et al., Arch. Dermatol. Res., 282, 164 (1990)
Непатентная Ссылка 5: Matunaga T., et al., J. Dermatol., 17, 135 (1990)
Непатентная Ссылка 6: Takahashi H., et al., J. Dermatol. Sci., 31, 21 (2003)
Непатентная Ссылка 7: Komine M., et al., Arch. Dermatol.
Res., 291, 500 (1999)
Непатентная Ссылка 8: Chem. Pharm. Bull., 39(12), 3221-3224 (1991)
Непатентная Ссылка 9: Chem. Pharm. Bull., 40(6), 1494-1499 (1992)
Непатентная Ссылка 10: Chem. Pharm. Bull., 44(12), 2280-2286 (1996)
Непатентная Ссылка 11: Steroids, 59, 686 (1994)
Непатентная Ссылка 12: Mizutani J., Iyaku Journal, 39, 122 (2003)
Непатентная Ссылка 13: Nakagawa H., Iyaku Journal, 39, 93 (2003)
Непатентная Ссылка 14: Bull. Chem. Soc. Jpn., 52(7), 1989-1993 (1979)
Непатентная Ссылка 15: Chem. Pharm. Bull., 44, 2280 (1996)
Непатентная Ссылка 16: Bioorg. Med. Chem. Lett., 2, 1713 (1992)
Непатентная Ссылка 17: Tetrahedron Lett., 45, 7837 (2004)
Непатентная Ссылка 18: J. Chem. Soc, 115, 1207 (1919)
Непатентная Ссылка 19: J. of Pharmacology и Experimental Therapeutics, 305, 675 (2003)
Непатентная Ссылка 20: J. Chem. Soc. Perkin Trans. 1, 7, 1951 (1990)
Непатентная Ссылка 21: Bull. Chem. Soc. Jpn, 67, 293 (1994)
Непатентная Ссылка 22: J. Org. Chem., 33, 1839 (1968)
Непатентная Ссылка 23: Chem. Pharm. Bull., 34(10), 4410-4413 (1986)
Непатентная Ссылка 24: J. Nutr. Sci. Vitaminol., 26, 545-556 (1980)
Непатентная Ссылка 25: J. Org. Chem., 66(23), 7832-7840 (2001)
Непатентная Ссылка 26: Tetrahedron, 42(11), 2931-2935 (1986)
Непатентная Ссылка 27: Tetrahedron Lett., 33, 41; 6193-6196 (1992)
Непатентная Ссылка 28: Synthesis, 134-135 (1983)
Непатентная Ссылка 29: J. Org. Chem., 68(1), 27-34 (2003)
Непатентная Ссылка 30: Yakugaku Zasshi, 72, 1172 (1952)
Непатентная Ссылка 31: J. Med. Chem., 31(2), 428-32 (1988)
Непатентная Ссылка 32: J. Chem. Soc, 115, 1207 (1919)
Непатентная Ссылка 33: J. Am. Chem. Soc, 80, 4969-4971 (1958)
Непатентная Ссылка 34: Tetrahedron., 42, 11, 2931-2935 (1986)
Непатентная Ссылка 35: Tetrahedron., 42, 11, 2931-2935 (1986)
Непатентная Ссылка 36: Synthesis, 7, 1009-1014 (1998)
Непатентная Ссылка 37: Tetrahedron Lett., 28(15), 1685-1688 (1987)
Непатентная Ссылка 38: J. Chem. Soc, 503-506 (1946)
Непатентная Ссылка 39: Tetrahedron Lett., 2749-2752 (1976)
Непатентная Ссылка 40: Archiv der Phamazie, 316, 339-346 (1983)
Непатентная Ссылка 41: J. Med. Chem., 11, 138-140 (1968)
Непатентная Ссылка 42: J. Med. Chem., 43, 1508-1518 (2000)
Непатентная Ссылка 43: J. Gen. Chem. USSR (Engl. Transl.), 32, 786-788 (1962)
Непатентная Ссылка 44: J. Org. Chem., 52, 4798-4800 (1987)
Непатентная Ссылка 45: Tetrahedron Lett., 42, 1029-1032 (2001)
Непатентная Ссылка 46: J. Am. Chem. Soc, 111, 393-395 (1989)
Непатентная Ссылка 47: J. Org. Chem., 68, 1367-1375 (2003)
Непатентная Ссылка 48: Tetrahedron Lett., 32, 7663 (1991)
Непатентная Ссылка 49: J. Med. Chem., 4662-4674 (1998)
Непатентная Ссылка 50: J. Org. Chem., 51,3098-3108 (1986)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, КОТОРЫЕ СТОЯТ ПЕРЕД ИЗОБРЕТЕНИЕМ
Основной задачей изобретения является представление нового и полезного производного витамина D3, которое имеет отличную активность витамина D3 и которое по сравнению с обычными производными витамина D3 имеет относительно небольшое воздействие на системный метаболизм кальция.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧ
Были проведены различные интенсивные исследования и найдено, что новое 9,10-секопрегнановое производное, которое будет упомянуто ниже, или его фармацевтически приемлемая соль, достигает решений поставленной задачи.
Изобретение может включать 9,10-секопрегнановое производное, представленное следующей общей формулой [1] (в дальнейшем именуемое как соединение по изобретению), или его фармацевтически приемлемую соль. Характерным признаком соединения по изобретению с точки зрения его структуры является то, что карбонилоксигруппа непосредственно связана с атомом углерода по 20-положению, а не через находящуюся между алкиленовую цепь.
[Формула 1]
В общей формуле [1]
следующая часть структуры между 16-положением и 17-положением означает простую связь или двойную связь:
[Формула 2]
Y представляет собой (1) простую связь, (2) алкилен, имеющий от 1 до 5 атомов углерода, и необязательно замещенный от 1 до 3 заместителями, выбранными из группы галогена, гидрокси и оксо, (3) алкенилен, имеющий от 2 до 5 атомов углерода или (4) фенилен;
R1 и R2 являются одинаковыми или различными, каждый представляет собой (1) водород, (2) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный от 1 до 3 атомами галогена или (3) циклоалкил, имеющий от 3 до 8 атомов углерода; или R1 и R2, взятые вместе со смежным атомом углерода, образует циклоалкил, имеющий от 3 до 8 атомов углерода;
R3 представляет собой водород или метил;
Z представляет собой водород, гидрокси или -NR11R12; R11 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R12 представляет собой (1) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный гидрокси или (2) алкилсульфонил, имеющий от 1 до 6 атомов углерода;
Ra и Rb оба представляют собой атомы водорода, или Ra и Rb, взятые вместе, образуют метилен;
Rc и Rd являются одинаковыми или различными, каждый представляет собой водород или метил, или Rc и Rd, взятые вместе, образуют метилен.
Однако соединения, где (1) Ra и Rb, взятые вместе, образуют метилен, (2) Rc и Rd представляют собой атомы водорода и (3) частичная структура между 16-положением и 17-положением представляет собой простую связь, исключены.
Изобретение также включает фармацевтическую композицию, содержащую соединение по изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента, или терапевтический агент для лечения дискератоза, включая псориаз, который содержит соединение по изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента.
Из соединений по изобретению, например, предпочтительными являются следующие соединения с (1) по (35):
(1) (1S,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(2) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(3) (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(4) (1R,3R,20S)-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(5) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(6) (1R,3R,20S)-2-метилен-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(7) (1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(8) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(9) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(10) (1R,3R,20S)-19-нор-2-метилен-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(11) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(12) (1R,2α,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(13) (1R,2β,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(14) (1R,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(15) (1R,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(16) (1R,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(17) (1R,3R,20S)-19-нор-2-метилен-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(18) (1R,3R,20S)-19-нор-2-метилен-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(19) (1R,3R,20S)-2-метилен-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(20) (1R,2α,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(21) (1R,2β,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(22) (1R,2α,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(23) (1R,2β,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(24) (1R,2α,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(25) (1R,2β,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(26) (1R,2α,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(27) (1R,2β,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(28) (1R,2α,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(29) (1R,2β,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(30) (1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(31) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(32) (1S,3R,20S)-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(33) (1S,3R,20S)-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(34) (1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(35) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол.
Изобретение также включает следующее соединение с (1) по (5) или его фармацевтически приемлемую соль, фармацевтическую композицию, содержащую следующее соединение с (1) по (5), или его фармацевтически приемлемую соль в качестве активного ингредиента, или терапевтический агент для лечения дискератоза, включая псориаз, который содержит следующее соединение с (1) по (5) или его фармацевтически приемлемую соль в качестве активного ингредиента.
(1) (1S,3R,20S)-20-(5-гидрокси-5-этилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(2) (1S,3R,20S)-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(3) (1S,3R,20S)-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(4) (1S,3R,20S)-20-(6,6,6-трифтор-5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(5) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метил-3-оксопентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол.
Изобретение описано подробно ниже.
Термин "галоген" в изобретении включает, например, фтор, хлор, бром, иод.
Термин "алкилен" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 1 до 5 атомов углерода, включая, например, метилен, этилен, триметилен, метилэтилен, тетраметилен, метилтриметилен, этилэтилен, пентаметилен, метилтетраметилен, этилтриметилен. В особенности предпочтительным является линейный алкилен, имеющий от 1 до 3 атомов углерода. Алкилен в изобретении может быть замещен от 1 до 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси и оксо.
Термин "алкенилен" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 2 до 5 атомов углерода. Например, он включает этенилен, пропенилен, бутилен, пентенилен. В особенности предпочтительным является линейный алкенилен, имеющий от 2 до 4 атомов углерода.
Термин "фенилен" в изобретении включает, например, 1,2-фенилен, 1,3-фенилен, 1,4-фенилен.
Термин "алкил" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 1 до 6 атомов углерода, включая, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил. В особенности предпочтительными являются метил и этил. Алкил в изобретении может быть замещен от 1 до 3 атомами галогена.
Термин "циклоалкил" в изобретении имеет значение, например, моно-трициклического алкила, имеющего от 3 до 8 атомов углерода, в особенности включая циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодеканил, адамантил (1-адамантил, 2-адамантил и так далее), 2-бицикло[3.1.1]гептил и 2-бицикло[2.2.1]гептил. В особенности, предпочтительным является монотрициклический алкил, имеющий от 4 до 6 атомов углерода.
Если конкретно не определено, защитная группа для "гидрокси" в изобретении может быть любой гидроксизащитной группой, используемой в реакции, включая, например, 1) триалкилсилил, такой как триэтилсилил, трибутилсилил, трет-бутилдиметисилил, и так далее; 2) (2-триметилсилил)этоксиметил, 3) арилметил, такой как бензил, 4-метоксифенилметил, и так далее; 4) ацил, такой как ацетил, и так далее; и 5) 2-тетрагидропиранил.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Соединение по изобретению может быть получено из известного соединения или из легко синтезируемого промежуточного соединения, например, в соответствии со способом, упомянутым ниже. При получении соединения по изобретению, в случае, когда исходный продукт имеет заместитель, имеющий влияние на ход реакции, как правило, исходный продукт предварительно защищают подходящей защитной группой в соответствии с известным способом и затем проводят реакцию. Защитная группа может быть удалена после реакции в соответствии с известным способом.
[Формула 3]
[В формуле Y, Z, R1, R2, R3, Ra, Rb, Rc и Rd имеют те же самые значения, как указано выше. Y1 представляет собой (1) простую связь, (2) алкилен, имеющий от 1 до 5 атомов углерода, и необязательно замещенный от 1 до 3 заместителями, выбранными из группы, состоящей из галогена, защищенной гидроксигруппы и оксо, (3) алкенилен, имеющий от 1 до 5 атомов углерода, или (4) фенилен. R5 и R6 каждый представляет собой защитную группу для гидрокси. Z1, Z2 и Z3 являются одинаковыми или различными, каждый представляет собой галоген, нитро или циано. Z4 представляет собой (1) водород, (2) защищенную гидроксигруппу или (3)-NR13R14. R13 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R14 представляет собой (1) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный защищенной гидроксигруппой или (2) алкилсульфонил, имеющий от 1 до 6 атомов углерода.]
Указанная реакция представляет собой конденсацию соединения (спирт) общей формулы [2] и соединения (карбоновая кислота) общей формулы [3] с последующим снятием защиты, и поэтому она может быть осуществлена в соответствии со способом per se как конденсация и снятие защиты. Например, указанный выше спирт взаимодействует с указанной выше карбоновой кислотой с последующим снятием защиты, что, таким образом, приводит к получению соединения по изобретению.
Первая Стадия (конденсация)
Указанная стадия предназначена для конденсации спирта [2] и карбоновой кислоты [3] при температуре реакции в интервале от -20 до 100ºC в присутствии или отсутствии основания (например, органического основания, такого как триэтиламин, N,N-диизопропил-N-этиламин, N,N-диэтиланилин, пиридин, 4-диметиламинопиридин и 1,8-диазабицикло[5,4.0]ундец-7-ен), используя конденсирующий агент (например, 1,1'-оксалилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, диэтилцианофосфонат, дифенилфосфорилазид и иодид 2-хлор-1-метилпиридиния). Применим, если конкретно не определено, любой растворитель, не участвующий в реакции, включая, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и так далее; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и так далее; нитрилы, такие как ацетонитрил, пропионитрил, и так далее; углеводороды, такие как бензол, толуол, и так далее; галогенуглеводороды, такие как хлороформ, дихлорметан, и так далее; или смешанные растворители. В указанной стадии может быть введена добавка (например, 1-гидроксибензотриазол, N-гидроксисукцинимид, и так далее).
Время реакции меняется в зависимости от типа исходных продуктов и агентов конденсации, температуры реакции и других условий, но в общем оно является подходящим в интервале от 30 минут до 24 часов. Количество указанной выше карбоновой кислоты [3] и соответствующего конденсирующего агента предпочтительно находится в интервале от 1 до 3 молярных единиц относительно спирта [2].
Вместо указанной выше карбоновой кислоты [3] для использования на указанной стадии также применимо ее реакционоспособное производное. Реакционоспособное производное включает такое, которое, как правило, используют при эфирообразующей конденсации, например, галогенангидриды кислоты (например, хлорангидриды и бромангидриды кислоты), смешанные ангидриды кислоты, имидазолиды, активные амиды, и так далее. Когда используют реакционноспособное производное в реакции, указанный выше конденсирующий агент может быть исключен.
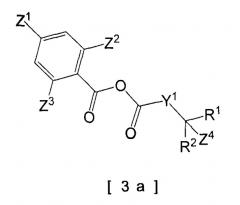
Например, в случае, когда используют смешанный ангидрид кислоты в качестве реакционоспособного производного карбоновой кислоты [3], используют пиридиновый растворитель, такой как пиридин, 4-метилпиридин или им подобные, или одно и то же основание и растворитель, как указано выше, и конденсация может быть осуществлена при температуре реакции в интервале от -20 до 100ºC. В качестве добавки может быть введен, например, 4-диметиламинопиридин. Время реакции меняется в зависимости от используемого типа смешанного ангидрида кислоты и температуры реакции, но в общем оно является подходящим в интервале от 30 минут до 24 часов. На стадии использования смешанного ангидрида кислоты смешанный ангидрид кислоты предпочтительно представляет собой смешанный ангидрид кислоты следующей общей формулы [3а] (например, ссылаясь на Непатентную Ссылку 14).
[Формула 4]
[В формуле Y1, R1, R2, Z1, Z2, Z3 и Z4 имеют те же самые значения, как указано выше.]
R5 и R6 конкретно не определены и могут быть любой гидроксизащитной группой, используемой в реакции. Например, они включают упомянутые выше защитные группы.
Исходное соединение общей формулы [2] может быть получено в соответствии с известным способом (например, ссылаясь на Патентную Ссылку 5 и Непатентные Ссылки с 15 по 17) или аналогичным способом или в соответствии со способом, описанным в Примерах, приведенных ниже.
Исходное соединение общей формулы [3] может быть получено, например, в соответствии с тем же самым способом, как в приведенных Непатентных Ссылках с 18 по 22, или в соответствии со способом, аналогичным способу, описанному в Патентной Ссылке 4 или Непатентных Ссылках с 26 по 41.
Вторая Стадия (снятие защиты)
Указанная стадия представляет собой снятие защиты с гидроксигруппы и может быть осуществлена, как таковая, в соответствии с обычным способом. Конкретно, поскольку варьирование находится в зависимости от типа используемой защитной группы, когда используют трет-бутилдиметилсилил в качестве защитной группы, его можно снять в соответствии с методикой, упомянутой ниже.
Для снятие защиты с соединения общей формулы [4] может быть использован агент снятия защиты (например, фторид тетрабутиламмония, фтористый водород, фтористый водород-пиридин, уксусная кислота и трифторуксусная кислота) и снятие защиты может быть осуществлено при температуре реакции в интервале от от -20 до 100ºC. Может быть использован, если конкретно не определено, любой растворитель, не участвующий в реакции, включая, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, и так далее; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и так далее; нитрилы, такие как ацетонитрил, пропионитрил, и так далее; углеводороды, такие как бензол, толуол, и так далее; галогенуглеводороды, такие как хлороформ, дихлорметан, и так далее; или смешанные растворители. Время реакции меняется в зависимости от типа исходного продукт и агента снятия защиты, но в общем оно является подходящим в интервале от 30 минут до 24 часов. Количество используемого агента снятия защиты предпочтительно составляет от 1 до 100 молярных единиц относительно соединения общей формулы [4].
Соединение по изобретению включает соединения, которые имеют асимметричный атом углерода, и изобретение включает не только его оптически активные соединения, но также его рацемические соединения. Для получения таких оптически активных соединений применимым является обычный способ разделения с помощью хиральной колонки; однако они могут также быть получены через асимметричный синтез из исходного соединения [2] (например, они могут быть получены в соответствии с методикой, аналогичной методике асимметричного получения, представленной в Непатентных Ссылках 15 и 16).
В случае, когда соединение по изобретению включает геометрические изомеры или таутомеры, не только любой один из них изомер, но также их смеси входят в объем соединений по изобретению.
Соединение по изобретению может быть использовано в качестве фармацевтического средства непосредственно как оно есть в виде свободного основания, но может быть использовано после перевода в фармацевтически приемлемую соль в соответствии с известным способом. Соль включает соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, и так далее; или соли с органической кислотой, такой как уксусная кислота, лимонная кислота, винная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, и так далее.
Например, гидрохлориды соединения по изобретению могут быть получены путем растворения соединения по изобретению в спиртовом растворе, этилацетном растворе или эфирном растворе хлористого водорода.
Соединение по изобретению является полезным в качестве его фармацевтического средства, как показано в Тестовых Примерах, приведенных ниже, и в особенности является полезным в качестве терапевтического агента для лечения дискератоза, включая псориаз.
В случае, когда соединение по изобретению вводят в качестве его фармацевтического средства, соединение по изобретению может быть введено млекопитающим, включая людей, непосредственно как таковое или в форме фармацевтической композиции, содержащей его в фармацевтически приемлемом и нетоксичном инертном носителе в количестве, например, от 0,0001 до 99,5%, предпочтительно от 0,001 до 90%.
Носителем может быть, по крайней мере, один из твердых, полутвердых или жидких разбавителей, наполнителей и других вспомогательных средств для составления композиций. Фармацевтическую композицию предпочтительно вводят в виде единичной дозы. Способ введения для фармацевтической композиции по изобретению конкретно не определен; но нельзя не сказать о том, что композицию вводят в виде препаративной формы, пригодной для применяемого способа введения. Предпочтительным является местное введение (трансдермальное введение, и так далее).
Дозу терапевтического агента для лечения дискератоза, включая псориаз, предпочтительно определяют с учетом особенности и степени заболевания, состояний пациента, таких как возраст, масса тела и других таких условий и способа введения. В общем, доза, как правило, составляет от 0,01 до 1000 мг/человек/в день, предпочтительно от 0,1 до 500 мг/человек/в день как эффективное количество соединения по изобретению для взрослых пациентов.
Возможно, что доза может быть ниже, чем упомянутая выше, или, напротив, может быть необходима большая доза, чем упомянутая выше. Доза может быть разделена на 2-5 порций, которые могут вводиться в разное время в течение дня.
ПРИМЕРЫ
Изобретение описано более подробно со ссылкой на следующие Ссылочные Примеры, Примеры, Тестовые Примеры и Примеры Композиций, которыми, тем не менее, изобретение не должно быть ограничено.
Ссылочный Пример 1:
3-(трет-бутилдиметилсилилокси)-3-метилмасляная кислота
Стадия 1:
4-Диметиламинопиридин (0,78 г) добавляют к безводному хлористометиленовому раствору 3-гидрокси-3-метилмасляной кислоты (3,76 г) и бензилового спирта (4,13 г) и перемешивают при охлаждении льдом. К полученной реакционной массе добавляют N,N'-дициклогексилкарбодиимид (9,9 г), затем баню со льдом удаляют и реакционную массу перемешивают в течение ночи при комнатной температуре. Высаженное нерастворимое вещество удаляют фильтрованием и маточный раствор концентрируют, что дает остаточное масло (13 г). Его очищают с помощью хроматографии на колонке с силикагелем, что дает бензил-3-гидрокси-3-этилбутират (7,2 г) в виде масла бледно-желтого цвета.
1H-ЯМР (CDCl3) δ: 1,28 (6H, с), 2,55 (2H, с), 5,16 (2H, с), 7,36 (5H, с).
Стадия 2:
2,6-Лутидин (3,6 г) добавляют к безводному хлористометиленовому раствору бензил-3-гидрокси-3-метилбутирата (3,5 г), полученному на стадии 1, и перемешивают при охлаждении льдом. Постепенно к полученной реакционной массе добавляют по каплям трет-бутилдиметилсилилтрифторметансульфонат (3,9 мл) и перемешивают в течение часа при охлаждении льдом и затем в течение 2 часов при комнатной температуре. Реакционную жидкость разбавляют этилацетатом, затем промывают водой, насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом магния и концентрируют. 4,5 г остатка очищают с помощью хроматографии на колонке с силикагелем, что дает бензил-3-(трет-бутилдиметилсилилокси)-3-метилбутират (2,62 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,07 (6H, с), 0,82 (9H, с), 1,36 (6H, с), 2,52 (2H, с), 5,09 (2H, с), 7,35 (5H, с).
Стадия 3:
Бензил-3-(трет-бутилдиметилсилилокси)-3-метилбутират (2,37 г), полученный на стадии 2, растворяют в этилацетате (30 мл) и к полученной реакционной массе добавляют 10% палладий на угле (0,47 г) для гидрогенизации с помощью H2 при атмосферном давлении. Через 40 минут перемешивание прекращают и катализатор удаляют фильтрованием. Маточную жидкость упаривают при пониженном давлении, что дает названное в заголовке соединение (1,70 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,18 (6H, с), 0,89 (9H, с), 1,40 (6H, с), 2,51 (2H, с).
Ссылочный Пример 2:
(1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ол
Через тетрагидрофурановый раствор (500 мл) (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-прегна-5,7-диен-20-ола (155 мг) (способ его получения, например, описан в Непатентной Ссылке 23) барботируют аргон при охлаждении льдом в течение 10 минут. Затем в реакционную баню помещают ртутную лампу высокого давления мощностью 500-ватт, при этом охлаждающийся слой циркулирует с раствором фильтрата никель сульфата-сульфата меди (это раскрыто, например, в Непатентной Ссылке 24) и облучение осуществляют в течение 5 минут при охлаждении льдом. Дополнительно реакционную жидкость после этого облучают в течение 2,5 минут и затем переносят в колбу коричневого цвета и нагревают при температуре кипения с обратным холодильником в течение 3 часов. Растворитель упаривают при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем и препаративной тонкослойной хроматографии, что дает названное в заголовке соединение (30 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,54 (3H, с), 0,88 (18H, с), 1,23 (3H, д), 2,45 (1H, дд), 2,84 (1H, дд), 3,71 (2H, м), 4,19 (1H, м), 4,38 (1H, дд), 4,86 (1H, д), 5,18 (1H, с), 6,03 (1H, д), 6,23 (1H, д).
Пример 1:
(1S,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
2,4,6-Трихлорбензоилхлорид (13 мкл) добавляют к тетрагидрофурановому раствору (0,5 мл) 4-триэтилсилилокси-4-метилпентановой кислоты (20 мг), полученной в соответствии со способом, описанным в Непатентной Ссылке 25, и триэтиламину (11,2 мкл) и затем перемешивают при комнатной температуре в течение 30 минут. После отделения кристаллического продукта фильтрованием тетрагидрофуран упаривают и остаток сушат при пониженном давлении. Добавляют безводный бензольный раствор (0,5 мл) (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола (30 мг), полученный в соответствии с Ссылочным Примером 2, и 4-диметиламинопиридин (30 мг) к остатку в атмосфере газа аргона и затем перемешивают при комнатной температуре в течение 30 минут. Реакционную жидкость разбавляют этилацетатом, затем промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом в указанном порядке, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен (27 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,54 (3H, с), 0,57 (6H, кв), 0,87 (18H, с), 0,94 (9H, т), 1,20 (6H, с), 2,36 (2H, т), 2,84 (1H, д), 4,19 (1H, м), 4,37 (1H, дд), 4,85 (1H, д), 4,94 (1H, м), 5,17 (1H, д), 6,02 (1H, д), 6,23 (1H, д).
Стадия 2:
Реагент, полученный путем добавления уксусной кислоты (16 мкл) к 1 M раствору фторида тетра(н-бутил)аммония (0,56 мл), добавляют к безводному тетрагидрофурановому раствору (1 мл) (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена (22 мг), полученному на стадии 1, в атмосфере аргона и затем перемешивают в течение ночи при комнатной температуре. К реакционной жидкости добавляют холодную воду и затем ее подвергают экстракции этилацетатом. Этилацетатный слой промывают насыщенным рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и препаративной тонкослойной хроматографии, что дает названное в заголовке соединение (7,1 мг) по изобретению в виде бесцветного порошка.
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,23 (6H, с), 1,23 (3H, д), 1,80 (2H, т), 2,39 (2H, т), 2,60 (1H, дд), 2,83 (1H, м), 4,24 (1H, м), 4,43 (1H, дд), 4,95 (1H, м), 4,99 (1H, дд), 5,33 (1H, ушир.), 6,02 (1H, д), 6,37 (1H, д).
(+) -FABMS m/z 447 [M+H]+
Пример 2:
(1S,3R,20S)-20-(3-гидрокси-3-метилбутаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-3-метилмасляную кислоту (Ссылочный Пример 1) вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,08 (6H, с), 0,53 (3H, с), 0,84 (9H, с), 0,87 (18H, с), 1,23 (3H, д), 1,40 (3H, с), 1,36 (3H, с), 2,43 (2H, ушир.с), 2,84 (1H, д), 4,18 (1H, м), 4,36 (1H, дд), 4,85 (1H, д), 4,91 (1H, м), 5,17 (1H, д), 6,02 (1H, д), 6,23 (1H, д).
Стадия 2:
В соответствии со способом, аналогичным способу, представленному на стадии 2 в Примере 1, но используя (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученному на стадии 1, вместо (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена получают указанное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,56 (3H, с), 1,26 (3H, д), 1,27 (6H, с), 2,32 (1H, дд), 2,44 (2H, с), 2,60 (1H, дд), 2,84 (1H, м), 3,74 (1H, ушир.), 4,24 (1H, м), 4,43 (1H, дд), 4,99 (1H, с), 5,01 (1H, м), 5,33 (1H, с), 6,03 (1H, д), 6,37 (1H, д).
ESIMS m/z 455 [M+Na]+
Пример 3:
(1S,3R,20S)-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 5-триэтилсилилокси-5-метилгексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 26, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 483,5 [M+Na]+
Пример 4:
(1S,3R,20S)-20-(4,4,4-трифтор-3-гидрокси-3-метилбутаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу,