Кристаллизация антител или их фрагментов
Иллюстрации
Показать всеНастоящее изобретение относится к способам кристаллизации и/или концентрирования антитела или фрагментов антител. Сущность способа заключается в том, что проводят контактирование антитела анти-VEGR или его фрагмента с раствором, включающим ZnCl2 либо MgCl2, и проводят инкубацию полученного раствора до образования кристаллов. Использование способа позволяет получать кристаллы анти-VEGR антитела или его фрагмента без добавления органических или полимерных осадителей. 16 з.п. ф-лы, 7 ил., 16 табл., 7 пр.
Реферат
Перекрестная ссылка к родственным заявкам
По настоящей заявке испрашивается приоритет заявки США № 60/590707, поданной 23 июля 2004 г. на основании 35 U.S.C.§ 119 (e), причем заявка приведена в настоящем описании в качестве ссылки.
Предшествующий уровень техники
Моноклональные антитела становятся высокоэффективными терапевтическими агентами для лечения ряда заболеваний и состояний, включая, но не ограничиваясь ими, рак, респираторные заболевания, воспалительные заболевания и инфекционные заболевания. Как правило, для лечебных мероприятий, в которых используют антитела, требуется доставка от 100 мг до 1 г антитела на дозу. Обычно применяемым подходом для таких курсов лечения является применение внутривенных инфузий от примерно 2 до 20 мл 50 мг/мл раствора антитела. Так как желательно создание способов, отличных от внутривенного введения, таких как подкожная инъекция, более концентрированные растворы могли бы иметь некоторые преимущества. Однако применение концентрированных растворов антител может быть проблематичным из-за, включая, но не ограничиваясь ими, высоковязких растворов, белковой агрегации и трудностей со стабильностью растворов.
Например, для применения в рентгеновской кристаллографии были кристаллизованы фрагменты антител. В ранее описанных способах кристаллизации моноклональных антител обычно применяли методику на основе диффузии паром. Недостатки этой методики включают незначительное количество кристаллов, которое продуцируется, и применение агентов, которые в некоторых случаях являются неприемлемыми для применения у людей. Способы периодического процесса также могут быть использованы для получения не слишком большого количества кристаллов. Обычно используемые способы периодического процесса, как правило, используют органические или полимерные осадители. Протоколы, в которых применяют органические осадители для кристаллизации антител, были описаны. Yang с сотр., PNAS, vol. 100, No 12, pp. 6934-6939 (2003); Kuznetsov с сотр., J. Crystal Growth, vol. 232, pp. 30-39 (2001); Kuznetsov с сотр., J. Structural Biology, vol. 131, pp. 108-115 (2000); Harris с сотр., Immunological Reviews, vol. 163, pp. 35-43 (1998); Harris с сотр., J. Mol. Biol., vol. 275, pp. 861-872 (1998); и Harris с сотр., Proteins, vol. 23, pp. 285-89 (1995). Примеры обычно используемых органических или полимерных осадителей включают полиэтиленгликоль (PEG), изопропанол, Jeffamine® (Hunstman Petrochemical Corp., Salt Lake City, UT) и (+/-)-2-метил-2,4-пентандиол (MPD).
Так как многие антитела в настоящий момент обрабатывают в крупном масштабе для введения людям, желательно иметь способы образования кристаллов и/или концентрирования белковых гелей в большом масштабе, особенно тех, которые не включают органические или полимерные осадители. Кристаллы и/или гели применяют для хранения и терапевтического введения.
Сущность изобретения
Один из аспектов изобретения относится к способу получения кристаллов антитела или его фрагмента, который включает стадии контактирования антитела или его фрагмента с раствором, который включает примерно 1-500 миллимолей (мМ) соли двухвалентного катиона и примерно 1-100 мМ буфера, и инкубацию антитела или его фрагмента и раствора до образования кристаллов антитела или его фрагмента.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, который содержит примерно 1-120 мМ соли цинка; и инкубацию антитела или его фрагмента и раствора до формирования кристаллов и/или белкового геля антитела или его фрагмента. В некоторых вариантах осуществления инкубацию осуществляют при температуре окружающей среды. В некоторых вариантах осуществления температура составляет от примерно 20 до 27˚C. В других вариантах осуществления инкубацию осуществляют при температуре менее чем примерно 20˚C, предпочтительно от примерно 0˚C до 20˚C, более предпочтительно от примерно 0˚C до 10˚C.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, который состоит, в основном, из раствора соли цинка и буфера; и инкубацию антитела или его фрагмента и раствора до образования кристаллов и/или белкового геля антитела или его фрагмента.
Способ получения кристаллов антитела или его фрагмента включает контактирование антитела или его фрагмента с раствором, который включает соль цинка и не содержит другие осадители; и инкубацию антитела или его фрагмента и раствора до формирования кристаллов антитела или его фрагмента.
В некоторых вариантах осуществления двухвалентной солью является примерно 10-80 мМ, более предпочтительно 25 мМ-60 мМ хлорид цинка (ZnCl2). В других вариантах осуществления буфером является примерно 1-20 мМ NaOAc, более предпочтительно примерно 25-75 мМ ацетат натрия (NaOAc). В некоторых вариантах осуществления раствор включает более чем примерно 10 мМ ZnCl2 и более чем примерно 5 мМ NaOAc. Например, раствор включает примерно 100 мМ ZnCl2 и примерно мМ NaOAc. В других вариантах осуществления рН буфера составляет от примерно 4 до примерно 9, более предпочтительно от примерно 4,7 до 5,7.
Изобретение также относится к кристаллам антитела или его фрагмента, полученным способом, описанным в данном описании. Антитела могут быть поликлональным антителом, моноклональным антителом, химерным антителом, биспецифичным антителом, антителом человека или гуманизированным антителом.
Изобретение также относится к композиции, включающей кристалл или белковый гель антитела, выбранного из группы, состоящей из: анти-VEGF антитела, анти-CD20, анти-CD11a, анти-CD40, анти-Apo-2, анти-HER2, анти-IgE и их фрагментов и носителя. Предпочтительно антитела являются полноразмерными гликозилированными антителами.
Изобретение также относится к составу, который включает кристалл или белковый гель антитела, выбранного из группы, состоящей из: анти-VEGF, анти-Apo-2, анти-CD20, анти-CD11a, анти-CD40, анти-HER2, анти-Apo-2, анти-IgE и их фрагментов и, по меньшей мере, одного ингредиента.
Изобретение также относится к способу лечения состояния у млекопитающего, включающему введение млекопитающему эффективного количества одной из вышеупомянутых композиций или составов. Состояния включают те, которые ассоциированы с VEGF, CD20, CD11a, CD40, Apo-2 и HER2.
Также предлагается изделие, которое включает, по меньшей мере, одну из вышеупомянутых композиций или составов и контейнер.
Изобретение относится к способам, композициям и составам, используемым, inter alia, для концентрирования, очистки, хранения и доставки антител или их фрагментов.
Краткое описание чертежей
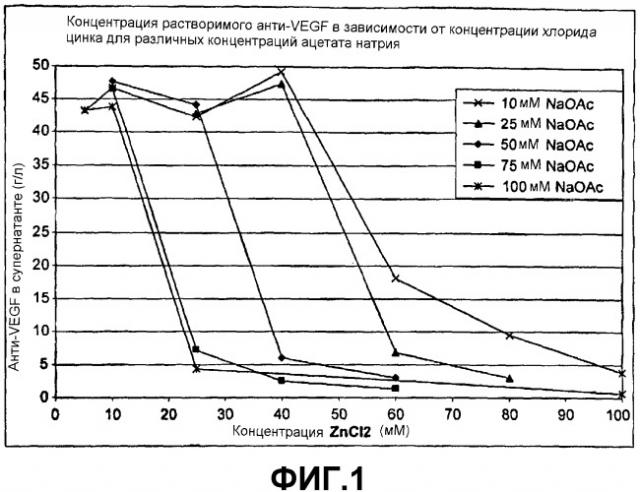
Фигура 1 представляет собой график, на котором показана растворимость анти-VEGF при изменяющихся концентрациях ZnCl2 и NaOAc, pH 5,7, комнатная температура. На графике показана концентрация растворимого анти-VEGF, построенная как функция концентрации ZnCl2 и концентраций NaOAc. Различные концентрации NaOAc показаны следующим образом: × 10 мМ NaOAc; ∆ 25 мМ NaOAc (белая линия); ♦ 50 мМ NaOAc; ■ 75 мМ NaOAc; * 100 мМ NaOAc.
Фигура 2a представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в присутствии 5 мМ ZnCl2 и 100 мМ NaOAc, pH 5,7 при отсутствии двойного лучепреломления света.
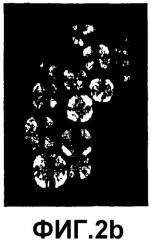
Фигура 2b представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в присутствии 5 мМ ZnCl2 и 100 мМ NaOAc, pH 5,7 при двойном лучепреломлении света.
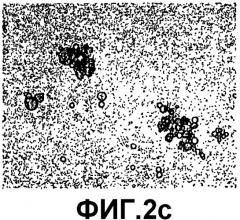
Фигура 2c представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в присутствии 25 мМ ZnCl2 и 10 мМ NaOAc, pH 5,7 при отсутствии двойного лучепреломления света.
Фигура 2d представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в присутствии 25 мМ ZnCl2 и 10 мМ NaOAc, pH 5,7 при двойном лучепреломлении света.
Фигура 2e представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в растворе 10 мМ ZnCl2 и 100 мМ NaOAc, pH 5,7 при отсутствии двойного лучепреломления света.
Фигура 2f представляет собой изображение при 200-кратном увеличении анти-VEGF кристаллов, сформированных в растворе 10 мМ ZnCl2 и 100 мМ NaOAc, pH 5,7 при двойном лучепреломлении света.
Фигура 3 показывает фазовую диаграмму статического состояния, генерированную путем построения концентрации ZnCl2 в зависимости от концентрации NaOAc. Следующие символы идентифицируют ♦ свободные кристаллы; ■ фазовые переходы; ∆ гелевые кристаллы (белые треугольники).
Фигура 4 показывает фазовую диаграмму смешанного состояния по сравнению со статическим состоянием. Символы представляют следующее: ◊ свободное смешивание; ♦ гелевое смешивание; --♦-- переходное смешивание; --■- - переходное статическое; □ свободное статическое и ■ гелевое статическое.
Фигура 5 показывает электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) анти-VEGF кристаллов, которые были выделены и ресолюбилизированы. Линия 1 представляет собой маркеры молекулярной массы; линия 2 представляет собой 5 мкг анти-VEGF; линия 3 пустая; линия 4 представляет собой супернатант; линия 5 представляет собой промывку 1, маточный раствор; линия 6 представляет собой промывку 2, маточный раствор; линия 7 представляет собой промывку 3, маточный раствор; линия 8 пустая; линия 9 представляет собой 1 мл кристалла (растворенного в воде); линия 10 представляет собой 5 мл кристалла (растворенного в воде); линия 11 представляет собой 10 мл кристалла (растворенного в воде); линия 12 представляет собой 15 мл кристалла (растворенного в воде); линия 13 представляет собой 20 мл кристалла (растворенного в воде).
Фигура 6 показывает добавление осадителей к режиму анти-VEGF кристаллизации - 10 мМ ZnCl2, 10 мМ NaOAc, pH 5,7. Количество растворимого анти-VEGF построили в зависимости от процентной (%) концентрации добавленного осадителя.
Фигура 7 показывает масс-спектрометрический анализ анти-VEGF исходного раствора (D), анти-VEGF кристаллических растворов (A, C) и промывного раствора от кристаллов (B). Укороченная легкая цепь анти-VEGF имеет массу примерно 23,499 Д.
Подробное описание предпочтительного варианта осуществления
Подробное описание
Определения
Термины «антитело» и «иммуноглобулин» применяют взаимозаменяемо в широком смысле и они включают моноклональные антитела (полноразмерные или интактные моноклональные антитела), поликлональные антитела, антительные композиции с полиэпитопной специфичностью, аффинно зрелые антитела, гуманизированные антитела, антитела человека, химерные антитела, гуманизированные, поливалентные антитела и мультиспецифичные антитела (например, биспецифичные антитела, поскольку они проявляют желаемую биологическую активность), а также антиген-связывающие фрагменты (например, Fab, F(ab')2, scFv и Fv), поскольку они проявляют желаемую биологическую активность.
Полноразмерное антитело включает четыре полипептидных цепи, две идентичные тяжелые (H) цепи и две идентичные легкие (L) цепи, связанные дисульфидными связями. Каждая тяжелая цепь включает вариабельную область домена (VH) тяжелой цепи и константную область тяжелой цепи. Константная область тяжелой цепи включает три домена, CH1, CH2 и CH3. Каждая легкая цепь включает вариабельную область домена (VL) легкой цепи и константную область домена легкой цепи. Константная область легкой цепи включает один домен CL. Домены VH и VL могут быть далее подразделены на комплементарные области (CDR) или гипервариабельные петли (HVL), вкрапленные в области, которые являются более консервативными, названные каркасными областями (FR). Каждый VH и VL обычно состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
В зависимости от аминокислотных последовательностей константных доменов этих тяжелых цепей антитела (иммуноглобулины) могут быть приписаны к различным классам. Существует пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть далее подразделены на подклассы (изотипы), например IgG-1, IgG-2, IgA-1, IgA-2 и т.п. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, названы α, δ, ε, γ и μ соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и, в целом, описаны, например, Abbas с сотр., Cellular and Mol. Immunology, 4th ed. (2000). Антитело может быть частью большой слитой молекулы, сформированной путем ковалентной или нековалентной связи антитела с одним или несколькими другими белками или пептидами.
Легкие цепи антител любых видов позвоночных могут относиться к одному из двух четко различимых типов, названных каппа (κ) и лямбда (λ), основанных на аминокислотных последовательностях своих константных доменов.
Термин «полноразмерное антитело» относится к антителу в своей по существу интактной форме, включающему по меньшей мере 2 тяжелых и 2 легких цепи, неантительные фрагменты, как определено ниже. Термин на практике относится к антителу с тяжелыми цепями, которое содержит Fc область. Полноразмерное антитело может быть антителом с нативной последовательностью или рекомбинантным антителом. Полноразмерное антитело может быть человеческим, гуманизированным и/или аффинно зрелым.
Термин «моноклональное антитело», как использовано в данном описании, относится к антителу, полученному из популяции существенно гомогенных антител, то есть индивидуальных антител, включая популяции, в основном, идентичные, за исключением вариантов, которые могут возникать в процессе получения антитела.
Моноклональные антитела в данном описании специфически включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична с или гомологична соответствующим последовательностям антител, полученных из определенных видов или принадлежащих к особому антительному классу или подклассу, где остаток цепи(ей) идентичен с или гомологичен соответствующим последовательностям в антителах, полученных из других видов, или принадлежащих к другому антительному классу или подклассу, а также фрагменты таких антител, поскольку они проявляют желаемую биологическую активность (Патент США № 4816567; и Morrison с сотр., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы нечеловеческих (например, мышиных) антител являются химерными антителами, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Большей частью гуманизированные антитела являются иммуноглобулинами человека (реципиентное антитело), в которых остатки из CDR или гипервариабельной петли (HVL) реципиента замещают остатками из CDR или HVL нечеловеческих видов (донорное антитело), таких как мышь, крыса, кролик или примат, не являющийся человеком, имеющих желаемую специфичность, аффинность и активность. В некоторых примерах остатки рамочной области (FR) иммуноглобулина человека замещают соответствующими нечеловеческими остатками для улучшения антиген-связывающей аффинности. Кроме того, гуманизированные антитела могут включать остатки, которые не найдены в реципиентном антителе или донорном антителе. Эти модификации могут быть сделаны для улучшения антительной аффинности или функциональной активности. В общем, гуманизированное антитело будет включать, в значительной степени все, по меньшей мере одно и обычно два вариабельных домена, в которых все или в значительной степени все гипервариабельные области соответствуют таковым нечеловеческого иммуноглобулина и все или в значительной степени все FR являются таковыми иммуноглобулиновой последовательности человека. Гуманизированные антитела также могут быть получены как антиген-связывающие фрагменты, как описано в данном описании. Гуманизированное антитело необязательно будет также включать по меньшей мере часть иммуноглобулиновой константной области (Fc), обычно заданной или полученной из иммуноглобулина человека. Более подробную информацию можно найти из Jones et al., Nature 321:522-525 (1986); Riechmann с сотр., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Смотри также следующие обзорные статьи и ссылки, цитированные в данном описании: Vaswani и Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle и Gross, Curr. Op. Biotech 5:428-433 (1994).
«Антитело человека» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует таковой антитела, продуцированного человеком, и/или было получено с использованием любой методики получения антител человека. Это определение антитела человека конкретно исключает гуманизированное антитело, включающее нечеловеческие антиген-связывающие остатки.
«Аффинно зрелое» антитело представляет собой антитело с одним или несколькими изменениями в одной или нескольких гипервариабельных областях, которые приводят к улучшению аффинности антитела для антигена по сравнению с родительским антителом, которое не обладает этим изменением(ями). Предпочтительная аффинность зрелых антител будет иметь наномолярные или даже пикомолярные аффинности для ссылочного антигена. Аффинно зрелые антитела получают с помощью методик, известных в данной области. Marks с сотр., Bio/Technology 10:779-783 (1992) описывает аффинное созревание путем перестройки VH и VL домена. Случайный мутагенез CDR и/или рамочных остатков описан: Barbas с сотр., Proc. Nat. Acad. Sci. USA 91:3809-3813 (1994); Scier с сотр., Gene 169:147-155 (1995); Yelton с сотр., J. Immunol. 155:1994-2004 (1995); Jackson с сотр., J. Immunol 154(7):3310-9 (1995); и Hawkins с сотр., J. Mol. Biol. 226:889-896 (1992).
«Антительные фрагменты» включают только часть интактного антитела, обычно включая антиген-связывающий сайт интактного антитела и, таким образом, сохраняя способность связывать антиген. Примеры антительных фрагментов, касающиеся настоящего определения, включают: (i) Fab-фрагмент, имеющий VL, CL, VH и CH1 домены, имеющие одну межцепочечную дисульфидную связь между тяжелой и легкой цепью; (ii) Fab'-фрагмент, который представляет собой Fab-фрагмент, имеющий один или несколько цистеиновых остатков на C-конце CH1 домена; (iii) Fd фрагмент, имеющий VH и CH1 домены; (iv) Fd'-фрагмент, имеющий VH и CH1 домены и один или несколько цистеиновых остатков на C-конце CH1 домена; (v) Fv-фрагмент, имеющий VL и VH домены одного плеча антитела; (vi) dAb-фрагмент, который состоит из VH домена; (vii) бесшарнирное антитело, включающее по меньшей мере VL, VH, CL, CH1 домены и не содержащее шарнирной области; (viii) F(ab')2 фрагменты, бивалентный фрагмент, включающий два Fab'-фрагмента, связанных посредством дисульфидного мостика в шарнирной области; (ix) молекулы одноцепочечного антитела (например, одноцепочечный Fv; scFV); (x) «димерные антитела» с двумя антиген-связывающими сайтами, включающие вариабельный домен (VH) тяжелой цепи, соединенный с вариабельным доменом (VL) легкой цепи в одной и той же полипептидной цепи; (xi) «линейные антитела», включающие пару тандемных Fd сегментов, (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи формируют пару антиген-связывающих областей.
Как использовано в данном описании, «кристалл» относится к такой твердой форме вещества, при которой атомы расположены в паттерне, который повторяется периодически в трехмерном пространстве, обычно, образуя решетку.
Как использовано в данном описании, «гель» относится к концентрированной форме антитела или антительного фрагмента, который представляет собой вязкоупругий раствор, который является более твердым, чем жидкий коллоидный раствор. Необязательно, гели могут включать кристаллы. Гели, которые сформированы с использованием способов по изобретению, обычно содержат высокую концентрацию антитела или его фрагментов и могут необязательно включать кристаллы.
«Осадитель», как использовано в данном описании, относится к агенту, который делает соединение или молекулу нерастворимой. В некоторых случаях соединение или молекула формирует кристалл. Осадители также могут быть использованы для формирования кристаллов солей или молекул, являются, обычно, солями, полимерами или органическими молекулами. Органические осадители включают изопропанол, этанол, гександиол и 2-метил-2,4-пентандиол (MPD). Полимерные осадители включают полиэтиленгликоль и полиамины, такие как Jeffamine®. Применяемые соли включают сульфат аммония, цитрат натрия, ацетат натрия, хлорид аммония, хлорид натрия и формиат магния, обычно в концентрации 0,2 М или более.
«Расстройство» или «состояние» представляет собой любое состояние, на которое оказывает благоприятное воздействие лечение антителом. Оно включает хронические и острые расстройства или заболевания, включающие те патологические состояния, которые предрасполагают млекопитающее к расстройству, о котором идет речь. Неограничивающие примеры расстройств, для которых лечение по настоящему изобретению может быть эффективно, включают злокачественные и доброкачественные опухоли, нелейкозные и лимфоидные злокачественные опухоли; нейрональные, глиальные, астроцитарные, гипоталомические и другие гландулярные, макрофагальные, эпителиальные, стромальные расстройства и опухоли брюшной полости; и воспалительные, ангиогенные и иммунологические расстройства.
Как использовано в данном описании, «лечение» относится к клиническому вмешательству с целью изменить естественное течение болезни индивидуума или клетки, на которую направлено лечение. Желательные эффекты лечения включают облегчение симптомов, ослабление любых прямых или опосредованных патологических последствий заболевания, предотвращение метастазов, уменьшение скорости прогрессирования заболевания, уменьшение интенсивности или временное облегчение состояния заболевания и ремиссию или улучшенный прогноз.
Способы осуществления изобретения
Антитело и фрагменты антитела стали очень эффективны, особенно терапевтически. В настоящее время многие антитела исследуют для терапевтического применения. Терапевтическое применение часто требует крупномасштабной продукции антител или фрагментов антител. Один из аспектов изобретения включает способ концентрирования, очистки и хранения антител или их фрагментов, особенно продуцируемых в крупном масштабе. Способами по изобретению получают кристаллы, гели и гели с кристаллами. Кристаллы и/или гели антител или их фрагментов применяют, например, для характеристики 3-мерной структуры посредством дифракции рентгеновских лучей, для хранения, для концентрирования, для очистки и для доставки антитела или фрагмента антитела.
Многие белки вследствие своих размеров и своих трехмерных конфигураций с трудом могут быть кристаллизованы. Обычно несколько комбинаций осадителей, буферов и pH должны быть скринированы для того, чтобы идентифицировать комбинацию режима, который будет обеспечивать кристаллизацию. Антитела и фрагменты антител были особенно трудны для кристаллизации вследствие их размера и того факта, что шарнирная область делает молекулу более гибкой и менее жесткой. Кроме того, антитела или их фрагменты могут быть гликозилированы в зависимости от источника антитела.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, включающим раствор, состоящий в основном из или состоящий из соли двухвалентного катиона. В некоторых вариантах осуществления двухвалентная катионная соль присутствует в низкой концентрации, например примерно 1-500 мМ. Раствор также может включать раствор, состоящий в основном из или состоящий из буфера, такого как ацетат натрия. В некоторых вариантах осуществления буфер имеет низкую ионную силу, например, примерно 1-100 мМ. Примеры двухвалентных катионов включают, но не ограничиваются ими, цинк, магний и кальций. При этом не подразумевая ограничение изобретения любым путем, соль двухвалентного катиона действует как осадитель и приводит к формированию белкового кристалла. В некоторых случаях раствор не содержит других осадителей, таких как органические или полимерные осадители.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, включающим раствор, состоящий в основном из или состоящий из соли цинка. В некоторых вариантах осуществления соль цинка присутствует в низкой концентрации, например примерно 1-120 мМ, предпочтительно 10-80 мМ и более предпочтительно 25-60 мМ. В некоторых вариантах осуществления солью цинка является ZnCl2. Раствор может включать раствор, состоящий в основном из или состоящий из буфера, такого как ацетат натрия. В некоторых вариантах осуществления буфер имеет низкую ионную силу, например, примерно 1-100 мМ, предпочтительно 1-20 мМ и более предпочтительно 25 мМ-75 мМ. В некоторых вариантах осуществления раствор включает примерно 100 мМ ZnCl2 и примерно 10 мМ NaOAc. В некоторых случаях раствор не включает другие осадители, такие как органические или полимерные осадители. Способы обеспечивают образование кристаллов и/или белковых гелей. Необязательно, белковые гели могут включать кристаллы.
В некоторых вариантах осуществления раствор включает более чем примерно 10 мМ ZnCl2 и более чем примерно 5 мМ NaOAc. В других вариантах осуществления раствор включает 100 мМ ZnCl2 и 10 мМ NaOAc.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, состоящим в основном из или состоящим из соли магния. В некоторых вариантах осуществления хлорид магния (MgCl2) используют в низкой концентрации, например примерно 1-500 мМ, более предпочтительно примерно 200-500 мМ и наиболее предпочтительно примерно 1-100 мМ. Раствор может включать раствор, состоящий в основном из или состоящий из буфера, такого как ацетат натрия или трис. В некоторых вариантах осуществления буфер имеет низкую ионную силу, например, примерно 1-100 мМ. В некоторых случаях раствор не включает другие осадители, такие как органические или полимерные осадители. В некоторых случаях pH раствора является высоким, например от примерно 7,5 до примерно 9. Способы обеспечивают образование кристаллов и/или белковых гелей. Необязательно, белковые гели могут включать кристаллы.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, состоящим в основном из или состоящим из соли цинка для формирования белкового геля. Необязательно белковые гели могут включать кристаллы. В некоторых вариантах осуществления соль цинка находится в низкой концентрации, например примерно 1-120 мМ. Раствор может включать раствор, состоящий в основном из буфера, такого как ацетат натрия, или состоящий из буфера, такого как ацетат натрия. В некоторых вариантах осуществления буфер имеет низкую ионную силу, например примерно 1-100 мМ. В некоторых случаях раствор не включает другие осадители, такие как органические или полимерные осадители.
Способы по изобретению обеспечивают малозатратный путь кристаллизации, концентрирования или очистки антитела или фрагментов антител. В некоторых случаях способы по изобретению предоставляют способы, которые не включают применение других осадителей, таких как полимеры или органические осадители, которые могут быть нежелательными в продукте. Кристаллы и/или белковые гели антитела или фрагментов антител могут быть смешаны с носителями или другими ингредиентами для хранения и/или введения.
Антитела или их фрагменты
Антитела или фрагменты антител применяют в способах по изобретению. Антитела включают, без ограничения, поликлональные, моноклональные антитела, аффинно зрелые антитела, антитела с полиэпитопной специфичностью, гуманизированные антитела, антитела человека, химерные антитела и мультиспецифичные антитела.
В некоторых случаях антитела получают как полноразмерные антитела. Полноразмерные антитела обычно включают 2 тяжелых и 2 легких цепи. Существует 5 главных классов иммуноглобулинов и они включают IgA, IgD, IgE, IgG и IgM. Некоторые из них могут быть далее подразделены на подклассы, такие как IgG1, IgG2, IgG3, IgG4, IgM1, IgM2, IgA1 или IgA2. Антитела одного или нескольких этих классов могут быть использованы в способах по изобретению. В некоторых вариантах осуществления антителом является антитело IgG.
Фрагменты антител также могут быть использованы в способах по изобретению. Фрагменты антител включают антиген-связывающие фрагменты и включают Fab, Fab', Fab2, Fab'2, Fd, одноцепочечный Fv, scFv2, dAb, бесшарнирные антитела, димерные антитела и линейные антитела.
В зависимости от источника антитела или его фрагмента антитела могут быть гликозилированы. Обычно рекомбинантные антитела, полученные из или продуцированные в клетках млекопитающих или насекомых, являются гликозилированными. Антитела или их фрагменты, полученные из или продуцированные в прокариотических клетках, не гликозилированы или являются агликозилированными. Гликозилирование антител также может быть модифицировано или элиминировано путем мутации последовательностей сайта гликозилирования.
Антитела или фрагменты антител являются специфичными для антигена. Антитела, применяемые в способах по изобретению, включают антитела к антигенам, включающим молекулы, такие как ренин; гормон роста, включая человеческий гормон роста и гормон роста крупного рогатого скота; фактор высвобождения гормона роста; паратиреоидный гормон; тиреоид-стимулирующий гормон; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы коагуляции, такие как фактор VIIIC, фактор IX, тканевой фактор (TP) и фактор Виллебранда; анти-коагулирующие факторы, такие как Белок C; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как активатор плазминогена урокиназного типа или человеческий мочевого типа, или тканевого типа (t-PA); бромбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухолей-альфа и -бета; энкефалиназа; RANTES (регулируемый активацией в норме экспрессируемых и секретируемых T-клеток); макрофагальный воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; фактор регрессии мюллеровых протоков; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; ассоциированный с цитотоксическими T-лимфоцитами антиген (CTLA), такой как CTLA-4; ингибин; активин; фактор роста сосудистого эндотелия (VEGF); рецепторы гормонов или факторов роста; белок A или D; ревматоидные факторы; нейротрофный фактор, такой как полученный из кости нейротрофный фактор (BDNE); нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF-β; полученный из тромбоцитов фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; фактор роста эпидермиса (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулин-подобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (мозговой IGF-I), белки, связывающие инсулин-подобный фактор роста; CD белки, такие как CD3, CD4, CD8, CD19, CD20 и CD40; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1-IL-10; супероксиддисмутаза; T-клеточные рецепторы; поверхностные мембранные белки; ускоряющий распад фактор; вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; хоминг-рецепторы; аддрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухоль-ассоциированный антиген, такой как рецептор HER2, HER3 или HER4; и фрагменты любых вышеперечисленных полипептидов.
Предпочтительные антигены для антител, касающиеся настоящего изобретения, включают CD белки, такие как CD3, CD4, CD8, CD19, CD20, CD40, CD34 и CD46; члены рецепторного семейства ErbB, такие как рецептор EGF, рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, p150.95, VLA-4, ICAM-1, VCAM, α4/β7 интегрин и αv/β3 интегрин, включая свои или α-, или β-субъединицы (например, анти-CD11a, анти-CD18 или анти-CD11b антитела); факторы роста, такие как VEGF; тканевой фактор (TF); TGF-β; альфа интерферон (α-IFN); интерлейкин, такой как IL-8; антигены группы крови; рецептор гибели Apo-2; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; белок C и т.п. Наиболее предпочтительными мишенями в данном описании являются VEGF, TF, CD19, CD20, CD40, TGF-β, CD11a, CD18, рецептор гибели Apo-2 и C24.
В некоторых вариантах осуществления антитела или их фрагменты включают анти-VEGF, анти-Apo-2, анти-IgE, анти-HER2, анти-CD11a или анти-CD20.
Антитела или фрагменты антител могут быть получены из природных источников, синтетически или с помощью рекомбинантных способов. Способы получения антител известны специалистам в данной области и включают получение антитела или фрагментов антител с помощью фагового дисплея. Способы крупномасштабной продукции известны и включают получение антитела или его фрагментов в количестве 10 л или более.
Антитела или фрагменты антител очищают способами, известными специалистам в данной области. В некоторых случаях продуцированное антитело или фрагмент очищают для получения препаратов, которые являются существенно гомогенными для дальнейшего анализа и применения. Стандартные способы белковой очистки, известные в данной области, могут быть применены. Следующие методики иллюстрируют приемлемые методики очистки: фракционирование на иммуноаффинных или ионообменных колонках, этанольное осаждение, высокоэффективная жидкостная хроматография с обращенной фазой (HPLS), хроматография на кремнеземной или на катионообменной смоле, такой как DEAE, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация с использованием, например, Sephadex G-75. Например, в качестве первой стадии очистки антитело или его фрагмент, полученный из клеточной культуры, наносят на иммобилизованную твердую фазу с Белком A, допуская специфическое связывание антитела с Белком A. Твердую фазу затем промывают для удаления загрязнений, неспецифически связанных с твердой фазой. Наконец антитело выделяют из твердой фазы путем элюирования.
В некоторых вариантах осуществления изобретения концентрация антитела в растворе, применяемая в способах по изобретению, составляет, по меньшей мере, 1 г/л. Концентрация антитела в растворе изменяется от 1 до примерно 100 г/л. В дальнейших вариантах осуществления изобретения концентрация антитела изменяется от 20 до примерно 100 г/л. Еще в другом варианте осуществления изобретения концентрация антитела изменяется от примерно 40 до примерно 90 г/л.
Способы
Способы по изобретению включают способы кристаллизации или концентрирования антитела или фрагмента антитела из раствора. Кристаллы или белковые гели применяют, например, для характеристики структуры, для хранения, для концентрирования, для очистки и для доставки антитела или его фрагмента. В некоторых вариантах осуществления концентрирование антитела представляет собой концентрирование до, по меньшей мере, 1 г/л и более предпочтительно, по меньшей мере, 40-90 г/л. Способы по изобретению предоставляют малозатратный способ получения кристаллов антитела или его фрагментов. В одном из аспектов изобретения способ включает контактирование антитела или его фрагмента с раствором, который включает раствор, состоящий в основном из или состоящий из соли двухвалентного катиона, и инкубацию антитела или его фрагмента с раствором до формирования кристаллов антитела или его фрагмента.
В некоторых вариантах осуществления способ включает контактирование антитела или его фрагмента с раствором, который включает раствор, состоящий в основном из или состоящий из соли цинка в концентрации от примерно 1 до примерно 120 мМ, более предпочтительно от 10 до 80 мМ и наиболее предпочтительно от 25 до 60 мМ соли цинка. Соли цинка включают хлорид цинка, фосфат цинка, цитрат цинка, ацетат цинка или сульфат цинка. В некоторых вариантах осуществления раствор включает раствор, состоящий в основном из или состоящий из примерно 1 до примерно 100 мМ ZnCl2. В специфических вариантах осуществления раствор включает более чем 10 мМ ZnCl2 и более чем 5 мМ NaOAc и предпочтительно примерно 100 мМ ZnCl2 и примерно 10 мМ NaOAc. В некоторых вариантах осуществления способ предлагает белковый гель, который может необязательно включать кристаллы.
В некоторых вариантах осуществления способ включает контактирование анти-VEGF антитела или его фрагмента с раствором, который включает раствор, состоящий в основном из или