Конъюгаты полипептида и олигосахарида
Иллюстрации
Показать всеНастоящее изобретение относится к коньюгатам полипептида и олигосахарида или его фармацевтически приемлемой соли, в которых полипептид коньюгирован по меньшей мере к одному олигосахаридно-спейсерному остатку, олигосахарид представляет собой синтетический сульфатированный пентасахаридный остаток и по существу обладает аффинностью к антитромбину III, и спейсер является связью или по существу фармакологически неактивным гибким сшивающим остатком. Коньюгаты настоящего изобретения имеют улучшенные фармакокинетические свойства по сравнению с соответствующими неконъюгированными полипептидами. 2 н. и 11 з.п. ф-лы, 24 ил., 7 табл., 28 пр.
Реферат
Настоящее изобретение относится к новым коньюгатам полипептидов и олигосахаридов, к способам их изготовления, к фармацевтическим композициям, содержащим в качестве активных компонентов эти соединения, а также к использованию указанных соединений для изготовления лекарств.
Последние разработки технологий рекомбинантных ДНК и усовершенствованных способов синтеза белков позволили осуществлять коммерческое производство полезных с медицинской точки зрения количеств терапевтических полипептидов. Вместе с тем, в силу короткого периода полувыведения многих терапевтических полипептидов, исторически стояла проблема введения этих соединений. Применяется ряд важных лекарственных препаратов на полипептидной основе, которые в силу увеличенного периода полувыведения могли бы обладать преимуществом. Их примерами являются эритропоэтин, инсулин, α-2b-интерферон, β-интерферон, γ-интерферон, гранулоцитарный колониестимулирующий фактор, человеческий гормон роста, гранулоцитарно-макрофагальный колониестимулирующий фактор, релаксин, урокиназа, стрептокиназа, активатор тканевого плазмогена, кальцитонин, интерлeйкин-2 и фактор некроза опухоли, периоды полувыведения которых составляют менее (значительно) нескольких часов. Например, период полувыведения человеческого инсулина составляет всего лишь около 12 минут. Другими примерами полипептидов, разработанных в качестве потенциальных терапевтических средств, но имеющих недостаток в виде короткого периода полувыведения, являются адреномедуллин, глюкагоноподобный пептид (ГПП-1) и кисспептин (метастин). Увеличение периода полувыведения терапевтических полипептидов способно улучшить современное лечение путем возможного снижения количества доз и частоты дозирования (Curr. Opin. Drug Disc. Dev. 2005, 8, 590-600).
Исследования ряда белков, проводимые за последнее время, были направлены на увеличение периода полувыведения in vivo, например, путем применения адаптации посредством пегилирования (то есть конъюгацией с полиэтиленгликолевой функциональной группой в 1-30 кДа; Drug Discovery Today 2005, 10, 1451-1458). Например, в настоящее время доступны аналоги пегилированного инсулина с увеличенным периодом полувыведения. Важными аспектами созданных в последнее время производных инсулина, помимо сниженной скорости клиренса, является сниженная иммуногенность (например, патент США 4179337) и повышенная растворимость. Дополнительно, разработки по пегилированию инсулина также привели к получению более физически и протеолитически стабильных коньюгатов по сравнению с нативным инсулином (см., например, WO 2004/091494, WO 2002/098232, США 2005/0152848).
Например, в WO 2004/022577 приведено описание пегилированного эритропоэтина с более длинным периодом полувыведения из сыворотки. Было дополнительно выявлено, что измененное гликозилирование эритропоэтина увеличивает период полувыведения. Кроме того, сообщалось, что гипергликозилированные аналоги эритропоэтина имели более высокую активность in vivo (WO 2000/24893). Другими примерами пегилированных (поли)пептидов с длительной продолжительностью действия являются глюкагоноподобный пептид-1 (ГПП-1) (WO 2005/058954, WO 2004/093823; Bioconjugate Chem. 2005, 16, 377-382; Biomaterials, 2005, 26, 3597-3606), глюкозозависимый инсулинотропный полипептид (ГИП) (Bioorg. Med. Chem. Lett, 2005, 75, 4114-4117), кальцитонин (Pharm. Dev. Technol. 1999, 4, 269-275) и октреотид (Pharm. Res. 2005, 22, 743-749).
Вместе с тем, существуют ограничения для применения ПЭГ. Получение ПЭГ осуществляют химическим синтезом и, как все синтетические полимеры, он является полидисперсным. Это означает, что порция ПЭГ состоит из молекул, имеющих различное число мономеров, что приводит к гауссовскому распределению молекулярного веса. Пегилирование полипептида приводит к получению набора коньюгатов, которые могут обладать различными биологическими свойствами, в особенности, периодами полувыведения и иммуногенностью. В этой связи воспроизводимость фармакологического действия пегилированных полипептидов может быть серьезным недостатком такой технологии. Известно также, что пегилирование белков часто сопровождается потерей биологической активности. Дополнительно, применение ПЭГ может вызывать проблемы, связанные с экскрецией из организма. ПЭГ с высокими значениями молекулярного веса могут накапливаться в печени, что приводит к макромолекулярному синдрому. Следовательно, пегилирование лекарственных препаратов необходимо осуществлять с большой осторожностью.
Результаты, сходные с результами пегилирования, были получены путем дериватизации полипептидов с полисахаридами, в частности, с цепочками полисиаловой кислоты (например, WO 92/22331 и WO 2001/87922).
В JP 02/231077 описаны коньюгаты гепарина, представляющие собой супероксиддисмутазы (СОД). Предпочтительно, несколько молекул гепарина присоединяют к СОД, получая коньюгат, имеющий более длинный период полувыведения, чем нативный СОД, в то же время сохраняющий около 90% ферментативной активности.
Другие коньюгаты полипептидов с увеличенным периодом полувыведения представлены конъюгированными производными инсулина (WO 2003/013573, WO 05/012346), или ГПП-1 (Bioorg. Med. Chem. Lett. 2004, 14, 4395-4398), которые связываются с сывороточным циркулирующим альбумином. Связывание с сывороточным альбумином в таких соединениях основано, в частности, на гидрофобных взаимодействиях связывающей функциональной группы с человеческим сывороточным альбумином в конъюгате. Чем выше гидрофобность этой функциональной группы, тем сильнее связывающая аффинность к человеческому сывороточному альбумину. Несмотря на то, что подходит широкий диапазон связывающих функциональных групп, недостаток таких коньюгатов заключается в низкой аффинности и селективности взаимодействия конъюгатов с человеческим сывороточным альбумином, в результате чего фармакодинамическое поведение является плохо прогнозируемым. Альтернативно, прямое слияние гена человеческого инсулина с геном человеческого сывороточного альбумина приводит к получению формы инсулина длительного действия, которая в течение длительного периода после подкожного введения активно снижает уровень глюкозы крови (Duttaroy et al. Diabetes 2005, 54, 251-258). Вместе с тем, в этом случае снижается биодоступность слитого полипептида, а также связывающая аффинность с рецептором-мишенью.
Дополнительно, в WO 2000/40253 раскрыты коньюгаты, например, пептида и, конкретно, цепочки (цепочек) гликозамингликана, которые считаются синтетическими протеогликанами. На терапевтическую активность этих коньюгатов оказывает значительное влияние фармакологическая активность конъюгированного гликозамингликана.
Также для повышения растворимости к фармацевтически активным соединениям присоединяют олигосахариды (WO 2004/03971).
Настоящее изобретение относится к новым коньюгатам полипептидов с увеличенными периодами полувыведения, представляющим собой коньюгаты полипептидов и олигосахаридов, при этом полипептид коньюгирован по меньшей мере к одному синтетическому сульфатированному олигосахаридно-спейсерному остатку, и олигосахарид содержит от 4 до 18 моносахаридных единиц и по существу обладает аффинностью к антитромбину III и к спейсеру, являющемуся связью, или по существу фармакологически неактивным гибким сшивающим остатком, или его фармацевтически приемлемой солью. Предпочтительные олигосахариды состоят из 4-6 моносахаридных единиц, и особенно предпочтительными являются пентасахариды. Коньюгаты настоящего изобретения имеют улучшенные фармакокинетические свойства, и, таким образом, обладают улучшенными фармакологическими свойствами по сравнению с исходными полипептидами (то есть, по существу, с соответствующими неконъюгированными полипептидами).
Настоящее изобретение дополнительно касается новой технологии, основанной на способе изготовления терапевтически активного конъюгата, содержащего полипептид и имеющего незначительную антитромбическую активность, содержащем стадию, в которой синтетический сульфатированный олигосахарид, в частности пентасахарид, который по существу обладает аффинностью к антитромбину III (ATIII), ковалентно присоединяют к полипептиду посредством связи или посредством по существу фармакологически неактивного гибкого сшивающего остатка.
ATIII представляет собой ингибитор сериновой протеазы, присутствующий в плазме крови, который прерывает каскад коагуляции для обеспечения петли обратной связи. Период полувыведения сульфатированного пентасахарида в значительной степени основан на его аффинности к ATIII (см., например, F. Paolucci et al. Clin. Pharmacokinet. 2002; 41 Suppl. 2: 11-18). В конъюгатах настоящего изобретения сывороточный период полувыведения является более длинным, чем период полувыведения исходного полипептида, благодаря периоду полувыведения пентасахарида, которым в значительной степени обусловлен период полувыведения конъюгата. Кроме того, коньюгаты настоящего изобретения не только имеют более продолжительный период полувыведения, но также обладают изменяемыми фармакокинетическими свойствами, основанными на специфическом взаимодействии между пентасахаридной частью конъюгата и ATIII (указанное взаимодействие описано, например, в публикациях Westerduin et al. Bioorg. Med. Chem. 1994, 1267-1280; van Amsterdam et al., Arterioscler Thromb Vasc Biol. 1995; 15:495-503). В варианте осуществления настоящего изобретения уровень циркуляции в плазме у олигосахаридно-полипептидного конъюгата (в частности, у олигосахарида, состоящего из 4-6 моносахаридных единиц и в особенности предствляющего собой пентасахарид), составляет ≤50 нМ. Ниже указанного уровня концентрации антикоагулянтная активность олигосахарида (в частности, пентасахарида), опосредованная ATIII, является незначительной, в частности относительно риска кровотечения (см. например, публикации (1) F. Donat et al, Clin. Pharmacokinet. 2002; 41 Suppl. 2: 1-9; (2) S. J. Keam et al. Drugs 2002; 62 (11):1673-1685 и (3) The Rembrandt Investigators Circulation 2000; 102: 2726-2731). Согласно варианту осуществления настоящего изобретения используемый в конъюгатах олигосахарид (в частности, состоящий из 4-6 моносахаридных единиц и в особенности представляющий собой пентасахарид) по существу обладает антикоагулянтной активностью, которая имеет субтерапевтический уровень по сравнению с фармакологической активностью полипептида самого по себе. Термин «субтерапевтический» в этом отношении означает, что он обладает эффектом ниже терапевтического и не имеет побочных эффектов, таких как риск кровотечения. Например, больные диабетом 1 типа нуждаются в инъекциях инсулина (с продолжительным периодом полувыведения) до комплементарных (базальных) терапевтических уровней в плазме, составляющих от около 0,1 до 1,0 нМ, которые совпадают с субтерапевтическим диапазоном пентасахаридов, используемых в коньюгатах настоящего изобретения. Специалист в данной области техники будет понимать, как выбирать коньюгаты с подходящим балансом между терапевтическими уровнями полипептида и пентасахарида, соответственно.
Полипептиды в конъюгатах настоящего изобретения сохраняют свою биологическую активность. Кроме того, фармакокинетическая кривая ATIII-связанного пентасахарида в конъюгатах настоящего изобретения обуславливает высоко прогнозируемый терапевтический эффект конъюгированных полипептидов, поскольку коньюгаты после внутривенного (в/в) или подкожного (п/к) введения в значительной степени остаются во внутрисосудистом русле.
Олигосахаридный остаток в конъюгатах настоящего изобретения представляет собой остаток синтетического сульфатированного олигосахарида, который по существу обладает аффинностью к антитромбину III (ATIII). Сульфатированные олигосахариды, и в частности пентасахариды, в общем обладают аффинностью к ATIII, вместе с тем, специалист в данной области техники легко сможет проверить аффинность олигосахарида к ATIII (van Amsterdam et al., Arterioscler Thromb Vase Biol. 1995; 15:495-503) и выбрать желательный уровень аффинности. Подходящие синтетические олигосахаридные остатки и в частности, пентасахаридные остатки можно получать из олиго- и пентасахаридов, раскрытых в EP 0454220, EP 0529715, WO 98/03554, WO 99/36428, J. Med. Chem. 2005; 48, 349-352, Angew. Chem. Intl. Ed. Engl. 1994, 32, 1671-1690 и подобных публикациях.
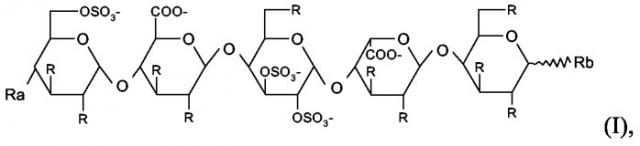
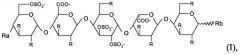
Олиго- и пентасахаридные остатки можно конъгировать в полипептид прямым путем или посредством сшивающего остатка, присоединенного к любому химически подходящему положению в пентасахаридном остатке. Таким образом, в варианте осуществления настоящего изобретения коньюгаты представляют собой коньюгаты, в которых олигосахаридно-спейсерный остаток имеет структуру (I)
в которой присутствует один по существу фармакологически неактивный гибкий сшивающий остаток, и в которой R независимо представляет собой OSO3 -, (1-8C)алкокси или по существу фармакологически неактивный гибкий сшивающий остаток, и
Rа независимо представляет собой OSO3 -, (1-8C)алкокси, по существу фармакологически неактивный гибкий сшивающий остаток или олигосахаридный остаток, содержащий от 1 до 13 моносахаридных единиц, и
Rb независимо представляет собой (1-8C)алкокси, по существу фармакологически неактивный гибкий сшивающий остаток или олигосахаридный остаток, содержащий от 1 до 13 моносахаридных единиц, и заряд компенсирован положительно заряженными противоионами.
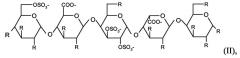
Более предпочтительными являются коньюгаты, в которых олигосахаридно-спейсерный остаток представляет собой пентасахаридно-спейсерный остаток, имеющий структуру (II)
в которой присутствует один по существу фармакологически неактивный гибкий сшивающий остаток, и в которой R независимо представляет собой OSO3 - или (1-8C)алкокси, или по существу фармакологически неактивный гибкий сшивающий остаток, и заряд компенсирован положительно заряженными противоионами.
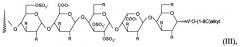
Дополнительно предпочтительными являются коньюгаты, в которых пентасахаридный остаток имеет структуру (III)
в которой R независимо представляет собой OSO3 - или (1-8C)алкокси, и заряд компенсирован положительно заряженными противоионами.
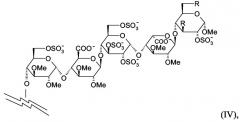
Согласно настоящему изобретению высоко предпочтительными соединениями являются соединения, в которых пентасахаридный остаток имеет структуру (IV)
в которой R независимо представляют собой OCH3 или OSO3 -, и в особенности обе группы R в (II) являются OSO3 -.
Согласно настоящему изобретению синтетические сульфатированные олигосахаридные остатки, в особенности пентасахаридные остатках, обладающие аффинностью к ATIII, можно конъгировать к любому полипептиду. Например, полипептид может являться биологически активным пептидом (например, длиной от 3 до 50 аминокислот) или может быть более длинным полипептидом, который может иметь или не иметь каталитической активности. Неограничивающие примеры биологически активных пептидов включают в себя медиаторы, такие как конантокин G, динорфин, эндорфин, энкефалин или нейротензин; активаторы желудочных функций, такие как бомбезин, мотилин или гастрин; регуляторы кальция, такие как кальцитонин или паратиреоидный гормон (ПТГ); модуляторы резорбции костей, такие как остеопротегерин (ОПГ); стимуляторы остеобластической активности, такие как адреномедуллин или его усеченные производные, такие как АДМ(27-52); гормоны, такие как вазоактивный кишечный полипептид, кортикотропин, секретин; гормональные ингибиторы, такие как соматостатин; гормональные стимуляторы, такие как меланоцитостимулирующий гормон, релизинг-фактор лютеинизирующего гормона или серморелин; антидиабетические вещества, такие как глюкагоны, амилин, глюкагоноподобный пептид-1 (ГПП-1) или его усеченные производные, такие как ГПП-1(7-36), ГПП-2, глюкозозависимый инсулинотропный полипептид (ГИП) или инсулин ("Humulin", Eli Lilly); противоинфекционные вещества, такие как лизостафин; гормоны, подавляющие аппетит, такие как обестатин; вазоконстрикторы, такие как ангиотензин II; вазодилятаторы, такие как брадикинин, субстанция P или каллидин; натрийуретические вещества, такие как атриальный натрийуретический полипептид (ANP); антидиуретические гормоны, такие как вазопрессин или десмопрессин; и стимуляторы родовой дятельности, такие как окситоцин. Дополнительные примеры возможных для использования полипептидов включают в себя человеческий гормон роста ("Humantrope", Genentech); релизинг-фактор лютеинизирующего гормона (ЛГРФ); рекомбинантный гранулоцитарный колониестимулирующий фактор rG-CSF ("Neupogen", Amgen); эритропоэтин ("Epogen", Amgen); интерферон α-2a, интерферон α-2b, интерферон β, или интерферон γ; фактор VIII или другие факторы свертывания крови, такие как белок C или фактор VIIa; фолликулостимулирующий гормон (ФСГ); цитокин, такой как интерлeйкин (ИЛ) (например, ИЛ-1, -2, -3, -4, - 5, -6, -7, -8, -9, -10, -11, -12 или -18); гемоглобин; супероксиддисмутаза; растворимый CD4 или рецептор CD4; тромбоцитарные аналоги GpIIb/IIIa и их рецепторы ("ReoPro", Johnson & Johnson); глюкоцереброзидаза ("Ceredase" или "Cerezyme", Genzyme); АКТГ; соматотропин; паратиреоидный гормон, антидиуретический гормон; пролактин; рекомбинантный человеческий гормон роста рЧГР, такой как пегвизомант ("Somavert", Pfizer); агонисты ГнРГ, такие как лейпролид ("Lupron", "Leprorelin", Takeda) или нафарелин ("Synarel", Roche) и антагонисты ГнРГ, такие как ганиреликс ("Antagon", Organon); агонисты соматотропин-высвобождающего гормона GHRH, такие как серморелин ("Geref, Serono); октреотид ("Sandostatin", Novartis); или тромболитикс, такой как стрептокиназа, стафилокиназа, урокиназа, или тканевой активатор плазминогена ("Activase", Genentech); метастин (KISS1 или кисспептин-54) или их усеченные производные, такие как кисспептин-10.
Молекулярный вес предпочтительных полипептидов составляет примерно от 0,3 до 50 кДа. Молекулярный вес других предпочтительных полипептидов составляет примерно от 0,3 до 20 кДа. Также предпочтительными являются полипептиды, молекулярный вес которых составляет примерно от 0,3 до 7,5 кДа.
Дополнительно предпочтительными полипептидами являются инсулин (период полувыведения t Ѕ = 12 минут; мол.вес = 5,8 кДа), кальцитонин (t Ѕ = 20 минут; мол.вес = 3,4 кДа), ГПП-1(7-36) (t Ѕ = 6 минут; мол.вес = 3,4 кДа), адреномедуллин (t Ѕ = 20 минут; мол.вес = 6,0 кДа), АДМ(27-52) (мол.вес 3,0 кДа), октреотид (t Ѕ = 1,7 часа, мол.вес = 1,0 кДа), интерлeйкин-2 (t Ѕ = 20 минут; мол.вес = 15 кДа) и ганиреликс (t Ѕ = 12 часов; мол.вес = 1,6 кДа). В особенности предпочтительными являются инсулин и [D-Ala8]-ГПП-1(7-36). Дополнительный вариант осуществления настоящего изобретения представляет собой полипептидный конъюгат, монозамещенный пентасахаридно-спейсерным остатком.
Спейсер представляет собой связь или по существу фармакологически неактивный гибкий сшивающий остаток. Предпочтительно, спейсер является по существу фармакологически неактивным гибким сшивающим остатком, имеющим в частности от 10 до 50 атомов, расположенных вдоль "скелета" спейсера, и не включающим в себя кислород из олигосахаридного остатка. Используемый в настоящем изобретении термин "по существу фармакологически неактивный" означает, что спейсер не содержит атомы или группы, которые сами по себе проявляют фармакологически активность в дозах, при которых соединения настоящего изобретения обладают терапевтическим эффектом. Таким образом, свойства спейсера не обуславливают доказуемые фармакологические побочные эффекты в дозах, в которых применяют соединения настоящего изобретения в качестве терапевтических лекарственных препаратов.
Спейсер может содержать несколько жестких элементов, таких как кольцевые структуры и ненасыщенные связи. Спейсер соединений настоящего изобретения предпочтительно является гибким. Специалист в данной области техники может с легкостью разработать подходящие спейсеры. Более длинные спейсеры считаются менее подходящими для синтеза, вместе с тем более длинные спейсеры могут успешно применяться в соединениях настоящего изобретения. Предпочтительные спейсеры содержат по меньшей мере один элемент -(CH2CH2O)-.
Типичные примеры конъюгатов настоящего изобретения представляют собой коньюгаты со следующими структурами:
в которых R1=R2=H, R3=
или в которых R1=R3=H, R2=
и в которых Y выбирают из структур A, B, C и D
или их другие соли, но также и коньюгаты, в которых спейсер отличается от указанных или присоединен к пентасахариду в другом положении. Предпочтительной является натриевая соль. И предпочтительно, Y выбирают из структур A и B.
Общепринято используемые химические сокращения, которые явно не определены в настоящем раскрытии, можно найти в справочниках The American Chemical Society Style Guide, Second Edition, American Chemical Society, Washington, DC (1997), "2001 Guidelines for Authors" J. Org. Chem. 66(1), 24A (2001), "A Short Guide to Abbreviations and Their Use in Polypeptide Science" J. Polypeptide. Sci. 5, 465-471 (1999).
Термин «полипептид» относится к цепочке по меньшей мере из трех аминокислот, независимо от посттрансляционных модификаций. Полипептиды могут быть полимерами аминокислот природного происхождения, синтезированными химически или полученными рекомбинантным путем. Полипептиды, имеющие от трех до 50 аминокислот, обычно классифицируют как пептиды.
Выражение "полипептид с каталитической активностью" означает фермент.
Используемый в настоящем изобретении термин «инсулин» относится к гипогликемическим полипептидам природного происхождения, обнаруживаемым у млекопитающих, включающих в себя человека, крысу, морскую свинку и кролика, а также к рекомбинантному инсулину и подобным гипогликемическим полипептидам, раскрытым в патентах США 4652525, 4431740, 5268453, 5506202, 5514646, и 5700662.
В описании конъюгатов настоящего изобретения дополнительно использованы следующие определения.
Термины (1-4C)алкил и (1-8C)алкил означают разветвленную или неразветвленную алкильную группу, имеющую, соответственно, от 1 до 4 и от 1 до 8 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, гексил и октил. Предпочтительными алкильными группами являются метил и этил.
Термин (1-8C)алкокси означает алкокси группу, имеющую от 1 до 8 атомов углерода, алкильная функциональная группа имеет вышеуказанное значение. Метоксигруппа является предпочтительной алкоксигруппой.
Длина спейсера обозначается числом атомов в спейсере, расположенных по самой короткой цепочке между олигосахаридным остатком и полипептидом, не считая связанный со спейсером атом кислорода олигосахаридного остатка.
Вариантом осуществления настоящего изобретения дополнительно является способ изготовления терапевтически активного конъюгата, содержащего полипептид, конъюгата, имеющего незначительную антитромбическую активность, в котором конъюгат обладает более длинным периодом полувыведения из плазмы, чем исходный полипептид, вместе с тем, по существу сохраняя его биологическую активность, и указанный способ содержит стадию, в которой синтетический сульфатированный олигосахарид, в частности, в которой олигосахарид состоит из 4-6 моносахаридных единиц, и наиболее конкретно является сульфатированным пентасахаридом, по существу обладающим аффинностью к антитромбину III, присоединен к полипептиду, необязательно посредством по существу фармакологически неактивного гибкого связывающего остатка.
Общие аспекты синтеза и анализа
Синтез пентасахаридов
Можно изготавливать ATIII - связывающий олигосахарид, в особенности пентасахарид, из соединений настоящего изобретения, например, согласно описанию в Angew. Chem. Intl. Ed. Engl. 1994, 32, 1671-1690. Можно получать различные олиго- и пентасахариды с измененной аффинностью к ATIII, варьируя промежуточные моно-, ди- или тетрасахаридные структурные блоки, например, путем введения (постоянных) алкильных групп или путем применения различных (временных) защитных групп, дающих регулируемый доступ к различным образом сульфатированным олиго- и пентасахаридам (например, Westerdu et al. in Bioorg. Med. Chem. 1994, 1267). Например, спейсер можно вводить согласно описанию WO 2001/42262. Для возможности прямого связывания с необязательно модифицированным полипептидом, олиго- и пентасахаридно-спейсерную молекулу дополнительно можно дериватизировать со сшивающими остатками, такими как гамма-малеимидобутирильная (GMB) группа, N-гидроксисукцинимидная (NHS) группа или с необязательно защищенной тиоловой группой (например, Angew. Chem. Intl. Ed. Engl. 1996, 35, 331-333).
Конъюгирование
В общем, коньюгаты настоящего изобретения получают согласно способу, содержащему (a) необязательную стадию, в которой полипептид адаптируют для конъюгирования, и (b) стадию связывания, в которой необязательно адаптированный полипептид реагирует с олиго- или пентасахаридно-спейсерной молекулой.
Общие способы синтетиза для производства биоконъюгатов описаны в "Bioconjugate Techniques" by Greg T. Hermanson, 1996, Academic Press. Для конъюгирования можно дополнительно учитывать лигирование Штаудингера (Staudinger) (например, как описано K.L. Kiick et al. Proc. Nat. Acad. Sci. 2002; 99:19-24) или 1,3-диполярное циклоприсоединение Хьюсгена (Huisgen) с использованием пентасахаридного производного и полипептида, независимо модифицированного с функциональной группой алкина или азида. Альтернативно, для конъюгирования пентасахаридного спейсерного остатка к необязательно модифицированному полипептиду можно адаптировать ферментативные реакции, такие как опосредованная региоселективной IgA протеазой элонгация полипептидов на N-конце (как описано авторами М. Lewinska et al. в Bioconjugate Chem. 2004, 75, 231-234), или катализированное трансглутаминазами введение аминоспейсера, содержащего олигосахариды (как описано М. Sato et al. в J. Chem. Soc. 2004, 126, 14013-14022).
Дополнительно, хорошо описано пегилирование, например, инсулина, ГПП-1 и октреотида. В эти белки можно вводить функциональную группу ПЭГ примерно от 5 до 30 кДа без нарушения их биологической активности; такие стратегии можно осуществлять для (сайт-специфичного) введения пентасахаридной (спейсерной) функциональной группы. Кроме того, необходимым условием является то, что присоединение пентасахаридного конъюгата к ATIII (около 50 кДа) не имеет какого-либо существенного вредного воздействия на биологическую активность полипептида.
Инсулин: Для биологической активности инсулина не являются необходимыми функциональные аминогруппы лизина N-конца B-1 и B-29 около C-конца. Изготовляли В1-пегилированный инсулин (S.W. Kim et al, Adv. Drug Del. Rev. 2002, 54, 505-530) с общим выходом 20% посредством реакции производного ПЭГ, активированного N-гидроксисукцинимидом (NHS) с инсулином, защищенным ди-N-Boc (бутилоксикарбонил). Подобная реакция с бифункциональным реактивом присоединения, таким как сложный эфир N-малеимидобутирилоксисукцинимида (GMBS), дает доступ к пентасахаридным коньюгатам В1-модифицированного инсулина. Альтернативно, можно селективно модифицировать остаток B29 Lys незащищенного Zn2+-инсулина избытком сложного эфира NHS при уровне pH примерно 10-11 с выходом около 60%. Другие общепринятые способы региоселективного конъюгирования к инсулину могут быть адаптированными способами из WO 98/02460, WO 2004/091494, WO 2005/012346, US 2005/0152848, Jensen et al. J. Pept. Sci. 2005, 11, 339-346, Lee et al. Bioconj. Chem. 2005, 16, 615-620, Jain et al. Biochim. Biophys. Act. 2003, 1622, 42-49, Tessmar et al. Tissue Engin. 2004, 10, 3, 441-453).
Ганиреликс: Пентасахаридные производные сложного эфира NHS можно конъгировать к свободному N-концу аминогруппы де-N-Ac ганиреликса или можно конъгировать аминоспейсер, содержащий пентасахаридное производное, необязательно посредством дополнительного спейсера, к свободной концевой карбоксильной кислотной группе дезамидоганиреликса, который в свою очередь можно получать усовершенствованным (твердофазным) синтезом белка, например, согласно описанию в J. Med. Chem. 1992, 55, 3942-3948.
Октреотид: N-концевой аминокислотный остаток D-Phe октреотида, являющегося коммерчески доступным пептидом, можно модифицировать с ПЭГ до 5 кДа без нарушения биологической активности (D. Hee et al. Pharm. Res. 2005, 22, 743-749). Можно достичь региоспецифической функционализации N-концевой аминогруппы с избытком бифункционального реактива присоединения сложного эфира NHS при уровне pH около 6, после чего можно осуществлять дальнейшее конъюгирование к пентасахаридному носителю согласно обычным способам синтеза для производства биоконъюгатов, как описано выше (например, путем конъюгирования пентасахаридного спейсерного остатка, содержащего тиоловую группу, к малеимидному производному октреотида).
АДМ(27-52): N-концевая половина от полноразмерного адреномедуллина (АДМ) не является необходимой для его остеогенной активности и действия, ингибирующего кальцификацию сосудов. Можно достичь региоспецифического конъюгирования пентасахаридно-спейсерного остатка к N-концевому остатку Ala из АДМ(27-52) путем синтеза необязательно модифицированного на N-конце АДМ(27-52) с использованием общепринятых способов, в которых применяется твердофазный синтез белка, и обычных способов синтеза для производства биоконъюгатов, как описано выше.
[D-Ala 8 ]-ГПП-1(7-36): C-концевая часть ГПП-1(7-36) и ее производные, такие как Эксендин-4(1-39), образуют α-спиральную структуру, в которой расположены аминокислотные остатки, важные для рецепторного связывания. Тем не менее, удлинение этой аминокислотной последовательности с помощью дополнительного лизинового остатка, модифицированного в Nε-положении, с малеимидной функциональной группой, с использованием адаптированного твердофазного синтеза белка, например, согласно описанию WO 2005/058954, проявляет рецепторное связывание и функциональную активность in vivo после ковалентного присоединения к Cys34 аминокислоте человеческого сывороточного альбумина, тогда как протеолитическую стабильность можно (дополнительно) улучшить включением в положение 2 остатка D-Ala (Bioorg. Med. Chem. Lett. 2004, 14, 4395-4398). Сходным способом можно конъгировать ГПП-1(7-36) или его аналоги к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе (например, содержащей тиоловую группу). Альтернативно, Cys аминокислоту можно включать в пептидную последовательность, предпочтительно в положении (положениях) 11, 12, 16, 22, 23, 24, 25, 26, 27, 30, 34, 35 или 36 или добавлять в положении 37, которую при этом можно присоединять к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе (например, содержащей малеимидную группу), используя способы, подобные описанным способам пегилирования производных ГПП-1 (WO 2004/093823). Кроме того, коньюгаты ГПП-1 можно получать прямым присоединением ГПП-1 к бифункциональному сложному эфиру NHS реактиву присоединения, с последующим разделением позиционных изомеров (например, как описано для прямого пегилирования ГПП-1 Lee et al. Bioconjugate Chem. 2005, 16, 377-382) и присоединением к функционализированной подходящим образом пентасахаридно-спейсерной функциональной группе.
Интерлeйкин-2 (ИЛ-2): свободная Cys125 аминокислота из коммерчески доступного нативного рекомбинантного человеческого ИЛ-2 (рЧ-ИЛ2) или свободные (дополнительные) Cys аминокислоты мутеинов ИЛ2, являющиеся тем не менее биологически активными, могут реагировать с пентасахаридно-спейсерной функциональной группой, содержащей малеимидную группу, согласно схеме, сходной с описанной для пегилирования ИЛ2 (патент США 5206344) с ПЭГ-малеимидом.
Связывание белков, представляющее собой возможную процедурную стадию в вышеупомянутом описанном способе изготовления соединений настоящего изобретения, можно осуществлять способами, общепринято известными в данной области техники, для связывания, или конденсации, фрагментов белка, такими как азидный способ, смешанный ангидридный способ, способ сложноэфирной активации, способ карбодиимида, или, предпочтительно, под действием солей аммония/урана, например, TBTU (2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурана тетрафторборат), особенно с добавлением соединений, подавляющих катализ и рацемизацию, таких как N-гидроксисукцинимид, N-гидроксибензотриазол и 7-аза-N-гидроксибензотриазол. Краткие обзоры этих тем приведены в следующей литературе: The Peptides, Analysis, Synthesis, Biology, Vol. 3, E. Gross and J. Meienhofer, eds. (Academic Press, New York, 1981) и Peptides: Chemistry and Biology. N. Sewald and H.-D. Jakubke (Wiley-VCH, Weinheim, 2002).
Присутствующие в соединениях функциональные аминогруппы во время процедуры синтеза можно защищать N-защитной группой, что означает общепринято используемую в химии белков группу для защиты α-аминогруппы, например, группу трет-бутилоксикарбонила (Boc), группу бензилоксикарбонила (Z), группу 9-флуоренилметилоксикарбонила (Fmoc) или группу фталоила (Phth), или их можно вводить путем демаскирования функциональной группы азида. Краткие обзоры защитных аминогрупп и способов их удаления приведены в вышеупомянутых изданиях The Peptides, Analysis, Synthesis, Biology, Vol. 3 и Peptides: Chemistry and Biology.
Соединения настоящего изобретения, которые могут находиться в виде свободного основания, можно выделять из реакционной смеси в виде фармацевтически приемлемой соли. Фармацевтически приемлемые соли также можно получать путем обработки свободного основания формулы (I) органической или неорганической кислотой, такой как хлористый водород, бромистый водород, йодистый водород, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота, аскорбиновая кислота и подобными кислотами.
Соединения настоящего изобретения или их промежуточные продукты могут иметь хиральные атомы углерода, и поэтому могут быть получены в виде чистого энантиомера или в виде смеси энантиомеров, или в виде смеси, содержащей диастереомеры. В данной области техники известны способы получения чистых энантиомеров, например, способ кристаллизации солей, полученных из оптически активных кислот и рацемических смесей, или путем хроматографии с использованием хиральных колонок. Для диастереомеров можно использовать колонки с прямой фазой или обращенной фазой.
Физико- и биохимический анализ
Являются доступными ряд технологий, контролирующих влияние реакции с бифункциональными линкерами и/или реагирующими пентасахаридно-функциональными группами на биологическую активность белка. В этом отношении ценным инструментом является анализ биомолекулярных взаимодействий (BIA) с использованием в качестве агентов комплиментарного связывания (инсулин) растворимых рецепторных молекул и определение активности фермента. Исследование связывания пентасахаридного конъюгата с ATIII также можно включать в эти анализы.
Ионнообменная, эксклюзионная хроматография и афинная хроматография ATIII являются доступными способами субфракционирования пентасахаридных коньюгатов, тогда как технологии электрофореза подходят для ортогонального, качественного и количественного параметров (например, для электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия SDS-PAGE, для капиллярного зонного электрофореза CZE). Части соединения можно идентифицировать анализом время-пролетной масс-спектрометрии с лазерной ионизацией и десорбцией из матрицы MS MALDI-TOF и N-концевым секвенированием конъюгатов.
Фармакокинетические (ФК) исследования
Для определения периода полувыведения in vivo немодифицированного полипептида и соответствующих пентасахаридных коньюгатов можно проводить ФК исследования на крысах. Доступны несколько вариантов, например, введение радиоактивных изотопов с применением Iodogen с 125I или лактопероксидазная ионизация для индукции электрофильного замещения, или использование реактива Болтона-Хантера в качестве группы мечения и определение гамма-излучения в образцах плазмы. Другие способы, известные в данной области техники, основаны на инъекции немеченных коньюгатов с последующим иммунохимическим анализом посредством твердофазного иммуноферментного анализа ELISA или люминисцентной технологии (Luminex).
Фармакологическая оценка
Фармакологические эффекты конъюгирования полипептидов настоящего изобретения к ATIII-связывающему пентасахариду можно изучать в анализах in vitro и in vivo на моделях животных, как описано ниже.
Инсулин является белком в 5,8 кДа, состоящим из двух пепт