Арильные соединения в качестве лигандов ppar и их применение
Иллюстрации
Показать всеИзобретение относится к соединению формулы I
где А представляет собой S или Se; В представляет собой Н или
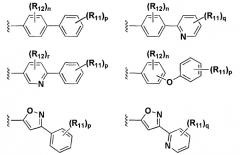
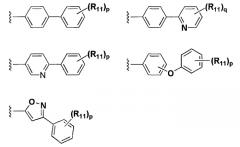
; R1 представляет собой арил, выбранный из следующих структур:
R2 представляет собой Н или ; R3 представляет собой Н или С1-С8 алкил; R4 и R5 независимо представляют собой Н или С1-С8 алкил; R6 представляет собой H, С1-С8 алкил, С2-С7 алкенил, щелочной металл или щелочноземельный металл; R11 и R12 независимо представляют собой Н, С1-С8 алкил или галоген; R21 представляет собой Н, галоген или С1-С7 алкил; m и n независимо представляют собой целые числа, имеющие значения 1-4; р представляет собой целое число, имеющее значение 1-5; q представляет собой целое число, имеющее значение 1-4; r представляет собой целое число, имеющее значение 1-3; s представляет собой целое число, имеющее значение 1-5; в качестве активатора рецептора активатора пролиферации пероксисом (PPAR) и его гидрату, сольвату, стереоизомеру и фармацевтически приемлемой соли и к фармацевтической композиции, средству для укрепления мышц, средству для улучшения памяти, терапевтическому средству для лечения деменции и болезни Паркинсона. 6 н. и 9 з.п. ф-лы, 8 табл., 348 пр.
Реферат
Область изобретения
Настоящее изобретение относится к соединению, представленному формулой (I), в качестве лиганда PPAR (Рецептор Активатора Пролиферации Пероксисом), и его гидрату, сольвату, стереоизомеру и фармацевтически приемлемой соли, которое можно использовать для лечения ожирения, гиперлипидемии, артериосклероза и диабета, и к фармацевтической композиции, косметической композиции, укрепляющему средству, средству для улучшения памяти, терапевтическому средству для лечения деменции и болезни Паркинсона, композиции функционального пищевого и кормового продукта, содержащим такое соединение.
Формула I
Предпосылки изобретения
Среди ядерных рецепторов PPAR (рецептор активатора пролиферации пероксисом) известен как имеющий три подтипа, которые представляют собой PPARα, PPARγ и PPARδ (Nature, 1990, 347, p645-650, Proc. Natl. Acad. Sci. USA 1994, 91, p7335-7359). PPARα, PPARγ и PPARδ имеют тканеспецифические функции in vivo и разные области для экспрессии. PPARα в основном экспрессируется в сердце, почках, скелетных мышцах и толстом кишечнике человека (Mol. Pharmacol. 1998, 53, p14-22, Toxicol. Lett. 1999, 110, p119-127, J. Biol. Chem. 1998, 273, p16710-16714), и он участвует в β-окислении пероксисомы и митохондрия (Biol. Cell. 1993, 77, p67-76., J. Biol. Chem. 1997, 272, p27307-27312). PPARγ экспрессируется в скелетных мышцах на низком уровне, но преимущественно экспрессируется в жировой ткани, индуцируя дифференциацию адипоцитов и накопление энергии в форме жира, и участвует в гомеостатической регуляции инсулина и глюкозы (Moll. Cell. 1999, 4, p585-594, p597-609, p611-617). PPARδ эволюционно сохранился у млекопитающих, включая человека и позвоночных, в том числе у грызунов и асцидий. Первый PPARδ, обнаруженный в Xenopus laevis, был известен как PPARβ (Cell 1992, 68, p879-887), а PPARδ, обнаруженный у человека, получил другое название NUC1 (Mol. Endocrinol. 1992, 6, pl634-1641), PPARδ (Proc. Natl. Acad. Sci. USA 1994, 91, p7355-7359), NUC1 (Biochem. Biophys. Res. Commun. 1993, 196, p671-677), FAAR (J. Bio. Chem. 1995, 270, p2367-2371) и т.д., но в настоящее время они переименованы и обозначаются как PPARδ. Известно, что у человека PPARδ существует в хромосоме 6p21.1-p21.2. У крыс мРНК PPARδ обнаружена в различных клетках, но ее уровень ниже, чем уровень мРНК PPARα или PPARγ (Endocrinology 1996, 137, p354-366, J. Bio. Chem. 1995, 270, p2367-2371, Endocrinology 1996, 137, p354-366). Проводимые ранее исследования подтвердили, что PPARδ играет важную роль в репродуктивной клеточной экспрессии (Genes Dev. 1999, 13, pl561-1574) и обладает физиологическими функциями дифференциации нервных клеток (J. Chem. Neuroanat 2000, 19, p225-232) в центральной нервной системе (ЦНС) и заживления ран с противовоспалительным эффектом (Genes Dev. 2001, 15, p3263-3277, Proc. Natl. Acad. Sci. USA 2003, 100, p6295-6296). Проводимые в последнее время исследования также подтвердили, что PPARδ участвует в дифференциации адипоцитов и метаболизме липидов (Proc. Natl. Acad. Sci. USA 2002, 99, p303-308, Mol. Cell. Biol. 2000, 20, p5119-5128). Например, PPARδ активирует экспрессию ключевого гена, участвующего в β-окислении в катаболизме жирных кислот и несвязывающихся белков (UCP), гена, участвующего в энергетическом обмене, что дает эффект при лечении ожирения (Nature 2000, 406, p415-418, Cell 2003, 113, pl59-170, PLoS Biology 2004, 2, p1532-1539). Активация PPARδ повышает уровень ЛПВП, обеспечивает улучшение при диабете типа 2 без изменения веса (Proc. Natl. Acad. Sci. USA 2001, 98, p5306-5311, 2003, 100, p15924-15929, 2006, 103, p3444-3449) и способствует лечению артериосклероза путем ингибирования гена, связанного с артериосклерозом (Science, 2003, 302, p453-457). Поэтому исследования регуляции метаболизма липидов с использованием PPARδ обеспечивают ключ к разработке способа лечения ожирения, диабета, гиперлипидемии и артериосклероза.
PPARδ участвует в образовании митохондрий и преобразовании мышечных волокон в мышцах для повышения выносливости. Мышцы содержат мышечное волокно с катаболизмом жирных кислот (Тип I), которое повышает выносливость, и гликокластное мышечное волокно (Тип II), которое повышает силу. Мышечное волокно с катаболизмом жирных кислот (Тип I), которое ответственно за повышение выносливости, красное, поскольку оно содержит большое количество митохондрий и миоглобин. Тогда как гликокластное мышечное волокно (Type II), которое ответственно за повышение силы, белое. Когда искусственно получали сверхэкспрессию PPARδ в мышцах крысы, наблюдали существенное увеличение мышечного волокна Типа I, в дополнение к повышению миоглобина, ферментов системы электронного транспорта (цитохром c, оксидаза II и IV цитохрома c) и оксидазы β жирных кислот. Поэтому время бега и расстояние увеличивались, соответственно, на 67% и 92% по сравнению с крысами дикого типа (PLoS Biology, 2004, 2:e294).
Синтетические PPARδ лиганды, разработанные к настоящему времени, обладают меньшей селективностью по сравнению с другими PPARα и PPARy лигандами. Одним из первых селективных лигандов был L-631033, разработанный Merk (J. Steroid Biochem. Mol. Biol. 1997, 63, p1-8), который был получен путем введения функциональной группы, способной фиксировать боковую цепь на основании ее природной жирнокислотной морфологии. Та же исследовательская группа позднее представила сообщение о более эффективном лиганде L-165041 (J. Med. Chem. 1996, 39, p2629-2654), где соединение, известное как агонист лейкотриена, обладает действием, направленным на активацию PPARδ человека. Это соединение демонстрировало высокую селективность в отношении hPPARδ, которая в 10 раз превышает селективность в отношении PPARα или PPARγ. И это соединение имело значение EC50 530 нМ. Другие лиганды L-796449 и L-783483 обладают улучшенным сродством (EC50=7,9 нМ), но обладают лишь незначительной селективностью в отношении других подтипов hPPAR.
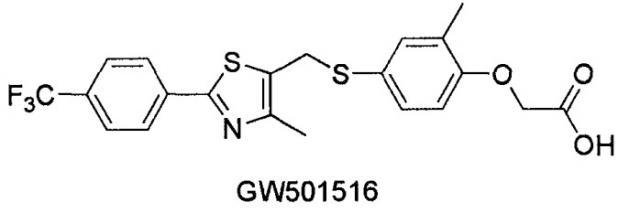
Селективный лиганд PPARδ, GW501516 ([2-метил-4-[[[4-метил-2-[4-(трифторметил)фенил]-1,3-тиазол-5-ил]метил]сульфанил]фенокси]уксусная кислота), разработанный GlaxoSmithKline, демонстрирует намного лучший физиологический эффект по сравнению с другими лигандами, разработанными ранее (Proc. Natl. Acad. Sci. USA 2001, 98, p5306-5311).
GW501516 обладает отличным сродством (1-10 нМ) в отношении PPARδ, а также отличной селективностью в отношении PPARα или PPARγ, которая, по меньшей мере, в 1000 раз выше селективности предшествующих лигандов.
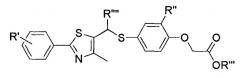
Тиазольное соединение, представленное формулой A, в качестве селективного активатора PPARδ было описано в WO 2001-00603 и WO 2002-62774, заявленных фирмой Glaxo group, и WO 2003-072100, заявленной фирмой Eli Lilly.
Формула А
где R' представляет собой CF3 или F, R'' представляет собой H, CH3 или Cl, R''' представляет собой H, CH3 или CH2CH3 и R'''' представляет собой H, алкил или арилалкил.
Однако активность PPARδ, индуцируемая всеми лигандами, которые разработаны на сегодняшний день, является результатом лишь 30-40% от общего количества лигандсвязывающих “карманов”.
Раскрытие изобретения
Техническая задача
Целью настоящего изобретения является обеспечение нового соединения, обладающего высокой селективностью в отношении PPAR, и фармацевтической композиции, косметической композиции, укрепляющего средства, средства для улучшения памяти, терапевтического средства для лечения деменции и болезни Паркинсона, композиции функционального пищевого и кормового продукта, содержащих такое соединение.
Техническое решение
Настоящее изобретение относится к соединению, представленному формулой (I), обладающему активностью в отношении рецептора активатора пролиферации пероксисом PPAR (далее в настоящей заявке указан как “PPAR”), и его гидрату, сольвату, стереоизомеру и фармацевтически приемлемой соли, к способу их получения и к содержащим их фармацевтической композиции, косметической композиции, укрепляющему средству, средству для улучшения памяти, терапевтическому средству для лечения деменции и болезни Паркинсона, композиции функционального пищевого и кормового продукта.
Формула I
где A представляет собой S или Se; B представляет собой H или ; R1 представляет собой арил, выбранный из следующих структур:
R2 представляет собой H, C1-C8 алкил или ; R3 представляет собой H, C1-C8 алкил или галоген; R4 и R5 независимо представляют собой H, C1-C8 алкил; R6 представляет собой H, C1-C8 алкил, C2-C7 алкенил, щелочной металл или щелочноземельный металл; R11 и R12 независимо представляют собой H, C1-C8 алкил или галоген; R21 представляет собой H, галоген, C1-C7 алкил, гетероциклическую группу или C1-C7 алкокси; m и n независимо представляют собой целые числа, имеющие значения 1-4; p представляет собой целое число, имеющее значение 1-5; q представляет собой целое число, имеющее значение 1-4; r представляет собой целое число, имеющее значение 1-3; s представляет собой целое число, имеющее значение 1-5; и алкил и алкокси R2, R3, R4, R5, R6, R11, R12 и R21 может быть замещен одним или несколькими атомами галогена или C1-C5 алкиламином. Однако случай, когда R2 представляет собой H и A представляет собой S, исключается.
В частности, R1 арильного соединения, представленного формулой (I), которое обладает активностью в отношении рецептора активатора пролиферации пероксисом (PPAR), предпочтительно представляет собой арил, выбранный из следующих структур:
R2 представляет собой C1-C8 алкил, замещенный или не замещенный галогеном или ; R3 представляет собой C1-C5 алкил, замещенный или не замещенный галогеном, или галоген; R4 и R5 независимо представляют собой H или C1-C5 алкил, замещенный или не замещенный галогеном; R6 представляет собой H, C1-C7 алкил, щелочной металл или щелочноземельный металл; R11 и R12 независимо представляют собой H, C1-C5 алкил, замещенный одним или несколькими атомами фтора, или фтор; R21 представляет собой H, галоген, C1-C5 алкил, замещенный или не замещенный галогеном, или C1-C5 алкокси, замещенный или не замещенный галогеном; p представляет собой целое число, имеющее значение от 1-5; q представляет собой целое число, имеющее значение от 1-4; и s представляет собой целое число, имеющее значение от 1-5.
R2 соединения, представленного формулой (I), может быть дополнительно замещен метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом, и бензил R2 может быть дополнительно замещен фтором, хлором, метилом, этилом, н-пропилом, изопропилом, трет-бутилом, фторметилом, дифторметилом, трифторметилом, 2-фторэтилом, пентафторэтилом, метокси, этокси, пропокси, н-бутокси, трет-бутокси, фторметокси, дифторметокси, трифторметокси, 2-фторэтокси и пентафторэтокси;
R3 представляет собой H, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 2-этилгексил, фторметил, дифторметил, трифторметил, 2-фторэтил, пентафторэтил, фтор или хлор;
R4 и R5 независимо представляют собой H, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 2-этилгексил, фторметил, дифторметил, трифторметил, 2-фторэтил или пентафторэтил;
R6 представляет собой H, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 2-этилгексил, фторметил, дифторметил, трифторметил, 2-фторэтил, пентафторэтил, этенил, 2-пропенил, 2-бутенил, 3-бутенил, Li+, Na+, K+, Ca2+ или Mg2+;
R11 и R12 независимо представляют собой H, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 2-этилгексил, фторметил, дифторметил, трифторметил, 2-фторэтил, пентафторэтил, фтор или хлор.
Новое соединение по настоящему изобретению можно получить согласно следующей реакционной формуле.
Реакционная формула 1
где A представляет собой S или Se; B представляет собой H или ; R1 представляет собой арил, выбранный из следующих структур:
R2 представляет собой H, C1-C8 алкил или ; R3 представляет собой H, C1-C8 алкил или галоген; R4 и R5 независимо представляют собой H или C1-C8 алкил; R6 представляет собой H, C1-C8 алкил, C2-C7 алкенил, щелочной металл (Li+, Na+, K+) или щелочноземельный металл (Ca2+, Mg2+); R11 и R12 независимо представляют собой H, C1-C8 алкил или галоген; R21 представляет собой H, галоген, C1-C7 алкил, гетероциклическую группу или C1-C7 алкокси.
Prot на представленных схемах означает фенолзащитную группу, которая может представлять собой C1-C4 низший алкил, аллил, алкилсилил, алкиларилсилил или тетрагидропиранил; алкил и алкокси R2, R3, R4, R5, R6, R11, R12 и R21 могут быть замещены одним или несколькими атомами галогена или С1-C5 алкиламином; m и n независимо представляют собой целые числа, имеющие значения 1-4; p представляет собой целое число, имеющее значение 1-5; q представляет собой целое число, имеющее значение 1-4; r представляет собой целое число, имеющее значение 1-3; s представляет собой целое число, имеющее значение 1-5; X1 представляет собой атом брома или атом йода; X2 и X3 независимо представляют собой атом хлора, атом брома, атом йода или удаляемую группу, обладающую реакционной способностью с нуклеофильным замещением. Однако случай, когда R2 представляет собой H и A представляет собой S, исключается.
Далее подробно описан способ получения по настоящему изобретению.
Способ A: Получение соединения, представленного формулой (IV)
Для получения соединения, представленного формулой (IV), соединение, представленное формулой (II), обрабатывали реагентом Гриньяра для защиты фенольной группы, без разделения, и подвергали взаимодействию с металлоорганическим реагентом и S или Se, постадийно, и в конце подвергали взаимодействию с соединением, представленным формулой (III). Этот способ включает 4 подстадии реакций, которые осуществляют последовательно.
Эти подстадии реакций описаны подробно ниже.
Защита фенольной группы реагентом Гриньяра
Безводный растворитель, используемый в этом способе, выбирают из группы, состоящей из таких отдельных растворителей, как простой диэтиловый эфир, тетрагидрофуран, гексан и гептан, и смешанных растворителей, включающих, по меньшей мере, два из таких растворителей. Более предпочтительно, когда выбирают простой диэтиловый эфир, тетрагидрофуран или смешанный растворитель, включающий простой диэтиловый эфир и тетрагидрофуран, в качестве безводного растворителя. И наиболее предпочтительно, когда выбирают полярный растворитель, который может представлять собой тетрагидрофуран.
Реагент Гриньяра, используемый в настоящем изобретении, может быть выбран из группы, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутилмагнийхлорида (R2MgCl) и алкилмагнийбромида (R2MgBr). Из них изопропилмагнийхлорид ((CH3)2CHMgCl) является наиболее предпочтительным.
Температура реакции зависит от растворителя, но, как правило, ее устанавливают в интервале -20~40°C и предпочтительно от 0°C до примерно комнатной температуры (25°C). Время реакции зависит от температуры реакции и растворителя, но, как правило, оно составляет 10-60 минут и предпочтительно 10-30 минут.
Галоген-литий замещение и введение S или Se
Металлоорганический реагент, используемый для галоген-литий замещения, может быть выбран из группы, состоящей из н-бутиллития, втор-бутиллития и трет-бутиллития. Из этих соединений трет-бутиллитий является наиболее предпочтительным.
S или Se является предпочтительным в виде тонкодисперсных частиц, и его добавляют в растворенном виде в безводном тетрагидрофуране или добавляют непосредственно.
Температура реакции зависит от растворителя, но, как правило, ее устанавливают в интервале -78~25°C. Температура реакции для галоген-металл замещения предпочтительно составляет -75°C, а температура для введения S или Se составляет от -75 до примерно комнатной температуры (25°C). Реакция замещения галоген-металл происходит в течение 10-30 минут, а реакция введения S или Se происходит в течение 30-120 минут.
Добавление соединения, представленного формулой (III)
Для получения соединения, представленного формулой (III), используемого в этом способе, индуцируют реакцию сочетания Сузуки с использованием традиционного палладиевого катализатора с последующим галогенированием. Галоген в соединении, представленном формулой (III), выбирают из группы, состоящей из хлора, брома и йода. И из них хлор является наиболее предпочтительным.
Температура реакции зависит от растворителя, но, как правило, ее устанавливают в интервале -78~25°C, более предпочтительно в интервале 0~10°C. Время реакции, как правило, составляет 10-120 минут и предпочтительно 10-60 минут.
Способ B: Получение соединения, представленного формулой (V)
Для получения соединения, представленного формулой (V), соединение, представленное формулой (IV), предпочтительно, подвергают взаимодействию с соединением, обычно используемым в качестве фенолзащитной группы, в присутствии основания.
Примеры фенолзащитной группы включают C1-C4 низший алкил, аллил, алкилсилил, такой как триметилсилил, трет-бутилдифенилсилил, триизопропилсилил и трет-бутилдиметилсилил, алкиларилсилил и тетрагидропиранил. Из этих соединений трет-бутильная группа, тетрагидропиранильная группа и силильная группа являются предпочтительными.
Апротонный полярный растворитель, используемый в этом способе, выбирают из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этилацетата, тетрахлорида углерода, хлороформа и дихлорметана. Указанный простой эфир может быть выбран из группы, состоящей из тетрагидрофурана, диоксана, диметоксиэтана, диметилового эфира диэтиленгликоля и диметилового эфира триэтиленгликоля. Примеры ароматического углеводорода включают бензол, толуол и ксилол. В качестве растворителя в настоящем изобретении апротонный полярный растворитель является предпочтительным, и, в частности, N,N-диметилформамид, хлороформ или дихлорметан является более предпочтительным.
Основание в настоящем способе представляет собой амин, включая пиридин, триэтиламин, имидазол, N,N-диметиламинопиридин. Для реакции алкил- или аллил-этерифицированной защитной группы используют такие основания, как гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия. В частности, имидазол и карбонат калия являются более предпочтительными.
Тетрагидропиранильную защитную группу получают путем каталитической реакции 3,4-дигидро-2H-пирана с алкил- или аллилтрифенилфосфонийбромидом.
Температура реакции зависит от растворителя, но, как правило, ее устанавливают в интервале -10~80°C, более предпочтительно от 0 до примерно комнатной температуры (25°C). Время реакции зависит от температуры реакции и растворителя, но, как правило, оно составляет от одного часа до одного дня. Более предпочтительно, когда реакция завершается в течение 4 часов.
Способ C: Получение соединения, представленного формулой (VII)
Для получения соединения, представленного формулой (VII), α-протон тио- или селеноэфирного соединения, представленного формулой (V), подвергают обработке сильной щелочью с получением нуклеофила, который подвергают взаимодействию с различными электрофилами.
Безводный растворитель, используемый в этом способе, выбирают из группы, состоящей из таких отдельных растворителей, как простой диэтиловый эфир, тетрагидрофуран, гексан и гептан, и смешанных растворителей, включающих, по меньшей мере, два из таких растворителей. Более предпочтительно, когда в качестве безводного растворителя выбирают простой диэтиловый эфир, тетрагидрофуран или смешанный растворитель, включающий простой диэтиловый эфир и тетрагидрофуран.
Сильную щелочь, используемую для экстракции α-протона, выбирают из группы, состоящей из трет-бутоксида калия (t-BuOK), диизопропиламида лития (LDA), н-бутиллития, втор-бутиллития и трет-бутиллития, и из этих соединений диизопропиламид лития (LDA) является наиболее предпочтительным.
Электрофил, взаимодействующий с нуклеофилом тио- или селеноэфира, представляет собой любое соединение, которое может быть легко получено традиционным способом, известным специалистам в данной области, или может быть легко получено в соответствии со способами, описанными в ссылочных документах, и в качестве примеров можно указать соединения, включающие высокореакционноспособную группу галогена, альдегида или кетона, и его либо растворяют в безводном растворителе для добавления, либо добавляют непосредственно для реакции.
Температура реакции зависит от растворителя, но, как правило, составляет -78~25°C. Более предпочтительно, когда реакцию экстракции α-протона осуществляют в присутствии сильной щелочи при температуре -75°C, при которой добавляют электрофил. Затем температуру медленно повышают до комнатной температуры (25°C). Время реакции является разным для каждой реакционной стадии. Например, экстракция α-протона сильной щелочью происходит в течение 10-30 минут, а реакция с электрофилом происходит в течение 30-90 минут.
Способ D: Получение соединения, представленного формулой (VIII)
Соединение, представленное формулой (VIII), получают путем удаления фенолзащитной группы из соединения, представленного формулой (VII).
Полярный растворитель, используемый в этом способе, выбирают из группы, состоящей N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этилацетата, тетрахлорида углерода, хлороформа и дихлорметана. Простой эфир в настоящем изобретении может быть выбран из группы, состоящей из тетрагидрофурана, диоксана, диметоксиэтана и диметилового эфира диэтиленгликоля. Спирт может представлять собой метанол или этанол. Примером ароматического углеводорода является бензол, толуол и ксилол. В качестве растворителя предпочтительным в настоящем изобретении является полярный растворитель, и, в частности, тетрагидрофуран является более предпочтительным.
Для удаления фенолзащитной группы, в частности для удаления метил-, этил-, трет-бутил-, бензил- или аллилэфирной защитной группы, используют триметилсилилйодид, натриевую соль этантиоспирта, йодид лития, галогенид алюминия, галогенид бора или кислоту Льюиса, такую как трифторацетат, и для удаления силильной защитной группы, такой как триметилсилил, трет-бутилдифенилсилил, триизопропилсилил и трет-бутилдиметилсилил, используют фторид, такой как тетрабутиламмонийфторид (Bu4N+F-), галогенсодержащую кислоту (фтористоводородную кислоту, хлористоводородную кислоту, бромистоводородную кислоту или йодистоводородную кислоту) или фторид калия.
Для удаления силильной защитной группы предпочтительно использование фторида, и более предпочтительно используют тетрабутиламмонийфторид.
Температура реакции зависит от способа и растворителя, но, как правило, составляет 0~120°C и предпочтительно 10~25°C.
Время реакции зависит от температуры реакции, но, как правило, оно составляет от 30 минут до одного дня. Более предпочтительно, когда реакция завершается в течение 2 часов.
Способ E: Получение соединения, представленного формулой (IX)
Для получения соединения, представленного формулой (IX), соединение, представленное формулой (VIII), предпочтительно подвергали взаимодействию со сложным алкиловым эфиром галогенуксусной кислоты или со сложным алкиловым эфиром алкилгалогенуксусной кислоты в присутствии основания.
Сложный алкиловый эфир галогенуксусной кислоты или сложный алкиловый эфир алкилгалогенуксусной кислоты представляет собой обычно используемое соединение, которое может быть легко получено. Из сложных алкиловых эфиров алкилгалогенуксусной кислоты соединение, которое не может быть легко получено, получают путем бромирования сложного алкилового эфира алкилуксусной кислоты. Галоген в настоящем способе представлен атомом хлора, атомом брома и атомом йода.
Растворитель, используемый в этом способе, может представлять собой растворимый отдельный растворитель, выбранный из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этанола и метанола, или смешанный растворитель, полученный путем смешивания этих соединений с 1-10% воды. Наиболее предпочтительный растворитель представляет собой смешанный растворитель, полученный путем смешивания ацетона или диметилсульфоксида с 1-5% воды.
Основание, используемое в этом способе, не ограничено, при условии, что оно не оказывает негативного влияния на реакцию, независимо от того, является оно сильным или слабым, примером которого является гидрид щелочного металла, такой как гидрид натрия и гидрид лития, гидрид щелочноземельного металла, такой как гидрид калия, гидроксид щелочного металла, такой как гидроксид натрия и гидроксид калия, и карбонат щелочного металла, такой как карбонат лития, карбонат калия, бикарбонат калия и карбонат цезия. Из этих соединений карбонат щелочного металла является предпочтительным, и более предпочтительным является карбонат калия.
Температура реакции не ограничивается, вплоть до температуры кипения растворителя. Однако высокая температура не является предпочтительной для ингибирования побочных реакций. Предпочтительная температура реакции составляет 0~90°C. Время реакции меняется в зависимости от температуры реакции, но, как правило, составляет от 30 минут до 1 дня и предпочтительно 30-120 минут.
Способ F-I: Получение соединения, представленного формулой (X)
Для получения соединения, представленного формулой (X), сложный эфир карбоновой кислоты соединения, представленного формулой (IX), гидролизуют в смешанном растворе растворимой неорганической соли и спирта. Или гидролиз сложного эфира осуществляют в смешанном растворе, включающем соединение, представленное формулой (IX), 2,0M гидроксид лития, ТГФ и воду.
Растворитель, используемый в этом способе, представляет собой растворимый растворитель, который можно смешивать с водой, например спирты, такие как метанол и этанол.
Основание, используемое в этом способе, представляет собой водный раствор, полученный путем смешивания гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия и гидроксид калия, с водой в концентрации 0,1-3 н., учитывая тип соли щелочного металла и карбоновой кислоты. Кислота, используемая для получения соединения, представленного формулой (X), представляет собой карбоновую кислоту, предпочтительно водный раствор уксусной кислоты, водный раствор бисульфата натрия (NaHSO4) или 0,1-3 н. водный раствор хлористоводородной кислоты, и более предпочтительным является 0,5M NaHSO4.
Реакцию предпочтительно осуществляют при низкой температуре для ингибирования побочных реакций, которая, как правило, находится в пределах от 0°C до комнатной температуры. Время реакции зависит от температуры реакции, но, как правило, составляет от 10 минут до 3 часов и более предпочтительно от 30 минут до 1 часа. Когда 2,0M гидроксида лития подвергают взаимодействию в смешанном растворе ТГФ и воды, предпочтительная температура реакции составляет 0°C, а предпочтительное время реакции составляет 1-2 часа.
Способ F-2: Получение соединения, представленного формулой (X)
Соединение, представленное формулой (X), получают путем замещения соли сложного аллилового эфира из соединения, представленного формулой (IX), с использованием соли щелочного металла или соли щелочноземельного металла 2-этилгексаноата и металлического катализатора в органическом растворителе.
Растворитель, используемый в этом способе, представляет собой безводный органический растворитель, выбранный из группы, состоящей из хлороформа, дихлорметана и этилацетата.
Металлический катализатор, используемый в этом способе, представляет собой палладийтетракистрифенилфосфин, и предпочтительное содержание такого катализатора составляет 0,01-0,1 эквивалент.
Реакцию предпочтительно осуществляют при низкой температуре для ингибирования побочных реакций, которая, как правило, находится в пределах от 0°C до комнатной температуры. Время реакции зависит от температуры реакции, но, как правило, составляет от 10 минут до 3 часов и более предпочтительно от 30 минут до 1 часа.
Такое солевое соединение можно легко выделить путем центрифугирования или при помощи ионообменной смолы. Полученное соединение соли металла формулы (X) намного легче выделить, чем солевое соединение, полученное способом F-1 (гидролиз).
Полученное соединение γ-типа формулы (I) представляет собой вещество, имеющее очень важное значение в качестве лиганда PPAR белка. Это соединение содержит хиральный углерод, и это говорит о том, что оно также включает стереоизомер этого соединения. Настоящее изобретение включает арильное соединение, представленное формулой (I), и его гидрат, сольват, стереоизомер и фармацевтически приемлемую соль.
Арильное соединение, представленное формулой (I), и его гидрат, сольват, стереоизомер и фармацевтически приемлемую соль по настоящему изобретению можно эффективно использовать в качестве композиции для активатора PPAR. Арильное соединение, представленное формулой (I), и его гидрат, сольват, стереоизомер и фармацевтически приемлемая соль по настоящему изобретению могут активировать PPAR, таким образом, их можно эффективно использовать в качестве фармацевтической композиции для профилактики и лечения артериосклероза, гиперлипидемии, ожирения, диабета, деменции или болезни Паркинсона и для снижения уровня холестерина, для укрепления мышц, для улучшения выносливости и памяти и в качестве композиции для функциональных пищевых продуктов и напитков, пищевых добавок, функциональных косметических средств и корма для животных.
Арильное соединение, представленное формулой (I), и его гидрат, сольват, стереоизомер и фармацевтически приемлемую соль по настоящему изобретению можно использовать для функциональной косметической композиции для профилактики и улучшения состояния ожирения и для функциональной косметической композиции для укрепления мышц и повышения выносливости. Функциональную косметическую композицию для укрепления мышц и повышения выносливости можно сформулировать в виде мази, лосьона или крема для нанесения на участок тела до/после физических упражнений и ее можно использовать в течение продолжительного периода времени для получения желаемого эффекта. Арильное соединение, представленное формулой (I), и его гидрат, сольват, стереоизомер и фармацевтически приемлемую соль по настоящему изобретению можно сформулировать в виде мази и наносить на участок тела для профилактики или лечения диабета или диабетической язвы стопы, так называемой диабетической язвы.
Настоящее изобретение обеспечивает фармацевтическую композицию, функциональное вспомогательное вещество для пищевых продуктов, функциональный напиток, пищевую добавку и композицию корма для профилактики и лечения артериосклероза, деменции и болезни Паркинсона, для укрепления мышц, для повышения выносливости или для улучшения памяти, содержащую активатор PPAR в качестве активного ингредиента.
Настоящее изобретение также обеспечивает способ скрининга активатора для профилактики и лечения артериосклероза, деменции и болезни Паркинсона, укрепления мышц, повышения выносливости и улучшения памяти, который включает стадии добавления средства-кандидата, представляющего собой активатор PPAR, к PPAR; и измерение активности PPAR.
Фармацевтически приемлемая соль в настоящем изобретении включает все фармацевтически приемлемые органические соли, которые могут образовывать соль с карбоновой кислотой соединения формулы (I), и неорганические соли, такие как ионы щелочных металлов и ионы щелочноземельных металлов, примеры которых включают Li+, Na+, K+, Ca2+ и Mg2+.
Терапевтически эффективную дозу соединения, представленного формулой (I), и его гидрата, сольвата, стереоизомера и фармацевтически приемлемой соли по настоящему изобретению можно определить в соответствии с типом соединения, способом введения, целевого субъекта и целевого заболевания, но она определяется в соответствии с принятыми в медицине стандартами. Предпочтительная доза соединения, представленного формулой (I), составляет 1-100 мг/кг (массы тела)/день. Частота введения может быть один или несколько раз в день, в рамках допустимой суточной дозы. Композицию по настоящему изобретению можно вводить перорально или парентерально и использовать в форме традиционных фармацевтических препаратов. Например, композицию по настоящему изобретению можно сформулировать в виде таблеток, порошков, сухих сиропов, жевательных таблеток, гранул, капсул, мягких капсул, пилюль, напитков, сублингвальных препаратов и т.д. Таблетки по настоящему изобретению можно вводить субъекту способом или путем доставки эффективной дозы таблетки с биодоступностью, который представляет собой пероральный путь. И способ введения или путь можно определить в соответствии с характеристиками, стадиями целевого заболевания и другими условиями. Когда композицию по настоящему изобретению получают в виде таблеток, она может дополнительно включать фармацевтически приемлемые эксципиенты. Содержание и характеристики эксципиента можно определить в соответствии с растворимостью и химическими свойствами выбранной таблетки, пути введения и стандартной фармацевтической практикой.
Способ осуществления изобретения
Практические и предпочтительные описанные в настоящей заявке варианты воплощения настоящего изобретения являются иллюстративными, как показано в представленных ниже примерах.
Однако должно быть понятно, что специалисты в данной области, при рассмотрении настоящего раскрытия, могут осуществить модификации и улучшения без отступления от сути и объема настоящего изобретения.
Пример 1: Получение соединения S1
Способ А
468 мг (2 ммоль) 4-йод-2-метилфенола растворяли в 20 мл безводного тетрагидрофурана в присутствии азота и в этот момент температуру поддерживали на уровне 0°C. К смеси медленно добавляли 1,5 мл изопропилмагнийхлорида (2M), с последующим взаимодействием в течение 10 минут. Реакционный раствор охлаждали до -78°С и медленно добавляли к нему 2,00 мл трет-бутиллития (раствор 1,7M в гексане, 1,0 эквивалент). После перемешивания в течение 10 минут к смеси добавляли 64 мг (2 ммоль, 1,0 эквивалент) S в виде твердого вещества при этой же температуре в один прием. Реакция продолжалась в течение 40 минут при повышении температуры до 15°C. 541 мг (2 ммоль, 1,0 эквивалент) 4-хлорметил-4'-трифторметил-бифенила формулы (III) растворяли в 10 мл безводного ТГФ при медленном добавлении при указанной температуре. После взаимодействия в течение еще одного часа реакцию останавливали при помощи раствора хлорида аммония и органический растворитель экстрагировали с использованием этилацетата и раствора хлорида натрия и сушили над сульфатом магния для удаления влаги из органического слоя. После фильтрования растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле с получением 630 мг (выход: 84%) целевого соединения.
1H ЯМР (300 МГц, CDCl3) δ7,67 (c, 4H), δ7,50 (д, 2H), δ7,28 (т, 2H), δ7,13 (c, 1H), δ7,07 (кв, 1H), δ6,68 (д, 1H), δ5,20 (c, 1H), δ4,02 (c, 2H), δ2,17 (c, 3H).
Пример 2: Получение соединения S2
Способ В
748 мг (2 ммоль) соединения S1 и 290 мг (2,0 эквивалента) имидазола полностью растворяли в 20 мл диметилформамида. К смеси добавляли 165 мг (1,1 эквивалент) трет-бутилдиметилсилилхлорида, с последующим перемешиванием при комнатной температуре в течение 4 часов. После завершения реакции органический растворитель экстрагировали с использованием раствора хлорида аммония и этилацетата. Влагу из органического слоя удаляли при помощи сушки над сульфатом магния. Для очистки использовали колонку с силикагелем и растворитель отгоняли при пониженном давлении с получением 928 мг (выход: 95%) целевого соединения.
1H ЯМР (300 МГц, CDCl3) δ7,67 (c, 4H), δ7,50 (д, 2H), δ7,27 (т, 2H), δ7,13 (c, 1H), δ7,05 (кв, 1H), δ6,66 (д, 1H), δ4,04 (c, 2H), δ2,15