Производное тиазола как ppar лиганд и фармацевтический, косметический и диетический пищевой продукт, содержащий его
Иллюстрации
Показать всеИзобретение относится к производному тиазола формулы 1, как активатору рецептора 5, активируемому пролифераторами пероксисом (PPARδ), или его фармацевтически приемлемым солям и к фармацевтической композиции для профилактики и лечения артериосклероза или гиперлипидемии, для повышения уровня липопротеина высокой плотности (HDL), для профилактики и лечения диабета, ожирения, для укрепления мышцы или усиления выносливости, для улучшения памяти или для профилактики и лечения деменции или болезни Альцгеймера или болезни Паркинсона, содержащим такое производное тиазола. 7 н.п. ф-лы, 3 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к производному тиазола, представленному формулой 1, как PPARδ лиганду (рецептор δ, активируемый пролифераторами пероксисом), который может быть использован для лечения ожирения, гиперлипидемии, артериосклероза, диабета, деменции, болезни Альцгеймера и болезни Паркинсона, и использован для укрепления мышц или улучшения памяти, и к фармацевтической композиции, косметической композиции, диетическому пищевому продукту, диетическим напиткам, добавке к пищевому продукту и кормам для животных, содержащих указанное соединение.
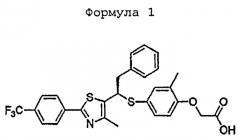
Формула 1
Уровень техники
Среди ядерных рецепторов, как известно, PPAR (рецептор, активируемый пролифераторами пероксисом) имеет три подтипа, которые представляют собой PPARα, PPARγ и PPARδ (Nature, 1990, 347, p645-650., Proc. Natl. Acad. Sci. USA 1994, 91, p7335-7359). PPARα, PPARγ, и PPARδ обладают тканеспецифическими функциями in vivo и различные области для экспрессии. PPARα, главным образом, экспрессирован в сердце, почке, скелетной мышце, толстом кишечнике у людей (Mol. Pharmacol. 1998, 53, p14-22., Toxicol. Lett. 1999, 110, p119-127., J. Biol. Chem. 1998, 273, p16710-16714), и включен в β-окисление пероксисомы и митохондрии (Biol. Cell. 1993, 77, p67-76., J. Biol. Chem. 1997, 272, p27307-27312). PPARγ экспрессирован в скелетной мышце в малом количестве, но, главным образом, экспрессирован в жировой ткани, чтобы вызывать дифференцировку адипоцитов и сохранять энергию в форме жира, и включен в гомеостатическое регулирование инсулина и глюкозы (Moll. Cell. 1999, 4, p585-594., р597-609., p611-617). PPARδ эволюционно сохраняется в теплокровных, включая людей и позвоночных, включающих грызунов и асцидий. Предшествующие исследования подтверждают, что PPARδ играет важную роль в репродуктивной экспрессии клеток (Genes Dev. 1999, 13, p1561-1574) и имеет физиологические функции по дифференцировке нейронных клеток (J. Chem. Neuroanat. 2000, 19, p225-232) в центральной нервной системе (ЦНС/CNS) и заживлению раны с противовоспалительным эффектом (Genes Dev. 2001, 15, p3263-3277., Proc. Natl. Acad. Sci. USA 2003, 100, p6295-6296). Недавние исследования также подтверждают, что PPARδ включен в дифференцировку адипоцитов и метаболизм липидов (Proc. Natl. Acad. Sci. USA 2002, 99, p303-308., Mol. Cell. Biol. 2000, 20, p5119-5128). Например, PPARδ активирует экспрессию ключевого гена, включенного в β-окисление в катаболизме жирных кислот, и разобщение белков (UCP), гена, включенного в энергетический метаболизм, который вносит эффект в положительную динамику ожирения (Nature, 2000, 406, p415-418., Cell 2003, 113, p159-170). Активация PPARδ повышает уровень HDL (липопротеин высокой плотности), дает положительную динамику по диабету типа 2 без изменений массы (Proc. Natl. Acad. Sci. USA 2001, 98, p5306-5311, 2003, 100, p15924-15929, 2006, 103, p3444-3449) и способствует лечению артериосклероза ингибированием гена, связанного с артериосклерозом (Science, 2003, 302, p453-457). Поэтому PPARδ лиганд может разрабатываться как лекарственное средство для лечения метаболических заболеваний, таких как ожирение, диабет, гиперлипидемия и артериосклероз.
PPARδ регулирует митохондриальный биосинтез. Когда PPARδ искусственно продолжительно экспрессировали в мышцах мыши, митохондриальный биосинтез повышался и значительно увеличивалось мышечное волокно типа I в дополнение к увеличению β-оксидазы жирных кислот. Поэтому продолжительность постоянного беганья и расстояние повышались соответственно до 67% и 92% при сравнении с мышью дикого типа (PloS Biology, 1004, 1:e294). Повышение митохондриального биосинтеза имеет положительное влияние на усиление функции головного мозга. Если митохондрия в клетке головного мозга разрушена окислительным стрессом, то значительно снижается память (Proc. Natl. Acad. Sci. USA 2002, 99, p2356-2361). Деменция, болезнь Альцгеймера и болезнь Паркинсона представляют собой соответствующие дегенеративные заболевания, которые показывают значительное снижение к обучению и памяти. Поэтому митохондриальное пролиферирующее средство, разработанное в данном изобретении, не только дает вклад в улучшение памяти, но также может быть разработано как терапевтическое средство для болезни Альцгеймера и болезни Паркинсона.
Разработанные синтетические PPARδ лиганды до сих пор имеют меньшую селективность по сравнению с другими PPARα и PPARγ лигандами. Ранее созданный селективный лиганд представлял собой L-631033, разработанный фирмой Merk (J. Steroid Biochem. Mol. Biol. 1997, 63, p1-8), который был получен введением функциональной группы, способной фиксировать боковую цепь на основе морфологии ее природной жирной кислоты. Та же самая группа исследователей позже сообщала о более эффективном лиганде L-165041 (J. Med. Chem. 1996, 39, p2629-2654), в котором соединение, известное как лейкотриеновый агонист, функционирует, чтобы активировать PPARδ человека. Данное соединение проявляет высокую селективность к hPPARδ, которая равна 10-кратной селективности PPARα или PPARγ. И ЕС50 данного соединения составляла 530 нМ. Другие лиганды L-796449 и L-783483 имеют улучшенную аффинность (ЕС50=7,9 нМ), но едва имеют селективность к другим hPPAR подтипам.
Glaxo-Smith-Kline опубликовал сведения о GW2433 (Chem Biol. 1997, 4, p909-918), PPARα активатора, который представляет собой лиганд Y-типа, содержащий структуру, аналогичную кристаллической структуре кармана PPARδ лиганда. В отличие от обычных лигандов, известных до сих пор, данный лиганд имеет структуру Y-типа, содержащую бензольное кольцо, которое способствует пространственному присоединению к карману PPARδ лиганда. Однако данный лиганд представляет собой двойственно-активный лиганд, имеющий активность к hPPARα, также предполагая, что селективность к PPARδ понижена. PPARδ селективный лиганд GW501516 ([2-метил-4-[[[4-метил-2-[4-(трифторметил)фенил]1,3-тиазол-5-ил]метил]сульфанил]фенокси]уксусная кислота), недавно разработанный GlaxoSmithKline, проявляет лучший физиологический эффект, чем любые другие лиганды, созданные ранее (Proc. Natl. Acad. Sci. USA 2001, 98, p5306-5311).
Данное соединение GW501516 обладает отличной аффинностью (1-10 нМ) к PPARδ и отличной селективностью к PPARα или PPARγ также, которая составляет, по меньшей мере, 1000-кратную селективность более ранних лигандов.
Однако PPARδ активность, вызываемая всеми лигандами, созданными до сих пор, является результатом только 30-40% общих лигандносвязывающих карманов.
WO 2001-00603, заявленная группой Glaxo, описывает соединение, представленное следующей формулой А, содержащей GW501516 в качестве селективного активатора PPARδ. Однако данное описание включает только часть тест-результатов соединения GW501516 с использованием резус/Rhesus модели.
Формула А
в которой R'означает CF3 или F, R'' означает H, CH3 или Cl, и R''' означает H, CH3 или CH2CH3.
Производное тиазола, представленное формулой В, в качестве PPARδ селективного активатора было описано в заявке WO 2002-62774, поданной группой Glaxo.
Формула В
Заявка WO 2003-072100, поданная фирмой Eli Lilly, описывает фармацевтическую композицию для селективного регулирования PPARδ, содержащую соединение, представленное следующей формулой С:
Формула С
Однако данное описание только декларирует, что данная композиция была получена, которая получена как рацемат, но не как оптический изомер, содержащий два типа. И данный документ только описывает М++1 величину по данным масс-спектрометрии полученного рацемата, который подтвержден с помощью 1Н-ЯМР и действует как селективный активатор PPARδ, но отсутствует упоминание о фармакологическом эффекте в качестве селективного активатора PPARδ.
Раскрытие
Техническая проблема
Авторы настоящего изобретения получили оптически-активное соединение, обладающее высокой PPARδ селективностью среди рацемических соединений производного тиазола, описанного в WO 2003-072100. Поэтому предмет данного изобретения состоит в том, чтобы предложить оптически-активное соединение, обладающее высокой PPARδ селективностью, и фармацевтическую композицию, функциональную косметическую композицию и композицию для диетического пищевого продукта и кормов для животных, содержащую оптически-активное соединение производного тиазола.
Техническое решение
Данное изобретение относится к производному тиазола, представленному формулой 1, как PPARδ лиганду (рецептор δ, активируемый пролифераторами пероксисом), который может быть использован для лечения ожирения, гиперлипидемии, артериосклероза, диабета, деменции, болезни Альцгеймера и болезни Паркинсона, и для укрепления мышц или улучшения памяти и для фармацевтической композиции, косметической композиции, и композиции диетического пищевого продукта и кормов для животных, содержащей указанное соединение.
Формула 1
Заявка WO 2003-072100 описывает производное тиазола, представленное формулой С. Но она только описывает М++1 величину по данным масс-спектрометрии полученного рацемата, который подтвержден с помощью 1Н-ЯМР и действует как селективный активатор PPARδ; она не описывает фармакологический эффект в качестве селективного активатора PPARδ.
Формула С
Вышеприведенное соединение формулы С содержит хиральный атом углерода и таким образом имеются его стереоизомеры.
Авторы настоящего изобретения утверждают, что изомер R-формы, представленный формулой 1, оптически активный изомер рацемического соединения формулы С, обладает высокой селективной активностью к PPARδ, но изомер S-формы, представленный формулой 2, показывает значительно пониженную активность к PPARδ.
Формула 2
Таким образом, соединение формулы 1 данного изобретения рассматривается как селективное изобретение в отношении заявки WO 2003-072100.
Соединение, представленное формулой 1 данного изобретения, может быть получено следующими реакциями для формулы 1.
Реакции для формулы 1
где R1 представляет собой защитную группу фенола, которая может быть С1-С4низшей алкильной, аллильной, алкилсилильной, алкиларилсилильной или тетрагидропиранильной; R2 представляет собой защитную группу карбоновой кислоты, содержащую С1-С4-алкил или аллил; Х1 представляет собой атом брома или атом иода; Х2 и Х3 независимо представляют собой атом хлора, атом брома, атом иода или удаляемую группу, обладающую реакционной способностью с нуклеофильным замещением.
Далее в настоящем документе способ получения соединения изобретения описан подробно. Однако нижеследующие описания не могут ограничивать ни объем, ни сущность данного изобретения.
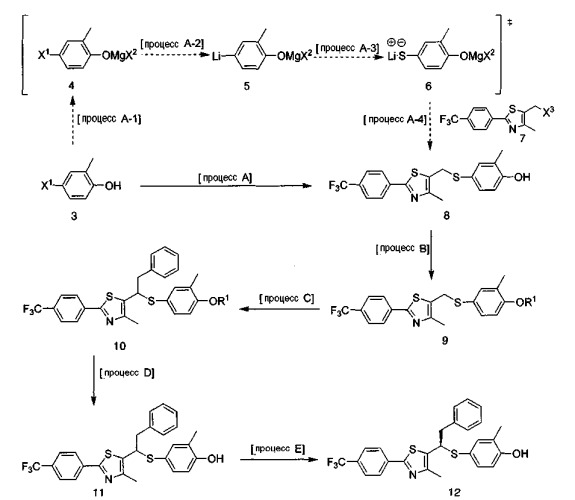
[Процесс А] Получение соединения, представленного формулой 8
Для получения соединения, представленного формулой 8, 4-галоген-2-метилфенол, соединение, представленное формулой 3, обрабатывали реактивом Гриньяра, чтобы защитить фенольную группу без самостоятельного процесса выделения, и подвергали взаимодействию с металлорганическим реагентом и S постадийно, и наконец подвергали взаимодействию с соединением, представленным формулой 7. Данный процесс имеет 4 подстадии реакций, протекающих подряд.
Данные подстадии реакций описаны подробно в настоящем документе далее.
(Процесс А-1): безводный растворитель, используемый в данном процессе, выбирают из группы, состоящей из таких отдельных растворителей, как диэтиловый эфир, тетрагидрофуран, гексан и гептан, и из смешанных растворителей, содержащих, по меньшей мере, два из данных растворителей. В большей степени предпочитают выбирать диэтиловый эфир, тетрагидрофуран, или смешанный растворитель, содержащий диэтиловый эфир и тетрагидрофуран в качестве безводного растворителя.
Реактив Гриньяра, используемый в данном описании, может быть выбран из группы, состоящей из метил-, этил-, н-пропил-, изо-пропил-, н-бутил-, втор-бутилмагнийхлорида (R2MgCl) и алкилмагнийбромида (R2MgBr). Среди перечисленных соединений изо-пропилмагнийхлорид [(CH3)2CHMgCl] является самым предпочтительным.
Температура реакции зависит от растворителя, но обычно ее устанавливают при -20~40°С, и предпочтительно при 0°С~комнатная температура (25°С). Время реакции зависит от температуры реакции и растворителя, но обычно оно составляет 10-60 минут и предпочтительно 10-30 минут.
(Процесс А-2 и процесс А-3): металлорганический реагент, используемый для замещения галогена литием, может быть выбран из группы, состоящей из н-бутиллития, втор-бутиллития и трет-бутиллития. Среди перечисленных соединений трет-бутиллитий является самым предпочтительным.
Предпочитают S в виде мелких частиц, которую непосредственно добавляют в растворитель.
Температура реакции зависит от растворителя, но обычно ее устанавливают при -78 ~ 25°С. Температура реакции для замещения галогена на металл предпочтительно равна -75°С, и температура для введения S находится в интервале -75 ~ комнатная температура (25°С). Для реакции замещения галогена на металл требуется 10-30 минут и для реакции введения S требуется 30-90 минут.
(Процесс А-4): 5-галогенметил-4-метил-2-[4-(трифторметил)фенил]тиазол, соединение, представленное формулой 7, используемое в данном процессе, получали известным способом (WO 03/106442). Галоген данного соединения, представленного формулой 7, выбирают из группы, состоящей из хлора, брома и иода. И среди перечисленных галогенов хлор является самым предпочтительным.
Температура реакции зависит от растворителя, но обычно ее устанавливают при -78 ~ 25°С, предпочтительнее, при 0 ~ 10°С. Время реакции обычно составляет 10-120 минут и, предпочтительно, 10-60 минут.
[Процесс В] Получение соединения, представленного формулой 9
Для получения соединения, представленного формулой 9, соединение, представленное формулой 8, предпочтительно подвергают взаимодействию с соединением, используемым в качестве защитной группы фенола, в присутствии основания.
Апротонный полярный растворитель, используемый в данном процессе, выбирают из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этилацетата, четыреххлористого углерода, хлороформа и дихлорметана. Простой эфир в данном описании может быть выбран из группы, состоящей из тетрагидрофурана, диоксана, диметоксиэтана, диэтиленгликольдиметилового эфира и триэтиленгликольдиметилового эфира. Ароматический углеводород представлен бензолом, толуолом и ксилолом. В качестве растворителя в данном описании предпочитают апротонный полярный растворитель, и особенно N,N-диметилформамид, хлороформ или дихлорметан являются более предпочтительными.
Основание в данном описании представляет собой амин, включающий пиридин, триэтиламин, имидазол и N,N-диметиламинопиридин. Для реакции алкильной или аллильной этерифицированной защитной группы используют такие основания как гидроксид натрия, гидроксид калия, карбонат натрия и карбонат калия. В особенности, имидазол и карбонат калия являются более предпочтительными.
Алкилсилилгалогенид или алкиларилсилилгалогенид используют в качестве силильной защитной группы и 3,4-дигидро-2Н-пиран используют в качестве тетрагидропиранильной защитной группы.
Температура реакции зависит от растворителя, но обычно ее устанавливают при 10 ~ 80°С, предпочтительнее при 0°С ~ комнатная температура (25°С). Время реакции зависит от температуры реакции и растворителя, но обычно требуется от одного часа до одних суток. В большей степени предпочитают заканчивать реакцию в течение 4 часов.
[Процесс С] Получение соединения, представленного формулой 10
Для получения соединения, представленного формулой 10, α-протон простого тиоэфира соединения, представленного формулой 9, обрабатывают сильной щелочью с получением нуклеофила, который подвергают взаимодействию с различными электрофилами.
Безводный растворитель, используемый в данном процессе, выбирают из группы, состоящей из таких отдельных растворителей, как диэтиловый эфир, тетрагидрофуран, гексан и гептан, и из смешанных растворителей, содержащих, по меньшей мере, два из данных растворителей. В большей степени предпочитают выбирать диэтиловый эфир, тетрагидрофуран или смешанный растворитель, содержащий диэтиловый эфир и тетрагидрофуран в качестве безводного растворителя.
Сильную щелочь, используемую для извлечения α-протона, выбирают из группы, состоящей из трет-бутоксида калия (t-BuOK), диизопропиламида лития (LDA), н-бутиллития, втор-бутиллития и трет-бутиллития и среди данных соединений диизопропиламид лития (LDA) является самым предпочтительным.
Электрофил, реагирующий с нуклеофилом тиоэфира, представляет собой бензилгалогенид.
Температура реакции зависит от растворителя, но обычно находится в интервале -78 ~ 25°С. В большей степени предпочитают выполнять реакцию извлечения α-протона в присутствии сильной щелочи при -75°С, при которых добавляют электрофил. Затем температуру медленно поднимают до комнатной температуры (25°С). Временной период реакции отличается в зависимости от каждой стадии реакции. Например, для извлечения α-протона сильной щелочью требуется 10-30 минут, и для реакции с электрофилом требуется 30-90 минут.
[Процесс D] Получение соединения, представленного формулой 11
Соединение, представленное формулой 11, получают элиминированием защитной группы фенола из соединения, представленного формулой 10.
Полярный растворитель, используемый в данном процессе, выбирают из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этилацетата, четыреххлористого углерода, хлороформа и дихлорметана. Простой эфир в данном описании может быть выбран из группы, состоящей из тетрагидрофурана, диоксана, диметоксиэтана и диэтиленгликольдиметилового эфира. Спирт может представлять собой метанол или этанол. Ароматический углеводород представлен бензолом, толуолом и ксилолом. В качестве растворителя в данном описании предпочитают полярный растворитель и, особенно, тетрагидрофуран является более предпочтительным.
Для элиминирования защитной группы фенола, особенно для элиминирования метильной, этильной, трет-бутильной, бензильной или аллилэфирной защитной группы, используют триметилсилилиодид, натриевую соль этантиоспирта, лития иодид, алюминия галогенид, бора галогенид или кислоту Льюиса, такую как трифторуксусная кислота, и для элиминирования силильной защитной группы, такой как триметилсилильная, трет-бутилдифенилсилильная, триизопропилсилильная и трет-бутилдиметилсилильная, используют фторид, такой как фторид тетрабутиламмония (Bu4N+F-), галогенводородную кислоту (фтористоводородную кислоту, хлористоводородную кислоту, бромистоводородную кислоту или иодистоводородную кислоту) или фторид калия. Предпочитают применять фторид, чтобы элиминировать силильную защитную группу и в большей степени предпочитают применять фторид тетрабутиламмония.
Температура реакции зависит от способа и растворителя, но обычно находится в интервале 0 ~ 120°С, и, предпочтительно, в интервале 10 ~ 25°С. Временной период реакции зависит от температуры реакции, но обычно требуется от 30 минут до одних суток. В большей степени предпочитают заканчивать реакцию в течение 2 часов.
[Процесс Е] Получение соединения, представленного формулой 12
Данное соединение получают выделением R-изомера, представленного формулой 12, и другого изомера, S-изомера, из рацемического соединения формулы 11. Данное разделение выполняют с помощью ВЭЖХ, используя колонку с нормальной хиральной фазой. Для этого случая данный растворитель представляет собой смешанный растворитель, содержащий неполярные растворители, такие как гексан, гептан и пентан, и полярные растворители, такие как этанол и изопропиловый спирт.
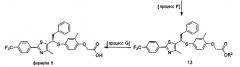
[Процесс F] Получение соединения, представленного формулой 13
Для получения соединения, представленного формулой 13, соединение, представленное формулой 12, подвергают взаимодействию предпочтительно с галогенацетаталкиловым сложным эфиром или с галогенацетаталлиловым сложным эфиром в присутствии основания.
Галогенацетаталкиловый сложный эфир или галогенацетаталлиловый сложный эфир представляет собой обычное соединение, которое может быть легко получено. Галоген в данном случае представлен атомом хлора, атомом брома и атомом иода. Предпочтительно используют бромацетатметиловый сложный эфир, бромацетаталлиловый сложный эфир или бромацетатэтиловый сложный эфир в качестве галогенацетаталкилового сложного эфира или галогенацетаталлилового сложного эфира.
Используемый растворитель в данном процессе может представлять собой отдельный растворитель, выбираемый из группы, состоящей из N,N-диметилформамида, N,N-диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона, этанола и метанола, или смешанный растворитель, полученный смешиванием данных растворителей с 1-10% воды. Самый предпочтительный растворитель является смешанным растворителем, полученным смешиванием ацетона или диметилсульфоксида с 1-5 % воды.
Основание, используемое в данном процессе, не ограничивают, поскольку оно не оказывает вредное влияние на данную реакцию, безотносительно к тому, сильное оно или слабое, и оно представлено гидридом щелочного металла, таким как гидрид натрия и гидрид лития, гидридом щелочноземельного металла, таким как гидрид калия, гидроксидом щелочного металла, таким как гидроксид натрия и гидроксид калия, и карбонатом щелочного металла, таким как карбонат лития, карбонат калия, бикарбонат калия и карбонат цезия. Среди данных соединений, предпочитают карбонат щелочного металла, и карбонат калия является в большей степени предпочтительным.
Температуру реакции не ограничивают, но только вплоть до температуры кипения растворителя. Однако высокая температура не является предпочтительной, чтобы ингибировать побочные реакции. Предпочитаемая температура реакции находится в интервале 0-60°С. Временной период реакции отличается от температуры реакции, но обычно составляет 30 минут-1 сутки и, предпочтительно, 30-90 минут.
[Процесс G] Получение соединения, представленного формулой 1
Соединение, представленное формулой 1, получают из соединения, представленного формулой 13, гидролизом сложного эфира карбоновой кислоты данного соединения в смешанном растворе растворимой неорганической соли и спирте, или соли получают из аллилового сложного эфира в присутствии палладиевого катализатора.
Растворитель, используемый в данном процессе, представляет собой растворитель, который может быть смешан с водой, например спирт, такой как метанол или этанол. Неорганическая соль, используемая в данном процессе, представляет собой водный раствор, полученный смешиванием гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия и гидроксид калия, с водой в концентрации 0,1-3 Н, с учетом типа щелочной соли карбоновой кислоты. Кислота, используемая для получения соединения, представленного формулой 13 в форме карбоновой кислоты, представляет собой предпочтительно водный раствор уксусной кислоты или 0,1-3 Н водный раствор хлористоводородной кислоты.
Данную реакцию предпочтительно проводят при низкой температуре, чтобы ингибировать побочные реакции, которая обычно находится в интервале 0°С-комнатная температура. Временной период реакции зависит от температуры реакции, но обычно составляет 10 минут-3 часа и, предпочтительнее, 30 минут-1 час.
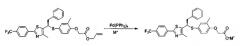
Фармацевтически приемлемую соль соединения, представленного формулой 1, получают замещением соли сложного аллилового эфира из соединения, представленного формулой 13, используя палладийтетракистрифенилфосфиновый катализатор и соль металла согласно реакции формулы 2. Растворитель, используемый в данном процессе, выбирают из группы, состоящей из хлороформа, четыреххлористого углерода, дихлорметана, тетрагидрофурана и этилацетата. Катализатор, используемый в данном процессе, представляет собой палладийтетракистрифенилфосфин. Соль для замещения соли представляет собой 2-этилгексаноат калия или 2-этилгексаноат натрия.
Реакция для формулы 2
Данное полученное соединение, содержащее S, представленное формулой 1, является очень важным продуктом в качестве PPARδ белкового лиганда.
Данное изобретение включает соединение, представленное формулой 1, его сольваты и соли, которые могут быть эффективно применены в качестве активаторной композиции рецептора δ (PPARδ), активируемого пролифераторами пероксисом. Определенно соединение, представленное формулой 1 данного изобретения, и его фармацевтически приемлемые соли могут быть очень эффективными в качестве фармацевтической композиции для лечения и профилактики артериосклероза или гиперлипидемии; для повышения липопротеида высокой плотности (HDL); для лечения и профилактики диабета; для лечения и профилактики ожирения; для укрепления мышцы или усиления выносливости; для улучшения памяти; для лечения и профилактики деменции или болезни Паркинсона; и в качестве композиции для добавок в диетические пищевые продукты, диетические напитки, добавок в пищевые продукты и корма для животных. Соединение, представленное формулой 1, или его фармацевтически приемлемые соли данного изобретения могут быть использованы для функциональной косметической композиции с целью профилактики или положительной динамики ожирения и для функциональной косметической композиции с целью укрепления мышцы и усиления выносливости. Функциональная косметическая композиция для укрепления мышцы и усиления выносливости может быть приготовлена как мазь, лосьон, крем или гель, предназначенная для применения на часть тела перед/после физической нагрузки, и может быть использована в течение длительного периода, чтобы вызывать желаемый эффект. Соединение, представленное формулой 1, или его фармацевтически приемлемые соли данного изобретения могут быть приготовлены как мазь и применены на часть тела для профилактики или лечения диабета или язвы диабетической стопы, так называемой диабетической язвы.
Данное изобретение также относится к активаторной композиции рецептора δ (PPARδ), активируемого пролифераторами пероксисом, содержащей производное тиазола, представленное формулой 1, или его фармацевтически приемлемые соли в качестве активного ингредиента.
Фармацевтически приемлемая соль в данном описании включает все соли, которые способны образовать соль с карбоновой кислотой соединения формулы 1 и ионами щелочного металла или ионами щелочноземельного металла, которые иллюстрированы посредством Li+, Na+, K+, Ca2+ и т.д.
Эффективная доза соединения, представленного формулой 1, или его фармацевтически приемлемых солей данного изобретения может быть определена согласно типу соединения, методу введения, целевому субъекту и целевому заболеванию, но определяется на основе обычного медицинского стандарта. Предпочитаемая доза соединения, представленного формулой 1, находится в интервале 1-100 мг/кг (масса тела)/сутки. Частота введения может быть один или несколько раз в сутки в пределах допускаемой дозировки в сутки. Композицию данного изобретения можно вводить перорально или парентерально и можно использовать в обычных формах фармацевтического препарата. Например, композиция данного изобретения может быть приготовлена в виде таблеток, порошков, сухих сиропов, жевательных таблеток, гранул, капсул, мягких капсул, пилюль, напитков, подъязычных препаратов и т.д. Таблетки данного изобретения могут быть введены субъекту способом или путем, который доставляет эффективную дозу таблетки с биодоступностью, которая равна таковой при пероральном пути. И способ введения или путь может быть определен согласно характеристикам, стадиям целевого заболевания и другим состояниям. Когда композицию данного изобретения формируют в виде таблеток, она может дополнительно включать один или несколько фармацевтически приемлемых эксципиентов. Содержание и характеристики эксципиента могут определяться растворимостью и химическими свойствами выбранной таблетки, путем введения и обычной фармацевтической практикой.
Соединение формулы 1 данного изобретения может быть внесено в добавки для диетических пищевых продуктов или в диетические напитки для профилактики или положительной динамики гиперлипидемии; для повышения липопротеина высокой плотности (HDL); для профилактики и положительной динамики диабета; для профилактики и положительной динамики ожирения; для укрепления мышцы или усиления выносливости; для улучшения памяти; для профилактики и положительной динамики деменции или болезни Паркинсона. В данном случае содержание соединения в этих диетических пищевых продуктах и напитках может быть установлено согласно цели и применению. Кроме ингредиентов, упоминаемых выше, соединение, представленное формулой 1 данного изобретения, может содержать разнообразные питательные вещества, витамины, минералы (электролиты), ароматизаторы/вкусовые добавки, включающие природные ароматизаторы и синтетические ароматизаторы, окрашивающие средства и наполнители (пластовый мармелад, шоколад и т.д.), пектиновую кислоту и ее соли, альгиновую кислоту и ее соли, органическую кислоту, защитные коллоидные загустители, регуляторы рН, стабилизаторы, антисептики, глицерин, спирты, карбонизаторы (науглероживатели), которые используются для добавления к соде, и т.д.
Наилучший способ
Практические и в настоящее время предпочтительные варианты осуществления данного изобретения проиллюстрированы, как показано в следующих примерах.
Однако следует определить, что специалисты в данной области при рассмотрении данного описания могут делать модификации и улучшения в пределах сущности и объема данного изобретения.
Пример 1: получение соединения формулы 8 (процесс А)
500 мг (2,14 ммоль) 4-иод-2-метилфенола растворяли в 20 мл безводного тетрагидрофурана в присутствии азота и в этот период температуру устанавливали при 0°С. К содержимому медленно добавляли 1,1 мл изопропилмагнийхлорида (2 М эфирный раствор, 2,16 ммоль), затем следовала реакция в течение 10 минут. Реакционный раствор охлаждали ниже -78°С, к которому медленно добавляли 2,77 мл трет-бутиллития (1,7 М-гептановый раствор, 4,70 ммоль). После взаимодействия в течение 20 минут к содержимому медленно добавляли 69 мг S (2,14 ммоль), затем следовала дополнительная реакция до тех пор, пока температура реагирующего вещества не достигала 15°С. 40 минут спустя, 624 мг (2,14 ммоль) 5-хлорметил-4-метил-2-[(4-трифторметил)фенил]тиазола, представленного формулой 7, растворяли в 2 мл безводного ТГФ, и этот раствор медленно добавляли в реакционную смесь при той же самой температуре. Спустя более одного часа взаимодействия, реакцию завершали добавлением 20 мл раствора хлорида аммония. Органический слой отделяли и сушили над сульфатом магния. После фильтрования смеси растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=3/1, об./об.) с получением 728 мг (выход: 86%) требуемого соединения.
1H ЯМР (300 МГц, CDCl3) δ 7,96 (д, 2H, J=8,1 Гц), 7,65 (д, 2H, J=8,3 Гц), 7,19 (д, 1Н, J=1,5 Гц), 7,01 (дд, 1Н, J=8,2, 2,0 Гц), 6,62 (д, 1Н, J=8,2 Гц), 5,86 (ушир.с, 1Н), 4,07 (с, 2H), 2,19 (с, 3H), 2,12 (с, 3H).
13C ЯМР (75,5 МГц, CDCl3) δ 163,9, 155,5, 151,7, 137,4, 136,9, 133,5, 131,9 (кв, J=32,6 Гц), 131,7, 126,8, 126,3, (кв, J=3,9 Гц), 125,8, 123,8, 115,7, 33,2, 16,2, 14,8.
Пример 2: получение соединения формулы 9 (R 1 =трет-Bu(CH 3 ) 2 Si-, процесс B)
500 мг (1,26 ммоль) соединения формулы 8 и 171 мг (2,52 ммоль) имидазола полностью растворяли в 5 мл диметилформамида. В данный раствор медленно добавляли 209 мг (1,38 ммоль) трет-бутилдиметилсилилхлорида с последующим перемешиванием при комнатной температуре в течение 4 часов. После завершения реакции органический растворитель экстрагировали с использованием раствора хлорида аммония и этилацетата. Влагу органического слоя сушили над сульфатом магния. После фильтрования смеси растворитель отгоняли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=10/1, об./об.) с получением 610 мг (выход: 95%) требуемого соединения.
1H ЯМР (300 МГц, CDCl3): 7,97 (д, 2H, J=8,1 Гц), 7,65 (д, 2H, J=8,2 Гц), 7,19 (д, 1Н, J=1,9 Гц) 7,07 (м, 1Н), 6,69 (д, 1Н, J=8,3 Гц), 4,11 (с, 2H), 2,21 (с, 3H), 2,11 (с, 3H), 1,01 (с, 9H), 0,21 (с, 6H).
13C ЯМР (75,5 МГц, CDCl3): δ 163,2, 154,7, 151,5, 137,1, 136,6, 133,3, 132,4, 131,7, 131,2, 131,0, 130,2, 129,2, 126,6, 126,1, 126,06, 126,01, 125,9, 124,9, 119,4, 32,8, 25,9, 18,5, 16,9, 15,0, -4,0.
Пример 3: получение соединения формулы 10 (R 1 =трет-Bu(CH 3 ) 2 Si- процесс С)
300 мг (0,59 ммоль) соединения (R1=трет-Bu(CH3)2-) формулы 9, приготовленного в примере 2, растворяли в 5 мл безводного тетрагидрофурана в присутствии азота и температуру снижали до -78°С. В реакционную смесь медленно добавляли 619 мкл (2,0 М эфирный раствор, 1,24 ммоль) раствора диизопропиламида лития, затем следовала реакция в течение 10 минут. Затем к реакционному раствору добавляли 77 мкл (0,65 ммоль) бензилбромида с последующим перемешиванием в течение 30 минут при той же самой температуре (-78°С). Реакцию завершали добавлением 5 мл раствора хлорида аммония. Влагу органического слоя сушили над сульфатом магния. После фильтрования смеси растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=10/1, об./об.) с получением 265 мг (выход: 75%) требуемого соединения.
1H ЯМР (300 МГц, CDCl3): δ 7,97 (д, 2H, J=8,1 Гц), 7,65 (д, 2H, J=8,2 Гц), 7,03-7,26 (м, 7H) 6,63 (д, 1Н, J=8,3 Гц), 4,51 (дд, 1Н, J=9,8, 5,3 Гц), 3,37 (дд, 1Н, J=9,8, 5,3 Гц), 3,05 (дд, 1Н, J=13,6, 9,9 Гц), 2,10 (с, 3H), 1,83 (с, 3H), 0,98 (с, 9H), 0,18 (с, 6H).
13C ЯМР (75 МГц, CDC13): δ 163,5, 155,1, 151,8, 138,4, 137,7, 136,5, 133,5, 130,3, 129,3, 128,9, 127,2, 126,8, 126,7, 126,2, 126,1, 124,5, 119,4, 49,2, 44,4, 26,1, 18,7, 17,1, 15,1, -3,81, -3,84.
Пример 4: получение соединения формулы 11 (процесс D)
200 мг (0,33 ммоль) соединения (R1=трет-Bu(CH3)2Si-) формулы 10, приготовленного в примере 3, растворяли в 5 мл безводного тетрагидрофурана в присутствии азота. В реакционную смесь при комнатной температуре медленно добавляли 660 мкл (0,66 ммоль) тетрабутиламмонийфторида в виде 1 М тетрагидрофуранового раствора с последующим перемешиванием в течение 1 часа. После завершения реакции органический слой отделяли добавлением этилацетата и воды. Влагу органического слоя сушили над сульфатом магния. После фильтрования смеси растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=5/1, об./об.) с получением 146 мг (выход: 91%) требуемого соединения.
1H ЯМР (500 МГц, CDCl3): δ 7,92 (д, 2H, J=8,2 Гц), 7,50 (с, 1Н), 7,59 (д, 2H, J=8,2 Гц), 7,07-7,22 (м, 6H), 6,85(м, 1Н), 6,44 (д, 1Н, J=8,2 Гц), 4,47 (дд, 1Н, J=9,7, 5,4 Гц), 3,39 (дд, 1Н, J=13,8, 5,4 Гц), 3,06 (дд, 1Н, J=13,8, 9,8 Гц), 2,12 (с, 3H), 1,73 (с, 3H).
13C ЯМР (125 МГц, CDCl3): δ 164,1, 155,7, 151,2, 138,0, 137,9, 137,0, 136,4, 133,8, 131,8, 131,5, 129,0, 128,6, 127,2, 127,0, 126,6, 126,14, 126,11, 125,7, 125,0, 122,9, 122,7, 115,2, 60,8, 49,1, 43,7, 21,2, 15,9, 14,3, 14,2.
Пример 5: получение соединения формулы 12 (процесс Е)
90 мг соединения формулы 11, полученного в примере 4, поступало для полуразделения на колонку ВЭЖХ с хиральной фазой (chiralpack AD-H) c получением 45 мг требуемого соединения, представленного формулой 12 в R-форме и 45 мг его соответствующего изомера в S-форме.
Подвижная фаза: гексан/изопропиловый спирт: 90/10.
Скорость потока: 3 мл/мин.
Пример 6: получение соединения формулы 13 (процесс F)
20 мг соединения формулы 12, полученного в примере 5, хорошо смешивали с 10 мл ацетона, содержащего 5% воды и 127 мг (0,9 ммоль, 2,3 эквивалента) карбоната калия при комнатной температуре. В реакционную смесь добавляли 67 мкл (0,6 ммоль, 1,5 эквивалента) бромацетатэтилового сложного эфира с посл