Новый лейкопластырный препарат
Иллюстрации
Показать всеИзобретение относится к медицине, конкретно к лейкопластырному препарату для введения через поверхность кожи 2-(4-этил-1-пиперазинил)-4-(4-фторфенил)-5,6,7,8,9,10-гексагидроциклоокта[b]пиридина (соединения А). Препарат включает адгезивный слой, сформированный на одной поверхности подложки, где адгезивный слой содержит (1) соединение А или его физиологически приемлемую соль, образованную присоединением кислоты, и (2) акриловый адгезив, или (1) соединение А или его физиологически приемлемую соль, образованную присоединением кислоты, (2) акриловый адгезив и (3) усилитель проницаемости. Препарат ингибирует генерацию метаболита и способен непрерывно поддерживать уровень лекарственного средства в крови. 18 з.п. ф-лы, 7 табл., 1 ил., 63 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к лейкопластырному препарату, предназначенного для всасывания через поверхность кожи. Более конкретно, оно относится к лейкопластырному препарату, включающему 2-(4-этил-1-пиперазинил)-4-(4-фторфенил)-5,6,7,8,9,10-гексагидроциклоокта[b]пиридин в качестве активного ингредиента, который может непрерывно поддерживать концентрацию соединения в крови, когда лейкопластырный препарат нанесен на поверхность кожи.
Уровень техники
2-(4-Этил-1-пиперазинил)-4-(4-фторфенил)-5,6,7,8,9,10-гексагидроциклоокта[b]пиридин (далее называемый как «блонансерин»), который представляет собой антагонист серотонина и допамина (SDA), был раскрыт в патенте JP-B-7(1995)-47574. Блонансерин применяется как антипсихотическое средство, поскольку он обладает более высокой аффинностью к допаминовому D2-рецептору и серотониновому 5-НТ2-рецептору, чем галоперидол, который представляет собой существующий антипсихотическое препарат.
Относительно орального введения блонансерина животным, авторы статьи Michiaki Matsuda, et al., J. Pharm. Biomed. Anal., 15, 1449-1456, 1997 (далее называемой как «Ссылка 1») описывают профиль уровня блонансерина в крови во времени и его метаболизм, где представлено, что блонансерин, введенный орально животным, таким как крыса, метаболируется до своего метаболита ввиду эффекта первого прохождения.
В общем, введение всасыванием через поверхность кожи известно как введение, которое характеризуется поддержанием концентрации лекарственного средства в крови на более постоянном уровне, чем путь орального введения, и исключением эффекта первого прохождения. В дополнение, введение всасыванием через поверхность кожи также имеет то преимущество, что оно не зависит от режима питания. В частности, лейкопластырный препарат, который представляет собой один из вариантов трансдермального способа введения, применим из тех соображений, что его легко контролировать в плане введения и прерывания введения.
В качестве состава для всасывания через поверхность кожи, включающего антипсихотическое средство, уже были известны состав для трансдермального введения, включающий оланзапин (заявка WO 97/09985), состав для трансдермального введения, включающий рисперидон (заявка WO 96/31201), и состав для трансдермального введения, включающий пероспирон (заявка WO 2006/025516).
В общем, необычным является то, что всасывание через поверхность кожи может обеспечить проникновение через кожу такого количества лекарственного средства, которое достаточно для того, чтобы лекарственное средство проявило свою активность. Поэтому необходимо исследовать проникающую способность самого лекарственного препарата, или предусматривать добавление средства, которое может ускорить проникновение лекарственного препарата через кожу. Однако предсказать такую проникающую способность лекарственного препарата или действие такого добавочного средства затруднительно, поскольку характеристики могут легко меняться в зависимости от типа лекарственного препарата. Поэтому представляется, что невозможно или очень трудно разработать состав для всасывания через поверхность кожи с использованием лекарственного препарата, применимого в качестве орального средства. В дополнение, по тем же соображениям, также затруднительно спрогнозировать, может ли быть исключен эффект первого прохождения благодаря способу введения через поверхность кожи.
Поэтому с точки зрения медицинских потребностей и фармакокинетического эффекта является весьма желательным, что вышеупомянутый полезный антипсихотический препарат: блонансерин будет разработан в качестве состава для всасывания через поверхность кожи. Однако представлялось, что разработка такого состава затруднительна, так как вопросы, связанные с проницаемостью блонансерина через кожу или исключением эффекта первого прохождения благодаря способу введения через поверхность кожи не были в достаточной мере разрешены.
С другой стороны, в качестве некоторых примеров комбинации антипсихотического препарата и еще одного лекарственного средства, заявка WO 2002/053140 раскрывает композицию, включающую ингибитор обратного захвата норэпинефрина и нейролептический препарат (антипсихотическое средство), патент JP-A-2002-308801 представляет композицию, включающую ингибитор обратного захвата серотонина и атипичный антипсихотический препарат, и патент JP-A-2006-505489 представляет одновременное введение производного вальпроевой кислоты и атипичного антипсихотического средства, в которых в каждой из публикаций блонансерин упомянут в качестве примера антипсихотического препарата, и применение через поверхность кожи описывается как один из способов введения.
Однако эти публикации направлены на лечение психоза комбинацией из 2 типов лекарственных препаратов, и блонансерин представляет собой лишь один пример антипсихотического средства, который может быть добавлен в комбинацию, и в дальнейшем его пример не приводится. Более того, эти публикации не представляют какого-либо практического описания композиции или эффекта в качестве препарата для всасывания через поверхность кожи. В конце концов, эти публикации не раскрывают ничего из того, что подтверждало бы применение блонансерина в составе препарата для всасывания через поверхность кожи. Поэтому на основе этих публикаций действительно невозможно разработать препарат для всасывания через поверхность кожи, включающий блонансерин.
Описание изобретения
Проблемы, решаемые изобретением
Настоящее изобретение представляет препарат для введения через поверхность кожи, включающий блонансерин, который может ингибировать образование метаболита, непрерывно поддерживая концентрацию лекарственного средства в крови.
Средство решения проблемы
Авторы настоящего изобретения провели обстоятельное исследование, чтобы решить вышеупомянутые проблемы, и нашли, что введение блонансерина с помощью лейкопластырного препарата, включающего акриловый адгезив в качестве базового материала, может ингибировать генерацию метаболита блонансерина, и непрерывно поддерживать концентрацию блонансерина в крови. Далее, авторы настоящего изобретения также обнаружили, что проницаемость кожи в отношении блонансерина может быть повышена за счет применения специального усилителя проницаемости, и количество блонансерина, выделяющегося из лейкопластырного препарата, включающего акриловый адгезив в качестве базового материала, может контролироваться, и тем самым они выполнили настоящее изобретение.
А именно, настоящее изобретение относится к лейкопластырному препарату, включающему адгезивный слой, сформированный на одной поверхности подложки, и представляет лейкопластырный препарат, отличающийся тем, что адгезивный слой включает (1) блонансерин или его физиологически приемлемую соль, образованную присоединением кислоты, и (2) полимерный адгезив; или (1) блонансерин или его физиологически приемлемую соль, образованную присоединением кислоты, (2) полимерный адгезив, и (3) усилитель проницаемости. Более подробно, настоящее изобретение представляет следующие варианты осуществления изобретения.
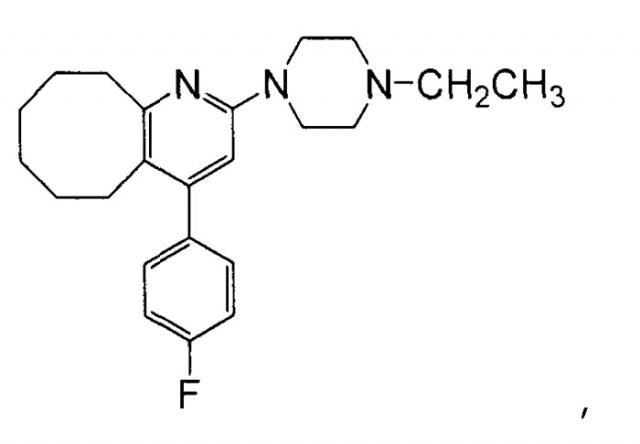
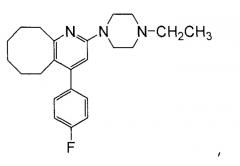
[1] Лейкопластырный препарат, включающий адгезивный слой, сформированный на одной поверхности подложки, где адгезивный слой включает (1) 2-(4-этил-1-пиперазинил)-4-(4-фторфенил)-5,6,7,8,9,10-гексагидроциклоокта[b]пиридин (далее называемый как «Соединение А») или его физиологически приемлемую соль, образованную присоединением кислоты, и (2) акриловый адгезив.
[2] Лейкопластырный препарат, включающий адгезивный слой, сформированный на одной поверхности подложки, в котором адгезивный слой включает (1) соединение А или его физиологически приемлемую соль, образованную присоединением кислоты, (2) акриловый адгезив и (3) усилитель проницаемости.
[3] Лейкопластырный препарат по пп.[1] или [2], в котором адгезивный слой включает ингредиент (1) в концентрации от около 0,1% до около 50% вес. соединения А.
[4] Лейкопластырный препарат по любому из пп.[1]-[3], в котором акриловый адгезив (2) представляет собой по меньшей мере одного соединения, выбранное из группы, состоящей из (со)полимера, главным образом содержащего алкил(мет)акрилат, и сополимер алкил(мет)акрилата и функционализированного мономера.
[5] Лейкопластырный препарат по любому из пп.[2]-[4], в котором усилитель проницаемости (3) представляет собой по меньшей мере один усилитель, выбранный из группы, состоящей из насыщенного или ненасыщенного алифатического С7-22-спирта, диизопропиладипата, триглицерида жирных кислот со средней длиной цепей, пропиленгликоля, олеиновой кислоты, кротамитона, N-метил-2-пирролидона, оливкового масла, соевого масла, миристиновой кислоты, глицерина, макрогола 200, сквалана, жидкого парафина, полиоксиэтилен(160)полиоксипропилен(40)гликоля, полиоксиэтилен-нонилфенилового простого эфира, лауромакрогола, α-моноизостеарилового простого эфира глицерина, производного полиоксиэтилена и гидрированного касторового масла 10, изопропилмиристата, диэтилсебацината, сорбитансесквиолеата, полиоксилстеарата 40, монолаурата полиэтиленгликоля, смешанного воска цетанола и моностеарата полиэтиленгликоля, жидкого ланолина, молочной кислоты, уксусной кислоты, цетиллактата, олеилолеата, цетил-2-этилгексаноата, н-бутилацетата, 1-ментола, метилизобутилкетона и триацетина.
[6] Лейкопластырный препарат по п.[5], в котором усилитель проницаемости (3) включает молочную кислоту.
[7] Лейкопластырный препарат по любому из пп.[2]-[6], в котором адгезивный слой включает усилитель проницаемости (3) в концентрации от около 0,01% до около 50% вес.
[8] Лейкопластырный препарат по любому из пп.[1]-[7], целевым заболеванием которого является шизофрения.
[9] Лейкопластырный препарат по любому из пп.[1]-[8], в котором поверхность адгезивного слоя, которая является противоположной стороной относительно подложки, покрыта защитной покровной пленкой.
[10] Лейкопластырный препарат по любому из пп.[1]-[9], в котором акриловый адгезив состоит из 2 или более типов акриловых адгезивов.
[11] Лейкопластырный препарат по любому из пп.[1]-[10], дополнительно включающий полимерный адгезив, иной, нежели акриловый адгезив.
[12] Лейкопластырный препарат по любому из пп.[1]-[11], в котором адгезивный слой дополнительно включает антипсихотическое средство, иное, нежели соединение А.
Эффект изобретения
За счет применения лейкопластырного препарата для всасывания через поверхность кожи согласно настоящему изобретению возможно ингибировать генерацию метаболита, непрерывно поддерживать концентрацию блонансерина в крови и дополнительно усиливать проницаемость блонансерина через поверхность кожи с помощью специального усилителя проницаемости.
Краткое описание чертежей
Фиг.1 показывает результат изменения концентрации в крови со временем после применения лейкопластырного препарата согласно настоящему изобретению.
Наилучший вариант осуществления изобретения
Термин «лейкопластырный препарат», применяемый здесь, представляет собой синоним «пластырного препарата».
Термин «адгезивный слой», применяемый здесь, означает слой, сформированный на подложке, который включает лекарственное средство.
Термин «% вес.», который приводится в настоящих пунктах формулы изобретения и описании, означает проценты (%) вес. на 100% общего веса адгезивного слоя без какого-либо растворителя, который получается определением по сухому состоянию или иным методом.
(1) Соединение А или его физиологически приемлемая соль, образованная присоединением кислоты
Соединение А согласно изобретению 2-(4-этил-1-пиперазинил)-4-(4-фторфенил)-5,6,7,8,9,10-гексагидроциклоокта[b]пиридин (общее наименование «блонансерин»), которое представляет собой антагонист серотонина и допамина, как упомянуто выше, и разработано в качестве антипсихотического средства имеет следующую химическую формулу:
Соединение А может быть получено как свободное основание или его физиологически приемлемая соль, образованная присоединением кислоты. Соль, образованная присоединением органической кислоты, включает, например, формиат, ацетат, лактат, адипат, цитрат, тартрат, метансульфонат, фумарат и малеат, и соль, образованная присоединением неорганической кислоты, включает, например, гидрохлорид, сульфат, нитрат, и фосфат, но не ограничивается ими. Далее, соединение А или его физиологически приемлемая соль, образованная присоединением кислоты, может представлять собой сольват, то есть гидрат или сольват, иной, нежели гидрат.
Соединение А или его физиологически приемлемая соль, образованная присоединением кислоты, упомянутые выше, могут быть получены согласно, например, способу, раскрытому в патенте JP-B-7(1995)-47574, или подобным ему способом. Полученное соединение А или его физиологически приемлемая соль, образованная присоединением кислоты, может быть необязательно измельчена с помощью общеизвестного способа.
«Соединение А или его физиологически приемлемая соль, образованная присоединением кислоты», которое содержится в лейкопластырном препарате согласно настоящему изобретению, может содержаться, на 100% вес. адгезивного слоя, в общем, в количестве от около 0,1% до около 50% вес. соединения А, предпочтительно от около 0,1% до около 40% вес. соединения А, и более предпочтительно от около 0,1% до около 30% вес. соединения А; или предпочтительно в количестве от около 0,5% до около 50% вес. соединения А, более предпочтительно от около 0,5% до около 40% вес. соединения А, и еще более предпочтительно от около 0,5% до около 30% вес. соединения А; но это зависит от площади поверхности лейкопластырного препарата. Термин «% вес. соединения А», применяемый здесь, означает, что вес ингредиента (1) не включает веса кислотного остатка в соли кислоты или кристаллизационной воды в случае, если соединение А приготовлено в солевой форме или гидратной форме.
(2) Акриловый адгезив
Полимерный адгезив, который, в общем, используется как базовый материал лейкопластырного препарата, включает, например, силиконовый адгезив, каучуковый адгезив, акриловый адгезив и т.д. Силиконовый адгезив здесь включает клеевое средство, включающее в качестве основного ингредиента силиконовый каучук, такой как полидиметилсилоксан и дифенилсилоксан, и каучуковый адгезив здесь включает, например, натуральный каучук, полиизопропиленовый каучук, полиизобутилен, бутадиен-стирольный сополимер, изопропилен-стирольный сополимер, стирол-изопрен-стирольный блок-сополимер и т.д.
Настоящее изобретение отличается тем, что было найдено, что лейкопластырный препарат, использующий акриловый адгезив, выбранный из вышеупомянутых полимерных адгезивов, может ингибировать образование метаболита соединения А и непрерывно поддерживать концентрацию соединения А в крови.
Акриловый адгезив включает (со)полимер, состоящий главным образом из алкил(мет)акрилата; например, полимер, состоящий главным образом из алкилакрилата, полимер, состоящий главным образом из алкил(мет)акрилата, сополимер, состоящий главным образом из алкилакрилата, сополимер, состоящий главным образом из алкил(мет)акрилата, сополимер, состоящий главным образом из алкилакрилата и алкил(мет)акрилата. (Со)полимер здесь может представлять собой сополимер, состоящий из 2 или более типов вышеупомянутого алкил(мет)акрилата, или сополимер, состоящий из алкил(мет)акрилата и функционализированного мономера, который может быть вовлечен в сополимеризацию с алкил(мет)акрилатом.
Термин «(мет)акрилат» здесь означает «акрилат или метакрилат», или «акрилат и/или метакрилат», и термин «(со)полимер» означает «полимер или сополимер», или «полимер и/или сополимер».
Алкил(мет)акрилат означает, например, алкил(мет)акрилат, который получается этерификацией (мет)акриловой кислоты спиртом с линейной или разветвленной С1-18-алкильной цепью, и включает, например, метил(мет)акрилат, бутил(мет)акрилат, гексил(мет)акрилат, октил(мет)акрилат, нонил(мет)акрилат, децил(мет)акрилат, и т.д. Функционализированный мономер включает, например, мономер, имеющий гидроксильную группу (например, гидроксиэтил(мет)акрилат), мономер, имеющий карбоксильную группу (например, бутилмалеат и кротоновая кислота), мономер, имеющий амидную группу (например, (мет)акриламид), мономер, имеющий аминогруппу (например, диметиламиноакрилат), мономер, имеющий пирролидоновый цикл (например, N-винил-2-пирролидон), и т.д.
Акриловый адгезив согласно настоящему изобретению может представлять собой либо одиночное клеевое средство, либо комбинацию из 2 или более клеевых средств. В дополнение, он может быть смесью с еще одним адгезивом. Термин «еще один адгезив» включает, например, силиконовый адгезив, каучуковый адгезив и т.д.
Примеры акрилового адгезива включают, но не ограничиваются ими, имеющиеся в продаже средства “POLYTHICK 410-SA” фирмы Sanyo Chemical Industries, Ltd., “Oribain BPS-4849-40” фирмы TOYO INK, “DURO-TAK 87-2194” и “DURO-TAK 387-2516” фирмы National Starch and Chemical Co., и т.д.
Количество добавляемого акрилового адгезива составляет остальную часть адгезивного слоя, за вычетом из него соединения А или его физиологически приемлемой соли, образованной присоединением кислоты, последующего усилителя проницаемости и каждого из необязательных дополнительных компонентов состава, которая представляет собой обязательную составную часть всего адгезивного слоя в целом. Например, когда адгезивный слой включает соединение А в количестве 10% вес. и усилитель проницаемости в количестве 10% вес., то содержание акрилового адгезива составляет около 80% вес.
Способность акрилового адгезива прилипать означает силу сцепления, вполне достаточную для использования в качестве фармацевтического лейкопластырного препарата, то есть это предполагает, что он легко размещается на коже и не создает проблем при его удалении. Дополнительно, есть возможность необязательного добавления к нему отверждающего средства, чтобы обеспечить надлежащую способность прилипать к коже. Отверждающее средство включает, например, имеющиеся в продаже продукты “POLYTHICK SC-75” фирмы Sanyo Chemical Industries, Ltd., “BHS8515” фирмы TOYO INK, и т.д. Количество добавляемого отверждающего средства должно выбираться именно таким, чтобы быть приспособленным к свойствам адгезива, например, от около 0,001 части до около 0,05 частей вес. на 1 часть вес. адгезива.
(3) Усилитель проницаемости
В настоящем изобретении было найдено, что добавление специального усилителя проницаемости к вышеупомянутому акриловому адгезиву может еще больше увеличить проницаемость соединения А через поверхность кожи.
Предпочтительный усилитель проницаемости, применяемый здесь, включает, но не ограничивается ими, насыщенный или ненасыщенный алифатический С7-22-спирт, такой как олеиловый спирт, лауриловый спирт и деканол, диизопропиладипат, триглицерид жирных кислот со средней длиной цепей, пропиленгликоль, олеиновую кислоту, кротамитон, N-метил-2-пирролидон (NMP), оливковое масло, соевое масло, миристиновую кислоту, глицерин, макрогол 200, сквалан, жидкий парафин, полиоксиэтилен(160)полиоксипропилен(40)гликоль, полиоксиэтилен-нонилфениловый простой эфир, лауромакрогол, α-моноизостеариловый простой эфир глицерина, производное полиоксиэтилена и гидрированного касторового масла 10, изопропилмиристат, диэтилсебацинат, сорбитансесквиолеат, полиоксилстеарат 40, монолаурат полиэтиленгликоля, смешанный воск цетанола и моностеарата полиэтиленгликоля, жидкий ланолин, молочную кислоту, уксусную кислоту, цетиллактат, олеилолеат, цетил-2-этилгексаноат, н-бутилацетат, 1-ментол, метилизобутилкетон и триацетин и т.д., и в особенности предпочтительной является молочная кислота.
Усилитель проницаемости согласно настоящему изобретению может быть либо одиночным, либо комбинацией из 2 или более усилителей проницаемости, и в особенности предпочтительным является усилитель проницаемости, включающий молочную кислоту. Усилитель проницаемости, который включен в лейкопластырный препарат согласно настоящему изобретению, содержится, в расчете на 100% вес. адгезивного слоя, в общем в количестве от около 0,01% до около 50% вес., предпочтительно от около 0,1% до около 40% вес., и более предпочтительно от около 0,3% до около 40% вес.
Адгезивный слой
Адгезивный слой настоящего лейкопластырного препарата может содержать фармацевтически приемлемый компонент для фармацевтического препарата, который обычно применяется для приготовления лейкопластырного препарата в такой мере, чтобы не создавать особенного неудобства. Что касается такого компонента для фармацевтического препарата, применимы любые ингредиенты, которые не оказывают вредного действия на препарат и должны быть приготовлены, которые включают, например, стабилизатор, средство для усиления липкости, пластификатор, вкусо-ароматическую добавку, наполнитель и т.д.
В дополнение, в адгезивном слое может содержаться любой другой фармацевтический компонент, иной, нежели соединение А, который включает, например, антипсихотическое средство, такое как галоперидол, клозапин, рисперидон, оланзапин, кветиапин, зипразидон и арипипразол.
Стабилизатор включает, но не ограничивается ими, например, аскорбиновую кислоту, альгинат натрия, пропиленгликольальгинат, дибутилгидрокситолуол, бутилгидроксианизол, токоферолацетат, токоферол, пропилгаллат, этил-пара-гидроксибензоат, бутил-пара-гидроксибензоат, пропил-пара-гидроксибензоат, метил-пара-гидроксибензоат, 2-меркаптобензимидазол и т.д.
Средство для усиления липкости включает, но не ограничивается ими, например, сложный эфир глицерина и смоляных кислот, глицерин, сложный эфир глицерина и гидрированной канифоли, нефтяную смолу, канифоль, полибутен и т.д. Пластификатор здесь включает, но не ограничивается ими, например, полибутен, жидкий парафин, глицерин, сложные эфиры глицерина и жирных кислот, и т.д. Вкусо-ароматическая добавка здесь включает, но не ограничивается ими, например, dl-ментол, апельсиновое масло, масло мяты, лимонное масло, розовое масло и т.д. Наполнитель включает, но не ограничивается ими, например, оксид титана, оксид цинка, привитый крахмалом акрилат 100, и т.д.
Лейкопластырный препарат согласно настоящему изобретению
Лейкопластырный препарат согласно настоящему изобретению имеет вышеупомянутый адгезивный слой, сформированный на одной стороне (поверхности) подложки и, необязательно, имеет защитную покровную пленку, покрывающую поверхность адгезивного слоя, которая является стороной, противоположной подложке. Во время применения лейкопластырного препарата покровную пленку снимают, и лейкопластырный препарат накладывают адгезивным слоем на кожу для всасывания через поверхность кожи.
Подложка лейкопластырного препарата не является особенно ограниченной в такой мере, насколько лекарственное средство незначительно или совсем не проникает в его материал, и не оказывает никакого или оказывает небольшое влияние на высвобождение лекарственного средства, и приемлемым является либо эластичная подложка, либо неэластичная подложка. Подложка включает, но не ограничивается ими, например, полимерную пленку, такую как этилцеллюлоза, нейлон, полиэтилентерефталат (РЕТ), сложный полиэфир, полипропилен и т.д., или их комбинацию. И полотно из нетканого материала, такого как полиэтилентерефталат (РЕТ), может быть нанесено в виде покрытия с одной стороны, где адгезивный слой не формируется.
Поверхность подложки, где сформирован адгезивный слой, может быть предпочтительно обработана, например, коронным разрядом, плазмой, подвергнута окислительному воздействию, обработке с нанесением тонкой штриховки, матированию с помощью пескоструйной обработки.
Лейкопластырный препарат согласно настоящему изобретению может быть приготовлен с помощью общепринятого способа. Например, он может быть получен согласно «Инструкции для разработки трансдермального состава», изданной под редакцией Mitsuo Matsumoto (1985 год, см. раздел приготовления состава пластыря). Состав для пластыря, описанный в тексте, означает то же самое, что и лейкопластырный препарат, как определено здесь.
Например, настоящий лейкопластырный препарат может быть получен следующим образом: смесь раствора соединения А или его соли, образованной присоединением кислоты, и акрилового адгезива; необязательного компонента для состава, такого как усилитель проницаемости и отверждающее средство; и органический растворитель смешивают для получения смеси адгезивного слоя. Смесь наносят на одну поверхность подложки или защитной покровной пленки, которую высушивают для удаления органического растворителя и формирования адгезивного слоя. И покровную пленку или подложку накладывают на противоположную сторону адгезивного слоя до/после высушивания.
Толщина данного адгезивного слоя составляет от около 10 мкм до около 400 мкм, и предпочтительно от около 20 мкм до около 200 мкм. Однако толщина адгезивного слоя не ограничивается вышеупомянутым диапазоном, то есть значение за пределами выше или ниже диапазона также предполагается входящим в область настоящего изобретения.
Защитная покровная пленка, покрывающая поверхность адгезивного слоя, может быть выбрана из множества материалов, и которая представляет собой удаляемый слой, поверхность которого имеет способность отделяться от подложки, и включает, например, бумажную пленку, полимерную пленку и т.д., которая обработана силиконовым полимером или подвергнута иной обработке, но не ограничивается ими.
Лейкопластырный препарат согласно настоящему изобретению может быть получен вышеупомянутым образом так, чтобы регулировать его размер сообразно желаемой дозировке, или он может быть разрезан для соответствия желаемым размеру/форме.
Лейкопластырный препарат может быть больше желательного размера, который реально применяется для пациентов, или может быть меньше его. В этом случае есть возможность по необходимости разрезать лейкопластырный препарат или накладывать должное число лейкопластырных препаратов на кожу при применении лейкопластырного препарата. Место нанесения на теле включает, но не ограничивается ими, например, руку, плечо, шею, спину, талию, живот, грудную клетку, бедро, ногу и т.д. Лейкопластырный препарат согласно настоящему изобретению может быть упакован с инструкцией, в которой приведена информация о лейкопластырном препарате, и выставлен на продажу. Инструкция может быть размещена на упаковке или может быть включена в упаковку в качестве вкладыша. «Информация о лейкопластырном препарате» включает, например, такие сведения, как «это может быть использовано для лечения шизофрении», и «это следует использовать для лечения шизофрении».
ПРИМЕР
Далее настоящее изобретение подробнее иллюстрируется Примерами, Сравнительными Примерами, Экспериментами и т.д., но не должно толковаться как ограничение заявленного изобретения. Знак «%», приведенный в последующих примерах и далее, означает «% вес.», если не оговорено иное.
В качестве подложки согласно изобретению использовали полиэтилентерефталатную пленку, имеющую толщину 25 мкм (изготовленную фирмой FUJIMORI KOGYO CO., LTD.). В качестве защитной покровной пленки применяли продукт Bynasheet 64S-018B (изготовленный фирмой FUJIMORI KOGYO CO., LTD.).
Пример 1
Лейкопластырный препарат согласно настоящему изобретению
Смешали 22,018 г акрилового адгезива (POLYTHICK 410-SA, фирма Sanyo Chemical Industries, Ltd. (остаток после испарения: 38% вес.)), 0,044 г отверждающего средства (POLYTHICK SC-75, фирма Sanyo Chemical Industries, Ltd. (остаток после испарения: 75% вес.)) и 6 мл этилацетата. К смеси добавили соединение А так, чтобы адгезивный слой содержал 16% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Эксперимент 1
Эксперимент, демонстрирующий всасывание через поверхность кожи
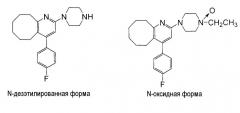
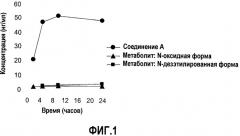
Анестезировали самца крысы SD (Sprague Dawley, СД) шестинедельного возраста, и депилировали его спинку. Лейкопластырный препарат примера 1, который имел вид квадрата с размерами 5 см × 5 см, наложили на депилированную спинку крысы, и кровь хронологически отбирали и отделяли сыворотку. Сыворотку анализировали методом LC/MS/MS (ЖХ/MC/MC, жидкостной хроматографии/тандемной масс-спектрометрии), и тем самым хронологически измеряли концентрации в сыворотке соединения А и последующих N-оксидной формы и N-дезэтилированной формы, которые представляют собой его метаболиты. Результаты представлены на фиг.1. Было найдено, что введенное количество составляло около 6,5 мг/кг по анализу остаточного количества соединения А в лейкопластырном препарате после применения.
Профиль изменения уровня в крови соединения А и N-оксидной формы и N-дезэтилированной формы, которые являются его метаболитами, в случае, когда соединение А было введено крысе орально, уже был описан (ссылка 1). Согласно фиг.5 в этом документе, отношение каждого метаболита (приблизительно в Cmax) к соединению А (3 мг/кг, перорально), рассчитано как составляющее около 0,40 для N-оксидной формы и около 0,10 для N-дезэтилированной формы.
Из значения концентрации соединения А в крови через 10 часов после введения в примере 1, которое было вблизи максимума его концентрации в крови, было найдено, что отношение количества каждого метаболита к количеству соединения А составляло 0,029 для N-оксидной формы и 0,043 для N-дезэтилированной формы (см. фиг.1). Из этого результата было найдено, что введение соединения А через поверхность кожи с помощью лейкопластырного препарата согласно настоящему изобретению может сделать продуцирование обоих метаболитов заметно сниженным по сравнению с оральным введением. Результат показывает, что настоящий лейкопластырный препарат имеет активность в плане заметного ингибирования образования метаболитов (заметно избегая эффекта первого прохождения), сравнительно с оральным введением.
| Таблица 1 | ||
| Оральное введение (ссылка 1) | Лейкопластырный препарат согласно настоящему изобретению из примера 1 | |
| N-оксидная форма/соединение А | 0,40 | 0,029 |
| N-дезэтилированная форма/соединение А | 0,10 | 0,043 |
Пример 2
Смешали 4,77 г акрилового адгезива (POLYTHICK 410-SA, фирма Sanyo Chemical Industries, Ltd.), 10,0 мг отверждающего средства (POLYTHICK SC-75, фирма Sanyo Chemical Industries, Ltd.) и 1,2 мл этилацетата. К смеси добавили соединение А так, чтобы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Пример 3
Смешали 4,48 г акрилового адгезива (Oribain BPS-4849-40, фирма TOYO INK (остаток после испарения: 40% вес.)), 0,16 г отверждающего средства (Oribain BHS-8515, фирма TOYO INK (остаток после испарения: 30% вес.)) и 1,2 мл этилацетата. К смеси добавили соединение А так, чтобы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Пример 4
Смешали 4,04 г акрилового адгезива (DURO-TAK 87-2194, фирма National Starch and Chemical Co. (остаток после испарения: 45% вес.)) и 1,2 мл этилацетата. К смеси добавили соединение А так, чтобы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Пример 5
Смешали 4,39 г акрилового адгезива (DURO-TAK 387-2516, фирма National Starch and Chemical Co. (остаток после испарения: 41,5% вес.)) и 1,2 мл этилацетата. К смеси добавили соединение А так, чтобы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Сравнительный пример 1
0,50 г стирол-изопрен-стирольного блок-сополимера (QUINTAC 3421, фирма ZEON CORPORATION), 0,42 г жидкого парафина, 0,40 г полибутена (HV-300, фирма NIPPON OIL CORPORATION), 0,50 г алициклического насыщенного углеводородного полимера (ARKON P-100, фирма ARAKAWA CHEMICAL INDUSTRIES, LTD.) и 3,0 мл этилацетата добавили так, что бы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Сравнительный пример 2
Смешали 0,50 г полиизобутилена (Oppanol B-100, фирма BASF), 0,42 г жидкого парафина, 0,40 г полибутена (HV-300, фирма NIPPON OIL CORPORATION), 0,50 г алициклического насыщенного углеводородного полимера (ARKON P-100, фирма ARAKAWA CHEMICAL INDUSTRIES, LTD.) и 10 мл гексана. К смеси добавили соединение А так, чтобы адгезивный слой содержал 9% соединения А, и данную смесь тщательно перемешали. Смесь нанесли ровным слоем на подложку так, чтобы толщина адгезивного слоя после высушивания составляла бы около 50 мкм. И затем ее высушили при комнатной температуре в течение недели. Затем нанесли слой защитной покровной пленки на противоположную от подложки сторону адгезивного слоя для получения лейкопластырного препарата.
Эксперимент 2
Эксперимент проницаемости кожи у крысы
С использованием кожи брюшной стенки безволосой крысы шестинедельного возраста испытали каждую проницаемость кожи для лейкопластырных препаратов из примеров 2-5 и сравнительных примеров 1-2. А именно, кожу безволосой крысы поместили в горизонтальную in vitro диффузионную ячейку, имеющую проницаемую площадь 1,33 см2, и в приемный отсек загрузили 3 мл смеси полиэтиленгликоля 200 (макрогол 200) и раствора фосфатного буфера (2:1), в то время как каждый препарат поместили в донорный отсек (n=4). Приемный раствор нагрели до температуры 37°С и перемешивали с помощью мешалки. Через 24 часа после начала эксперимента соединение А в приемном растворе проанализировали с использованием высокоэффективной жидкостной хроматографии (колонка: YMC A312 ODS 5 мкм (колонка YMC; 6 мм φ × 150 мм), подвижная фаза: раствор с концентрацией 0,01 моль/л додецилсульфата натрия в воде (величина рН 2,4, регулирование фосфорной кислотой):ацетонитрил:метанол (2:5:3), температура колонки: 40°С, скорость потока: 1,0 мл/мин) для измерения прошедшего через кожу количества каждого препарата. Результаты были показаны в таблице 2.
| Таблица 2 | ||
| Количество проникшего соединения А в 24-часовом эксперименте на проницаемость | ||
| Пример/сравнительный пример | Адгезив | (мкг/см 2 /24 часа) |
| Пример 2 | Акриловый адгезив | 0,280 |
| Пример 3 | Акриловый адгезив | 0,214 |
| Пример 4 | Акриловый адгезив | 0,276 |
| Пример 5 | Акриловый адгезив | 0,250 |
| Сравнительный пример 1 | Стирол-изопрен-стирольный блок-сополимер | 0,115 |
| Сравнительный пример 2 | Полиизобутилен | 0,162 |
Все лейкопластырные преп