Фармацевтические композиции glp-1
Иллюстрации
Показать всеИзобретение относится к области фармакологии и представляет собой фармацевтическую композицию, содержащую аналог GLP-1 [Aib8,35]hGLP-1(7-36)NH2, полученную вместе с фармацевтически приемлемой солью указанного аналога или смесью соли указанного аналога и аналога, указанная композиция дополнительно содержит двухвалентный метал и/или соль двухвалентного металла, причем молярное соотношение указанного аналога GLP-1 и указанного двухвалентного металла и/или соли двухвалентного металла в указанной фармацевтической композиции составляет приблизительно от 5,4:1 до приблизительно 1,5:1; где указанный выбранный двухвалентный металл представляет собой цинк или медь и где диапазон значений молярного соотношения указанной соли (Aib8,35)hGLP-1(7-36)NH2 и аналога пептида GLP-1 составляет от приблизительно 0,5:1 до приблизительно 10:1. Изобретение обеспечивает легкое и воспроизводимое введение пациенту композиции, а также снижение или исключение нежелательных побочных эффектов. 10 з.п. ф-лы, 9 пр., 7 табл., 12 ил.
Реферат
Уровень техники
Настоящее изобретение относится к усовершенствованию композиций, содержащих пептидные аналоги глюкагоноподобного пептида-1 и/или их фармацевтически приемлемые соли, к способам получения таких композиций, к фармацевтическим композициям и к способам получения таких композиций для лечения млекопитающих.
Глюкагоноподобный пептид-1(7-36)амид (GLP-1) синтезируется в L-клетках кишечника при тканеспецифичном посттрансляционном процессинге предшественника глюкагона предпроглюкагона (Varndell, J.M. et al., J. Histochem Cytochem, 1985:33:1080-6) и высвобождается в кровь в ответ на прием пищи. Концентрация GLP-1 в плазме повышается от уровня приблизительно 15 пмоль/л натощак до максимального уровня 40 пмоль/л после приема пищи. Было показано, что, при таком повышении концентрации глюкозы в плазме, происходит приблизительно трехкратное увеличение инсулина в плазме, если глюкоза поступает перорально по сравнению с внутривенным введением (Kreymann B. et al., Lancet 1987:2, 1300-4). Такое алиментарное увеличение секреции инсулина, известное как "инкретиновый эффект", является прежде всего гуморальным, и полагают, что GLP-1 является наиболее сильным физиологическим инкретином человека. Кроме инсулинотропного эффекта, GLP-1 подавляет секрецию глюкагона, задерживает опорожнение желудка (Wettergren A. et al., Dig Dis Sci 1993:38:665-73) и может повышать периферическую утилизацию глюкозы (D'Alessio D.A. et al., J. Clin Invest 1994:93:2293-6).
В 1994 году в результате наблюдения было сделано предположение, что GLP-1 обладает терапевтической эффективностью, что единичная подкожная (п/к) доза GLP-1 может полностью нормализовать уровни глюкозы после приема пищи у пациентов с инсулинонезависимым сахарным диабетом (NIDDM) (Gutniak M.K. et al., Diabetes Care 1994:17:1039-44). Этот эффект, как полагают, опосредуется как усилением секреции инсулина, так и ослаблением секреции глюкагона. Кроме того, было показано, что внутривенное введение GLP-1 задерживает опорожнение желудка после приема пищи у пациентов с NIDDM (Williams B. et al., J. Clin Endo Metab 1996:81:327-32). В отличие от производных сульфонилмочевины, инсулинотропный эффект GLP-1 зависит от концентрации глюкозы в плазме (Holz G.G. 4th, et al., Nature 1993:361:362-5). Таким образом, ослабление секреции инсулина, опосредованное GLP-1 при низкой концентрации глюкозы в плазме, защищает от тяжелой гипогликемии. Такое сочетание эффектов дает GLP-1 исключительные преимущества над другими средствами, в настоящее время используемыми для лечения NIDDM.
Многочисленные исследования показали, что прием здоровыми индивидами GLP-1 значительно влияет на гликемические уровни, а также концентрацию инсулина и глюкагона (Orskov C, Diabetologia 35:701-711, 1992; Holst J.J. et al., Potential of GLP-1 in diabetes management in Glucagon III, Handbook of Experimental Pharmacology, Lefevbre P.J., Ed. Berlin, Springer Verlag, 1996, p. 311-326), а эти эффекты зависят от глюкозы (Kreymann B. et al., Lancet ii: 1300-1304, 1987; Weir G.C. et al., Diabetes 38:338-342, 1989). Более того, GLP-1 также эффективен у пациентов с диабетом (Gutniak M., N. Engl J Med 226:1316-1322, 1992; Nathan D.M. et al., Diabetes Care 15:270-276, 1992), так как нормализует уровни глюкозы крови у больных диабетом типа 2 (Nauck M.A. et al., Diabetologia 36:741-744, 1993) и улучшает гликемический контроль у больных диабетом типа 1 (Creutzfeldt W.O. et al., Diabetes Care 19:580-586, 1996), что указывает на его способность, в числе прочего, повышать чувствительность к инсулину/снижать резистентность к инсулину. GLP-1 и его агонисты были предложены для использования у индивидов с риском развития инсулинонезависимого диабета (смотрите WO 00/07617), а также для лечения гестационного диабета (патент США № 20040266670).
Кроме указанного выше, GLP-1 и его агонисты были предложены для использования в ряде терапевтических схем у млекопитающих, например людей, включая, но ими не ограничиваясь: повышение обучаемости, усиление нейропротективного действия и/или уменьшение симптома заболевания или расстройства центральной нервной системы, например, за счет регулирования нейрогенеза, и, например, при болезни Паркинсона, болезни Альцгеймера, болезни Хантингтона, боковом амиотрофическиом склерозе (ALS), инсульте, синдроме дефицита внимания (ADD) и психоневрологических синдромах (патентные публикации США №№ 20050009742 и 20020115605); дифференцировка стволовых клеток/клеток-предшественников печени в функциональные клетки поджелудочной железы (WO03/033697); профилактика разрушения бета-клеток (патентные публикации США №№ 20040053819 и 20030220251) и стимуляция пролиферации бета-клеток (патентная публикация США № 20030224983); лечение ожирения (патентная публикация США № 20040018975; WO98/19698); подавление аппетита и стимуляцию чувства насыщения (патентная публикация США № 20030232754); лечение синдрома раздраженного кишечника (WO 99/64060); снижение заболеваемости и/или смертности при инфаркте миокарда (патентная публикация США № 20040162241, WO98/08531) и инсульте (смотрите WO 00/16797); лечение острого коронарного синдрома, проявляющегося инфарктом миокарда с отсутствием зубца Q на ЭКГ (патентная публикация США № 20040002454); ослабление послеоперационных катаболических изменений (патент США № 6006753); лечение гибернации миокарда или диабетической кардиомиопатии (патентная публикация США № 20050096276); снижение уровней норэпинефрина в плазме (патентная публикация США № 20050096276); усиление выведения натрия с мочой, снижение концентрации калия в моче (патентная публикация США № 20050037958); лечение состояний или расстройств, связанных с токсической гиперволемией, например, при почечной недостаточности, застойной сердечной недостаточности, нефротическом синдроме, циррозе, отеке легких и гипертензии (патентная публикация США № 20050037958); индукцию инотропного эффекта и усиление сокращаемости сердечной мышцы (патентная публикация США № 20050037958); лечение синдрома поликистоза яичников (патентные публикации США №№ 20040266678 и 20040029784); лечение дыхательной недостаточности (патентная публикация США № 20040235726); улучшение питания при неалиментарном пути введения, а именно при внутривенной, подкожной, внутримышечной, перитонеальной или другой инъекции или инфузии (патентная публикация США № 20040209814); лечение нефропатии (патентная публикация США № 20040209803); лечение систолической дисфункции левого желудочка, например, при патологической фракции выброса левого желудочка (патентная публикация США № 20040097411); ингибирование антро-дуоденальной моторики, например, при лечении или профилактики желудочно-кишечных расстройств, таких как диарея, послеоперационный демпинг-синдром и синдром раздраженного кишечника, и в качестве медикаментозной подготовки при эндоскопических процедурах (патентная публикация США № 20030216292); лечение полиневропатии критического состояния (CIPN) и синдрома системной воспалительной реакции (SIRS) (патентная публикация США № 20030199445); регулирование уровней триглицеридов и лечение дислипидемии (публикации патентов США №№ 20030036504 и 20030143183); лечение поражения ткани органа, вызванного реперфузией кровотока после ишемии (патентная публикация США № 20020147131); уменьшение фактора риска развития коронарной болезни сердца (CHDRF) (патентная публикация США № 20020045636) и другие.
Однако GLP-1 является метаболически нестабильным, его период полувыведения из плазмы крови (t1/2) составляет лишь 1-2 минуты in vivo. Экзогенно введенный GLP-1 также быстро деградирует (Deacon C.F. et al., Diabetes 44:1126-1131, 1995). Такая метаболическая нестабильность ограничивает терапевтические возможности природного GLP-1. Были сделаны попытки улучшить терапевтические возможности GLP-1 и его аналогов путем улучшения его лекарственных форм. Например, в международной патентной публикации № WO01/57084 описан процесс получения кристаллов аналогов GLP-1, которые, как указывается, используются при получении фармацевтических композиций, таких как лекарственные средства, вводимые инъекцией, содержащие кристаллы и фармацевтически приемлемый носитель. Неоднородные микрокристаллические кластеры GLP-1(7-37)OH выращивали из солевых растворов и анализировали после пропитки цинком и/или м-крезолом (Kim and Haren, Pharma. Res. Vol. 12 No. 11 (1995)). Из фосфатных растворов, содержащих цинк или протамин, были получены сырые суспензии кристаллов GLP(7-36)NH2, содержащие игольчатые кристаллы и аморфный осадок (Pridal et. al., International Journal of Pharmaceutics Vol. 136, pp. 53-59 (1996)). В европейской патентной публикации № EP0619322A2 описано получение микрокристаллических форм GLP-1(7-37)OH путем смешивания белковых растворов в буфере pH 7-8,5 с определенными комбинациями солей и низкомолекулярных полиэтиленгликолей (ПЭГ). В патенте США № 6566490 описано введение затравки микрокристаллов, и в числе прочего, GLP-1, которое, как указано, способствует получению очищенных пептидных продуктов. В патенте США 6555521 (США '521) описаны кристаллы GLP-1, имеющие форму тетрагонального плоского стержня или пластинчатую форму, которые, как указывается, обладают повышенной чистотой и демонстрируют пролонгированную активность in vivo. В США '521 сообщается, что такие кристаллы являются относительно однородными и сохраняются в суспензии в течение более длительного периода времени, чем предшествующие кристаллические кластеры и аморфные кристаллические суспензии, которые, как указано, быстро оседают, агрегируют или слипаются, забивают иглы для шприцев и, как правило, осложняют непредсказуемое дозирование.
Биодеградируемый триблоксополимер поли[(dl-лактид-co-гликолид)-β-этиленгликоль-β-(лактид-co-гликолид)] был предложен для использования в лекарственных формах с контролируемым высвобождением GLP-1. Однако, как и в случае других полимерных систем, получение триблоксополимера предусматривает сложные методики и формирование несоответствующих частиц.
Аналогично, также были предложены биодеградируемые полимеры, например, поли(сополимер молочной и гликолевой кислоты) (PLGA), для использования в лекарственных формах пептидов с замедленным высвобождением. Однако использование таких биодеградируемых полимеров, не принятых в области техники, поскольку эти полимеры в основном плохо растворимы в воде, и при их получении требуются не смешивающиеся с водой органические растворители, например, метиленхлорид, и/или жесткие условия получения. Такие органические растворители и/или жесткие условия получения, как полагают, повышают риск индукции конформационного превращения интересующего пептида или белка, что приводит к снижению структурной целостности и нарушению биологической активности (Choi et al., Pharm. Research, Vol. 21, No. 5, (2004)). Полоксамеры имеют аналогичные проблемы.
Композиции GLP-1, описанные в указанных выше ссылках, не являются оптимальными для получения фармацевтических композиций GLP, так как задерживают примеси, и/или существует другая трудность, чтобы осуществлять воспроизводимо производство и введение. Также известно, что аналоги GLP вызывают тошноту при повышенных концентрациях, таким образом, существует необходимость обеспечить пролонгированный эффект лекарственного средства при пониженных начальных концентрациях в плазме (Ritzel et al., Diabetologia, 38: 720-725 (1995); Gutniak et al., Diabetes Care, 17(9): 1039-1044 (1994); Deacon et al., Diabetes, 44: 1126-1131 (1995)). Следовательно, существует необходимость в лекарственных формах GLP-1 с надежным и простым производством, которые можно легко и воспроизводимо вводить пациенту и которые обеспечивают пониженные начальные концентрации в плазме для того, чтобы снизить или исключить нежелательные побочные эффекты.
Сущность изобретения
Сущность изобретения приведена в абзацах ниже, а также в формуле изобретения. Таким образом, изобретение относится к фармацевтической композиции, содержащей аналог GLP-1. Особенно предпочтительным является аналог GLP-1 следующей формулы (I):
(Aib8,35)hGLP-1(7-36)NH2
(I)
или его фармацевтически приемлемая соль, где состав указанной композиции позволяет упростить получение, введение, улучшить фармакокинетические и фармакодинамические свойства, а также минимизировать отрицательные побочные эффекты. Предпочтительно, фармацевтическая композиция по изобретению не имеет в своем составе прозрачного водного раствора ZnCl2 с pH 4, в котором указанный [Aib8,35]hGLP-1(7-36)NH2 находится в концентрации 4 мг/мл и указанный ZnCl2 присутствует в концентрации 0,5 мг/мл.
В одном из предпочтительных вариантов осуществления изобретение относится к фармацевтической композиции с улучшенными характеристиками высвобождения лекарственного средства, предпочтительно, с пониженной начальной концентрацией.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I) с пролонгированным действием.
В другом варианте осуществления изобретение также относится к фармацевтической композиции, которая выпадает в осадок in vivo при физиологическом значении pH с образованием in situ депо для обеспечения замедленного высвобождения лекарственного средства.
В еще одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель или разбавитель. Предпочтительно, указанный носитель или разбавитель содержит воду.
В предпочтительных вариантах изобретение относится к фармацевтической композиции, содержащей соединение или аналог пептида GLP-1, полученный в виде соли пептида или в виде смеси пептида и его соли.
Предпочтительно, соль аналога пептида GLP-1 в указанной фармацевтической композиции выбрана из перечня фармацевтически приемлемых солей органических кислот, таких как уксусная, молочная, яблочная, аскорбиновая, янтарная, бензойная, лимонная, метансульфоновая или толуолсульфоновая кислоты, или фармацевтически приемлемых солей неорганических кислот, таких как хлористоводородная, бромистоводородная, йодистоводородная, серная или фосфорная кислоты. Фармацевтически приемлемые соли сильных кислот, таких как хлористоводородная кислота, являются особенно предпочтительными. Под сильной кислотой понимают кислоту с pKA, равной менее 4,5. Другими предпочтительными солями пептида в указанной фармацевтической композиции являются соли органических кислот, таких как уксусная кислота или трифторуксусная кислота, молочная, яблочная, аскорбиновая, янтарная, бензойная или лимонная кислота.
В одном из предпочтительных вариантов осуществления растворимость, pH и характер высвобождения фармацевтической композиции могут регулироваться путем подбора молярного отношения аналога GLP-1 в форме соли и аналога GLP-1 не в форме соли для улучшения характеристик высвобождения и уменьшения начального пика концентрации аналога GLP-1.
В предпочтительном варианте осуществления фармацевтическая композиция, кроме того, содержит двухвалентный металл, для снижения растворимости композиции в воде, и, таким образом, улучшения характеристик высвобождения, наряду с уменьшением начального выброса или пика концентраций в плазме. Предпочтительные двухвалентные металлы включают в себя цинк и медь. Формы солей двухвалентных металлов являются особенно предпочтительными, включая, но ими не ограничиваясь, хлоридные и ацетатные соли двухвалентных металлов. Наиболее предпочтительными являются CuAc2, CuCl2, ZnAc2 и/или ZnCl2. Предпочтительно, двухвалентный металл и/или соли двухвалентного металла находятся в указанной фармацевтической композиции в концентрации от приблизительно 0,0005 до приблизительно 50 мг/мл. Даже более предпочтительно, двухвалентный металл и/или соли двухвалентного металла находятся в указанной фармацевтической композиции в концентрации от приблизительно 0,01 до приблизительно 0,50 мг/мл. Более предпочтительно, указанная фармацевтическая композиция содержит разбавитель, где указанный разбавитель содержит фармацевтически приемлемый водный раствор. Разбавитель может содержать стерильную воду.
В другом варианте осуществления указанная фармацевтическая композиция дополнительно содержит двухвалентный металл и/или соль двухвалентного металла, где молярное соотношение указанного аналога GLP-1 и указанного двухвалентного металла и/или соли двухвалентного металла в указанной фармацевтической композиции составляет от приблизительно 6:1 до приблизительно 1:1. Предпочтительно, указанное соотношение составляет от приблизительно 5,5:1 до приблизительно 1:1. Более предпочтительно, указанное соотношение составляет от приблизительно 5,4:1 до приблизительно 1,5:1. Однако еще более предпочтительно, указанное соотношение составляет приблизительно 5,4:1, 4,0:1 или 1,5:1. Наиболее предпочтительно, указанное соотношение составляет приблизительно 1,5:1. В данном аспекте изобретения "приблизительно" означает соотношение 1,5:1±10% каждой указанной величины, таким образом, предполагаемое соотношение включает в себя соотношения, включающие, например, 1,35-1,65:0,85-1,15.
Предпочтительно, указанная фармацевтическая композиция содержит водную смесь, суспензию или раствор, где указанный аналог GLP-1, соединение формулы (I) или его соль находятся в концентрации приблизительно 0,5-30% (масс./масс.). Более предпочтительно, концентрация указанного аналога GLP-1 и/или его соли в указанной водной смеси, суспензии или растворе составляет приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30% (масс./масс.). Более предпочтительно, концентрация указанного аналога GLP-1 и/или его соли в указанном водном растворе составляет приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 14, 15, 16, 19, 20, 21, 22, 23, 24, 25, 26, 29 или 30% (масс./масс.). Еще более предпочтительно, концентрация указанного аналога GLP-1 и/или его соли в указанном водном растворе составляет приблизительно 1, 2, 3, 4, 5, 6, 9, 10, 11, 22, 23, 24, 25 или 26% (масс./масс.). Еще более предпочтительно, концентрация указанного аналога GLP-1 и/или его соли в указанном водном растворе составляет приблизительно 1, 2, 3, 4, 5, 6, 10, 22, 23, 24, 25 или 26% (масс./масс.). Еще более предпочтительно, концентрация указанного аналога GLP-1 и/или его соли в указанном водном растворе составляет приблизительно 1, 2, 5, 10, 23 или 25% (масс./масс.). Под "приблизительно" понимают следующее: для концентраций от приблизительно 0,5 до приблизительно 4% необходимый диапазон составляет ±0,5% указанной величины (например, 0,5-1,5% составляет приблизительно 1%); для указанных концентраций приблизительно 5% и выше, желательный диапазон составляет 20% указанной величины (например, 8-12% соответствует приблизительно 10%).
Предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2, аналога GLP-1 или его соли в фармацевтической композиции составляет приблизительно 1% (масса/объем), а молярное соотношение [Aib8,35]hGLP-1(7-36)NH2 и указанного двухвалентного металла и/или соли двухвалентного металла составляет приблизительно 1,5:1. Более предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной фармацевтической композиции составляет приблизительно 2% (масса/объем), а молярное соотношение [Aib8,35]hGLP-1(7-36)NH2 и указанного двухвалентного металла и/или соли двухвалентного металла составляет приблизительно 1,5:1. Еще более предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной фармацевтической композиции составляет приблизительно 10% (масса/объем), а молярное соотношение [Aib8,35]hGLP-1(7-36)NH2 и указанного двухвалентного металла и/или соли двухвалентного металла составляет приблизительно 1,5:1. Наиболее предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной фармацевтической композиции составляет приблизительно 23 или приблизительно 25% (масса/объем), а молярное соотношение [Aib8,35]hGLP-1(7-36)NH2 и указанного двухвалентного металла и/или соли двухвалентного металла составляет приблизительно 1,5:1.
В предпочтительном варианте осуществления концентрация аналога GLP-1, [Aib8,35]hGLP-1(7-36)NH2 или его солей в фармацевтической композиции составляет приблизительно 5% (масса/объем), а молярное соотношение пептида и двухвалентного металла и/или соли двухвалентного металла составляет приблизительно 5,4:1. Более предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной композиции составляет приблизительно 5% (масса/объем), а указанное соотношение составляет приблизительно 4,0:1. Однако более предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной композиции составляет приблизительно 10% (масса/объем), а указанное соотношение составляет приблизительно 5,4:1. Еще более предпочтительно, концентрация [Aib8,35]hGLP-1(7-36)NH2 или его соли в указанной композиции составляет приблизительно 10% (масса/объем), а указанное соотношение составляет приблизительно 4,0:1.
Предпочтительно, указанный двухвалентный металл и/или соль двухвалентного металла находятся в виде хлорида цинка или ацетата цинка. Более предпочтительно, указанный ацетат цинка находится в виде ZnAc2·2H2O.
В другом варианте осуществления указанный двухвалентный металл и/или соль двухвалентного металла находятся в виде хлорида меди или ацетата меди.
В одном из вариантов осуществления значение pH указанной фармацевтической композиции увеличивают с помощью основания. Более предпочтительно, регулирование указанного значения pH осуществляют с помощью NaOH. Еще более предпочтительно, значение pH указанной фармацевтической композиции регулируют с помощью NaOH, и если разбавляют до приблизительно 1/2 от начальной концентрации, используя 0,9% NaCl, то получают значение pH, равное приблизительно 5,0-5,5, используя непосредственно потенциометрическое титрование.
В предпочтительном варианте осуществления изобретение относится к фармацевтической композиции, которая составлена так, что пептидный аналог GLP-1 или его соль, например соединение формулы (I) или его соль, высвобождаются в организме индивида, например, млекопитающего, предпочтительно, человека, в течение продолжительного периода времени. Предпочтительно, указанное высвобождение указанного соединения продолжается по меньшей мере час, более предпочтительно, по меньшей мере 4, 6, 12 или 24 часа. Еще более предпочтительно, указанная композиция составлена так, что соединение формулы (I) высвобождается в организме индивида в течение по меньшей мере 36, 48, 60, 72, 84 или 96 часов. Более предпочтительно, указанная композиция составлена так, что соединение формулы высвобождается в организме индивида в течение по меньшей мере приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней. Еще более предпочтительно, указанная композиция составлена так, что соединение формулы (I) высвобождается в организме индивида в течение по меньшей мере приблизительно 2, 3 или 4 недель. Еще более предпочтительно, указанная композиция составлена так, что соединение формулы (I) высвобождается в организме индивида в течение не менее приблизительно 1, 1,5, 2 или 3 месяцев или дольше.
В одном из аспектов изобретения регулирование состава солей пептидного аналога GLP-1 в указанной фармацевтической композиции улучшает растворимость и стабильность пептидного аналога GLP-1 в фармацевтической композиции и, кроме того, обеспечивает улучшение характера высвобождения in vivo за счет снижения начального выброса высвобождения.
Термин "регулирование" в данном аспекте изобретения означает изменение состава соли за счет регулирования молярного соотношения аналога GLP-1, находящегося в форме соли, и аналога GLP-1 не в виде соли.
Еще более предпочтительно, соль пептида в указанной фармацевтической композиции представляет собой соль хлористоводородной или уксусной кислоты, или хлориды или ацетаты указанного пептида формулы (I). В указанной фармацевтической композиции ацетат или хлорид находится в конечном молярном соотношении ацетата или хлорида и указанного соединения формулы (I) в диапазоне от приблизительно 0,5:1 до приблизительно 10:1. Более предпочтительно, указанное соотношение изменяется от приблизительно 0,8:1 до приблизительно 9:1. Даже более предпочтительно, указанное соотношение составляет от приблизительно 1:1 до приблизительно 6:1. Наиболее предпочтительно, указанное соотношение составляет приблизительно 3,0:1, в частности, 3,2:1.
В этом аспекте изобретения молярное соотношение ацетата или хлорида и пептида обозначает молярную пропорцию ацетата (CH3COO-) или хлорида (Cl-) в фармацевтической композиции к молярной пропорции пептида в фармацевтической композиции. Например, при молярном соотношении 3:1 в фармацевтической композиции ацетата, молярное содержание в три раза больше молярного содержания пептида в пропорции. Это является стехиометрическим соотношением соединения по сравнению с другим соединением.
В данном аспекте изобретения термин "приблизительно" означает соотношение 1,5:1±10% каждой указанной величины, таким образом, предполагаемое соотношение включает в себя соотношения, включающие, например, 1,35-1,65:0,85-1,15.
В других предпочтительных аспектах изобретения значение pH фармацевтической композиции устанавливают путем регулирования содержания ацетата в композиции. Предпочтительно, диапазон значений pH указанной фармацевтической композиции составляет pH от 3 до 6. Более предпочтительно, указанный диапазон значений pH указанной фармацевтической композиции составляет pH от 3,5 до 5,5. Наиболее предпочтительно, указанный диапазон значений pH указанной фармацевтической композиции составляет pH от 4,2 до 4,6.
Предпочтительно, для подкисления фармацевтической композиции содержание ацетата может увеличиваться при добавлении уксусной кислоты.
В одном из вариантов осуществления значение pH указанной фармацевтической композиции может быть увеличено исходя из пептидной соли аналога GLP-1, имеющей низкое содержание ацетата или не содержащей ацетат, путем регулирования содержания ацетата.
В предпочтительных вариантах осуществления установление значения pH в конечной фармацевтической композиции путем регулирования содержания ацетата и хлорида делает возможным регулирование таких параметров, как концентрация пептида, концентрация цинка, химическая стабильность, физическая стабильность и характер высвобождения in vivo путем снижения начального выброса высвобождения.
В одном из аспектов изобретения содержание Zn или Cu является фиксированным, а значение pH контролируется путем регулирования содержания ацетата. Повышенное содержание ацетата приводит к улучшению растворимости и физической стабильности, а пониженное содержание ацетата приводит к увеличению влияния на значение pH и снижению влияния на Cмакс.
В предпочтительных вариантах осуществления указанная фармацевтическая композиция содержит водную смесь, суспензию или раствор.
Настоящее изобретение также относится к способу индукции эффекта агониста GLP-1, где указанный способ включает приведение рецептора лиганда GLP-1(7-36)NH2 в контакт с аналогом GLP-1 или его солью, напрямую или опосредованно.
В указанном выше способе указанный рецептор лиганда GLP-1(7-36)NH2 находится у животного, предпочтительно, примата, более предпочтительно, человека. Таким образом, в этом варианте осуществления настоящее изобретение относится к способу индукции эффекта агониста рецептора GLP-1 у индивида, который включает введение указанному индивиду композиции по настоящему изобретению, где указанная композиция содержит эффективное количество аналога GLP-1 или его фармацевтически приемлемую соль.
В предпочтительном аспекте указанного выше способа указанный индивид является человеком, страдающим или имеющим риск развития заболевания или состояния, выбранного из группы, состоящей из диабета типа I, диабета типа II, гестационного диабета, ожирения, булимии, отсутствия чувства насыщения и нарушения обмена веществ. Предпочтительно, указанное заболевание представляет собой диабет типа I или диабет типа II.
В еще одном более предпочтительном аспекте указанного выше способа указанный индивид является человеком, страдающим или имеющим риск развития заболевания, выбранного из группы, состоящей из диабета типа I, диабета типа II, ожирения, глюкагономы, секреторных расстройств дыхательных путей, артрита, остеопороза, растройств центральной нервной системы, рестеноза, нейродегенеративного заболевания, почечной недостаточности, застойной сердечной недостаточности, нефротического синдрома, цирроза, отека легких, гипертензии и расстройств, при которых желательно снизить потребление пищи, заболевания или нарушения центральной нервной системы (например, за счет регулирования нейрогенеза и, например, болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона, ALS, инсульт, ADD и психоневрологические синдромы), синдрома раздраженного кишечника, инфаркта миокарда (например, снижая связанные с ним заболеваемость и/или смертность), инсульта, острого коронарного синдрома (например, отличающегося отсутствием зубца Q) инфаркта миокарда; послеоперационных катаболических изменений, гибернации миокарда или диабетической кардиомиопатии, недостаточного выведения натрия с мочой, избыточной концентрации калия в моче, состояний или расстройств, связанных с токсической гиперволемией (например, при почечной недостаточности, застойной сердечной недостаточности, нефротическом синдроме, циррозе, отеке легких и гипертензии), синдрома поликистоза яичников, дыхательной недостаточности, нефропатии, систолической дисфункции левого желудочка (например, при патологической фракции выброса левого желудочка), желудочно-кишечных расстройств, таких как диарея, послеоперационный демпинг-синдром и синдром раздраженной кишки (а именно, за счет ингибирования антро-дуоденальной моторики), полиневропатии критического состояния (CIPN), синдрома системной воспалительной реакции (SIRS), дислипидемии, поражения ткани органа, вызванного реперфузией кровотока после ишемии, фактора риска развития ишемической болезни сердца (CHDRF).
В дополнительном аспекте изобретения изобретение относится к способу дифференцировки стволовых клеток/клеток-предшественников печени в функциональные клетки поджелудочной железы, предотвращения разрушения бета-клеток и стимуляции пролиферации бета-клеток, снижению уровней норэпинефрина в плазме крови, индукции инотропного эффекта и усиления сокращаемости сердечной мышцы, улучшения питания при неалиментарном пути (например, за счет внутривенной, подкожной, внутримышечной, перитонеальной или другой инъекции или инфузии), медикаментозной подготовки индивида к эндоскопическим процедурам, и регулированию уровней триглицеридов у больных, где указанный способ включает введение указанному индивиду композиции по настоящему изобретению, содержащей эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Предпочтительно, указанный индивид является млекопитающим, более предпочтительно, приматом, еще более предпочтительно, человеком.
Краткое описание чертежей
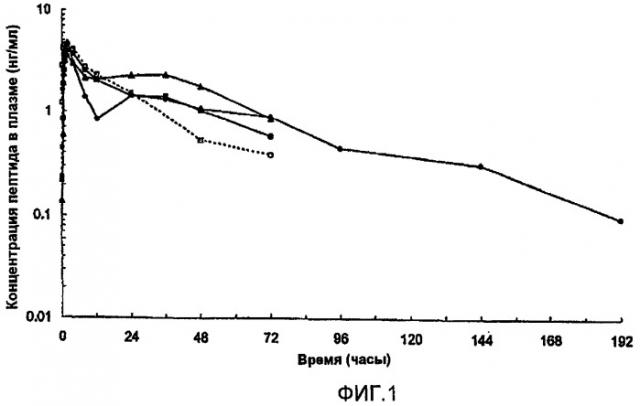
На фиг.1 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.с.) введения собакам приблизительно 1 мг [Aib8,35]hGLP-1(7-36)NH2. В каждом случае пептид вводили в виде водной цинксодержащей композиции, содержащей приблизительно 1% (масс./об.) пептида и имеющей молярное соотношение пептид:Zn, равное приблизительно 1,5. Закрашенные квадраты и пустые квадраты соответствуют композициям, в которых значение pH регулируется с помощью NaOH, как описано в описании; закрашенные треугольники соответствуют композиции, в которой рН не регулировали с помощью NaOH; закрашенные круги соответствуют композиции, забуференной AcOH/AcO-.
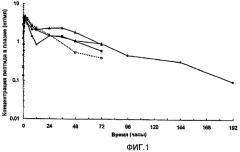
На фиг.2 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.с.) введения собакам приблизительно 15 мг [Aib8,35]hGLP-1(7-36)NH2. В каждом случае пептид вводили в виде водной цинксодержащей композиции, содержащей приблизительно 10% (масс./об.) пептида и имеющей молярное соотношение пептид:Zn, равное приблизительно 1,5. Закрашенные квадраты и пустые квадраты соответствуют композициям, в которых значение pH регулируется с помощью NaOH, как описано в описании; закрашенные треугольники соответствуют композиции, в которой значение pH не регулировали с помощью NaOH; закрашенные круги соответствуют композициии, забуференной AcOH/AcO-.
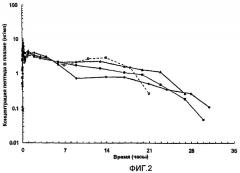
На фиг.3 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.с.) введения собакам приблизительно 1 мг [Aib8,35]hGLP-1(7-36)NH2. В каждом случае пептид вводили в виде полутвердой водной цинксодержащей композиции следующим образом: черные круги: приблизительно 5% (масс./об.) пептида, молярное соотношение пептид:Zn составляет приблизительно 5,4:1, без регулирования значения pH; белые круги: приблизительно 10% (масс./об.) пептида, молярное соотношение пептид:Zn составляет приблизительно 5,4:1, без регулирования значения pH; белые квадраты: приблизительно 10% (масс./об.) пептида, молярное соотношение пептид:Zn составляет приблизительно 5,4:1, pH регулировали с помощью NaOH; черные квадраты: приблизительно 10% (масс./об.) пептида, молярное соотношение пептид:Zn составляет приблизительно 4:1, pH регулировали с помощью NaOH.
На фиг.4 схематично представлены различные устройства, которые можно использовать для получения некоторых композиций по настоящему изобретению.
На фиг.5 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.c.) введения собакам приблизительно 1 мг [Aib8,35]hGLP-1(7-36)NH2. Пептид вводили в виде водной цинксодержащей композиции с концентрацией пептида, равной приблизительно 2%, и молярным соотношением пептид:Zn, равным приблизительно 1,5:1.
На фиг.6 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.c.) введения собакам приблизительно 15 мг [Aib8,35]hGLP-1(7-36)NH2. Пептид вводили в виде полутвердой цинксодержащей композиции с концентрацией пептида, равной приблизительно 25%, и молярным соотношением пептид:Zn, равным приблизительно 4:1.
На фиг.7 представлены параметры плазмы (медиана), полученные после однократного подкожного (s.c.) введения собакам приблизительно 15 мг [Aib8,35]hGLP-1(7-36)NH2. Пептид вводили в виде полутвердой цинксодержащей композиции с концентрацией пептида, равной приблизительно 23%, и молярным соотношением пептид:Zn, равным приблизительно 1,5:1.
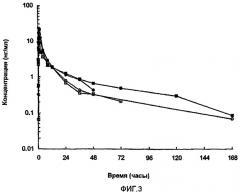
На фиг.8 представлен полный цикл параметров плазмы (медиана), полученных после однократного подкожного (s.c.) введения крысам 0,3 мг (3 мкл 10% раствора) анализируемых композиций HCl-соли аналога GLP-1:
(1) HCl-соль [Aib8,35]hGLP-1(7-36)NH2 с CuCl2: молярное соотношение [Aib8,35]hGLP-1(7-36)NH2/CuCl2 составляет 1,5:1. Концентрация пептида составляет 10% (30 мМ) в воде (масс./масс.) с приблизительно pH 5,5.
(2) HCl-соль [Aib8,35]hGLP-1(7-36)NH2 с ZnCl2: молярное соотношение ([Aib8,35]hGLP-1(7-36)NH2/ZnCl2 составляет 1,5:1. Концентрация пептида составляет 10% (30 мМ) в воде (масс./масс.) с приблизительно pH 5,5.
На фиг.9 представлен полный цикл параметров плазмы (медиана), полученных после однократного подкожного (s.c.) введения крысам 0,3 мг (3 мкл 10% раствора) анализируемых композиций ацетатной соли аналога GLP-1:
Ацетатная соль [Aib8,35]hGLP-1(7-36)NH2 с ZnCl2: молярное соотношение [Aib8,35]hGLP-1(7-36)NH2/ZnCl2 составляет 1,5:1. Концентрация пептида составляет 10% (30 мМ) в воде (масс./масс.) с pH приблизительно 5,5.
На фиг.10 представлена начальная часть параметров плазмы (медиана), полученных после однократного подкожного (s.c.) введения крысам 0,3 мг (3 мкл 10% раствора) анализируемых композиций, представленных на фиг.8.
На фиг.11 представлена начальная часть параметров плазмы (медиана), полученных после однократного подкожного (s.c.) введения крысам 0,3 мг (3 мкл 10% раствора) анализируемых композиций, представленных на фиг.9.
На фиг.12 представлен рассчитанный процент [Aib8,35]hGLP-1(7-36)NH2, оставшегося на месте инъекции у крыс после однократного подкожного (s.c.) введения 0,3 мг (3 мкл 10% раствора) трех анализируемых композиций, представленных на фиг.8.
Подробное описание изобретения
Предпочтительный пептид GLP-1, который может быть использован в виде соли пептида по изобретению, обозначен в описании следующим образом, например, [Aib8,35]hGLP-1(7-36)NH2, с аминокислотными заменами в природной последовательности, расположенными в первых скобках (например, Aib8,35 обозначает, что Ala8 и Gly35 в hGLP-1 заменены на Aib). Aib является аббревиатурой α-аминоизомасляной кислоты. Аббревиатура GLP-1 обозначает глюкагоноподобный пептид-1; hGLP-1 обозначает глюкагоноподобный пептид-1 человека. Цифры между вторыми скобками обозначают число аминокислот в пептиде (например, hGLP-1(7-36) обозначает аминокислоты 7-36 пептидной последовательности GLP-1 человека). Последовательность hGLP-1(7-37) приведена в статье Mojsov S., Int. J. Peptide Protein Res., 40, 1992, pp. 333-342. О