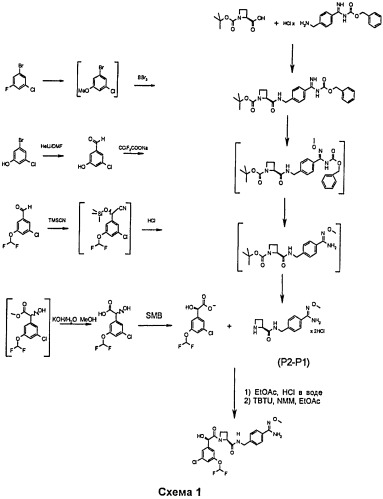
Новые кристаллические формы
Иллюстрации
Показать всеИзобретение относится к кристаллической ангидратной форме (2S)-1-{(2R)-2-[3-хлор-5-(дифторметокси)фенил]-2-гидроксиацетил}-N-[4-(N'-метоксикарбамимидоил)бензил]азетидин-2-карбоксамида формулы:
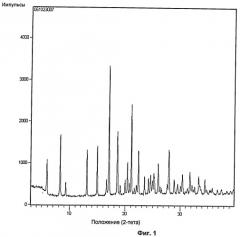
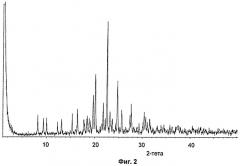
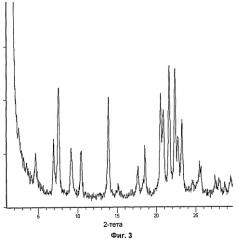
имеющей картину дифракции рентгеновских лучей на порошке, характеризующуюся пиками со значениями d 15,2 Å, 10,8 Å, 6,8 Å, 6,0 Å, 5,2 Å, 4,79 Å, 4,23 Å и 3,98 Å, которое может быть использовано в фармацевтической композиции в качестве ингибитора тромбина. 2 н. и 4 з.п. ф-лы, 27 пр., 4 ил.
Реферат
Область изобретения
Данное изобретение относится к новым твердым формам некоторых лекарственных соединений, к фармацевтическим композициям, содержащим их, к способам их получения и применению новых твердых форм и композиций, содержащих их, в лечении.
Предшествующий уровень техники
При приготовлении лекарственных композиций в виде препарата важно, чтобы лекарственное средство находилось в форме, в которой с ним можно удобно обращаться и его обрабатывать. Это важно не только с точки зрения достижения рентабельного производственного процесса, но также с точки зрения последующего изготовления фармацевтических композиций (например, пероральных лекарственных форм, таких как таблетка), содержащих активное соединение.
Кроме того, при изготовлении пероральных лекарственных композиций, важно, чтобы обеспечивался надежный и воспроизводимый профиль концентрации лекарственного вещества в плазме после введения пациенту. Это особенно важно в изготовлении композиций, содержащих антитромботические агенты.
Химическая стабильность, стабильность твердого состояния и "срок годности" активных ингредиентов также являются очень важными факторами. Лекарственное средство и композиции, содержащие его, должны обладать способностью эффективно храниться в течение длительных периодов времени без демонстрации значительного изменения физико-химических характеристик активного компонента (например, его химического строения, плотности, гигроскопичности и растворимости).
Кроме того, также важна возможность обеспечить лекарственное средство в форме, которая является химически чистой настолько, насколько это возможно.
Аморфные вещества могут создавать трудности в этом отношении. Например, такие вещества обычно трудны в обращении и для приготовления в виде препарата, обеспечивают ненадежную растворимость, и часто обнаруживают нестабильность и химическую неоднородность.
Специалисту понятно, что, если лекарственное средство можно легко получать в стабильной кристаллической форме, вышеуказанные проблемы могут быть решены.
Таким образом, в изготовлении рентабельных и фармацевтически приемлемых лекарственных композиций важно, когда это возможно, получить лекарственное средство в по существу кристаллической и стабильной форме.
Однако следует заметить, что такая цель не всегда достижима. Действительно, обычно невозможно предвидеть, исходя только из молекулярной структуры, какой будет характер кристаллизации соединения, либо как такового, либо в форме соли. Это можно определять только опытным путем.
В международной патентной заявке WO 02/44145 раскрыт ряд соединений, которые, как было обнаружено, полезны в качестве ингибиторов тромбина или пролекарств ингибиторов тромбина, где ингибиторы тромбина имеют общую формулу I
(где Ra, R1, R2, Y и R3 имеют значения, приведенные в описании WO 02/44145), и их фармацевтически приемлемые производные (включая пролекарства).
В WO 02/44145 также конкретно раскрыты соединения Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe), (упоминаемый ниже в данном описании изобретения как Соединение А), где Aze представляет собой (S)-азетидин-2-карбоксилат и Pab представляет собой пара-амидинобензиламино, и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) (упоминаемый ниже в данном описании изобретения как Соединение В).
Способ синтеза Соединений А и В описан в Примерах в WO 02/44145, но Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) в кристаллической форме не раскрыты.
Соединения А и В метаболизируются после перорального и/или парентерального введения в соответствующее свободное амидиновое соединение (Соединение С), которое, как было обнаружено, является ингибитором тромбина (смотри WO 02/44145, релевантное описание которой включено в данное описание изобретения посредством ссылки).
В международной патентной заявке WO 03/101957 предложены кристаллические фармацевтически приемлемые соли присоединения кислот, таких как этансульфоновая кислота, н-пропансульфоновая кислота, н-бутансульфоновая кислота и соли бензолсульфоновой кислоты соединений, таких как Соединение А.
Однако сохраняется необходимость найти кристаллические формы таких активных соединений, которые находятся не в форме солей. Такие кристаллические формы свободного основания позволяют получать композиции без условий в отношении противоиона (который, например, вносит "нетерапевтическую" массу в конечную композицию). Например, использование свободного основания Соединения А вместо соли бензолсульфоновой кислоты позволяет понизить массу приблизительно на 30%, с соответствующим меньшим размером таблетки.
Описание изобретения
Авторы изобретения обнаружили, что Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) можно получать в одной или более чем одной несолевых формах, которые являются по существу кристаллическими по своей природе.
Таким образом, согласно первому аспекту изобретения предложены соединения Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) в по существу кристаллических, несолевых формах (ниже упоминаемых как "соединения по изобретению" или "твердые или кристаллические формы по изобретению").
Хотя авторы изобретения обнаружили, что возможно получить Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) в формах, которые являются кристаллическими более чем на 80% под "по существу кристаллической" авторы изобретения подразумевают более чем на 10% (например, более 20%), в частности более 30%, и более конкретно более 40% кристалличность. Степень (%) кристалличности может определить специалист, используя дифракцию рентгеновских лучей на порошке (XRPD). Можно использовать другие способы, такие как ЯМР твердого тела (ядерно-магнитно-резонансная) спектроскопия, FT-IR (инфракрасная спектроскопия с Фурье-преобразованием), Рамановская спектроскопия, дифференциальная сканирующая калориметрия (DSC) и микрокалориметрию.
Соединения по изобретению могут находиться в несольватированной форме (такой как ангидрат) или в форме сольвата, и все такие формы включены как часть изобретения. Сольваты Соединения А или В включают алкоголяты, такие как изопропанольный сольват (например, соединение по изобретению, которое находится в форме изопропанольного сольвата, содержащего 1/3 молекулы изопропанола на молекулу соединения по изобретению).
Кроме того, как часть изобретения также включены любые таутомеры соединений по изобретению.
Соединения по изобретению могут иметь улучшенные свойства, например стабильность, например по сравнению с Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH), полученными, как описано в WO 02/44145. Соединения по изобретению имеют другие свойства по сравнению с их аморфными формами свободного основания и/или кристаллическими солевыми формами. Например, другая растворимость и/или скорость растворения (в различных растворителях, например водных системах) может быть полезной в композициях, содержащих соединения по изобретению (такие как, например, кристаллическая форма Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe), описанная в данном описании изобретения).
Согласно дополнительному аспекту изобретения, таким образом в данной заявке предложена стабильная кристаллическая форма Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) и стабильная кристаллическая форма Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH).
Термин "стабильность", как определено в данном описании изобретения, включает химическую стабильность и/или стабильность твердого состояния.
Под "химической стабильностью" авторы изобретения подразумевают, что соответствующие соединения можно хранить в отдельной форме, или в форме композиции, в которой они представлены в смеси с фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами (например, в пероральной лекарственной форме, такой как таблетка, капсула и так далее), при нормальных условиях хранения, с ограниченной степенью химической деструкции или разложения.
Под "стабильностью твердого тела", авторы изобретения подразумевают, что соответствующие соединения можно хранить в отдельной твердой форме, или в форме твердой композиции, в которой они представлены в смеси с фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами (например, в пероральной лекарственной форме, такой как таблетка, капсула и так далее), при нормальных условиях хранения, с незначительной степенью фазовых превращений в твердом состоянии (например, кристаллизации, перекристаллизации, твердофазного перехода, гидратации, дегидратации, сольватации или десольватации).
Примеры "нормальных условий хранения" включают температуру от минус 80°С до плюс 50°С (в частности, 0°С-40°С и более конкретно комнатную температуру, такую как 15°С-30°С), давление 0,1-2 бар (0,1-2×105 Па) (в частности, атмосферное давление), относительную влажность от 5 до 95% (в частности, от 10 до 75%), и/или воздействие УФ-излучения/видимого света до 460 люкс, в течение длительных периодов (например, больше или равных шести месяцам). Соединения по изобретению при таких условиях могут обнаруживать соответствующую химическую деструкцию/разложение или полиморфную трансформацию менее 15%, более конкретно менее 10%, и особенно менее 5%. Специалистам очевидно, что вышеуказанные верхние и нижние пределы для температуры, давления и относительной влажности представляют собой крайние значения нормальных условий хранения, и что некоторые комбинации таких крайних значений не будут иметь место во время нормального хранения (например, температура 50°С и давление 0,1 бар (0,1×105 Па)).
Соединения по изобретению можно предпочтительно получать путем кристаллизации Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) или Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH), как описано в данном описании изобретения.
Согласно дополнительному аспекту изобретения, предложен способ получения соединения по изобретению, который включает кристаллизацию Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) или Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) из перенасыщенного раствора соответствующего соединения в подходящем растворителе. В таком способе важно оставить перенасыщенный раствор перемешиваться в течение достаточного периода времени. Длительность этого промежутка времени зависит от перенасыщения так, что сильно перенасыщенные растворы могут кристаллизоваться в течение суток или двух, тогда как для менее перенасыщенных растворов может требоваться большее время (например, неделя или более).
Было обнаружено, что в среде, не содержащей затравочных кристаллов, выпаривание растворителя не приводит к кристаллизации, то есть важно поддерживать постоянный уровень перенасыщения (например, при использовании закрытого сосуда).
Представляется важным подходящее смешивание, например посредством перемешивания, возможно потому, что оно создает сайты для первичного, а также вторичного зарождения кристаллов, таким образом ускоряя процесс кристаллизации. Если возможно, добавление затравочных кристаллов (кристаллизуемой формы) к перенасыщенному раствору ускорит процесс кристаллизации в связи с тем, что время первичного зарождения кристаллов в таком случае сократится. Таким образом, в дополнительном способе по изобретению предложено получение соединения по изобретению, которое включает кристаллизацию Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OMe) или Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-Aze-Pab(OH) из (перенасыщенного) раствора или суспензии соединения и подходящего растворителя с использованием затравки соответствующего соединения для инициации и/или облегчения кристаллизации. Подходящие растворители включают спирты (такие как этанол и изопропанол), этилацетат, изопропилацетат, водные системы и подходящие их смеси (например, вода/этанол, изопропанол/этилацетат и изопропилацетат/этанол/гептан). При необходимости также можно применять антирастворители. Конкретный способ по изобретению включает применение трех систем растворителей, которые способствуют агрегации кристаллов, то есть применение сильного растворителя, умеренного растворителя и антирастворителя, таких как сильный растворитель этанол, умеренный растворитель изопропилацетат и антирастворитель гептан.
Таким образом можно сокращать период кристаллизации от нескольких суток до примерно одних суток с получением выхода примерно 90%. Увеличенное количество затравочных кристаллов (например, вплоть до 4% масс./масс.) и время добавления антирастворителя может снижать время кристаллизации посредством такого образования центров кристаллизации.
Согласно изобретению кристаллическое Соединение А или В может быть получено путем кристаллизации из перенасыщенного раствора соответствующего аморфного соединения в подходящем растворителе. Перенасыщенный раствор можно получить после растворения соединения в подходящем растворителе и упаривания с получением интересующего (аморфного) соединения, с последующим получением подходящего перенасыщенного раствора. Более предпочтительно перенасыщенный раствор может быть получен из растворов, которые экстрагировали непосредственно из реакционных растворов, в которых интересующие соединения были образованы; или, особенно предпочтительно, непосредственно из реакционных растворов, внутри которых интересующее соединение было образовано.
Дополнительная информация о способах изобретения и продуктах, получаемых посредством этого, описана в Примерах данного описания изобретения.
Кристаллическое вещество - ангидрат можно получать, как описано в данном описании изобретения, посредством кристаллизации Соединения А или В из одного или более подходящих растворителей или их смесей. Ангидрат может быть получен посредством кристаллизации из системы растворителя, которая является по существу не содержащей воду (которая может быть высушена, и/или которую можно сушить в процессе кристаллизации). Однако кристаллическое безводное вещество (например, Соединение А) можно также получать из воды или смесей вода/этанол.
Соединения по изобретению, которые представляют собой ангидраты, обычно содержат не более 2%, в частности 1%, более конкретно 0,5% и более конкретно 0,2% (масс./масс.) воды, причем эта вода либо связана (кристаллизационная вода или иная), либо не связана.
Кристаллический изопропанольный сольват можно получить, как описано в данном описании изобретения путем кристаллизации (например, Соединения В) из системы растворителя, содержащей изопропанол, или комбинации изопропанола и одного или более других подходящих растворителей.
Соединения по изобретению можно выделять, используя методы, которые хорошо известны специалистам в данной области техники, например путем декантации, фильтрации или центрифугирования.
Соединения по изобретению можно сушить, используя стандартные методы. Специалисту очевидно, что температура сушки и продолжительность сушки могут влиять на характеристики твердого состояния соединений, которые находятся в форме сольватов (например, при повышенных температурах и/или пониженном давлении может происходить десольватация).
Если соединения по изобретению кристаллизуются, или перекристаллизуются, как описано в данном описании изобретения, то полученное соединение находится в форме, которая имеет улучшенную химическую стабильность и/или стабильность твердого состояния, упоминаемую здесь.
Кристаллические формы соединений по изобретению можно легко охарактеризовать, используя методы дифракции рентгеновских лучей на порошке (XRPD), например, как описано ниже. Также можно использовать стандартные методы DSC, TGA.
Фармацевтические препараты и медицинские применения
Согласно изобретению кристаллические формы по изобретению можно вводить перорально, внутривенно, подкожно, трансбуккально, ректально, дермально, назально, трахеально, бронхиально, любым другим парентеральным путем, или посредством ингаляции, в форме фармацевтического препарата, содержащего соединение по изобретению в фармацевтически приемлемой лекарственной форме. Однако авторы изобретения предпочитают, чтобы соединение по изобретению представляло собой форму, которая пригодна для перорального введения.
В зависимости от расстройства и пациента, подлежащего лечению, а также пути введения, кристаллические формы по изобретению можно вводить в различных дозах (смотри ниже).
Кристаллические формы по изобретению можно дополнительно обрабатывать перед приготовлением в виде подходящей фармацевтической композиции, например, их можно размалывать или измельчать на более мелкие частицы.
Согласно дополнительному аспекту изобретения предложена фармацевтическая композиция, содержащая кристаллическую форму по изобретению в смеси с фармацевтически приемлемым вспомогательным веществом, разбавителем или носителем.
Количество кристаллического соединения по изобретению, которое используют в такой композиции, зависит от состояния и пациента, подлежащего лечению, а также кристаллических(ой) форм(ы), которые(ую) используют, но может быть определено без изобретательского подхода.
Согласно еще одному аспекту изобретения, предложена фармацевтическая композиция, содержащая соединение по изобретению в композиции с немедленным высвобождением, как описано в международной патентной заявке WO 03/101423, релевантная часть описания которой включена в данное описание изобретения посредством ссылки.
Термин фармацевтическая композиция с "немедленным высвобождением" включает любую композицию, в которой скорость высвобождения лекарственного средства из композиции и/или абсорбции лекарственного средства ни заметно, ни намеренно, не замедлена галеновыми манипуляциями. В настоящем случае немедленное высвобождение может быть обеспечено с помощью подходящего фармацевтически приемлемого разбавителя или носителя, причем разбавитель или носитель не пролонгируют в значительной степени, скорость высвобождения лекарственного средства и/или абсорбцию. Таким образом, термин исключает композиции, которые адаптированы для обеспечения "модифицированного", "контролируемого", "замедленного", "продолжительного", "пролонгированного" или "отсроченного" высвобождения лекарственного средства.
В данном контексте термин "высвобождение" включает предоставление (или презентацию) лекарственного средства из композиции в желудочно-кишечный тракт, к тканям организма и/или в системный кровоток. Для высвобождения в желудочно-кишечном тракте (натощак) высвобождение происходит при таких значениях рН, как рН=1-3, особенно при значении, равном или примерно равном рН=1. В одном аспекте изобретения композиция, как описано в данном описании изобретения, с Соединением А или В в кристаллической форме (ниже "Соединение А или В") высвобождает лекарственное средство в интервале значений рН. В другом аспекте изобретения композиция, как описано в данном описании изобретения, с Соединением А или В (в кристаллической форме) высвобождает лекарственное средство в интервале значений рН, таком как рН=1-3, в частности, при рН, равном или примерно равном рН=1. Таким образом, композиции по изобретению могут высвобождать по меньшей мере 70% (в частности 80%) активного ингредиента в течение 4 часов, например в течение 3 часов, в частности 2 часов, более конкретно в течение 1,5 часов, и особенно в течение одного часа (например, в течение 30 минут) после либо перорального, либо парентерального введения.
Композиции по изобретению можно готовить в виде препарата согласно ряду известных методик, например, как описано в М.Е.Aulton "Pharmaceutics: The Science of Dosage Form Design" (1988) (Churchill Livingstone), релевантные части описания данного документа включены в данную заявку посредством ссылки.
Композиции по изобретению могут являться, или их можно адаптировать стандартными методами, чтобы они являлись пригодными для перорального введения, например в форме таблетки с немедленным высвобождением, капсулы с немедленным высвобождением или в виде жидкой лекарственной формы, содержащей активный ингредиент. Такие типы композиций хорошо известны специалистам и могут быть получены методами, известными в данной области техники.
Подходящие разбавители/носители (которые также можно называть "наполнителями") для использования в пероральных композициях по изобретению, например в композициях в форме таблеток с немедленным высвобождением, включают одноосновный фосфат кальция, двухосновный фосфат кальция (включая дигидрат двухосновного фосфата кальция и ангидрат двухосновного фосфата кальция), трехосновный фосфат кальция, лактозу, микрокристаллическую целлюлозу, силикатированную микрокристаллическую целлюлозу, маннит, сорбит, крахмал (например, кукурузный, картофельный или рисовый), глюкозу, лактат кальция, карбонат кальция и тому подобное. Конкретные разбавители/носители включают двухосновный фосфат кальция и микрокристаллическую целлюлозу, которые можно использовать самостоятельно или в комбинации с другим разбавителем/носителем, таким как маннит.
Композиция по изобретению в форме таблетки с немедленным высвобождением может содержать один или более эксципиентов для улучшения физических и/или химических свойств конечной композиции, и/или для облегчения способа изготовления. Такие эксципиенты являются обычными в изготовлении композиций с немедленным высвобождением для пероральной доставки лекарственного средства и включают один или более чем один из следующего: один или более чем один смазывающий агент (такой как стеарат магния, стеариновая кислота, стеарат кальция, стеариловый спирт или, в частности, стеарилфумарат натрия); скользящее вещество (например, тальк или коллоидный оксид кремния); один или более чем один наполнитель (такой как поливинилпирролидон, микрокристаллическая целлюлоза, полиэтиленгликоль (PEG), полиэтиленоксид, гидроксипропилметилцеллюлоза (НРМС) с низкой молекулярной массой, метилцеллюлоза (МС) с низкой молекулярной массой, гидроксипропилцеллюлоза (НРС) с низкой молекулярной массой, гидроксиэтилцеллюлоза (НЕС) с низкой молекулярной массой, крахмал (такой как кукурузный, картофельный или рисовый) или натрий-карбоксиметилцеллюлоза с низкой молекулярной массой; (конкретными связующими веществами являются поливинилпирролидон или НРМС с низкой молекулярной массой); один или более чем один агент, регулирующий рН (такой как органическая кислота (например, лимонная кислота) или соль щелочного металла (например, натрия), оксид магния, щелочной или щелочноземельный металл (например, сульфат, метасульфат, пропионат или сорбат натрия, кальция или калия); один или более чем один разрыхлитель (например, натрия крахмала гликолят, сшитый поливинилпирролидон, сшитая натрий-карбоксиметилцеллюлоза, крахмал (такой как кукурузный, картофельный или рисовый) или альгинат); краситель, вкусоароматизатор, агент, изменяющий тоничность, покрывающее вещество или консервант.
Очевидно, что некоторые из вышеуказанных эксципиентов, которые могут присутствовать в конечной пероральной композиции с немедленным высвобождением (например, таблетке) по изобретению, могут обладать более чем одной из вышеуказанных функций.
В дополнительном аспекте изобретения жидкая композиция по изобретению адаптирована, чтобы быть пригодной для перорального введения.
Подходящие жидкие композиции, которые следует вводить перорально, включают такие, в которых Соединение А или В присутствует вместе с водным носителем, таким как вода. Композиция по настоящему изобретению, содержащая водный носитель, также может содержать один или более чем один эксципиент, такой как противомикробный консервант; модификатор тоничности (например, хлорид натрия, маннит или глюкоза); агент, корректирующий рН (например, обычная неорганическая кислота или основание, включая соляную кислоту или гидроксид натрия); агенты, регулирующие рН (то есть буфер; например винная кислота, уксусная кислота или лимонная кислота); поверхностно-активное вещество (например, додецилсульфат натрия (SDS) или Solutol™); солюбилизатор, который служит для содействия солюбилизации активного ингредиента (например, этанол, полиэтиленгликоль или гидроксипропил-β-циклодекстрин или поливинилхлорид (PVP)); или антиоксидант.
Жидкие пероральные композиции могут находиться в форме суспензий активного ингредиента вместе с водным растворителем или, более конкретно, водными растворами (то есть растворы активного соединения, включающие воду в качестве растворителя). В данном контексте термин "водный раствор" включает композиции, в которых по меньшей мере 99% активного ингредиента находится в растворе примерно при 5°С и атмосферном давлении, и термин "суспензия" означает, что более 1% активного ингредиента не находится в растворе при таких условиях. Типичные дисперсионные агенты для суспензий представляют собой гидроксипропилметилцеллюлозу, АОТ (диоктилсульфосукцинат натрия), PVP (поливинилпирролидон) и SDS (додецилсульфат натрия). Могут быть возможны другие альтернативы.
В другом аспекте настоящего изобретения предлагается жидкая пероральная композиция, содержащая Соединения А или В, воду и по меньшей мере один дополнительный агент. Дополнительные агенты включают:
1) полиэтиленгликоль (PEG) и возможно также этанол, и/или винную кислоту, и/или лимонную кислоту, и/или соляную кислоту; или
2) хлорид натрия (который растворяют в композиции), и возможно также этанол; или
3) соляную кислоту и/или гидроксид натрия для доведения рН до подходящего значения (в частности, в диапазоне 3-8); или
4) DMA (диметилацетамид) и возможно также триглицерид со средней длиной цепи (такой как миглиол); или
5) β-циклодекстрин (такой как гидроксипропил-β-циклодекстрин);
6) модификатор тоничности, такой как хлорид натрия и/или маннит.
В дополнительном аспекте настоящего изобретения предложен пероральный раствор, содержащий Соединение А или В, воду и по меньшей мере один дополнительный агент, как перечислено выше в (1)-(6).
В другом аспекте изобретения предлагается водная композиция Соединения А или В, содержащая солюбилизирующий агент, такой как полиэтиленгликоль, β-циклодекстрин (такой как гидроксипропил-β-циклодекстрин), сорбит или этанол.
В дополнительном аспекте настоящего изобретения предлагается композиция в виде перорального раствора, содержащая Соединения А или В и этанол. Такая композиция может дополнительно содержать триглицерид со средней длиной цепи (такой как миглиол).
В еще одном дополнительном аспекте настоящего изобретения предлагается композиция в виде перорального раствора, содержащая соединение формулы (I) и DMA. Такая композиция может дополнительно содержать триглицерид со средней длиной цепи (такой как миглиол).
В дополнительном аспекте изобретения композиция по изобретению адаптирована, чтобы быть пригодной для парентерального введения. Термин "парентеральный" включает любой способ введения, который не включает пероральное введение в желудочно-кишечный тракт, и включает введение подкожно, внутривенно, внутриартериально, трансдермально, интраназально, внутрибуккально, внутрикожно, внутримышечно, внутрь липомы, внутрибрюшинно, ректально, сублингвально, местно, посредством ингаляции, или любым другим парентеральным путем.
Подходящие композиции по изобретению, которые предназначены для парентерального введения, включают композиции, в которых Соединение А или В присутствует вместе с водным носителем, таким как вода.
Композиция по настоящему изобретению, содержащая водный носитель, может дополнительно содержать один или более чем один эксципиент, такой как противомикробный консервант; модификатор тоничности (например, хлорид натрия, маннит или глюкоза); рН-корректирующий агент (например, обычная неорганичная кислота или основание, включая соляную кислоту или гидроксид натрия); агенты, регулирующий рН (то есть буфер; например винная кислота, уксусная кислота или лимонная кислота); поверхностно-активное вещество (например, додецилсульфат натрия (SDS) или Solutol™); солюбилизатор, который служит для содействия солюбилизации активного ингредиента (например, этанол, полиэтиленгликоль или гидроксипропил-β-циклодекстрин или поливинилхлорид (PVP)); или антиоксидант.
Парентеральные композиции могут находиться в форме суспензий активного ингредиента вместе с водным растворителем или, более конкретно, водными растворами (то есть растворы активного соединения, включающие воду в качестве растворителя). В данном контексте термин "водный раствор" включает композиции, в которых по меньшей мере 99% активного ингредиента находится в растворе при приблизительно 5°С и атмосферном давлении, и термин "суспензия" означает, что более 1% активного ингредиента не находится в растворе при таких условиях. Типичные дисперсионные агенты для суспензий представляют собой гидроксипропилметилцеллюлозу, АОТ, PVP и SDS, но возможны и другие варианты.
Число эксципиентов, используемых в пероральных и парентеральных композициях по изобретению, зависит от многих факторов, таких как природа и количество присутствующего активного ингредиента и количество включенного разбавителя/носителя (водного растворителя или иного).
В другом аспекте настоящего изобретения предложена парентеральная композиция, содержащая Соединение А или В, воду и по меньшей мере один дополнительный агент. Дополнительные агенты включают:
1) полиэтиленгликоль (PEG) и также возможно этанол, и/или винную кислоту, и/или соляную кислоту; или
2) хлорид натрия (который будет растворен в композиции), и возможно также этанол; или
3) соляную кислоту и/или гидроксид натрия для доведения рН до подходящего значения (в частности, в диапазоне 3,5-8); или
4) DMA (диметилацетамид) и возможно также триглицерид со средней длиной цепи (такой как миглиол); или
5) β-циклодекстрин (такой как гидроксипропил-β-циклодекстрин);
6) модификатор тоничности, такой как хлорид натрия и/или маннит.
В дополнительном аспекте настоящего изобретения предлагается инъецируемый раствор, содержащий Соединение А или В, воду и по меньшей мере один дополнительный агент, как перечислено выше в (1)-(6).
В другом аспекте изобретения предлагается водная композиция Соединения А или В, содержащая солюбилизирующий агент, такой как полиэтиленгликоль, β-циклодекстрин (такой как гидроксипропил-β-циклодекстрин), сорбит или этанол.
В дополнительном аспекте настоящего изобретения предлагается парентеральная композиция, содержащая Соединение А или В и этанол. Такая композиция может дополнительно содержать триглицерид со средней длиной цепи (такой как миглиол).
В еще одном дополнительном аспекте настоящего изобретения предлагается парентеральная композиция, содержащая соединение формулы (I) и DMA. Кроме того, данная композиция может содержать триглицерид со средней длиной цепи (такой как миглиол).
В еще одном дополнительном аспекте настоящего изобретения предлагается твердая композиция, содержащая микрокристаллическую целлюлозу и поливинилпирролидон (PVP); или содержащая микрокристаллическую целлюлозу и натрия крахмала гликолят.
Композиции по изобретению, например парентеральные композиции, содержащие соли, можно получать путем добавления разбавителя/носителя к подходящей предварительно приготовленной соли.
Композиции, содержащие активный ингредиент, можно также представить в твердой форме, пригодной для применения в получении композиции по изобретению (например, раствора, такого как водный раствор, например, для парентерального введения) ex tempore. Такие композиции могут находиться в форме твердого вещества, содержащего активный ингредиент, возможно в присутствии одного или более дополнительных эксципиентов, как определено выше в данном описании изобретения, и возможно вплоть до 10% (масс./масс.) разбавителя и/или носителя, как определено выше в данном описании, эти композиции упоминаются выше в данном описании изобретения как "твердые композиции по изобретению".
Твердые композиции по изобретению можно получать путем удаления разбавителя/носителя (например, растворителя) из композиции по изобретению или из концентрированной композиции по изобретению, которые могут, например, находиться в форме раствора, например водного раствора.
В другом аспекте настоящего изобретения предлагается перорально вводимая композиция с немедленным высвобождением, содержащая Соединение А или В, носитель (такой как микрокристаллическая целлюлоза), разрыхлитель (такой как натрия крахмала гликолят), связующее вещество (такое как поливинилпирролидон) и смазывающее вещество (такое как натрия стеарилфумарат). Такая композиция может также содержать дополнительный носитель (или наполнитель), такой как маннит.
Композиции по изобретению, которые находятся в форме таблеток с немедленным высвобождением, можно получать путем объединения активного ингредиента с разбавителем/носителем, используя стандартные методы, и применяя стандартное оборудование, известное специалисту, включающие влажное или сухое гранулирование, прямое прессование/уплотнение, сушку, измельчение, смешивание, таблетирование и нанесение покрытия, а также комбинации таких методов, например, как описано ниже. В одном аспекте изобретения соли присоединения кислоты соединений формулы (I) в кристаллической форме готовят в таблетках.
Таким образом, предложен способ для создания твердой композиции, пригодной для применения в получении препарата по изобретению (например, раствора, такого как водный раствор) ex tempore, включающий удаление разбавителя/носителя (например, растворителя) из композиции по изобретению, или концентрированной композиции по изобретению.
Растворитель можно удалять различными способами, известными специалистам в данной области техники, например выпариванием (при пониженном давлении или иным способом), лиофильной сушкой или любым способом удаления (высушивания) растворителя, который удаляет растворитель (такой как вода) с сохранением целостности активного ингредиента. Примером сушки является сублимационная сушка.
Таким образом, согласно дополнительному аспекту изобретения предлагается высушенная сублимацией (лиофилизированная) твердая композиция по изобретению.
Специалистам ясно, что при получении твердых композиций по изобретению можно добавлять подходящие дополнительные эксципиенты на подходящей стадии до удаления разбавителя/носителя. Например, в случае водных растворов, рН можно регулировать и/или корректировать, как описано выше в данном описании изобретения. Кроме того, можно добавлять подходящий дополнительный эксципиент с целью облегчения образования твердой композиции по изобретению в процессе удаления разбавителя/носителя (например, маннит, сахарозу, глюкозу, маннозу или трегалозу).
Твердая композиция Соединения А или В, таким образом, включает композицию, в которой содержание растворителя (например, воды), отличного от кристаллизационного растворителя, составляет не более 10%, например, менее 2% несвязанного растворителя, такого как вода.
Композиции по изобретению можно стерилизовать, например, посредством стерильной фильтрации или автоклавирования, и/или заполнять ими первичные упаковки, такие как флаконы, картриджи и предварительно заполняемые шприцы. Такие технологические операции также могут иметь место перед сушкой с образованием твердой композиции по изобретению.
Перед введением высушенную твердую композицию можно восстанавливать и/или разбавлять, например, в воде, физиологическом растворе, растворе глюкозы или любом другом подходящем растворе.
Количество разбавителя/носителя в пероральной (например, таблетка с немедленным высвобождением) композиции по изобретению зависит от многих факторов, таких как природа и количество используемого активного ингредиента и природа и количества любых других компонентов (например, дополнительных эксципиентов), присутствующих в композиции, но обычно составляет вплоть до 40% (масс./масс.), в частности вплоть до 30%, более конкретно вплоть до 20%