Гетероциклические соединения, имеющие сродство к мускариновым рецепторам
Иллюстрации
Показать всеНастоящее изобретение относится к гетероциклическим соединениям формулы (I), где Х2 представляет собой остаток C-Z-R2 или C-R3, где Z представляет собой NH или S; R1 выбран из структур (а), (b) и (с); R2 и R3 имеют значения, указанные в п.1 формулы изобретения, или к его фармацевтически приемлемым солям. Соединения по изобретению имеют сродство к мускариновым рецепторам и могут применяться при лечении, облегчении или предупреждении заболеваний и состояний, опосредованных мускариновыми рецепторами. Изобретение также относится к фармацевтической композиции, ряду конкретных соединений, применению заявленных соединений и к промежуточному соединению для получения соединений формулы (I). 5 н. и 8 з.п. ф-лы, 3 табл.
и
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к новым гетероциклическим соединениям, имеющим сродство к мускариновым рецепторам, фармацевтической композиции, содержащей указанные соединения, а также к применению указанных соединений для получения лекарственного средства для лечения, облегчения или предупреждения заболеваний и состояний, опосредованных мускариновыми рецепторами.
Предшествующий уровень техники
Мускариновые холинергические рецепторы опосредуют действие нейромедиатора ацетилхолина в центральной и периферической нервных системах. Мускариновые рецепторы содержат пять различных подтипов, обозначенных как мускариновые М1, М2, М3, М4 и М5 рецепторы. Каждый подтип имеет специфическое распределение в центральной и периферической нервных системах. М1 рецептор преимущественно экспрессирован в коре головного мозга и считается участвующим в регуляции высших когнитивных функций; М2 рецептор представляет собой преобладающий подтип, обнаруживаемый в сердце и участвующий в регуляции частоты сердечных сокращений; М3 рецептор широко экспрессирован во многих периферических тканях и считается участвующим в стимуляции желудочно-кишечного тракта и мочевыводящих путей, а также потоотделении и слюноотделении; М4 рецептор присутствует в головном мозге и может быть вовлечен в двигательную функцию и антипсихотические действия; М5 рецептор локализуется в головном мозге и может участвовать в присоединении к соединению и в развитии психотических состояний, таких как шизофрения. Ввиду ключевых физиологических ролей, отводимых каждому из подтипов мускариновых рецепторов, обширные усилия были предприняты для разработки новых соединений, проявляющих селективные агонистические или антагонистические свойства (см., например, ЕР 0296721; ЕР 0316718; Sauerberg, P. et al., J. Med. Chem., 1992, Vol. 35, No. 22, 2274-2283; Ward, J.S. et al., 1992, J. Med. Chem., Vol. 35, No. 22, 4011-4019; US 5,527,813; Zlotos, D.P. et al., Exp. Opin. Ther. Patents, Vol. 9, No. 8, 1999, 1029-1053; Plate, R., et al., Bioorg. Med. Chem. 4 (1996), 227-237; Plate, R. et al., Bioorg. Med. Chem. 8 (2000), 449-454; Del Guidice, M.R. et al., Arch. Pharm. Med. Chem. 2003, 336, 143-154).
Хорошо известным примером преимущественного агониста M1/M4 мускариновых рецепторов является тиадиазольное соединение ксаномелин, которое в преклинических исследованиях имеет желательный профиль, однако, в клинических исследованиях проявляет неблагоприятные побочные эффекты (см., например, обзор Eglen, R.M., Progress in Medicinal Chemistry, 2005, 43, p.105-136 и патент США № 5376668), которые, как представляется, связаны с активностью, опосредованной М2 рецепторами (например, воздействия на частоту сердечных сокращений). Кроме того, ксаномелин имеет относительно низкую (in vitro) метаболическую устойчивость. Связанные с ксаномелином соединения, кроме того, раскрыты в патенте США 5527813. Однако репрезентативные соединения проявляют неблагоприятные побочные эффекты, которые, как представляется, связаны с активностью, опосредованной М2 и М3 рецепторами (например, воздействия соответственно на частоту сердечных сокращений и слюноотделение).
Хотя продолжаются дальнейшие исследования по разработке терапевтических средств, которые имеют селективный M1/M4 профиль, до сих пор не получены перспективные средства. Поэтому существует потребность в новых селективных соединениях с заданными свойствами.
Описание изобретения
В настоящее время было обнаружено, что гетероциклические соединения формулы (I)
где гетероцикл содержит две двойные связи, которые могут присутствовать в нескольких положениях, представленных пунктирными линиями (---);
- гетероцикл содержит два гетероатома,
- W представляет собой N или NH;
- Y представляет собой CH, O или NH, где
если Y представляет собой О, то Х1 представляет собой СН и Х2 представляет собой остаток C-Z-R2 или C-R3, где Z представляет собой NH, О или S; и
если Y представляет собой CH или NH, то один из Х1 и Х2 представляет собой СН или N, причем другой представляет собой остаток C-Z-R2 или C-R3, где Z представляет собой NH или S;
-R1 выбран из структур (a), (b) и (c):
| (b) | и | ; |
- R2 выбран из (С1-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, оксо, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкенилокси, (С1-С6)алкенилтио, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, 5-членного ненасыщенного гетероцикла (необязательно замещенного галогеном), фенила, фенилокси и фенилтио, где фенильная группа необязательно замещена галогеном; или
- R2 представляет собой неразветвленный (С2-С8)алкил, замещенный в положении символа Za- группы соединением формулы (Ia)
,
где если Х1 представляет собой СН или N, X1a представляет собой СН или N и X2a представляет собой С-Za-, или
если Х1 представляет собой C-Z-R2, X1a представляет собой C-Za- и X2a представляет собой СН или N; и символы Wa, Ya и Za и заместитель R1a имеют такое же значение, как определено ранее для символов W, Y и Z и заместителя R1, и при этом не являются независимо выбранными, причем каждый из символов Wa, Ya и Za и заместитель R1a представляют соответственно символы и заместители, идентичные символам W, Y и Z и заместителю R1 в другой части структуры формулы (I);
- R3 выбран из (С4-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкенилокси, (С1-С6)алкенилтио, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, 5-членного ненасыщенного гетероцикла, необязательно замещенного галогеном, фенила, фенилокси и фенилтио, где фенильная группа необязательно замещена галогеном; или их фармацевтически приемлемые соли, сольваты или гидраты,
проявляют сродство к мускариновым рецепторам, в частности к М1 и/или М4 рецепторам, оказывая модулирующее, в частности (частично) агонистическое действие на мускариновые рецепторы. Кроме того, соединения по настоящему изобретению проявляют более высокую (in vitro) метаболическую устойчивость, чем соединение ксаномелин предшествующего уровня техники.
Соединения по изобретению могут применяться для лечения, облегчения и предупреждения заболеваний и состояний, опосредованных мускариновыми рецепторами. Предпочтительные соединения представляют собой агонисты М1 и М4 рецепторы и могут применяться при лечении заболеваний и состояний, опосредованных мускариновыми М1/М4 рецепторами, например, но не ограничиваясь перечисленным, болезни Альцгеймера, когнитивного нарушения, болезни Шегрена, шизофрении и для обезболивания. В частности, соединения по настоящему изобретению могут применяться для лечения, облегчения или предотвращения когнитивного нарушения и психотических расстройств.
В одном варианте осуществления изобретения соединения имеют формулу (I), где R2 выбран из (С1-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, оксо, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкенилокси, (С1-С6)алкенилтио, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, 5-членного ненасыщенного гетероцикла (необязательно замещенного галогеном), фенила, фенилокси и фенилтио, где фенильная группа необязательно замещена галогеном. Предпочтительно, R2 выбран из (С1-С8)алкила, (С2-С8)алкенила и (С2-С8)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, оксо, (С1-С6)алкокси, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, тетрагидрофуранила и фенила, где фенильная группа необязательно замещена галогеном. Особенно предпочтительны соединения формулы (I), где R2 выбран из (С1-С8)алкила, (С2-С8)алкенила, необязательно замещенного одним или несколькими заместителями, выбранными из галогена или (С1-С6)алкокси.
Кроме того, в одном варианте осуществления изобретения R3 выбран из (С4-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, необязательно замещенного заместителем, выбранным из (С5-С7)циклоалкила или фенила, где фенильная группа необязательно замещена галогеном.
В еще одном варианте осуществления изобретения R1 имеет структуру (а) или (b), в частности (а).
В другом варианте осуществления соединения имеют формулу (I), где W представляет собой N, и Y представляет собой NH, в частности, когда Х1 представляет собой СН, и Х2 представляет собой остаток C-Z-R2 или C-R3, и Z представляет собой O или S, а предпочтительно, Х2 представляет собой остаток C-Z-R2. Z предпочтительно представляет собой S.
В еще одном варианте осуществления Y представляет собой О и Z представляет собой O или S, а предпочтительно, Z представляет собой S.
Термин «галоген» относится к фтор-, хлор-, бром- или йод-. Предпочтительным является фтор-.
Термин «(С1-С10)алкил» означает разветвленную или неразветвленную алкильную группу, имеющую 1-10 атомов углерода, например метил, этил, пропил, изопропил, бутил, н-пентил, втор-пентил, гексил, октил. В частности, в остатке C-Z-R2, когда Z представляет собой O или S, н-пентил является предпочтительной алкильной группой. Предпочтительные алкильные группы с замещенным R2 представляют этоксиэтил, когда Z представляет собой O или S, и -(CH2)3CF3, когда Z представляет собой S.
Термин «(С1-С6)алкокси» означает алкоксигруппу, имеющую 1-6 атомов углерода, где алкильный фрагмент представляет собой, как определено выше. Термин «(С1-С6)алкилтио» имеет аналогичное значение. Термин «(С1-С4)алкокси(С1-С4)алкокси» означает (С1-С4)алкоксигруппу, алкильная часть которой в свою очередь замещена (С1-С4)алкокси.
Термин «(С2-С8)алкенил» означает разветвленную или неразветвленную алкенильную группу, имеющую 2-8 атомов углерода, где двойная связь (связи) могут присутствовать в различных частях группы, например винил, аллил, бутенил, н-пентенил, втор-пентенил, гексенил, октенил и т.д. В остатке C-Z-R2, когда Z представляет собой O или S, алкенильная группа представляет собой 4-пентенил, а предпочтительная замещенная алкенильная группа представляет собой 4,4-дифторбут-3-енил.
Термин «(С1-С6)алкенилокси» означает алкенилоксигруппу, имеющую 1-6 атомов углерода, где алкенильная часть представляет собой, как определено выше. Термин «(С1-С6)алкенилтио» имеет аналогичное значение.
Термин «(С2-С8)алкинил» означает разветвленную или неразветвленную алкинильную группу, имеющую 2-8 атомов углерода, где тройная связь (связи) может присутствовать в различных частях группы, например этинил, пропаргил, 1-бутинил, 2-бутинил и т.д.
Термин «(С5-С7)циклоалкил» означает циклическую алкильную группу, имеющую 5-7 атомов углерода, таким образом, циклопентил, циклогексил, циклогептил или циклооктил.
Термин «5-членный ненасыщенный гетероцикл» при определении R2 означает гетероцикл, содержащий 5 атомов, где, по меньшей мере, один атом представляет собой гетероатом, выбранный из C, N и S, причем другие атомы представляют собой атомы углерода, где гетероцикл, кроме того, по меньшей мере, содержит одну двойную связь. Примерами являются фуранильная и пирролильная группы. Со ссылкой на заместители, термин «независимо» означает, что заместители могут быть такими же или отличными друг от друга.
Соединения по изобретению могут подходящим образом быть получены способами, имеющимися в данной области, и как иллюстрируется в экспериментальном разделе настоящего описания. Для получения соединений по изобретению были обнаружены некоторые новые и полезные промежуточные соединения.
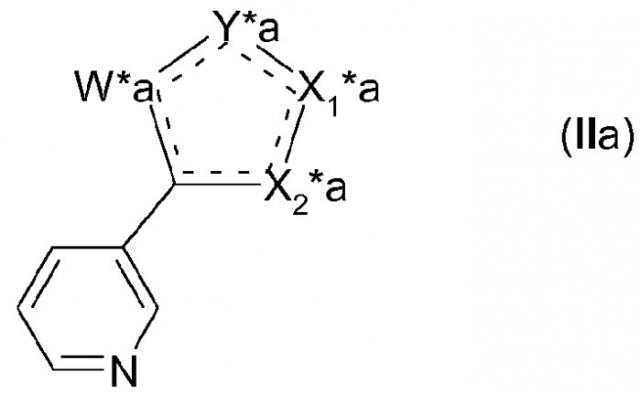
Таким образом, другой вариант осуществления изобретения представляет собой гетероциклическое соединение формулы (II)
,
где гетероцикл содержит две двойные связи, которые могут присутствовать в нескольких положениях, представленных пунктирными линиями (---);
- гетероцикл содержит два гетероатома,
- причем W* представляет собой N, NH или N-2-(триметилсилил)этоксиметил;
- Y* представляет собой CH, O, N или NR4, где R4 выбран из Н, 2-(триметилсилил)этоксиметила, -SO2N(CH3)2 и -SO2фенила; где
если Y* представляет собой O, Х1* представляет собой CH и Х2* представляет собой остаток C-Z*-R2* или C-R3*, где Z* представляет собой NH, O или S; и
если Y* представляет собой CH или NH, то один из Х1* и Х2* представляет собой CH или H, причем другой представляет собой остаток C-Z*-R2* или C-R3*, где Z* представляет собой NH или S;
-R2* выбран из (С1-С8)алкила, (С2-С8)алкенила и (С2-С8)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, оксо, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкенилокси, (С1-С6)алкенилтио, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, 5-членного ненасыщенного гетероцикла (необязательно замещенного галогеном), фенила, фенилокси или фенилтио, где фенильная группа необязательно замещена галогеном;
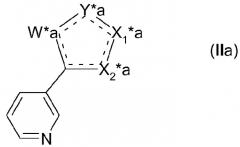
или
-R2* представляет собой неразветвленный (С2-С8)алкил, замещенный в положении символа Z*a группы заместителем групп формулы (IIa)
,
где если Х1* представляет собой СН или N, то X1*a представляет собой CH или N, а X2*a представляет собой C-Z*a-, или
если Х1* представляет собой C-Z*-R2*, то X1*a представляет собой C-Z*a-, а X2*a представляет собой СН или N; и
символы W*a, Y*a и Z*a имеют такое же значение, как определено ранее для символов W*, Y* и Z*, и они не являются независимо выбранными, каждый из символов W*a, Y*a и Z*a представляет соответственно символы, идентичные W*, Y* и Z* в другой части структуры формулы (II); и
-R3* выбран из (С4-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, необязательно независимо замещенного одним или несколькими заместителями, выбранными из галогена, гидрокси, циано, (С1-С6)алкокси, (С1-С6)алкилтио, (С1-С6)алкенилокси, (С1-С6)алкенилтио, (С1-С4)алкокси(С1-С4)алкокси, (С5-С7)циклоалкила, 5-членного ненасыщенного гетероцикла, необязательно замещенного галогеном, фенила, фенилокси и фенилтио, где фенильная группа необязательно замещена галогеном,
причем это соединение может применяться при получении соединений формулы (I), где R1 имеет структуру (а). Предпочтительный тип замещения в соединении формулы (II) соответствует предпочтительному типу замещения соединений формулы (I).
Также еще один вариант осуществления настоящего изобретения представляет собой гетероциклическое соединение формулы (III)
,
где R5 представляет собой Н и R6 представляет собой Br,
или R5 представляет собой -Si(CH3)3 и R6 представляет собой Br или -Si(CH3)3,
причем это соединение может применяться при получении соединений формулы (I), где R1 имеет структуру (а).
Соединения по настоящему изобретению могут содержать один или несколько асимметричных центров и таким образом могут встречаться в виде рацематов и рацемических смесей, одиночных энантиомеров, диастереомерных смесей и отдельных диастереомеров. Дополнительные асимметричные центры могут присутствовать в зависимости от природы различных заместителей на молекуле. Каждый такой асимметричный центр независимо получит два оптических изомера, и предполагается, что все возможные оптические изомеры и диастереоизомеры в смесях и в виде чистых или частично очищенных соединений включены в притязания настоящего изобретения. Подразумевается, что настоящее изобретение охватывает все такие изомерные формы этих соединений. Независимый синтез этих диастереомеров или их хроматографические разделения могут быть достигнуты, как известно в данной области, раскрытой в настоящем описании соответствующей модификацией методологии. Их абсолютную стереохимию можно определить рентгеновской кристаллографией кристаллических продуктов или кристаллических промежуточных соединений, которые при необходимости дериватизируются реагентом, содержащим асимметрический центр известной абсолютной конфигурации. При желании рацемические смеси соединений можно отделить с тем, чтобы были выделены отдельные энантиомеры. Отделение может проводиться способами, хорошо известными в данной области, такими как соединение рацемической смеси соединений энантиомерно чистым соединением для образования диастереомерной смеси с последующим отделением отдельных диастереомеров стандартными способами, такими как фракционная кристаллизация или хроматография.
Соединения могут существовать в виде полиморфов и в такой форме предназначены для включения в настоящее изобретение. В дополнение соединения могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и предполагается, что такие сольваты также охватываются объемом данного изобретения.
Меченное изотопами соединение формулы (I) или его фармацевтически приемлемые соли, включая соединения формулы (I), меченные изотопами, подлежащими для выявления PET (позитронно-эмиссионной томографией) или SPECT (однофотонной эмиссионной компьютерной томографией), также подпадают под объем изобретения. То же относится к соединениям формулы (I), меченным [13C]-, [14C]-, [3H]-, [18F]-, [125I]-, или другими изотопно обогащенными атомами, подходящими для мечения рецепторов, или исследований метаболизма.
Термин «фармацевтически приемлемая соль» относится к тем солям, которые в пределах здравого медицинского суждения подходят для применения в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и тому подобного и являются целесообразными с точки зрения соотношения выгоды/риска. Фармацевтически приемлемые соли хорошо известны в данной области. Они могут быть получены in situ при конечном выделении и очистке соединений по изобретению, или отдельно взаимодействием их с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты.
Соединения по изобретению могут вводиться внутрь или парентерально. Точная доза и схема введения этих соединений и их композиций будут зависеть от биологической активности самого соединения, возраста, массы тела и пола пациента, потребностей конкретного субъекта, которому вводится лекарственное средство, степени поражения или потребности и суждения медицинского работника. В целом, парентеральное введение требует более низких дозировок, чем другие способы введения, которые больше зависят от адсорбции. Однако дозировки для людей составляют предпочтительно от 0,001 до 10 мг на 1 кг массы тела, предпочтительнее от 0,01 до 1 мг на кг массы тела. В целом, энтеральные и парентеральные дозировки будут находиться в диапазоне от 0,1 до 1000 мг в день общего количества активных ингредиентов.
Лекарственные средства, изготовленные с соединениями по настоящему изобретению, могут также применяться в качестве адъюванта при лечении. В таком случае лекарственное средство вводится при комбинированном лечении с другими соединениями, используемыми при лечении таких патологических состояний. В этом отношении также рассматриваются фармацевтические комбинированные препараты, содержащие, по меньшей мере, одно соединение по настоящему изобретению и, по меньшей мере, одно другое фармакологически активное вещество.
После смешивания с фармацевтически приемлемыми вспомогательными веществами, например, как описано в стандартной ссылке «Remington, The Science and Practice of Pharmacy» (21st edition, Lippincott Williams & Wilkins, 2005, see especially Part 5: Pharmaceutical Manufacturing), соединения могут прессоваться в твердые лекарственные формы, такие как пилюли или таблетки, или могут быть переработаны в капсулы или суппозитории. Посредством фармацевтически приемлемых жидкостей соединения могут также применяться в форме раствора, суспензии или эмульсии.
Для изготовления лекарственных форм, например таблеток, предусматривается использование обычных добавок, таких как наполнители, красящие вещества, полимерные связывающие вещества и им подобные. В целом, может использоваться любая фармацевтически приемлемая добавка, которая не препятствует функции активных соединений.
Подходящие носители, с которыми могут вводиться соединения по изобретению, включают, например, лактозу, крахмал, производные целлюлозы и тому подобные или их смеси, используемые в подходящих количествах. Композиции для внутривенного введения могут, например, представлять собой растворы соединений по изобретению в стерильном изотоническом водном буфере. При необходимости внутривенные композиции могут включать, например, солюбилизирующие агенты, стабилизирующие агенты и/или местный анестетик для облегчения боли в участке инъекции.
Фармацевтические композиции по изобретению могут составляться для любого пути введения и содержать, по меньшей мере, одно соединение по настоящему изобретению и его фармацевтически приемлемые соли с любым фармацевтически приемлемым ингредиентом, эксципиентом, носителем, адъювантом или наполнителем.
Под «фармацевтически приемлемым» подразумевается, что носитель, разбавитель или эксципиент должен быть совместим с другими ингредиентами состава и не вредными для их реципиента.
В одном варианте осуществления изобретения предоставляется фармацевтическая упаковка или набор, содержащие один или несколько контейнеров, заполненных одной или несколькими фармацевтическими композициями по изобретению. Вместе с таким контейнером(ами) могут находиться различные письменные материалы, такие как инструкции по применению или уведомление в форме, предписанной правительственным агентством, регулирующие производство, применение и продажу фармацевтических продуктов, причем уведомление отражает утверждение агентством изготовления, применения или продажи для применения в медицине или ветеринарии.
Пока нет других определений, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно понятно среднему специалисту в данной области, к которому относится настоящее изобретение. Хотя в осуществлении или тестировании настоящего изобретения могут использоваться способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящей заявке, в настоящем документе описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем описании, полностью включены в него путем ссылки. В случае противоречия преимущество имеет настоящее описание, включая определения.
Следующие примеры предназначены только для дальнейшей более детальной иллюстрации изобретения и поэтому эти примеры никоим образом не следует рассматривать как суживающие или ограничивающие объем изобретения.
ПРИМЕРЫ
1. Материалы и методы
Спектры ядерного магнитного резонанса (1Н ЯМР и 13С ЯМР, АРТ) определяли в указанном растворителе, используя прибор Bruker ARX 400 (1Н: 400 МГц, 13С: 100 МГц) при 300 К, пока нет других указаний. Эксперименты 19F ЯМР и 13С ЯМР проводили на спектрометре Varian Inova 500, работающем при 11,74 Т (499,9 МГц для 1Н; 125,7 МГц для 13С; 50,7 МГц, 470,4 МГц для 19F), с использованием 5 мм коротковолнового датчика. Спектры определяли в дейтерированном хлороформе или дихлорметане, полученном от Cambridge Isotope Laboratories Ltd. Химические сдвиги (δ) представлены в м.д. в нижнем поле от тетраметилсерина (1Н, 13С) или CC13F (19F). Константы соединения J представлены в Гц. Формы пиков на ЯМР спектрах указаны символами “q” (квартет), “dq” (двойной квартет), “t” (триплет), “dt” (двойной триплет), “d” (дублет), “dd” (двойной дублет), “s” (синглет), “bs” (уширенный синглет) и “m” (мультиплет). Сигналы NH и OH идентифицировали после смешивания образца с каплей D2O.
Флэш-хроматография относится к очистке с использованием указанного элюента и силикагеля (силикагеля Acros: 0,030-0,075 мм или силикагеля Merck 60: 0,040-0,063 мм).
Хроматографию на колонке выполняли с использованием силикагеля 60 (0,063-0,200 мм, Merck).
Точки плавления регистрировали на аппарате для определения точки плавления Büchi B-545.
Масс-спектры (MS) регистрировали на приборе Macromass QTOF-2 с применением программного обеспечения MassLynx для получения и реконструкции данных. Производили точное измерение массы квазимолекулярного иона [M+H]+. Точные измерения массы выполняли с использованием спектрометра JEOL JMS-SX/SX 102 A Tandem Mass Spectrometer с использованием бомбардировки быстрыми атомами (FAB). Использовали силу разрешения 10000 (определение 10% понижения) для FAB масс-спектрометрии с высоким разрешением.
Все реакции, включающие чувствительные к влаге соединения или условия, проводили в безводной атмосфере азота.
Реакции контролировали использованием тонкослойной хроматографии (TLC) на покрытых оксидом кремния пластиковых листах (предварительный покрытый силикагель Merck 60 F254) с указанным элюентом.
Пятна визуализировали УФ светом (254 нм) или I2.
Коэффициенты затухания определяли спектрофотометром НР 8453 в УФ-видимом спектре.
Аналитическую высокоэффективную жидкостную хроматографию (ВЭЖХ) выполняли на колонке С18 (Interstill ODS-3, размер частиц 3 мм; 4,6 мм, 50 мм), используя следующий градиент элюирования: линейный градиент от 5% до 95% водного CH3CN, содержащего 0,04% HCO2H в течение 2 мин при 2,0 мл/мин. Продукты выявляли при λ=254 нм.
Жидкостная хроматография - масс-спектрометрия (LC-MS), метод А.
Система LC-MS состоит из 2 микронасосов Perkin Elmer серии 200. Насосы соединены друг с другом купажным миксером 50 мкл, соединенным автоматическим пробоотборником Gilson 215. Метод выполняется следующим образом:
| Стадия | Общее время | Поток (мл/мин) | А (%) | В (%) |
| 0 | 0 | 2000 | 95 | 5 |
| 1 | 1,8 | 2000 | 0 | 100 |
| 2 | 2,5 | 2000 | 0 | 100 |
| 3 | 2,7 | 2000 | 95 | 5 |
| 4 | 3,0 | 2000 | 95 | 5 |
А = 100% воды с 0,025% НСООН и 10 ммоль NH4HCOOO рН ±3.
В = 100% ACN с 0,025% НСООН.
Автоматический пробоотборник имеет инжекционную петлю емкостью 2 мкл. Автоматический пробоотборник соединен с колонкой Waters Atlantis C18 30*4,6 мм с частицами размером 3 мкм. Колонка термостатирована в колоночном термостате Perkin Elmer серии 200 при 40°С. Колонка соединена с УФ-счетчиком Perkin Elmer серии 200 с проточной кюветой 2,7 мкл. Длину волн устанавливают на 254 нм. УФ-метр соединен с масс-спектрометром Sciex API 150EX. Масс-спектрометр имеет следующие параметры:
Диапазон сканирования: 150-900 a.m.u.; полярность: положительная; тип скана: профиль; разрешение Q1: UNIT; размер шага: 0,10 a.m.u.; время на скан: 0,500 сек; NEB: 10; CUR: 10; IS: 5200; TEM: 325; DF: 30; FP: 225 и EP: 10.
Детектор рассеивания света соединен с Sciex API 150. Детектор рассеивания света представляет собой Sedere Sedex 55, работающий при 50°С и 3 барах N2.
Полная система соединена кабелем G3.
Жидкостная хроматография - Масс-спектрометрия (LC-MS), метод В.
Система LC-MS состоит из устройства Agilent серии 1100, состоящей из следующих компонентов:
- Дегазатор G1379A
- Бинарный насос G1312A
Метод осуществляется следующим образом:
| Стадия | Общее время (мин) | Поток (мл/мин) | А (%) | В (%) |
| 0 | 0 | 1,0 | 2 | 98 |
| 1 | 10,5 | 1,0 | 98 | 2 |
| 2 | 18,0 | 1,0 | 98 | 2 |
| 3 | 18,1 | 1,0 | 2 | 98 |
| 4 | 24,0 | 1,0 | 2 | 98 |
А: Ацетонитрил с 0,1% НСООН или ацетонитрил с 10 мМ NH3.
В: Вода с 0,1% НСООН или вода с 10 мМ NH3.
Автоматический пробоотборник соединен с колонкой Zorbax Extend C18 150×4,6 мм с частицами 3,5 мкм.
Колонка термостатирована в колоночном термостате G1316A Colcomm при 35°С.
Колонка соединена с детектором из серии диодов G1315B DAD. Диапазон длины волн установлен от 220 до 320 нм. УФ-метр соединен с масс-спектрометром G1946D MSD, работающим в режиме электронного распыления.
Масс-спектрометр имеет следующее параметры:
| Диапазон скана: | 100-800 amu |
| Полярность: | положительная и отрицательная |
| Режим: | Скан |
| Размер шага: | 0,20 |
| Время цикла: | 1,04 сек |
| % Времени цикла: | 50% |
| Сушащий газ: | азот |
| Поток газа: | 10 л/мин |
| Температура газа: | 300°С |
| Давление распыления | 30 psi |
| Капиллярное напряжение: | 3000 В |
Детектор Allitech ELSD 2000 соединяется параллельно с MSD. Поток разделяется после DAD.
ELSD имеет следующие параметры:
| Сушащий газ: | азот |
| Поток газа: | 1,5 л/мин |
| Температура трубки дрейфа: | 39°С |
| Ударник: | включен |
2. Аббревиатуры
| n-BuLi | н-бутиллитий |
| t-BuOH | трет-бутанол |
| dba | дибензилиденацетон |
| DCM | дихлорметан |
| DMF | N,N'-диметилформамид |
| DMF-DMA | N,N'-диметилформамид-диметилацеталь |
| DMSO | диметилсульфоксид |
| EtOH | этанол |
| Et2O | простой диэтиловый эфир |
| г | грамм(ы) |
| ч | час(ы) |
| Ме | метил |
| Mel | метилйодид |
| MeOH | метанол |
| мг | миллиграмм(ы) |
| Мин | минута(ы) |
| Мл | миллилитр(ы) |
| m.p., mp | точка плавления или диапазон плавления |
| NBS | N-бромсукцинимид |
| NIS | N-йодсукцинимид |
| PE | простой петролейный эфир |
| Rt | время удерживания (LC/MS) |
| SEM-CI | (2-хлорметоксиэтил)триметилсилан |
| TBAF | фторид тетрабутиламмония |
| THF | тетрагидрофуран |
3. Общие аспекты синтеза
Различные пути синтеза для получения соединений по настоящему изобретению, иллюстрируемых в формуле I, описаны и могут быть легко получены из общедоступных исходных материалов. Более общую информацию о химии пиразола, имидазола и изоксазола можно найти, например, в J.A. Joule, K. Mills and G.F. Smith, "Heterocyclic Chemistry", third edition, Stanley Thornes (Publishers) Ltd., Cheltenham, 1998. Больше информации по добавлению и последующему удалению защитных групп при органическом синтезе можно найти в T.W. Greene and P.G.M. Wuts, "Protective Groups in Organic Synthesis", third edition, John Wiley & Sons, Inc., New York, 1999.
Выбор определенного способа зависит от таких факторов, как: совместимость функциональных групп с используемым реагентом, возможность использования защитных групп, катализаторов, активирующих и соединяющих реагентов и конечных структурных признаков, присутствующих в конечном получаемом соединении.
В примере общей процедуры (схема 1) гидрохлорид никотиноилхлорида (1) превращается в N-метил-N-метоксиамид (2) в присутствии основания и взаимодействует с гексиллитием (J. Med. Chem., 35, 1992, 2392-2406) для получения 1-пиридин-3-илгептан-1-она (3).
Легкое α-метиленирование соединения 3 (J. Org. Chem., 71, 2006, 2538-2541) дало 2-метилен-1-пиридин-3-илгептан-1-он (4), который взаимодействовал с гидразином (Synthesis, 1989, 320-321) для получения 1-(4-пентил-3-пиридин-3-ил-4,5-дигидропиразол-1-ил)этанона (5). Окисление 2-пиразолина в пиразол может осуществляться с использованием способов, хорошо известных специалистам в данной области. Специфическими условиями являются активированный MnO2 в дихлорэтане (ЕР0094555) для получения соединения 6, защитную группу которого удаляли в основных условиях для получения соединения 7. Производное 3-(4-пентил-1Н-пиразол-3-ил)-1,2,5,6-тетрагидро-1-метилпиридина (9) получали из соединения 8 кватернизацией пиридиновой части CH3I и восстановлением соответствующей соли пиридиния NaBH4 (Arch. Pharm. Med. Chem., 336, 2003, 143-154).
Схема 1
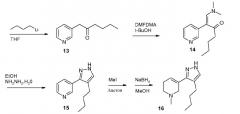
В другом примере общей процедуры (схема 2) общедоступная пиридин-3-илуксусная кислота (10) превращается в производное N-метил-N-метоксиамида (12), которое взаимодействует с BiuLi для получения 1-пиридин-3-илгексан-2-она (13). Обработка соединения 13 N,N-диметилформамилддиметилацеталем дала энамин (14), который превращается в пиразол (15). Синтез 3-(4-бутил-1Н-пиразол-3-ил)-1,2,5,6-тетрагидро-1-метилпиридина (16) иллюстрируется на схеме 2, в соответствии с состоящей из двух стадий последовательностью, показанной на схеме 1.
Схема 2
В еще одном примере общей процедуры (схема 3) 3-(4-бром-1Н-пиразол-3-ил)пиридин (20А) или его йод-аналог (20В) (Bioorganic & Medicinal Chemistry, 4, 1996, 227-237) используется в качестве предшественника для синтеза соединений общей формулы I. Дилитий производное (Bioorganic & Medicinal Chemistry, 8, 2000, 2317-2335) соединение 20А, полученное в миллиграммовом диапазоне депротонированием пиразола-NH и обменом брома-лития (2,1 экв. n-BuLi, THF, -78°С, 2 ч), захватывалось дисульфидом (например, метилдисульфанилметаном), давая 3-(4-метилсульфанил-1Н-пиразол-3-ил)пиридин 21А, который был превращен в производное 1,2,5,6-тетрагидро-1-метилпиридина 22А, в соответствии с состоящей из двух стадий последовательностью, показанной на схеме 1.
Продуцирование анионов в орто-положении ароматических систем, используемых в синтетических процедурах, описанных в настоящей заявке, выполняется в соответствии с общей стратегией синтеза, известной как направленное орто-металлирование (DOM). В пределах указанной зоны с этой целью был изучен ряд функциональных групп, известных как группы направленного металлирования (DMG).
Диметилсульфонамидная группа в качестве группы направленного металлирования (DMG) в N1-положении диметиламида 3-пиридин-3-илпиразол-1-сульфоновой кислоты (23) обеспечивает возможность литирования 5-го положения и посредством этого его функционализации (Chem. Ber., 124, 1991, 1639-1650). 5-литий-производное соединения 23, полученное в миллиграммовом диапазоне α-металлированием (1,0 экв. t-BuLi, THF, -78°С, 1 ч), захватывалось (J. Org. Chem., 64, 1999, 5366-5370) дисульфидом (например, 1-бутилдисульфанилбутаном) для получения диметиламида 5-бутилсульфанил-3-пиридин-3-илпиразол-1-сульфоновой кислоты 24, который был депротектирован (25) и превращен в производное 1,2,5,6-тетрагидро-1-метилпиридина 26, в соответствии с состоящей из двух стадий последовательностью, показанной на схеме 1.
Схема 3
Другой синтетический путь для получения соединений по настоящему изобретению, иллюстрированных в формуле I, описан в схеме 4. Введение 2-(триметилсилил)этоксиметильной группы (SEM) в качестве защитной группы (Tetrahedron Letters, 39, 1998, 5171-5174) дало смесь соединений 27А и 27В. Последующий обмен брома-лития (1,1 экв. n-BuLi, THF, -78°С, 1 ч) и взаимодействие этого 4-литий-производного 27A/B с S8 приводит к образованию промежуточного соединения литийарилтиоат (J. Org. Chem., 69, 2004, 3236-3239) 3-пиридин-3-ил-1-(2-триметилсиланилэтоксиметил)-1Н-пиразол-4-тиол. Это промежуточное соединение захватывалось 4-бром-1,1,1-трифторбутаном для получения смеси соединений 28А и 28В. Последующее удаление защитной группы SEM привело к получению целевого соединения 3-[4-(4,4,4-трифторбутилсульфанил)-1Н-пиразол-3-ил]пиридин 21В, которое было превращено в производное 1,2,5,6-тетрагидро-1-метилпиридина 22В, в соответствии с состоящей из двух стадий последовательностью, пока