Агенты для подавления повреждения трансплантированных островков после трансплантации островков
Иллюстрации
Показать всеИзобретение относится к медицине и касается эффекта подавления повреждения трансплантированных островков после трансплантации островков антителами против рецептора IL-6. Изобретение обеспечивает уменьшение повреждения трансплантированных островков, увеличение выживаемости островков и корректировку гипергликемии у реципиентов. 4 н. и 13 з.п. ф-лы, 3 пр., 10 ил.
Реферат
Область техники
Настоящее изобретение относится к агентам для подавления повреждения трансплантированных островков после трансплантации островка, которые включают ингибиторы IL-6 в качестве активных ингредиентов, и к их применениям.
Предшествующий уровень техники
Инсулин представляет собой гипогликемический гормон. Причиной инсулинозависимого диабета является избирательное разрушение продуцирующих инсулин клеток (островковых β-клеток) благодаря иммунологическим механизмам, и известно, что его возникновение приводит к гипергликемии, вызывающей различные нарушения. При традиционном лечении вводят (инъецируют) препараты недопоставляемого инсулина для того, чтобы компенсировать нехватку инсулина с целью снижения гипергликемии. Однако при основанном на инсулине лечении строгая регуляция сахара в крови затруднена, что может привести к избыточному введению, которое может вызвать смертельную гипогликемию. После возникновения диабета прогрессируют диабетические сосудистые осложнения (такие как ретинопатия, нефропатия и нейропатия). Традиционные терапевтические способы, такие как инъекции инсулина, не могут остановить этот прогресс, что приводит к терапевтически серьезным проблемам. Уровень сахара в крови физиологически контролируется главным образом с помощью регуляторного механизма островковых β-клеток; однако при инсулинозависимом диабете делеция этих островков приводит к сильным подъемам и спадам уровня сахара в крови, что является причиной описанных выше клинических симптомов.
В последние годы в Европе и Соединенных Штатах началось клиническое применение трансплантации островков, при которой панкреатические островки Лангерганса (островки) трансплантируют в качестве средства лечения диабета. Таким образом, пытаются лечить не путем введения инсулина, а путем трансплантации продуцирующих инсулин клеток. Практической методикой клинической трансплантации островков является следующая методика: под местной анестезией осуществляют чрескожную, чрезлегочную катетеризацию воротной вены с ультразвуковым контролем направления, и затем островки донора трансплантируют в печень через катетер. Трансплантаты островков приживаются в конце воротной вены и регулируют уровень сахара в крови путем секреции инсулина. При успешной трансплантации островков она восстанавливает нормальный уровень сахара в крови реципиентов, страдающих диабетом, так что отпадает необходимость лечить инсулином. Однако на сегодняшний день успешные случаи клинической трансплантации островков ограничены. Кроме того, для трансплантации одному реципиенту требуются островки, выделенные из поджелудочных желез двух или трех доноров. В частности, поскольку нарушения функции островков, которые возникают немедленно после трансплантации, уменьшают жизнеспособность трансплантатов, трансплантация островков от одного донора одному реципиенту является недостаточной, и, таким образом, осуществляют трансплантацию от двух или трех доноров одному реципиенту. В некоторых сообщениях говорится только о 20-30% выживаемости трансплантированных трансплантатов. Детали этих функциональных нарушений остаются неясными, но они являются причиной чрезвычайно серьезной проблемы в улучшении результатов клинической трансплантации островков.
Обычно трансплантацию островков осуществляли с использованием островков, выделенных из поджелудочных желез доноров после смерти их головного мозга или доноров с остановкой сердца. В недавних сообщениях также описываются успешные случаи трансплантации островков от живых доноров, при которых островки выделяют и очищают из части поджелудочной железы, иссеченной у здоровых доноров, и трансплантируют больным диабетом. Такая трансплантация островков живых доноров является инвазивной и тяжелой для доноров. Таким образом, предпочтительно сделать возможным лечение, которое подавляет повреждение трансплантированных островков сразу после трансплантации и при котором используется меньшее число островков доноров.
IL-6 является цитокином, называемым стимулирующим В-клетки фактором 2 (BSF2), или интерфероном β2. IL-6 был обнаружен как фактор дифференциации, вовлеченный в активацию В-лимфоцитов (непатентный документ 1), и, как позже обнаружилось, является многофункциональным цитокином, оказывающим влияние на функцию различных клеток (непатентный документ 2). Сообщалось, что IL-6 индуцирует созревание Т-лимфоцитов (непатентный документ 3).
IL-6 передает свою биологическую активность через два вида белков в клетку. Один из белков представляет собой рецептор IL-6, являющийся связывающим лиганд белком, с которым связывается IL-6, и имеет молекулярную массу, составляющую приблизительно 80 кДа (непатентные документы 4 и 5). Помимо связанной с мембраной формы, которая пронизывает и экспрессируется на клеточной мембране, рецептор IL-6 присутствует в виде растворимого рецептора IL-6, который главным образом состоит из внеклеточной области связанной с мембраной формы.
Другим белком является мембранный белок gp130, имеющий молекулярную массу, составляющую приблизительно 130 кДа, и вовлеченный в нелигандную передачу сигнала связывания. Биологическая активность IL-6 передается в клетки благодаря образованию IL-6 и рецептором IL-6 комплекса IL-6/рецептор IL-6 и после этого связыванию комплекса с gp130 (непатентный документ 6).
Ингибиторы IL-6 являются веществами, ингибирующими передачу биологической активности IL-6. К настоящему времени известны антитела против IL-6, антитела против рецептора IL-6, антитела против gp130, варианты IL-6, частичные пептиды IL-6 или рецепторы IL-6.
Имеется несколько сообщений, касающихся антител против рецепторов IL-6 (непатентные документы 7 и 8, патентные документы 1-3). Известно (патентный документ 4) гуманизированное антитело РМ-1, полученное трансплантацией в антитело человека определяющего комплементарность области (CDR) антитела РМ-1 мыши (непатентный документ 9), которое является одним из антител против рецептора IL-6.
Ниже представлена информация о документах предшествующего уровня техники, относящихся к настоящему изобретению:
[Непатентный документ 1] Hirano, T. et al., Nature (1986) 324, 73-76;
[Непатентный документ 2] Akira, S. et al., Adv. in Immunology (1993) 54, 1-78;
[Непатентный документ 3] Lotz, M. et al., J. Exp. Med. (1988) 167, 1253-1258;
[Непатентный документ 4] Taga, T. et al., J. Exp. Med. (1987) 166, 967-981;
[Непатентный документ 5] Yamasaki, K. et al., Science (1988) 241, 825-828;
[Непатентный документ 6] Taga, T. et al., Cell (1989) 58, 573-581;
[Непатентный документ 7] Novick, D. et al., Hybridoma (1991) 10, 137-146;
[Непатентный документ 8] Huang, Y.W. et al., Hybridoma (1993) 12, 621-630;
[Непатентный документ 9] Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906;
[Патентный документ 1] публикация международной заявки на патент № WO 95/09873;
[Патентный документ 2] заявка на патент Франции № FR 2694767;
[Патентный документ 3] патент США № 5216128;
[Патентный документ 4] WO 92/19759.
Раскрытие изобретения
[Проблемы, решаемые настоящим изобретением]
При трансплантации островков для лечения диабета важно увеличить жизнеспособность островков с помощью подавления повреждения трансплантированных островков во время трансплантации. Однако на сегодняшний день нет эффективных способов. Кроме того, не было предшествующей оценки того, демонстрирует ли антитело против рецептора IL-6, являющееся ингибитором IL-6, эффект подавления повреждения трансплантированных островков после трансплантации островков.
Настоящее изобретение было создано ввиду вышеуказанных предпосылок и нацелено на обеспечение агентов для подавления повреждения трансплантированных островков, которые включают ингибиторы IL-6 в качестве активных ингредиентов и используются при трансплантации островков. Другой целью настоящего изобретения является обеспечение способов подавления повреждения островков, трансплантированных субъектам, которые включают стадию введения субъектам ингибиторов IL-6.
[Способ решения проблем]
Для достижения описанных выше целей авторы настоящего изобретения проверили, вызывают ли антитела против рецептора IL-6 эффект подавления повреждения трансплантированных островков после трансплантации островков.
Сначала авторы настоящего изобретения приготовили в качестве реципиентов страдающих диабетом мышей с помощью внутривенного введения стрептозотоцина самцам мышей С57BL/6.
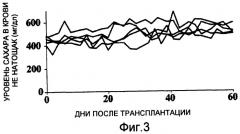
Затем мышам-реципиентам, страдающим диабетом, трансплантировали островки, выделенные из поджелудочных желез двух мышей (400 островков) или от одной мыши (200 островков). Результаты показывают, что трансплантация островков поджелудочных желез двух мышей восстанавливает нормальные уровни сахара в крови и, следовательно, демонстрирует терапевтический эффект в отношении диабета, в то время как трансплантация островков поджелудочной железы одной мыши не восстанавливает нормальные уровни сахара в крови, и гипергликемическое состояние сохраняется (фиг. 2 и 3).
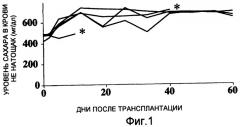
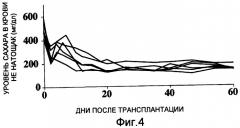
Между тем, когда внутрибрюшинно вводили 500 мкг антитела против рецептора IL-6 (MR16-1) трижды после трансплантации островков одной мыши (200 островков), нормальные уровни сахара в крови восстанавливались у всех реципиентов после трансплантации (фиг. 4). Альтернативно, когда один раз вводили равную дозу антитела против рецептора IL-6, нормальные уровни сахара в крови восстанавливались у ¾ реципиентов (фиг. 5). Когда один раз вводили 200 мкг антитела против рецептора IL-6, нормальные уровни сахара в крови восстанавливались у 1/3 реципиентов (фиг. 6).
Также обнаружено, что введение антител против рецептора IL-6 по настоящему изобретению подавляет продукцию воспалительных цитокинов в инфильтрующих клетках после трансплантации.
Вышеуказанные обнаруженные факты демонстрируют, что антитела против рецептора IL-6 уменьшают повреждение трансплантированных островков, увеличивают жизнеспособность островков и корректируют гипергликемию у реципиентов.
В частности, авторами настоящего изобретения впервые обнаружено, что повреждение трансплантированных островков после трансплантации островков можно подавить, используя антитела против рецептора IL-6 в соответствии с настоящим изобретением, и, таким образом, они завершили настоящее изобретение.
Более конкретно, настоящим изобретением обеспечиваются следующие пункты [1]-[23]:
[1] Агент для подавления повреждения трансплантированного островка после трансплантации островка, который включает ингибитор IL-6 в качестве активного ингредиента;
[2] Агент для подавления повреждения трансплантированного островка, в соответствии с п. [1], в котором ингибитором IL-6 является антитело, которое распознает IL-6;
[3] Агент для подавления повреждения трансплантированного островка в соответствии с п. [1], в котором ингибитором IL-6 является антитело, которое распознает рецептор IL-6;
[4] Агент для подавления повреждения трансплантированного островка в соответствии с п. [2] или [3], в котором антителом является моноклональное антитело;
[5] Агент для подавления повреждения трансплантированного островка в соответствии с любым из п.п. [2]-[4], в котором антителом является антитело против IL-6 человека или антитело против рецептора IL-6 человека;
[6] Агент для подавления повреждения трансплантированного островка в соответствии с любым из п.п. [2]-[5], в котором антителом является рекомбинантное антитело;
[7] Агент для подавления повреждения трансплантированного островка в соответствии с п. [6], в котором антителом является химерное, гуманизированное антитело или антитело человека;
[8] Агент для подавления повреждения трансплантированного островка в соответствии с любым из п.п. [1]-[7], используемый для лечения диабета;
[9] Способ подавления повреждения трансплантированных островков у субъекта с трансплантацией островков, который включает стадию введения субъекту ингибитора IL-6;
[10] Способ увеличения жизнеспособности островка у субъекта с трансплантацией островка, который включает стадию введения субъекту ингибитора IL-6;
[11] Способ в соответствии с п. [9] или [10], в котором ингибитором IL-6 является антитело, которое распознает IL-6;
[12] Способ в соответствии с п. [9] или [10], в котором ингибитором IL-6 является антитело, которое распознает рецептор IL-6;
[13] Способ в соответствии с п. [11] или [12], в котором антителом является моноклональное антитело;
[14] Способ в соответствии с любым из п.п. [11]-[13], в котором антителом является антитело против IL-6 человека или антитело против рецептора IL-6 человека;
[15] Способ в соответствии с любым из п.п. [11]-[14], в котором антителом является рекомбинантное антитело;
[16] Способ в соответствии с п. [15], в котором антителом является химерное, гуманизированное антитело или антитело человека;
[17] Применение ингибитора IL-6 для получения агентов для подавления повреждения трансплантированного островка после трансплантации островка;
[18] Применение в соответствии с п. [17], при котором ингибитором IL-6 является антитело, которое распознает IL-6;
[19] Применение в соответствии с п. [17], при котором ингибитором IL-6 является антитело, которое распознает рецептор IL-6;
[20] Применение в соответствии с п. [18] или [19], при котором антителом является моноклональное антитело;
[21] Применение в соответствии с любым из п.п. [18]-[20], при котором антителом является антитело против IL-6 человека или антитело против рецептора IL-6 человека;
[22] Применение в соответствии с любым из п.п. [18]-[21], при котором антителом является рекомбинантное антитело; и
[23] Применение в соответствии с п. [22], при котором антителом является химерное, гуманизированное антитело или антитело человека.
Краткое описание чертежей
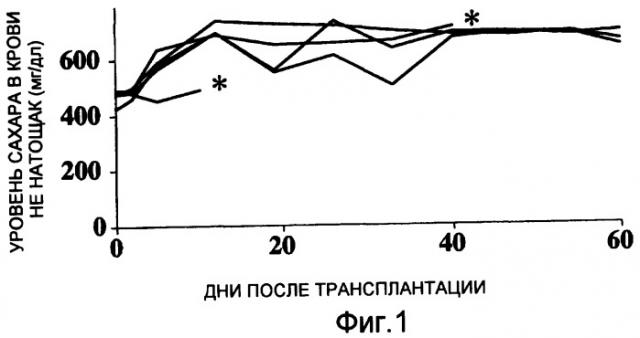
Фиг. 1 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые не подвергались трансплантации островков.
Фиг. 2 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись изогенной трансплантации островков из поджелудочных желез двух мышей (400 островков).
Фиг. 3 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись изогенной трансплантации островков из поджелудочной железы одной мыши (200 островков).
Фиг. 4 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись изогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили трижды 500 мкг антитела против рецептора IL-6 после трансплантации.
Фиг. 5 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись изогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили однократно 500 мкг антитела против рецептора IL-6 после трансплантации.
Фиг. 6 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись изогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили однократно 200 мкг антитела против рецептора IL-6 после трансплантации.
Фиг. 7 представляет собой график, демонстрирующий, что введение антитела против рецептора IL-6 подавляет продукцию после трансплантации воспалительных цитокинов инфильтрующими клетками.
Фиг. 8 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись аллогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили трижды 200 мкг IgG крысы после трансплантации.
Фиг. 9 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись аллогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили однократно 200 мкг антитела против CD4 после трансплантации.
Фиг. 10 представляет собой график, демонстрирующий изменения уровней сахара в крови мышей-реципиентов, страдающих диабетом, которые подверглись аллогенной трансплантации островков из поджелудочной железы одной мыши (200 островков) и которым внутрибрюшинно вводили трижды 500 мкг антитела против рецептора IL-6 и один раз 200 мкг антитела против CD4 после трансплантации.
Лучший вариант осуществления изобретения
Авторы настоящего изобретения обнаружили, что антитело против рецептора IL-6 может подавлять повреждение трансплантированных островков после трансплантации островков. Настоящее изобретение основано на этом обнаружении.
Настоящее изобретение относится к агентам для подавления повреждения трансплантированных островков после трансплантации островков, которые включают ингибитор IL-6 в качестве активного ингредиента.
Здесь «ингибитор IL-6» представляет собой вещество, блокирующее опосредуемую IL-6 передачу сигнала и ингибирующее биологическую активность IL-6. Предпочтительно ингибитором IL-6 является вещество, имеющее ингибиторную в отношении связывания IL-6, рецептора IL-6 или gp130 функцию.
Ингибиторы IL-6 по настоящему изобретению включают, но без ограничения, например, антитела против IL-6, антитела против рецептора IL-6, антитела против gp130, варианты IL-6, варианты растворимого рецептора IL-6 и частичные пептиды IL-6 или рецепторов IL-6 и низкомолекулярные соединения, демонстрирующие схожие активности. Предпочтительные ингибиторы IL-6 по настоящему изобретению включают антитела, которые распознают рецепторы IL-6.
В настоящем изобретении источник антитела особенно не ограничен, однако предпочтительно антитело является происходящим от млекопитающих, и более предпочтительно оно происходит от человека.
Используемое в настоящем изобретении антитело против IL-6 можно получить в виде поликлонального или моноклонального антитела с помощью известного способа. В частности, в качестве используемого в настоящем изобретении антитела против IL-6 предпочтительными являются моноклональные антитела, происходящие от млекопитающих. Моноклональные антитела, происходящие от млекопитающих, включают антитела, продуцируемые гибридомами, и антитела, продуцируемые хозяевами, трансформированными экспрессирующим вектором, включающим ген антитела, с использованием методов генной инженерии. При связывании с IL-6 антитело ингибирует связывание IL-6 с рецептором IL-6 и блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают MH166 (Matsuda, T. et al., Eur. J. Immunol. (1988) 18, 951-956), антитело SK2 (Sato, K. et al., сообщение 21st Annual Meeting of the Japanese Society for Immunology (1991) 21, 166) и т.д.
В сущности, гибридомы, продуцирующие антитела против IL-6, можно получить с использованием известных методов следующим образом. В частности, такие гибридомы можно получить, используя IL-6 в качестве сенсибилизирующего антигена для осуществления иммунизации с помощью традиционного способа иммунизации, осуществляя слияние полученных иммунных клеток с известными исходными клетками с помощью традиционного способа слияния клеток и скринируя продуцирующие моноклональные антитела клетки с помощью традиционного способа скрининга.
Более конкретно, антитела против IL-6 можно получить следующим образом. Например, IL-6 человека, используемый в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя ген IL-6 и/или аминокислотные последовательности, раскрытые в Eur. J. Biochem. (1987) 168, 543-550; J. Immunol. (1988) 140, 1534-1541; и/или Agr. Biol. Chem. (1990) 54, 2685-2688.
После трансформации соответствующей клетки-хозяина известной экспрессирующей векторной системой, в которую встроена последовательность гена IL-6, желаемый белок IL-6 очищают с помощью известного способа от внутреннего содержимого клетки-хозяина или от супернатанта в культуре клеток. Этот очищенный белок IL-6 можно использовать в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать слитый белок IL-6 и другого белка.
Используемые для настоящего изобретения антитела против рецептора IL-6 можно получить в виде поликлональных или моноклональных антител с помощью известных способов. В частности, используемыми в настоящем изобретении антителами против рецептора IL-6 предпочтительно являются моноклональные антитела, происходящие от млекопитающих. Моноклональные антитела, происходящие от млекопитающих, включают антитела, продуцируемые гибридомами, и антитела, продуцируемые хозяевами, трансформированными экспрессирующим вектором, включающим ген антитела, с использованием методов генной инженерии. При связывании с рецептором IL-6 антитело ингибирует связывание IL-6 с рецептором IL-6 и блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают антитело MR16-1 (Tamura, T. et al., Proc. Natl. Acad. Sci. USA (1993) 90, 11924-11928), антитело PM-1 (Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906); антитело AUK12-20, антитело AUK64-7 и антитело AUK146-15 (WO 92/19759); и т.д. Среди них в качестве примера предпочтительного моноклонального антитела против рецептора IL-6 человека можно привести антитело РМ-1, а качестве примера предпочтительного моноклонального антитела против рецептора IL-6 мыши - антитело MR16-1.
В сущности, гибридомы, продуцирующие моноклональное антитело против рецептора IL-6, можно получить с использованием известных методов следующим образом. В частности, такие гибридомы можно получить, используя рецептор IL-6 в качестве сенсибилизирующего антигена для осуществления иммунизации с помощью традиционного способа иммунизации, осуществляя слияние полученных иммунных клеток с известной исходной клеткой с помощью традиционного способа слияния клеток и скринируя продуцирующие моноклональное антитело клетки с помощью традиционного способа скрининга.
Более конкретно, антитела против рецептора IL-6 можно получить следующим образом. Например, рецептор IL-6 человека или рецептор IL-6 мыши, используемые в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя гены рецепторов IL-6 и/или аминокислотные последовательности, раскрытые в публикации заявки на европейский патент № ЕР 325474 и публикации Kokai заявки на патент Японии № (JP-A) H03-155795 (не рассмотренной, опубликованной заявки на патент Японии), соответственно.
Существуют два вида белков рецепторов IL-6, т.е. белок, экспрессируемый на клеточной мембране, и белок, отделенный от клеточной мембраны (растворимый рецептор IL-6) (Yasukawa, K. et al., J. Biochem. (1990) 108, 673-676). Растворимый рецептор IL-6 состоит по существу из внеклеточной области связанного с клеточной мембраной рецептора IL-6 и отличается от связанного с мембраной рецептора IL-6 тем, что в нем отсутствует трансмембранная область или как трансмембранная, так и внутриклеточная области. В качестве белка рецептора IL-6 можно использовать любой рецептор IL-6 при условии, что его можно использовать в качестве сенсибилизирующего антигена для продукции антитела против рецептора IL-6, используемого в настоящем изобретении.
После трансформации соответствующей клетки-хозяина известной экспрессирующей векторной системой, в которую встроена последовательность гена рецептора IL-6, желаемый белок рецептора IL-6 очищают с помощью известного способа от внутреннего содержимого клетки-хозяина или от супернатанта в культуре клеток. Этот очищенный белок рецептора IL-6 можно использовать в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать клетку, экспрессирующую рецептор IL-6, или слитый белок рецептора IL-6 и другого белка.
Используемые в настоящем изобретении антитела против gp130 можно получить в виде поликлональных или моноклональных антител с помощью известных способов. В частности, используемыми в настоящем изобретении антителами против gp130 предпочтительно являются моноклональные антитела, происходящие от млекопитающих. Моноклональные антитела, происходящие от млекопитающих, включают антитела, продуцируемые гибридомами, и антитела, продуцируемые хозяевами, трансформированными экспрессирующим вектором, включающим ген антитела, с использованием методов генной инженерии. При связывании с gp130 антитело ингибирует связывание gp130 с комплексом IL-6/рецептор IL-6 и блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают антитело AM64 (JP-A (Kokai) H03-219894); антитело 4B11 и антитело 2Н4 (US 5571513); антитело B-S12 и антитело В-Р8 (JP-A (Kokai) H08-291199) и т.д.
В сущности, гибридомы, продуцирующие моноклональное антитело против gp130, можно получить с использованием известных методов следующим образом. В частности, такие гибридомы можно получить, используя gp130 в качестве сенсибилизирующего антигена для осуществления иммунизации с помощью традиционного способа иммунизации, осуществляя слияние полученных иммунных клеток с известной исходной клеткой с помощью традиционного способа слияния клеток и скринируя продуцирующие моноклональное антитело клетки с помощью традиционного способа скрининга.
Более конкретно, моноклональное антитело можно получить следующим образом. Например, gp130, используемый в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя ген gp130 и/или аминокислотную последовательность, раскрытые в публикации заявки на Европейский патент № ЕР 411946.
После трансформации соответствующей клетки-хозяина известной экспрессирующей векторной системой, в которую встроена последовательность гена gp130, желаемый белок gp130 очищают с помощью известного способа от внутреннего содержимого клетки-хозяина или супернатанта в культуре клеток. Этот очищенный белок gp130 можно использовать в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать клетку, экспрессирующую gp130, или слитый белок gp130 и другого белка.
Иммунизируемые сенсибилизирующим антигеном млекопитающие особенно не ограничены, но их предпочтительно выбирают, принимая во внимание совместимость с исходной клеткой, используемой для слияния клеток. Обычно используют грызунов, таких как мыши, крысы и хомячки.
Иммунизацию животных сенсибилизирующим антигеном проводят в соответствии с известными способами. Например, в качестве общего способа осуществляют инъекцию млекопитающим сенсибилизирующего антигена внутрибрюшинно или подкожно. В частности, сенсибилизирующий антиген предпочтительно разводят или суспендируют в соответствующем количестве забуференного фосфатом солевого раствора (PBS), физиологического раствора или такового, смешанного с соответствующим количеством общего адъюванта (например, полного адъюванта Фрейнда), превращают в эмульсию и затем вводят млекопитающему несколько раз каждые 4-21 день. Кроме того, для иммунизации сенсибилизирующим агентом можно использовать соответствующий носитель.
После такой иммунизации подтверждают возросший уровень желаемого антитела в сыворотке и затем от млекопитающего получают иммунные клетки для слияния клеток. Предпочтительные иммунные клетки для слияния клеток включают, в частности, клетки селезенки.
Для миеломных клеток млекопитающего, используемых в качестве исходной клетки, т.е. клетки-партнера, сливаемой с вышеуказанными иммунными клетками, соответствующим образом используют различные известные линии клеток, например, P3X63Ag8.653 (Kearney, J. F. et al., J. Immunol (1979) 123, 1548-1550), P3X63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler, G. and Milstein, C., Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies, D.H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), F0 (de St. Groth, S.F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I.S., J. Exp. Med. (1978) 148, 313-323), R210 (Galfre, G. et al., Nature (1979) 277, 131-133) и т.п.
В сущности, слияние упоминаемой выше иммунной клетки и миеломной клетки можно осуществить, используя известные способы, например способ Milstein и др. (Kohler, G. and Milstein, C., Methods Enzymol. (1981) 73, 3-46) и т.п.
Более конкретно, упоминаемое выше слияние клеток выполняют в общей питательной культуральной среде в присутствии усиливающего слияние клеток агента. Например, в качестве усиливающего слияние клеток агента используют полиэтиленгликоль (PEG), вирус Сендай (HVJ) и т.п. Кроме того, для увеличения эффективности слияния можно добавить для использования в соответствии с потребностями вспомогательные агенты, такие как диметилсульфоксид.
Используемое соотношение иммунных клеток и миеломных клеток составляет предпочтительно, например, 1-10 иммунных клеток на каждую миеломную клетку. Культуральной средой, используемой для упоминаемого выше слияния клеток, является, например, культуральная среда RPMI1640 или MEM, которые подходят для пролиферации упоминаемых выше миеломных клеток. Можно также использовать общую культуральную среду, используемую для культивирования этого типа клетки. Кроме того, в комбинации можно использовать дополнения сывороткой, такой как фетальная сыворотка теленка (FCS).
Для слияния клеток представляющие интерес клетки слияния (гибридомы) образуют с помощью хорошего смешивания заранее определенных количеств упоминаемых выше иммунной клетки и миеломной клетки в упоминаемой выше культуральной среде и последующего добавления и смешивания раствора PEG (например, раствора PEG со средней молекулярной массой, составляющей приблизительно 1000-6000), предварительно нагретого до приблизительно 37°С, в концентрации 30-60% (вес/объем). Затем удаляют агенты для слияния клеток и т.п., которые не подходят для роста гибридомы, с помощью повторения стадий последовательного добавления соответствующей культуральной среды и удаления супернатанта с использованием центрифугирования.
Вышеуказанные гибридомы отбирают с помощью культивирования клеток в общей культуральной среде для отбора, например, культуральной среде НАТ (культуральной среде, содержащей гипоксантин, аминоптерин и тимидин). Культивирование в культуральной среде НАТ продолжают в течение достаточного периода времени, обычно в течение от нескольких дней до нескольких недель, для уничтожения клеток, отличных от представляющих интерес гибридом (неслившихся клеток). Затем осуществляют стандартный метод серийных разведений для скрининга и клонирования гибридом, продуцирующих представляющее интерес антитело.
Помимо способа иммунизации не являющегося человеком животного антигеном для получения упоминаемых выше гибридом, желаемое антитело человека, обладающее активностью связываться с желаемым антигеном или экспрессирующей антиген клеткой, можно получить с помощью сенсибилизации лимфоцита человека желаемым белком-антигеном или экспрессирующей антиген клеткой in vitro и слияния сенсибилизированного В-лимфоцита с миеломной клеткой человека (например, U266) (см. публикацию Kokoku заявки на патент Японии № (JP-B) H01-59878 (рассмотренную, одобренную заявку на патент Японии, опубликованную для опротестования)). Кроме того, желаемое антитело человека можно получить с помощью введения антигена или экспрессирующей антиген клетки трансгенному животному, имеющему набор генов антител человека, и затем следования упоминаемому выше способу (см. публикации международных заявок на патенты № WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735).
Приготовленные таким образом гибридомы, продуцирующие моноклональные антитела, можно субкультивировать в традиционной культуральной среде и хранить в жидком азоте в течение длительного периода.
Для получения моноклональных антител из упоминаемых выше гибридом можно использовать следующие способы: (1) способ, в котором гибридомы культивируют в соответствии с традиционными способами, а антитела получают в виде супернатанта в культуре клеток; (2) способ, в котором гибридомы пролиферируют при введении их в совместимого млекопитающего, а антитела получают в виде асцитов; и т.д. Первый из двух названных способов является предпочтительным при получении антител высокой степени чистоты, а второй из двух названных способов является предпочтительным при высокомасштабном получении антител.
Например, получение продуцирующих антитело против рецептора IL-6 гибридом можно осуществить способом, раскрытым в JP-A (Kokai) H03-139293. Получение можно осуществить способом инъецирования продуцирующей антитело РМ-1 гибридомы в брюшную полость мыши BALB/c, получения асцита и затем очистки антитела РМ-1 из асцита или способом культивирования гибридомы в соответствующей среде (например, среде RPMI1640, содержащей 10% фетальной бычьей сыворотки и 5% BM-Condimed H1 (Boehringer Mannheim); среде для гибридом SFM (GIBCO-BRL); среде PFHM-II (GIBCO-BRL) и т.д.) и затем получения антитела РМ-1 из супернатанта в культуре клеток.
В качестве моноклонального антитела по настоящему изобретению можно использовать рекомбинантное антитело, получаемое благодаря методам генетической рекомбинации путем клонирования гена антитела из гибридомы, встраивания гена в соответствующий вектор и затем введения вектора в хозяина (см., например, Borrebaeck, C.A.K. and Larrick, J.W., THERAPEUTIC MONOCLONAL ANTIBODIES, документ, опубликованный в Соединенном Королевстве MACMILLAN PUBLISHERS LTD., 1990).
Более конкретно, мРНК, кодирующую вариабельную (V) область антитела, выделяют из клетки, продуцирующей представляющее интерес антитело, такой как гибридома. Выделение мРНК можно осуществить путем приготовления общей РНК согласно известным способам, таким как способ ультрацентрифугирования в гуанидине (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299) и способ AGPC (Chomczynski, P. et al., Anal. Biochem. (1987) 162, 156-159), и приготовления мРНК с использованием набора для очистки мРНК (Pharmacia) и т.п. Альтернативно, мРНК можно непосредственно приготовить, используя набор для очистки мРНК QuickPrep (Pharmacia).
С использованием полученной мРНК синтезируют кДНК V-области антитела, используя обратную транскриптазу. Синтез кДНК можно выполнить, используя набор для синтеза первой цепи кДНК с помощью обратной транскриптазы AMV, и т.д. Кроме того, для синтеза и амплификации кДНК можно использовать 5'-RACE-способ (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932), используя набор 5'-Ampli FINDER RACE-kit (Clontech), и ПЦР. Представляющий интерес фрагмент ДНК очищают из полученных ПЦР-продуктов и затем лигируют с векторной ДНК. Затем, используя вышеуказанную ДНК, готовят рекомбинантный вектор и вводят его в Escherichia coli или т.п, и отбирают колонии для получения желаемого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК подтверждают, например, дидезокси-методом.
Когда получают ДНК, кодирующую V-область представляющего интерес антитела, ее лигируют с ДНК, кодирующей константную область (С-область) желаемого антитела, и встраивают в экспрессирующий вектор. Альтернативно, ДНК, кодирующую V-область антитела, можно встроить в экспрессирующий вектор, включающий ДНК С-области антитела.
Для получения антитела, используемого в настоящем изобретении, как описано ниже, ген антитела встраивают в экспрессирующий вектор так, чтобы он экспрессировался под контролем регулирующей экспрессию области, например, энхансера и промотора. Затем антитело можно экспрессировать трансформированием клетки-хозяина этим экспрессирующим вектором.
В настоящем изобретении для уменьшения гетероантигенности в отношении человека и т.п. можно использовать искусственно модифицированные генетические рекомбинатные антитела, например химерные антитела, гуманизированные антитела или антитела человека. Эти модифицированные антитела можно приготовить, используя известные способы.
Химерное антитело можно получить лигированием кодирующей V-область антитела ДНК, полученной, как указано выше, с кодирующей С-область антитела человека ДНК, встраиванием ДНК в экспрессирующий вектор и введением его в хозяина для продуцирования (см. публикацию заявки на европейский патент № ЕР 125023; публикацию международной заявки на патент № WO 92/19759). Этот известный способ можно использовать для получения химерных антител, используемых для настоящего изобретения.
На гуманизированные антитела также приводится ссылка в виде реконструированных антител человека, и они представляют собой антитела, в которых определяющие комплементарность области (CDR) антитела млекопитающего, отличного от человека, (например, антитела мыши) переносят в CDR антитела человека. Общие способы этой рекомбинации генов также известны (см. публикацию заявки на