Способ получения n-(1,3,5-дитиазинан-5-ил)-изоникотинамида и n-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)-изоникотинамида
Иллюстрации
Показать всеИзобретение относится к способу получения амидосодержащих 1,3,5-дитиазинанов общей формулы (I). Способ осуществляют путем взаимодействия насыщенного сероводородом альдегида (муравьиного или уксусного) со смесью гидразида изоникотиновой кислоты - BuONa (1:3, рН>11.5). Процесс проводят при соотношении гидразид:альдегид:H2S, равном 1:3:2, при температуре 40°C и постоянном перемешивании в течение 4 часов с последующей нейтрализацией рассчитанным количеством разбавленной HCl и очищением колоночной хроматографией на SiO2. Полученные предлагаемым способом вещества могут найти применение как в качестве радиопротекторных, противоопухолевых, диуретических средств, так и в качестве селективных сорбентов и экстрагентов благородных и драгоценных металлов. Технический результат - амидосодержащие 1,3,5-дитиазинаны общей формулы (I). 2 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, а именно к способу синтеза амидосодержащих 1,3,5-дитиазинанов общей формулы:
Представленные соединения могут найти применение в качестве фармакологически активных соединений (Z.Brzozowski, F.Saczewski and M.Gdaniec Bioorganic & Medicinal Chemistry, 2003, №11, p 3673-3681; R.B.Pawar, V.V.Mulwad ХГС, 2004, №2, с 257-263), а также модифицированных селективных сорбентов и экстрагентов благородных и драгоценных металлов (Ю.И.Муринов, В.Н.Майстренко, Н.Г.Афзалетдинова. Экстракция металлов S,N-органическими соединениями. М.: Наука, 1993, с.192).
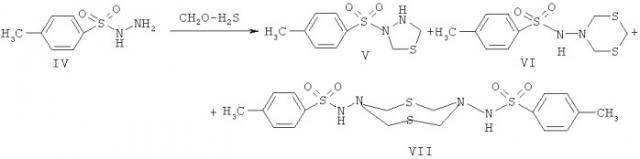
Синтезы данного класса 1,3,5-дитиазинов на основе ароматических гидразидов кислот в литературе не описаны. Известен синтез функционально замещенного 1,3,4-тиадиазинана (III), полученного при кипячении тиосемикарбазидоакрилата (II) в толуоле в присутствии K2CO3 путем внутримолекулярного замещения атомов фтора в о- и м-положении ароматического кольца, группы NH- и атома серы тиосемикарбазидного фрагмента (Липунова Г.Н., Носова Э.В., Сидорова Л.П. и др. ЖОрХ, 2002, т.38, №12, с.851-1856),
В литературе описан также способ синтеза смеси N,S-содержащих гетероциклических систем [1,3,4-тиадиазолидина, 1,3,5-дитиазинана и 1,3,5,7-дитиадиазаоктана] реакцией циклотиометилирования тозилгидразина с CH2O и H2S (Ахметова В.Р., Надыргулова Г.Р., Тюмкина Т.В. и др. Изв., АН. Сер. хим., №Ю, 2006, 1758-1767).
Известный метод циклотиометилирования гидразина (IX) с H2S и CH2O в присутствии BuONa в BuOH (pH 10.75-11.5) при соотношении NH2NH2-CH2O-H2S-BuONa, 1:4:2:4, температуре 20°C приводит к преимущественному образованию N-метилен-1,3,5-дитиазинанил-5-амина (X) наряду с [1,3,4]тиадиазоло[3.4-c][1,3,4]тиадиазолом (XI) с выходами 56% и 23% соответственно (В.Р.Ахметова, Г.Р.Надыргулова, С.Р.Хафизова и др. ЖОрХ, 2006, Т.42, №1, 151-153).
Перечисленными выше способами не могут быть получены N-(1,3,5-дитиазинан-5-ил)-изоникотинамид и N-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)-изоникотинамид.
Предлагаемый нами способ синтеза N-(1,3,5-дитиазинан-5-ил)-изоникотинамида и N-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)-изоникотинамида заключается во взаимодействии насыщенного сероводородом альдегида (муравьиный или уксусный) со свежеприготовленной смесью гидразида изоникотиновой кислоты (изониазид) и BuONa (1:3, рН>11.5) при соотношении изониазид:альдегид:H2S, равном 1:3:2. Реакционную смесь перемешивают 4 ч, поддерживая заданную температуру (40°C), затем нейтрализуют рассчитанным количеством разбавленной HCl. Образующиеся продукты экстрагируют хлороформом и очищают колоночной хроматографией на SiO2. Реакция протекает по схеме:
Отличия предлагаемого способа
Предлагаемый способ позволит получить селективно ранее неописанные амидосодержащие 1,3,5-дитиазинаны, потенциально обладающие комплексообразующей и биологической активностью исходя из доступных реагентов (изониазид, альдегиды, сероводород).
Преимущества предлагаемого способа
На основании предложенного способа можно селективно получать N-(1,3,5-дитиазинан-5-ил)-изоникотинамид (Ia) и N-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)-изоникотинамид (Iб), синтез которых в литературе ранее не описан. Предлагаемый способ технологически прост, в качестве каталитической системы используется бутилат натрия в бутаноле, процесс не требует больших энергозатрат.
Способ поясняется примерами
ПРИМЕР 1. В стеклянный реактор, снабженный магнитной мешалкой, обратным холодильником, газопроводящей трубкой и капельной воронкой, при 40°C помещали 3 моля формальдегида, барботированием насыщают его сероводородом в течение 20 мин. В другом реакторе при комнатной температуре (20°C) смешивали гидразид изоникотиновой кислоты с BuONa в BuOH при соотношении 1:3 (рН>11.5) и прибавляли по каплям в раствор, полученный барботированием газообразного H2S в формальдегид. Реакционную смесь перемешивали 4 ч, поддерживая заданную температуру (40°C), затем нейтрализовали рассчитанным количеством разбавленной HCl. Образующийся продукт экстрагировали хлороформом и очищали колоночной хроматографией на SiO2 (элюент CHCl3-этилацетат-C2H5OH, 5:1:1). Выделяли целевой N-(1,3,5-дитиазинан-5-ил)изоникотинамид с выходом 68%.
Спектральные характеристики N-(1,3,5-дитиазинан-5-ил)изоникотинамида (Ia)
| Выход 68%, т.пл. 200-202°C. Rf 0.35 (CHCl3-этилацетат - C2H5OH, 5:1:1). ИК-спектр, ν/см-1: 700, 1070, 1270, 1460-1540, 1650, 2905, 3390. Спектр ЯМР 1H (δ, м.д., ДМСО-d6): 4.59 (c, 2H, CH2(2)), 5.06 (c, 4H, H2C (4,6)); 8.12-8.17 (д, 2H, HC (11,13), J=4.662); 9.14-9.19 (д, 2H, HC (10,14), J=4.662); 9.74 (c, 1H, NH (7)); Спектр ЯМР 13C (δ, м.д., ДМСО-d6):30,87 (т, C (2)); 57.73 (т, C (4.6)); 121.46 (д, C (11, 13)); 141.20 (д, C (9)); 150.31 (д, C (10,14)); 163.20 (c, C (8)). Масс-спектр, m/z (Iотн., %): 242 (5) [M+].; 150 (100) [M-SCH2SCH2]+; 122 (13) [M-CH2SCH2SCH2N]+; 108 (6) [M-CH2SCH2SCH2NHN]+. C9H11N3S2O. Вычислено (%): C, 44.81; H, 4.56; N, 17.43; S, 26.55. Получено (%): C, 46.18; H, 4.74; N, 17.97; S, 25.97. |
ПРИМЕР 2. Аналогичным способом проводят циклотиометилирование гидразида изоникотиновой кислоты с помощью уксусного альдегида и H2S. Полученный продукт экстрагируют хлороформом и очищают колоночной хроматографией на SiO2 (элюент CHCl3-этилацетат-C2H5OH, 5:1:1). Выход целевого N-(1,3,5-дитиазинан-5-ил)изоникотинамида составляет 58%.
Спектральные характеристики N-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)изоникотинамида (Iб)
| Выход 58%, nd 20 1.4990. Rf 0.78 (CHCl3-этилацетат-C2H5OH, 5:1:1). ИК-спектр, ν/см-1: 700, 1050, 1255, 1450-1510, 1600, 1695, 2935, 3370. Спектр ЯМР 1H (δ, м.д., CDCl3): 1.39 (м, 3H, CH3 (15)), 1.64 (м, 6H, CH3 (16, 17)); 3.54 (c, 2H, CH2 (2)), 4.28 (c, 4H, H2C (4,6)); 7.27-7.32 (д, 2H, HC (11, 13)); 7.63-7.68 (д, 2H, HC (10, 14); 8.71 (c, 1H, NH (7)). Спектр ЯМР 13C (δ, м.д., CDCl3): 19.47 (c, C (15)); 23.57 (c, C (16, 17)); 44.15 (c, C (2)); 68.93 (c, C (4, 6)); 121.06 (д, C (11, 13)); 140.20 (д, C (9)); 150.59 (д, C (10, 14); 164.90 (c, C (8)). Масс-спектр, m/z (Iотн., %): 284 (100) [M+1]+; 224 (5) [M-CH3CHSCHCH3]+; 164 (25) [M-SCHCH3SCHCH3]+; 107 (7) [M-CH3CHSCHCH3SCHCH3]+. | |
| * - Спектры ЯМР 1H и 13C записаны на спектрометре "Bruker AVANCE 400" с рабочей чистотой 300 и 100 МГц, внутренний стандарт ТМС. ИК-спектры снимали на спектрометре "Specord 75 IR" в вазелиновом масле. Хромато-масс-спектрометрический анализ проведен на приборе «Shimadzu LCMS-2010 EV» в режиме химической ионизации при атмосферном давлении (ХИАД). Максимальная температура ионного источника (APCI probe) 500°C; температура нагревателя 200°C, температура испарителя 250°C. Скорость жидкого потока 0.05 мл/мин. Скорость газа - распылителя составила 2.5 мл/мин. Напряжение на источнике ионов (+) 4.5 кВ, (-) 3 кВ. Элементный анализ образцов определяли на элементном анализаторе фирмы Karlo Erba, модель №1106 |
Способ получения N-(1,3,5-дитиазинан-5-ил)-изоникотинамида и N-(2,4,6-триметил-1,3,5-дитиазинан-5-ил)-изоникотинамида общей формулы отличающийся тем, что насыщенный сероводородом альдегид (муравьиный или уксусный) взаимодействует со свежеприготовленной смесью гидразида изоникотиновой кислоты (изониазид) и BuONa (1:3, рН>11,5) при соотношении изониазид:альдегид:H2S, равном 1:3:2, при постоянном перемешивании в течение 4 ч с последующей нейтрализацией рассчитанным количеством разбавленной HCl и очищением колоночной хроматографией на SiO2.