Новый функционально активный высокоочищенный стабильный конъюгат интерферона с полиэтиленгликолем, представленный одним позиционным изомером пэг-n h-ифн, с уменьшенной иммуногенностью, с пролонгированным биологическим действием, пригодный для медицинского применения, и иммунобиологическое средство на его основе
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению ПЭГилированного интерферона альфа (ИФН-альфа), и может быть использовано в медицине. Получают конъюгат ИФН-альфа с монометоксиполиэтиленгликолем, присоединенным к N-концевому ИФН-цистеину альфа, общей формулы:
где n - целые значения от 454 до 1000; m - целое число ≥4; NαH-IFN - интерферон-α-2b, обладающий активностью интерферона-альфа. Полученный конъюгат обладает активностью ИФН-альфа и пролонгированным биологическим действием, что позволяет использовать его в составе фармацевтических композиций и как лекарственное средство для профилактики или лечения вирусных и онкологических заболеваний и заболеваний, сопровождающихся первичными или вторичными иммунодефицитными состояниями. 9 н. и 14 з.п. ф-лы, 9 ил., 6 табл., 20 пр.
Реферат
Настоящее изобретение относится к фармацевтике и медицине, а именно к новым физиологически активным конъюгатам интерферона, в частности к новым коньюгатам интерферона с полиэтиленгликолем, которые могут быть использованы в медицине, например, для лечения вирусных, иммунных и онкологических заболеваний.
Интерфероны (ИФН) - это группа биологически активных белков или гликопротеидов, продуцируемых различными клетками в ответ на вирусную инфекцию или при воздействии на клетки некоторых химических и биологических веществ (Isaacs&Lindeman, 1957; Pestka et al., 2007). Связывание ИФН с клеточными рецепторами приводит к индукции синтеза целого ряда внутриклеточных белков, которые опосредуют противовирусное, иммуномодулирующее и антипролиферативное действие ИФН (Pestka et al., 2004; Bekisz, 2004).
Гены различных ИФН человека были клонированы и экспрессированы в бактериальных и животных клетках, в результате были получены и очищены многие рекомбинантные ИФН (Pestka et al., 2004; Pestka, 2007). Лекарственные препараты, содержащие рекомбинантные ИФН, применяются в клинической практике для лечения целого ряда вирусных, онкологических и иммунных заболеваний (Pestka et al., 2004; Chevaliez&Pawlotsky, 2009).
В настоящее время препараты на основе ИФН применяются в клинической практике для лечения целого ряда вирусных, онкологических и иммунных заболеваний (Pestka et al., 2004). Наиболее широкое использование препараты ИФН получили для лечения вирусных гепатитов (Chevaliez&Pawlotsky, 2009), представляющих одну из наиболее серьезных социальных проблем. В настоящее время в мире насчитывается около 350 млн хронически больных гепатитом В и 170 млн больных гепатитом С (Marcellin, 2009). Заболевание гепатитом С в большинстве случаев приобретает хроническое течение с формированием тяжелых исходов - цирроза печени и гепатоцеллюлярной карциномы (Modi&Liang, 2008). По данным ВОЗ, с 1961 года в США и странах Западной Европы хронические гепатиты и циррозы печени, как причина смерти, переместились с 10 на 5 место (Marcellin, 2009). Известно также применение препаратов, содержащих ИФН-α, для лечения ряда лейкозов и солидных опухолей, в том числе рецедивирующей меланомы (Bukowski et al., 2002; Decantris et al., 2002; Qintas-Cardama et al., 2006).
Эффективность действия препаратов нативных ИФН ограничена быстрым всасыванием из подкожных тканей, большим объемом распределения, относительно низкой стабильностью, коротким периодом полувыведения, высокой иммуногенностью и токсичностью (Wills, 1990). В результате, в течение нескольких часов после введения наблюдается быстрое падение концентрации ИФН в плазме крови, при этом интерферон не определяется в плазме уже через 24 ч после инъекции (Chatelut et al., 1999). Снижение концентрации интерферона создает условия для возобновления репликации вируса и увеличения концентрации вирусных частиц (Lam et al., 1997). Поэтому возникает необходимость частых введений препарата для достижения эффективных терапевтических концентраций в плазме крови, что приводит к возникновению дозозависимых побочных эффектов. Вследствие указанных особенностей монотерапия хронического гепатита С (ХГС) ИФН-α2b в течение 12 мес приводила к устойчивому вирусологическому ответу всего у 15-20% пациентов, у больных с генотипом Iв и высокой вирусологической нагрузкой эффективность препарата не наблюдалась вовсе (Mc Hutchinson et al., 1998).
Терапевтическая эффективность ИФН может быть повышена при использовании препаратов пролонгированного действия, в частности - «ПЭГилированных» ИФН (Manns et al., 2001; Hadziyannis et al., 2004; Zeuzem et al., 2001).
Получение ПЭГилированных ИФН заключается в химическом связывании молекулы интерферона с полимером - монометоксиполиэтиленгликолем (мПЭГ), состоящим из повторяющихся субъединиц этиленоксида с метокси-группой на одном конце и гидроксильной группой - на другом. Молекула мПЭГ может иметь различную молекулярную массу и стереохимическую структуру (линейная или разветвленная). Для проведения реакции ПЭГилирования гидроксильную группу на конце мПЭГ активируют различными реактивными функциональными группами. Активированный мПЭГ может ковалентно связываться с белком в одном или в нескольких местах, что зависит от природы активированной группы и условий реакции (Zaiipsky&Hums, 1997; Roberts et al., 2002).
ПЭГилирование ИФН приводит к улучшению фармакокинетики, увеличению времени полувыведения из крови, снижению колебаний концентрации в крови, снижению иммуногенности и токсичности, увеличению активности in vivo (при снижении активности in vitro); увеличению стабильности (Glue et al., 2000; Reddy et al., 2001).
Снижение активности в системе in vitro напрямую зависит от молекулярной массы используемого ПЭГ. Присоединение небольших молекул ПЭГ с молекулярной массой ≤5000 Да вызывает незначительные изменения активности in vitro (Grace et al., 2005). Фармакодинамические и фармакокинетические свойства ПЭГилированных белков, содержащих ПЭГ с такой массой, и немодифицированных белков практически не различаются. Присоединение ПЭГ с большей молекулярной массой и множественными участками приводит к значительному снижению биоактивности in vitro, в результате неэффективного связывания с рецептором, однако в этом случае наблюдается улучшение фармакокинетических и фармакодинамических свойств ПЭГилированных белков (Delgado et al., 1992), что в результате приводит к увеличению биологической активности in vivo (Bailon&Berthold, 1998). Форма ПЭГ также оказывает влияние на биоактивность и фармакокинетические свойства - коньюгат с линейным ПЭГ распространяется на больший объем, чем с ПЭГ, имеющим разветвленную структуру (Caliceti et al., 2003).
Противовирусная активность и биологические свойства коньюгатов ПЭГ-ИФН в значительной степени зависят также от используемых активированных мПЭГ, функциональные группы которых различаются по способности модифицировать различные аминокислотные остатки белка и по типу образуемых с белком химических связей (Roberts et al., 2002). При получении ПЭГилированных белков наиболее широкое применение нашли активированные мПЭГи, способные связываться со свободными аминогруппами белков (сукцинимидилкарбонатные, сукцинимидилсукцинатные, трезилатные, триазиновые, гидроксисукцинимидные эфиры, ацетальальдегиды и др.).
Из уровня техники известны различные коньюгаты ПЭГ-ИФН.
Известен коньюгат ПЭГ-ИФН-α2а с линейным ПЭГ с молекулярной массой 1-5000 Да (Патент U.S. No.5,382,657, 1995). Для конъюгации использовали этандиольные производные мПЭГ, реакцию проводили при рН=10 при комнатной температуре в течение 0,5-4 час. Для проведения реакции ПЭГилирования ИФН использовали 3-кратный избыток ПЭГ. В используемых условиях связывание ПЭГ с ИФН происходило через стерически доступные свободные аминогруппы различных лизинов (Lys-31, Lys133, Lys134, Lys23, Lys131, Lys121, Lys70, Lys83, Lys49 и Lys112) с образованием карбамидной связи (Monkarsh et al., 1997). Таким образом, полученный коньюгат ПЭГ-ИФН-α2а состоял из смеси позиционных изомеров, где каждый изомер содержал один ПЭГ. В сравнении с немодифицированным ИФН удельная противовирусная активность изомеров варьировала от 6% (для Lys1l2) до 40% (для Lys133). Суммарная удельная активность полученного коньюгата, состоящего из 11 изомеров, составляла 34% от немодифицированного ИФН. Активность полученных коньюгатов in vitro также зависела от молекулярной массы ПЭГ и варьировала от 45% (для ПЭГ - 2500 Да) до 25% (в случае ПЭГ - 10000 Да). Недостатками полученного коньюгата являются:
1. Использование этандиол-активированных мПЭГ с низкой молекулярной массой (≤5000 Да), в результате чего фармакокинетические параметры полученного коньюгата ПЭГ-ИФН и немодифицированного ИФН различались незначительно, в связи с чем данный коньюгат не нашел применения в клинике.
2. Образование большого количества позиционных изомеров с различной удельной активностью, в которых ПЭГ был связан с молекулой ИФН через свободные аминогруппы различных лизинов.
Известны коньюгаты ПЭГ-ИФН-α2b, полученные при конъюгации нативного ИФН-α2b с линейным (патент RU 2311930, 2004) или разветвленным (патент RU 2382048, 2008) производными мПЭГ с молекулярной массой 13000-17000 Да. Реакцию проводили при рН 9,5 в течение 60 часов (для линейного мПЭГ) или при рН 7,5 в течение 12 часов (для разветвленного мПЭГ), используя 50-100-кратный молярный избыток активированного ПЭГ. В результате были получены коньюгаты ПЭГ-ИФН, суммарная противовирусная активность которого варьировала от 29 до 38% от активности немодифицированного ИФН. Данных о стабильности связи, количестве позиционных изомеров и их удельной противовирусной активности не приведено. Недостатками полученных коньюгатов являются:
1. Использование трезил-производных активированного мПЭГ с временем полужизни в водных растворах менее 20 мин. Ранее было показано, что при взаимодействии трезилат-производных ПЭГ с белками, помимо стабильных амидных связей через аминогруппы, образуются также нестабильные сульфаматные связи (Gais&Ruppert,1995).
2. Связывание трезил-активированных ПЭГ с белками происходит через все стерически доступные свободные аминогрупп лизина (Roberts et al., 2002), что приводит к образованию нескольких позиционных изомеров.
3. Проведение реакции ПЭГилирования ИФН при высоких значениях рН (рН=10) в течение длительного времени (60 час) может привести к изменению структуры ИФН.
4. Значительный избыток активированного ПЭГ при проведении реакции ПЭГилирования ИФН (молярное соотношение ПЭГ/белок составляло 50-100/1) приводит к высокой стоимости полученного продукта.
Известен коньюгат ПЭГ-ИФН-α2b, полученный при связывании нативного ИФН-α2b с разветвленным триазиновым производным мПЭГ с молекулярной массой 7500-35000 Да (Патент RU 2298560, 2004), суммарная противовирусная активность которого составляла 6,4% от активности немодифицированного ИФН. Данных о стабильности связи, количестве позиционных изомеров и их удельной противовирусной активности не приведено.
Недостатками полученного коньюгата являются:
1. Использование триазин-хлорид производных активированного мПЭГ, которые помимо свободных аминогрупп способны связываться с функциональными группами других аминокислот - серина, тирозина, треонина и гистидина, что приводит к появлению множества изомеров, часть из которых характеризуется нестабильной связью. Более того, триазиновые производные в настоящее время не используются из-за их высокой токсичности (Veronese&Pasut, 2005).
2. Низкая удельная активность коньюгата ПЭГ-ИФН.
Известен коньюгат ПЭГ-ИФН-α2а, полученый при коньгации ИФН-α2а с разветвленным ПЭГ с молекулярной массой 40 кДа (патент RU 2180595, 1997). Для конъюгации использовали N-гидроксисукцинимид-эфир производное мПЭГ, избирательно взаимодействующий с доступными свободными аминогруппами белка с образованием стабильной амидной связи. Реакцию проводили при рН 9 при 4°С в течение 2 часов при соотношении мПЭГ/белок, равном трем. Реакцию останавливали и очистку полученного коньюгата проводили на сорбенте Fractogel EMD CM 650 (М). Выход очищенного коньюгата составлял 40-45%. В этом случае был получен коньюгат ИФН-ПЭГ, состоящий из 6 позиционных изомеров, каждый из которых был связан с одной молекулой ПЭГ стабильной связью через свободные аминогруппы лизинов - Lys31, Lys121, Lys 131, Lys 134, Lys 70 и Lys 83 (Bailon et al., 2001; Foser et al., 2003). Изомеры, связанные с ПЭГ, через лизины в положении 31, 121, 131 и 134, в сумме составляли 94%. Активность суммарного коньюгата, состоящего из 6 позиционных изомеров, составляла 1-7% от нативного ИФН-α2а (Bailon et al., 2001; Boulestin et al., 2006). Несмотря на низкую противовирусную активность in vitro, данный коньюгат по сравнению с немодифицированным ИФН обладал улучшенными фармакокинетическими свойствами (Silva et al., 2006, Boulestin et al., 2006), и в настоящее время используется в клинике под названием «Пегасис» (производство фирмы "Хоффманн-Ля Рош).
Недостатками полученного коньюгата являются:
1. Использование N-гидроксисукцинимид-эфир активированного ПЭГа, связывающегося со всеми стерически доступными аминогруппами, в результате полученный коньюгат представлял смесь из 6 изомеров, различающихся по удельной активности.
2. Низкая противовирусная удельная активность полученного коньюгата in vitro.
Прототипом для настоящего изобретения является коньюгат ПЭГ-ИФН-α2b, описанный в патенте US 5,951,974, 1999. Для реакции ПЭГилирования использовали линейный мПЭГ, активированный сукцинимидил карбонатной группой (SC-mPEG) с молекулярной массой от 5000 до 12000 Да. По описанному методу был получен коньюгат ИФН с ПЭГ с молекулярной массой 12 кДа, который настоящее время применяется в клинике для лечения вирусных гепатитов - препарат «Пегинтрон» (фирма "Shering-Plough", США).
Установлено, что полученный коньюгат ПЭГ-ИФН-α2b (препарат «Пегинтрон») состоит из 13 позиционных изомеров, каждый из которых содержит одну молекулу ПЭГ, присоединенную к различным участкам молекулы белка (Wang et al., 2000; Grace et al., 2001; Youngster et al., 2002). Было показано, что молекула ПЭГ была связана с интерфероном не только через свободные аминогруппы лизинов (Lys 31 Lys 49, Lys 83, Lys 121, Lys 131, Lys 133, Lys 134 и Lys 164) и N-концевого цистеина (Cys 1), но и через имидазольное кольцо гистидина (His 7, His 34), тирозина (Туr 129) и ОН-группу серина (Ser 163). Содержание отдельных изомеров варьировало от 0,8 (Туr 129) до 47% (His 34). Противовирусная активность суммарного препарата Пегинтрона, состоящего из 13 позиционных изомеров, составляла 28% от нативного белка. Удельная активность отдельных изомеров варьировала от 11 до 37% от нативного ИФН-α2b (Youngster et al., 2002). Наибольшая удельная активность была у основного изомера, сконьюгированного с ПЭГ через His 34, которая составляла 37% от нативного белка. Свободные аминогруппы ИФН были соединены с ПЭГ через стабильную связь, тогда как в основном изомере, составляющим примерно 47%, ПЭГ был соединен с имидазольным кольцом гистидина (His 34) через нестабильную (в водных растворах) карбаматную связь (Roberts et al., 2002).
Фармакокинетические параметры полученного коньюгата были лучше, чем у немодифицированного ИФН (Silva et al., 2006).
Недостатками полученного коньюгата являются:
1. Использование сукцинимидил карбонат активированного ПЭГа связывающегося не только со свободными аминогруппами ИФН, но и с функциональными группами других аминокислот. В результате полученный коньюгат состоял из смеси 13 позиционных изомеров, различающихся по противовирусной удельной активности.
2. Образование нестабильной имидазол-карбонатной (карбаматной) связи в основном (His-34) изомере коньюгата ПЭГ-ИФН приводит к тому, что при попадании в организм препарат «Пегинтрон» гидролизуется и высвобождается нативный ИФН, который оказывает биологическое действие. Таким образом, препарат «Пегинтрон» лучше всего расценивать как про-лекарство, которое после введения в организм расщепляется с образованием активного интерферона (Foster, 2004). Из-за нестабильности ПЭГ-ИФН в растворе лекарственная форма «Пегинтрона» хранится только в виде лиофильно-высушенного порошка.
Задача настоящего изобретения состояла в получении нового стабильного коньюгата ПЭГилированного ИФН, с активностью ИФН альфа, состоящего из одного позиционного изомера, с улучшенной стабильностью, со сниженной иммуногенностью, с улучшенными фармакокинетическими параметрами, с оптимальным сочетанием параметров молекулярной массы ПЭГ и противовирусной активности, пригодного для создания лекарственного препарата медицинского назначения, способствующего расширению арсенала лекарственных средств заданной направленности, фармацевтической композиции на основе полученного ПЭГ-ИФН.
Поставленная задача решается созданием новой молекулы функционально активного коньюгата ПЭГ-ИФН с активностью интерферона-альфа, в котором линейная молекула ПЭГ с молекулярной массой от 10 до 40000 Да связана с молекулой ИФН-α стабильной связью строго через альфа-аминогруппу N-концевого цистеина так, что общая формула коньюгата ПЭГ-ИФН с линейным мПЭГ представляет собой следующее соединение (I):
где n - целые значения от 227 до 10 000;
m - целое число ≥4;
IFN - природный или рекомбинантный полипептид, обладающий активностью ИФН-альфа.
В полученном коньюгате линейный ПЭГ с молекулярной массой 10000 - 40000 Да связан с альфа-аминогруппой N-концевой аминокислоты ИФН.
Избирательность модификации ИФН строго по альфа-аминогруппе N-концевой аминокислоты достигается за счет использования альдегид-активированных мПЭГ общей формулы (II) и проведения реакции ПЭГилирования при рН≤6:
где n - целые значения от 227 до 10000, так что молекулярная масса ПЭГ составляет примерно 10000-40000 Да;
m - целое число ≥4.
Оптимальное соотношение параметров молекулярной массы ПЭГ и противовирусной активности достигается за счет использования активированного мПЭГ (II) со значением m≥4.
Снижение иммуногенности, токсичности и улучшение фармакокинетических параметров достигается за счет увеличения молекулярной массы присоединенного ПЭГ.
Новым по сравнению с прототипом является:
1. Для получения коньюгата ПЭГ-ИФН использованы альдегидные производные активированных мПЭГ.
2. Структурная формула коньюгата ПЭГ-ИФН.
3. Полученный коньюгат ПЭГ-ИФН представлен одним позиционным изомером.
4. Стабильная связь между молекулой ПЭГ и молекулой ИФН.
5. Увеличение молекулярной массы коньюгата ПЭГ-ИФН за счет размера присоединенного ПЭГ.
6. Улучшенные фармакокинетические параметры.
Для получения заявляемого коньюгата ПЭГ-ИФН был использован рекомбинантный ИФН-α2b человека (производство ЗАО «Биокад») и бутир- или пентальалдегидные производные мПЭГ формулы (II) с молекулярной массой 20000 Да.
Реакцию коньюгирования проводили при рН ниже 6.0 в присутствии восстанавливающего агента при температуре, равной или ниже 20°С. Молярное соотношение ПЭГ/белок составляло 2,5-5/1. Контроль образования коньюгата ПЭГ-ИФН проводили при помощи электрофореза в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДДС) в восстанавливающих условиях и обратно-фазной высокоэффективной хроматографии (ОФ ВЭЖХ). Очистку моноПЭГ-ИФН от продуктов реакции, немодифицированного ИФН и от нежелательных форм ПЭГ-ИФН, содержащих две и более молекулы ПЭГ на молекулу белка, проводили при помощи хроматографии на катионообменных сорбентах. Элюцию моноПЭГ-ИФН проводили градиентом концентрации хлористого натрия от 0,05 до 0,2 М в буферном растворе с рН ниже 6. Очищенный препарат моноПЭГ-ИФН диализовали против 10-50 мМ буферного раствора с рН 4-5, добавляли соли, или полисахариды, или многоатомные спирты, или поливинилпирролидоны, или моносахариды, или аминосахара, или белки, или аминокислоты и неионные детергенты и хранили в пластиковых или стеклянных флаконах с силиконизированной поверхностью при температуре 4±2°С.
Для характеристики полученного коньюгата моноПЭГ-ИФН-α2b исследовали его чистоту, гомогенность, физико-химические, биологические и фармакокинетические параметры в сравнении с немодифицированным ИФН.
Предлагаемое изобретение иллюстрируется фигурами графического изображения, где представлены:
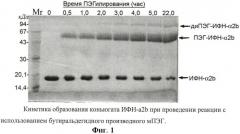
Фиг.1. Кинетика образования коньюгата ИФН-α2b при проведении реакции с использованием бутиральдегидного производного мПЭГ.
Фиг.2. Обратно-фазная ВЭЖХ коньюгата ПЭГ-ИФН-α2b на колонке "Symmetry С18"(4,6×150 mm).
Фиг.3. Электрофоретический анализ коньюгата ПЭГ-ИФН-α2b в сравнении немодифицированным ИФН-α2b.
Фиг.4. MALDI масс-спектры немодифицированного ИФН-α2b и коньюгата ПЭГ-ИФН-α2b.
Фиг.5. Локализация сайта ПЭГилирования в коньюгате ПЭГ-ИФН-α2b. Сравнение масс-спектров триптических пептидов немодифицированного ИФН-α2b (А) и коньюгата ПЭГ-рчИФН-α2 (В) в диапазоне m/z 1200-1400.
Фиг.6. Динамика изменения концентрации неоптерина в сыворотке после однократного введения коньюгата ПЭГ-ИФН в различных дозах.
Фиг.7. Термостабильность коньюгата ПЭГ-ИФН-α2.
Фиг.8. Протеолитическая стабильность коньюгата ПЭГ-ИФН-α2b при обработке трипсином.
Фиг.9. Иммуногенность коньюгата ПЭГ-ИФН-α2b в сравнении с немодифицированным ИФН-α2b.
Фиг.10. Фармакокинетика коньюгата ПЭГ-ИФН-α2b в сравнении с немодифицированным ИФН-α2b.
Примеры конкретного выполнения способа получения ПЭГ-ИФН-α2b и исследования его свойств приведены ниже.
Коньюгаты ПЭГ-ИФН-α2 формулы (I), являющиеся объектом настоящего изобретения, могут быть использованы для получения лекарственных средств для профилактики и/или лечения вирусных заболеваний, поскольку помимо высокой стабильности и сниженной иммуногенности обладают высоким значением противовирусной активности. Также фармацевтические композиции, содержащие в качестве активного ингредиента эффективное количество коньюгата формулы (I) и получаемые известными методами, применяемыми в фармацевтике, могут использоваться как отдельно, так и совместно с другими терапевтическими средствами (например, рибавирин) для профилактики и/или лечения вирусных заболеваний (хронический активный гепатит (в частности, гепатиты В и С) (Jay et al, 2006; Mc Hutchison et al, 2009). Объектом настоящего изобретения также является способ профилактики и/или лечения вирусных заболеваний, например гепатита С и гепатита В, включающий введение терапевтически эффективного количества заявляемого коньюгата формулы (I).
Из уровня техники известно также использование ИФН-α и ПЭГилированных интерферонов-α в качестве иммуномодуляторов для лечения онкологических заболеваний, в частности волосатоклеточного лейкоза, папилломатоза гортани, меланомы, почечной карциномы, миелолейкозов, саркомы Капоши (Decatris et al., 2002; Bukowski et al., 2002; Qintas-Cardama et al., 2006; Loquai et al., 2008; Kaehler et al., 2010). На основании известного из уровня техники этиопатогенеза данных заболеваний и применения ИФН-α, а также из коньюгатов для их профилактики и/или лечения, объектами настоящего изобретения являются также лекарственные средства и фармацевтические композиции, содержащие заявляемый коньюгат ПЭГ-ИФН-α в эффективном количестве, обладающие антипролиферативным и иммуномодулирующим действием, которые могут применяться для профилактики и/или лечения онкологических заболеваний и заболеваний, сопровождающихся первичными или вторичными иммунодефицитными состояниями, а также объектом настоящего изобретения является способ профилактики и/или лечения онкологических заболеваний и заболеваний, сопровождающихся первичными или вторичными иммунодефицитными состояниями, включающий введение терапевтически эффективного количества коньюгата ПЭГ-ИФН-α формулы (I).
Коньюгат формулы (I) с необязательным фармакологически приемлемым наполнителем, разбавителем и/или фармацевтически приемлемыми вспомогательными веществами вводят внутривенно, подкожно, внутримышечно или каким-либо другим подходящим способом, например, в виде капсул, сиропа, спрея, капель, инъекции или суппозитория. Путь введения варьируют в зависимости, например, от симптомов и возраста, частоту введения и интервал между введениями варьируют в зависимости от заболевания и его тяжести или от цели (терапевтическое или профилактическое использование), эффективное количество активного начала ПЭГ-ИФН-α выбирается с учетом вышеизложенных факторов.
В качестве фармацевтически приемлемых вспомогательных компонентов, которые могут входить в фармацевтическую композицию с ПЭГ-ИФН-α2, могут быть использованы: буферные соли (например, ацетатный, цитратный, водород-карбонатный, фосфатный буферы), стабилизаторы (например, полисорбаты, ЭДТА, поливинилпирролидоны, декстраны, ЧСА, эфиры параоксибензойной кислоты, спирты (например, бензиловый спирт), фенолы, сорбиновая кислота), обеззараживающий компонент (например, бензиловый спирт), регулятор осмотического давления (например, хлорид натрия, хлорид калия, полиолы, например, глицерин, арабитол, сорбитол, маннитол, лактоза, декстран), сурфактанты (например, ЧСА, поливинилпирролидон, лецитин, Твин 80, полиоксиэтилен-полиоксипропилен сополимер, казеин), поверхностно-активные вещества (например, блок-сополимеры этиленоксида и пропиленоксида, пропиленоксида и этиленоксида, сорбитанмонолаурат, сложный эфир сорбита, сложный эфир жирной кислоты полиглицирина, кокамид DEA лаурилсульфат, алканоламид, стеарит полиоксиэтилен пропилен гликоля, лауриновый эфир полиоксиэтилена, цетиловый эфир полиоксиэтилена, полисорбат, моностеарат глицерина, дистеарат глицерина, монопальмитат сорбита, сорбитанмоноолеат полиоксиэтилена, сорбитанмонолаурат полиоксиэтилена и моностеарат пропиленгликоля), антиоксиданты (например, Трилон Б, L-цистеин, сульфит натрия, аскорбат натрия, глутатион, 2-меркаптоэтанол, дитиотриитол, цистеингидрохлорид моногидрат, аскорбиновая кислота) и разбавители (например, вода).
Пример 1
Получение коньюгата ПЭГ-ИФН-α2b с использованием бутиральдегидного производного мПЭГ с молекулярной массой 20 кДа
К 785 мл буферного раствора (100 мМ натрий-ацетата, 150 мМ натрия хлористого, рН 5,0), содержащего рекомбинантный ИФН-α2 в концентрациии 1,7 мг/мл, добавляли 16 мл 1М раствора цианборгидрида натрия, перемешивали и добавляли 5 г сухого бутиральдегидного производного ПЭГ с молекулярной массой 20000 дальтон. Смесь тщательно перемешивали и инкубировали в течение 22 часов при температуре 17±3°С. Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования коньюгата ПЭГ-ИФН-α2 при помощи метода электрофореза в ПААГ в присутствии ДДС. Для этого к отобранной пробе добавляли 1/3 объема буфера, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% ДДС, 0,005% бромфеноловый синий, и нагревали 3 мин на кипящей водяной бане. Пробы в объеме 5 мкл вносили в лунки подготовленных пластин ПААГ и проводили электрофорез в 12,5% ПААГ в присутствии ДДС. По окончании электрофореза гель окрашивали при помощи Кумасси R-250. Кинетика образования коньюгата ПЭГ-ИФН-α2 представлена на фиг.1. В момент времени, когда содержание ПЭГ-ИФН составляло более 70%, реакционную смесь разводили в 10 раз 5 мМ натрий ацетатным буфером, рН 5,0.
Пример 2
Получение коньюгата ПЭГ-ИФН-α2b с использованием бутиральдегидного производного мПЭГ с молекулярной массой 30 кДа
К 500 мл буферного раствора (50 мМ натрий-ацетата, 150 мМ натрия хлористого, рН 5,0), содержащего рекомбинантный ИФН-α2 в концентрациии 2,2 мг/мл, добавляли 10 мл 1М раствора цианборгидрида натрия, перемешивали и добавляли 5 г сухого бутиральдегидного производного ПЭГ с молекулярной массой 30000 дальтон. Смесь тщательно перемешивали и инкубировали в течение 28 часов при температуре 17±3°С. Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования коньюгата ПЭГ-ИФН-α2 при помощи метода электрофореза в ПААГ в присутствии ДДС, как описано в п.1. В момент времени, когда содержание ПЭГ-ИФН составляло более 60%, реакционную смесь разводили в 5 раз 5 мМ натрий ацетатным буфером, рН 5,0.
Пример 3
Получение коньюгата ПЭГ-ИФН-α2b с использованием пропилальдегидного производного мПЭГ с молекулярной массой 40 кДа
К 200 мл буферного раствора (50 мМ натрий-ацетата, 150 мМ натрия хлористого, рН 5,0), содержащего рекомбинантный ИФН-α2 в концентрациии 2,5 мг/мл, добавляли 4 мл 1М раствора цианборгидрида натрия, перемешивали и добавляли 5 г сухого бутиральдегидного производного ПЭГ с молекулярной массой 40000 дальтон. Смесь тщательно перемешивали и инкубировали при температуре 17±3°С.Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования коньюгата ПЭГ-ИФН-α2 при помощи метода электрофореза в ПААГ в присутствии ДДС, как описано в п.1. В момент времени, когда содержание ПЭГ-ИФН составляло более 60%, реакционную смесь разводили в 5 раз 5 мМ натрий ацетатным буфером, рН 5,0.
Пример 4
Получение коньюгата ПЭГ-ИФН-α2b с использованием пентальальдегидного производного мПЭГ с молекулярной массой 20 кДа
К 100 мл буферного раствора (100 мМ натрий-ацетата, 150 мМ натрия хлористого, рН 5,5), содержащего рекомбинантный ИФН-α2b в концентрациии 2,2 мг/мл, добавляли 2,05 мл 1М раствора цианборгидрида натрия, перемешивали и добавляли 0,9 г сухого пентальдегидного производного ПЭГ с молекулярной массой 20000 дальтон. Смесь тщательно перемешивали и инкубировали в течение 24 часов при температуре 6±2°С. Через различные промежутки времени из реакционной смеси отбирали аликвоты по 50 мкл и анализировали кинетику образования коньюгата ПЭГ-ИФН при помощи метода электрофореза в ПААГ, как описано в примере 1. В момент времени, когда содержание ПЭГ-ИФН составляло более 70%, реакционную смесь разводили в 10 раз 5 мМ натрий ацетатным буфером, рН 5,0.
Пример 5
Очистка коньюгата моноПЭГ-ИФН-α2b при помощи ионообменной хроматографии на катионообменном сорбенте
Разбавленный раствор, полученный в примере 1, наносили на колонку с катиоонообменным сорбентом (СМ-сефароза, 300 мл), уравновешенным 5 мМ натрий ацетатным буфером, рН 5.0, (буфер А) со скоростью 5 мл/мин. Колонку с сорбентом промывали последовательно буфером А и буфером А, содержащим градиент концентрации NaCl от 0,05 до 0,2 М. Из каждой фракции отбирали аликвоты для анализа проб методом электрофореза в ПААГ, как описано в примере 1. Фракции, содержащие моноПЭГилированный коньюгат ПЭГ-ИФН-α2, объединяли, диализовали против 10 объемов 20 мМ натрий ацетатного буфера, содержащего 150 мМ натрия хлористого, проводили стерильную фильтрацию и хранили при температуре 4±2°С.
Пример 6
Очистка коньюгата моноПЭГ-ИФН-α2b при помощи ионообменной хроматографии на катионообменном сорбенте
Разбавленный раствор, полученный в примере 4, наносили на колонку с катиоонообменным сорбентом (SP-сефароза, 50 мл), уравновешенным 5 мМ натрий ацетатным буфером, рН 5.0, (буфер А) со скоростью 5 мл/мин. Колонку с сорбентом промывали последовательно буфером "А" и буфером А, содержащим градиент концентрации NaCl от 0,03 до 0,3 М. Из каждой фракции отбирали аликвоты для анализа проб методом электрофореза в ПААГ, как описано в примере 1. Фракции, содержащие моноПЭГилированный коньюгат ПЭГ-ИФН-α2, объединяли, диализовали против 10 объемов 20 мМ натрий ацетатного буфера, содержащего 150 мМ натрия хлористого, проводли стерильную фильтрацию и хранили при температуре 4±2°С.
Пример 7
Анализ коньюгата ПЭГ-ИФН-α2b при помощи метода обратно-фазной высокоэффективной жидкостной хроматографии
Коньюгат ПЭГ-ИФН-α2, полученный по п.5, разводили 20 мМ натрий-ацетатным буфером рН 5.0 до концентрации 0,1 мг/мл и 100 мкл полученной пробы вносили на колонку Symmetry С18 (4.6×150 mm). Исследование проводили на хроматографе «Breeze» фирмы "Waters" при 214 нм. Из результатов, представленных на фиг.2, следует, что по данным ОФ ВЭЖХ чистота заявляемого коньюгата ПЭГ-ИФН-α2 составляет более 99%.
Пример 8
Определение уровня эндотоксинов
Содержание бактериальных эндотоксинов (БЭ) в пробах коньюгата ПЭГ-ИФН-α2, приготовленных по п.5 и п.6, определяли in vitro с помощью ЛАЛ-теста (модификация гель-тромб тест) в соответствии с требованиями ОФС 42-0002-00. В работе использовали диагностический многокомпонентный набор фирмы «Associates of CAPE COD, Inc. ЛАЛ-реактив PYROTELL® с чувствительностью 0,03 ЕЭ/мл, контрольный стандарт эндотоксина (КСЭ, 0,5 мкг во флаконе), воду для ЛАЛ-теста. Из результатов, представленных в табл.1, видно, что содержание БЭ в пробах коньюгата составляет менее 1,5 единиц эндотоксина (еЭ) на мг белка, что гораздо ниже уровня БЭ, допустимого для медицинских препаратов на основе рекомбинантных белков.
| Табл.1 | |
| Содержание бактериальных эндотоксинов в коньюгате ПЭГ-ИФН-α2 | |
| Препарат коньюгата ПЭГ-ИФН-α2 | Содержание эндотоксинов (еЭ/мг белка) |
| ПЭГ-ИФН-α2, полученный по п.5 | ≤1,5 |
| ПЭГ-ИФН-α2, полученный по п.6 | ≤1,4 |
Пример 9
Электрофоретический анализ коньюгата ПЭГ-ИФН-α2b в сравнении с немодифицированным ИФН-α2b
Пробу коньюгата ПЭГ-ИФН, полученную по п.5, анализировали методом электрофореза в ПААГ, как описано в п.1. Электрофорез проводили с нагрузкой на лунку 40 мкг белка в нередуцирующих условиях. Окраску белков в геле проводили красителем Кумасси R-250. Одновременно проводили электрофорез немодифицированного ИФН-α2. Коньюгат ПЭГ-ИФН был представлен одной полосой (фиг.3, трек 1). Из электрофореграмм коньюгата ПЭГ-ИФН-α2 и немодифицированного ИФН-α2, представленных на фиг 3, видно, что коньюгат ПЭГ-ИФН-α имеет более высокую молекулярную массу, чем рчИФН-α (фиг.3, треки 1 и 2). Следует отметить, что методом ЭФ точное значение молекулярной массы для ПЭГилированных белков определить нельзя, так как присоединение гидрофильной молекулы ПЭГ к белку значительно увеличивает радиус Стокса образовавшегося комплекса. В результате продвижение комплекса ПЭГ-белок в геле замедляется и значение его молекулярной массы оказывается значительно выше, чем сумма молекулярных масс белка и ПЭГ.
Пример 10
Определение молекулярной массы коньюгата ПЭГ-ИФН-α2 в сравнении с немодифицированным ИФН-α2 методом масс-спектрометрии
1 мкл пробы коньюгата ПЭГ-ИФН, полученной по п.5, и 0,3 мкл раствора 2,5-дигидроксибензойной кислоты (Aldrich 10 мг×мл-1 в 20% ацетонитриле в воде с 0.5% ТФУ) смешивали и высушивали на воздухе. Аналогичным способом готовили пробу немодифированного ИФН-α2.
Масс-спектры были получены на MALDI-времяпролетном масс-спектрометре Ultraflex II BRUKER (Германия), оснащенном УФ-лазером (Nd). Масс-спектры получены в режиме положительных ионов, в линейном режиме, погрешность измерения средней массы не превышает 10-15 Да.
Результаты по масс-спектрометрическому анализу немодифицированного рчИФН-α2 и коньюгата ПЭГ-ИФН-α2 в диапазоне m/z от 10000 - 50000 приведены на фиг.4. Из фиг.4А видно, что масс-спектр рчИФН-α2 содержит основной пик, соответствующий однозарядному иону[M]+ с молекулярной массой 19295 Да.
В масс-спектре коньюгата ПЭГ-ИФН-α2, приведенном на фиг.4 В, представлен размытый основной пик, соответствующий однозарядному иону [М]+ с молекулярной массой 40498 Да. Размытость пика связана с гетерогенностью препаратов монометоксиПЭГ. Для коньюгата ПЭГ-ИФН измеренное значение m/z в максимуме пика (40498 Да) совпадает с расчетными данными по сумме молекулярных масс ИФН-α2 (19295 Да) и присоединенного ПЭГ (20000 Да).
Пример 11
Локализация сайта ПЭГилирования в коньюгате ПЭГ-ИФН-α2b
К 5 мкл пробы коньюгата ПЭГ-ИФН, полученной по п.5, добавляли 5 мкл раствора модифицированного трипсина (Promega) в 0.05 М NH4НСО3 с концентрацией 15 мкг×мл-1. Гидролиз проводили в течение 16 ч при 37°С, затем к раствору добавляли 10 мкл 0.5% ТФУ в 10% растворе ацетонитрила в воде и тщательно перемешивали. Аналогичным способом готовили пробу немодифированного ИФН. Полученные растворы использовали для получения MALDI-масс-спектров.
Локализацию сайта связывания ПЭГ с молекулой ИФН определяли путем сравнения масс-спектров триптического гидролизата коньюгата ПЭГ-ИФН-α2 и немодифицированного рчИФН-α2. В триптическом гидролизате коньюгата ПЭГ-ИФН-α2 должен отсутствовать пептид, соответствующий участку белка, по которому произошла модификация. В табл.2 представлены масс-спектры экспериментальных триптических пептидов для немодифицированного ИФН-α и коньюгата ПЭГ-ИФН-α2. Из таблицы видно, что масс-спектры триптических пептидов немодифицированного ИФН-α2b практически совпадают с масс-спектрами триптических пептидов коньюгата ПЭГ-ИФН-α2 (табл.2), но в триптическом переваре коньюгата ПЭГ-ИФН-α2 отсутствует пептид с молекулярной массой 1313.649 присутствующий в триптическом переваре немодифицированного рчИФН-α2 (см. также фиг.5). Согласно анализу теоретических масс триптического гидролизата ИФН-α2 пик с m/z 1313,649 соответствует N-концевому пептиду белка (табл.2). Его отсутствие в триптическом переваре коньюгата ПЭГ-ИФН-α2 свидетельствует о модификации N-концевого пептида, который, став тяжелее на массу ПЭГ, находится за пределами исследуемой области спектра. Связывание ПЭГ с молекулой ИФН произошло по единственной свободной аминогруппе, присутствующей в этом пептиде - по аминогруппе N-концевого цистеина.
| Табл.2 | ||||
| Экспериментальные масс-спектры триптических пептидов коньюгата ПЭГ-ИФН-α2 и немодифицированного ИФН-α2 в сравнении с теоретическими значениями | ||||
| Экспериментально обнаруженные пептиды [М+Н+]+ | Теоретические пептиды | |||
| ИФН-α2b | Коньюгат ПЭГ-ИФН | Масса [М+Н+]+ | Пептид | Последовательность |
| 1313.649 | - | 1313.6266 | 1-12 | CDLPQTHSLGSR |
| 1232.720 | 1232.673 | 1232.6966 | 13-22 | RTLMLLAQMR |
| 1076.598 | 1076.558 | 1076.5955 | 14-22 | TLMLLAQMR |
| 910.463 | 910.463 | 910.5066 | 24-31 | ISLF |