Лечение рака, комбинирующее лимфоистощающее вещество с цтл и цитокинами
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении рака. Способ включает получение исходных CD8+ T-клеток от субъекта, введение субъекту кладрибина; контактирование исходных CD8+ Т-клеток с ксеногенными антигенпредставляющими клетками, нагруженными одним или несколькими пептидными антигенами, генерируя посредством этого активированные цитотоксические Т-лимфоциты (ЦТЛ), которые нацелены на клетки, экспрессирующие указанные один или несколько пептидных антигенов. Затем субъекту вводят активированные ЦТЛ и, по меньшей мере, два цитокина, которые влияют на персистирование ЦТЛ. Использование изобретения позволяет повысить эффективность лечения за счет продления времени персистенции активированных ЦТЛ и снижения количества осложнений, а именно - оппортунистических инфекций. 9 з.п. ф-лы, 1 табл., 2 ил., 1 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка утверждает приоритет предварительной заявки США No. 60/778516, поданной 1 марта 2006.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам лечения рака у пациентов, включающим введение активированных цитотоксических Т-лимфоцитов, цитокинов, таких как IL-2 и IFN-α-2b, и кладрибина или денилейкин дифтитокса в качестве лимфоистощающего вещества.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Для облегчения понимания изобретения данный раздел можно рассматривать в качестве исторических и технических предпосылок, приведших к разработке изобретения, включающих наблюдения, заключения и точки зрения, которые могут быть присущими авторам. Соответственно положения предпосылок здесь не следует истолковывать в качестве допущения в отношении содержания прототипа.
Для лечения многообразия злокачественных новообразований был разработан ряд терапевтических схем. Многие из этих попыток были сконцентрированы вокруг химиотерапевтических режимов. В одном конкретном комбинированном химиотерапевтическом режиме, предназначенном для лечения метастатической меланомы, уровни ответа в 35-50% отмечались при «дартмутском режиме» (с комбинированием DTIC, цисплатина, BCNU и тамоксифена), однако продолжительность жизни выживших осталась в пределах от 6 до 10 месяцев. Также сообщалось о высоких уровнях достижения ремиссии при сильнодействующей высокодозовой интенсивной химиотерапии1 и насыщении гемопоэза при помощи аутогенного трансплантата костного мозга. Тем не менее усредненная продолжительность жизни была короткой, приблизительно четыре месяца2.
Значительные сдвиги в продолжительности жизни порядка нескольких лет были отмечены у небольшой части пациентов с меланомой, подвергшихся определенным видам иммунотерапии. Эти виды включают интенсивную специфическую иммунотерапию при помощи антиканцероматозной вакцины, а также использование неспецифических помощников иммунной системы, таких как интерлейкин-2 (IL-2) и интерферон-α (IFN-α).3-5
Идентифицирование распознаваемых Т-клетками опухолевых антигенов в меланоме привело к клинической проверке, которая выявляла раковые клетки путем попытки усиления антиген-специфического клеточного иммунного ответа. Такому подходу следовали в многочисленных стратегиях вакцинации, при которых антигены представляют в иммуногенном контексте в попытке индуцировать потенциальные Т-клеточные ответы in vivo. Несмотря на то, что в исследованиях с вакцинами были отмечены некоторые клинические ответы, величина вызванных Т-клеточных ответов была в большинстве случаев низкой или не определялась, и слабо коррелировала с клиническими ответами. Иммунизация меланомных пациентов раковыми антигенами может увеличивать число циркулирующих предшественников ЦТЛ; однако это не коррелировало с клинической регрессией опухоли, что дает возможность предположить нарушение функции или активации in vivo.
Исследования в модельных системах на мышах продемонстрировали, что адоптивная иммунотерапия, которая включает в себя in vitro-иммунизацию Т-клеток, специфических для одного или нескольких опухолевых антигенов, может быть эффективна при минимальной токсичности. Препятствием для применения этой стратегии для лечения опухолей человека стало выявление иммуногенных антигенов, которые представляют опухолевые клетки, чувствительные к ЦТЛ-обусловленному разрушению. Выделение реагирующих на опухоль Т-клеток из меланомы пациентов привело к идентифицированию некоторых опухолевых антигенов (эпитопов), на которые направлены ЦТЛ. Эти антигены включают тирозиназу, MART-1/Melan A, gp100 и MAGE. Из них тирозиназа и MART-1 экспрессируются в меланоме почти повсеместно и, таким образом, представляют требуемый выбор мишени для адоптивной иммунотерапии.
Адоптивная Т-клеточная терапия включает в себя извлечение Т-клеток из организма хозяина, где у онкологических больных активирован механизм индукции толерантности in vivo, и содействует неэффективным ответам, обнаруживаемым в этой популяции пациентов. CD8+ Т-клетки могут быть стимулированы ех vivo для образования антиген-специфических ЦТЛ (см., например, патент США No. 6225042). Ранее подходы адоптивной иммунотерапии использовали активированные лимфоциты в качестве терапии для всевозможных злокачественных новообразований.14 Первоначально использовали лимфокин-активированные клетки-убийцы (LAK), а впоследствии - противоопухолевые эффекторные лимфоциты (TIL), активированные ex vivo IL-2, однако доказательство эффективности было нечетким. Эти предварительные контролируемые клинические испытания оказались не в состоянии продемонстрировать преимущество в использовании ех vivo-активированных клеток перед непосредственным введением IL-2 больным меланомой. Более поздние исследования Yee et al. (Fred Hutchinson Cancer Research Center)15 и Dudley et al. (NCI)16 продемонстрировали возможность определенных подходов адоптивной Т-клеточной терапии. Эти исследования включали в себя использование либо клонов Т-клеток, специфических для MART-1 или gp100 и небольших доз IL-2, либо противоопухолевых эффекторных лимфоцитов, растущих ex vivo с аллогенными питающими клетками и высокими дозами IL-2. Данные исследования подтвердили, что адоптивная иммунотерапия оправдывает надежды на лечение рака, хотя ее полноценному развитию препятствовал недостаток воспроизводимых способов для образования ex vivo терапевтических количеств антиген-специфических CD8+ ЦТЛ.17
Цитолитические клетки CD8+T представляют собой главную линию защиты от вирусной инфекции. СD8+-лимфоциты специфически распознают и лизируют клетки организма-хозяина, которые инфицированы вирусом. Несмотря на то, что было желательно обуздывать цитотоксическую активность ЦТЛ, в распоряжении имелось незначительное число методик in vitro/ex vivo для специфического активирования ЦТЛ. Идентифицирование ключевых ассоциированных с меланомой антигенов и способа специфической in vitro-активации ЦТЛ позволяет эффективно оценивать адоптивную иммунотерапию метастатической меланомы.15-18
Несмотря на то, что существует возможность использования естественных антиген-представляющих клеток (АРС) для активации CD8+ in vitro (например, дендритные клетки, макрофаги, аутологичные опухолевые клетки), эффективность активации является невысокой, поскольку молекулы МНС Класса I природных АРС содержат много других пептидных эпитопов, что предполагает поэтому минимальную представленность ассоциированных с опухолью пептидных эпитопов. Большинство из этих представленных пептидов являются нормальными, безвредными эндогенными белками. Более прямым подходом к этой проблеме могла бы быть специфическая активация CD8+ Т-клеток к тем эпитопам, которые имеют отношение к противодействию заболеванию, в данном конкретном случае ассоциированным с меланомой антигенам.
Недавно, с использованием эмбриональной линии клеток Drosophila melanogaster (плодовая мушка) была разработана искусственная АРС, которая экспрессирует молекулы Класса I главного комплекса гистосовместимости (МНС).18,19 См. также патенты США No. 6225042 и 6355479. Из-за отсутствия развитой иммунной системы у насекомого Drosophila нет пептидного транспортера ТАР-1,2, который у человека вовлечен в нагружение пептидных эпитопов на молекулы Класса I. В результате трансфицированные молекулы Класса I появляются на поверхности клеток Drosophila в качестве незаполненных резервуаров. При инкубации этих трансфицированных клеток Drosophila с экзогенными синтетическими пептидами, которые связываются со специфическими молекулами Класса I (т.е. Т-клеточные пептидные эпитопы опухолевых антигенов), все доступные молекулы Класса I могут быть заняты МНС-рестриктированным, специфическим пептидным эпитопом(ами). Высокая плотность экспрессии молекул Класса I, представляющих одиночные или множественные эпитопы, и добавление ключевых ко-стимулирующих молекул В7-1 (CD80), CD70, LFA-3 (CD58) и ICAM-1 (CD54) на этих АРС Drosophila может обеспечивать образование in vitro эффективных, аутологичных цитотоксических CD8+ Т-клеток, которые являются специфическими для антигенных пептидов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Различные общие аспекты и предпочтительные варианты осуществления по изобретению отражены в пунктах формулы изобретения, прилагаемой к данному описанию, которые приводятся здесь в качестве ссылки. Другие предпочтительные варианты осуществления, особенности и преимущества различных аспектов по изобретению станут наглядными из приведенного ниже подробного описания, представленного вместе с чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует цитолитическую активность образованных ex vivo ЦТЛ, направленных против нагруженных пептидами клеток-мишеней. Выделеннные из меланомы пациента CD8+ Т-клетки были иммунизированы in vitro АРС Drosophila, нагруженными пятью различными ассоциированными с меланомой пептидными эпитопами. Активированные CD8+ Т-клетки культивировали in vitro с использованием IL-2 и IL-7 для селективного размножения меланома-специфических ЦТЛ. Активность оценивали по специфическому лизису 51Cr-меченных Т2-клеток-мишеней, индивидуально нагруженных каждым пептидом (Tyr-1689, Tyr-2792, gp100-1817, gp100-2853 или MART-1819 в сравнении с Т2-клетками, нагруженными контрольным пептидом HLA-A2).
Фигура 2 предоставляет схематическую иллюстрацию двух предпочтительных вариантов осуществления режимов лечения по изобретению наряду с контрольным режимом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ЕГО ОСУЩЕСТВЛЕНИЯ
Различные аспекты изобретения проиллюстрированы ниже путем подробного описания специфических и предпочтительных вариантов осуществления. Для краткости раскрытие всех патентов и других цитируемых публикаций приведены здесь в качестве ссылки. Если не определено особо здесь или не очевидно из контекста, все применяемые здесь технические и научные термины имеют то же значение, что и при повсеместном использовании в данной области.
Термины «включающий», «охватывающий» и «содержащий» используются здесь в их прямом, неограниченном значении. Терапевтические режимы по изобретению, которые включают введение ЦТЛ, активированных в результате контактирования хАРС, нагруженных выбранным пептидом, с цитокинами и, по меньшей мере, одним лимфоистощающим веществом, выбранным из кладрибина и DAB-IL2, могут быть использованы для лечения рака у субъекта, нуждающегося в таком лечении. Предпочтительно рак выбран из злокачественной меланомы, множественной миеломы, рака предстательной железы, лимфомы, неходжкинской лимфомы, лейкемии, острого лимфобластного лейкоза, острого миелолейкоза, хронического лимфоцитарного лейкоза, хронического миелолейкоза, лимфосаркомы Беркитта, рака щитовидной железы, рака тела матки, рака почки, рака яичника, рака легкого, рака молочной железы, рака печени, рака поджелудочной железы, рака предстательной железы, колоректального рака, рака кожи, рака желудка и рака шейки матки.
Таким образом, в одном предпочтительном варианте осуществления изобретение предоставляет режим адоптивной ЦТЛ-терапии для лечения или облегчения течения метастатической меланомы, включающий: получение первичных CD8+ Т-клеток от субъекта; контактирование первичных CD8+ Т-клеток с ксеногенными антиген-представляющими клетками (хАРС), нагруженными выбранным пептидным антигеном, в связи с чем образуются активированные ЦТЛ, которые выявляют клетки, экспрессирующие выбранный пептидный антиген; введение активированных ЦТЛ обратно субъекту; введение, по меньшей мере, одного лимфоистощающего вещества, выбранного из кладрибина и DAB-IL2; и введение, по меньшей мере, двух цитокинов, которые влияют на персистенцию ЦТЛ. Режим адоптивной ЦТЛ-терапии предпочтительно использует аутологичные CD8+ Т-клетки, активированные ex vivo, которые при активировании и введении субъекту в соответствии с изобретением способны к разрушению in vivo опухолевых клеток, содержащих ассоциированные с раком антигенные эпитопы.
Термин «субъект» в данном контексте относится к пациенту-млекопитающему, нуждающемуся в лечении рака. Например, субъект может быть человеком с выявленной меланомой, такой как развившаяся злокачественная метастатическая меланома, например пациент, который диагносцирован как HLА-А2-положительный и имеет нерезектабельное заболевание III/IV стадии.
Агент, включающий ЦТЛ, изготовляют из хАРС. Типичные ксеногенные антиген-представляющие клетки (хАРС), которые пригодны для использования, могут включать следующие компоненты: экзогенная молекула МНС I; одна или более экзогенных вспомогательных молекул для содействия активации исходных Т-клеток; и клетки хозяина, способные экспрессировать на своей поверхности экзогенные молекулы. Предпочтительно экзогенные молекулы кодируются экзогенной нуклеиновой кислотой, введенной в клетки хозяина. хАРС также предпочтительно экспрессируют экзогенные ко-стимуляторы и молекулы адгезии, которые усиливают способность Т-клеточной активации хАРС. Предпочтительно клетки хозяина представляют собой клетки насекомого, более предпочтительно клетки Drosophila, такие как клетки Schneider 2 (S2). Типичные хАРС и способы их получения описаны, например, в патентах США No. 6225042 и 6355479.
хАРС могут быть нагружены пептидным антигеном множеством способов, известных и доступных для использования в данной области. Выбирают пептиды, которые способны связываться с ненагруженными молекулами МНС Класса I. Выбранные пептиды предпочтительно соответствуют эпитопам, включающим антигенные или иммуногенные аминокислотные последовательности, полученные из белка, экспрессированного на поверхности клеток, которые могли бы служить в качестве мишеней для Т-клеток, используемых в адоптивной ЦТЛ-терапии. Для загрузки незаполненных молекул МНС Класса I выбранным пептидом один или более видов антигенных или иммуногенных пептидов, которые связываются с такими незаполненными молекулами МНС Класса I, могут контактировать с хАРС при соответствующих условиях для осуществления связывания.
Можно выбрать один или более видов антигенных или иммуногенных пептидов. В случае выбора более одного вида они могут контактировать с хАРС одновременно или по-отдельности, что приводит к образованию на хАРС мультиантигенных или мультииммуногенных МНС-пептидных комплексов.
Загрузка выбранным пептидом незаполненных молекул МНС предпочтительно происходит при условиях, которые почти соответствуют биологическим условиям связывания, которые могут быть аппроксимированы in vitro, ex vivo или in vivo. У выбранных пептидов любой специалист может рассматривать один или несколько факторов, таких как термодинамические, электростатические, энергетические и энтропийные соображения, а также специфические аминокислоты внутри выбранных пептидов, которые необходимы для эффективного присоединения к молекулам МНС.
Предпочтительные пептиды включают, например, пептиды, представляющие собой аминокислотные последовательности, выбранные из белка тирозиназы, белка gp100 и белка MART-1. Другие предпочтительные пептиды включают YMNGTMSQV (SEQ ID NO:1), YMDGTMSQV (SEQ ID NO:2), AAGIGILTV (SEQ ID NO:3), ITDQVPFSV (SEQ ID NO:4), YLEPGPVTA (SEQ ID NO:5) и KTWGQYWQV (SEQ ID NO:6). Дополнительные типичные пептиды, которые можно выбрать, включают, например, следующие аминокислотные последовательности, где белок, из которого получен каждый пептид, указан в скобках: SILSLKEAST (С-лектин; SEQ ID NO:70), KMASRSMRL (С-лектин; SEQ ID NO:71), ALALAALLVV (Рес60; SEQ ID NO:72), ALLVVDREV (Рес60; SEQ ID NO:73), YMNGTMSQV (Тирозиназа; SEQ ID NO:74), YMDGTMSQV (Тирозиназа; SEQ ID NO:75), ITDQVPFSV (gp100; SEQ ID NO:7), YLEPGPVTA (gp100; SEQ ID NO:8), AAGIGILTV (MART-1; SEQ ID NO:9), ELAGIGILTV (MART-1; SEQ ID NO:10), CLTSTVQLV (Her-2/neu; SEQ ID NO:11), HLYQGCQVV (Her-2/neu; SEQ ID NO:12), KIFGSLAFL (Her-2/neu; SEQ ID NO:13), IISAVVGIL (Her-2/neu; SEQ ID NO:14), PLTSIISAV (Her-2/neu; SEQ ID NO:15), VMAGVGSPYV (Her-2/neu; SEQ ID NO:16), VLVKSPNHV (Her-2/neu; SEQ ID NO:17), ELVSEFSRM (Her-2/neu; SEQ ID NO:18), YLSGANLNL (CEA; SEQ ID NO:19), GPLTPLPV (AES; SEQ ID NO:20), SLLMWITQC (NY-ESO-1; SEQ ID NO:21), KALFAGPPV (CA-125; SEQ ID NO:22), YLETFREQV (CA-125; SEQ ID NO:23), GLQSPKSPL (CA-125; SEQ ID NO:24), VLLKLRRPV (CA-125; SEQ ID NO:25), ELYIPSVDL (CA-125; SEQ ID NO:26), SLLMWITQV (NY-ESO-1; SEQ ID NO:27), ILAKFLHWL (Теломераза; SEQ ID NO:28), STAPPVHNV (MUC-1; SEQ ID NO:29), FLWGPRALV (MAGE-3; SEQ ID NO:30), FMWGNLTLA (CA-125; SEQ ID NO:31), RLVDDFLLV (Теломераза; SEQ ID NO:32), HLSTAFARV (G250; SEQ ID NO:33), QLSLLMWIT (NY-ESO-1; SEQ ID NO:34), ELWTHSYKV (FBP; SEQ ID NO:35), KVAELVHFL (MAGE-3; SEQ ID NO:36), YIFATCLGL (MAGE-3; SEQ ID NO:37), HLYIFATCL (MAGE-3; SEQ ID NO:38), MLMAQEALAFL (CAMEL; SEQ ID NO:39), STLEKINKT (SSX-4; SEQ ID NO:40), KASEKIFYV (SSX-2; SEQ ID NO:41), SLLMWITQCFL (NY-ESO-1; SEQ ID NO:42), ELTLGEFLKL (Сурвивин; SEQ ID NO:43), LTLGEFLKL (Сурвивин; SEQ ID NO:44), SLLEKREKT (SP17; SEQ ED NO:45), TLGEDDPWL (SART-1; SEQ ID NO:46), KLGLKPLEV (SART-1; SEQ ID NO:47), YLWTSAKNT (SCP-1; SEQ ID NO:48), STAPPAHGV (MUC-1; SEQ ID NO:49), GMGSEELRL (LIVIN; SEQ ID NO:50), SLGSPVLGL (LIVIN; SEQ ID NO:51), YLFFYRKSV (hTRT; SEQ ID NO:52), CQQEETFLL (CA-125; SEQ ID NO:53), TLAKFSPYL (PRAME; SEQ ID NO:54), NLTHVLYPV (PRAME; SEQ ID NO:55), STFKNWPFL (Сурвивин; SEQ ID NO:56), SLLQHLIGL (PRAME; SEQ ID NO:57), FLDQRVFFV (gp100; SEQ ID NO:58), FLDQRVFVV (gp100; SEQ ID NO:59), FLDQVAFVV (gp100; SEQ ID NO:60), GLDREQLYL (MUC-16; SEQ ID NO:61), VMQHLLSPL (MUC-16; SEQ ID NO:62), QQTHGITRL (MUC-16; SEQ ID NO:63), LQPLSGPGL (MUC-16; SEQ ID NO:64), TLDRDSLYV (MUC-16; SEQ ID NO:65), QLYLELSQL (MUC-16; SEQ ID NO:66), KVLEYVIKV (MAGE-1; SEQ ID NO:67), KVADLVGFL (MAGE-1; SEQ ID NO:68) и KTWGQYWQV (SEQ ID NO:69).
Выбранные пептиды могут быть представлены клеткам с помощью множества средств и способов, известных в данной области. Выбранные пептиды могут быть представлены способом, который позволяет им входить в состав внутриклеточного пула пептидов. Например, пептиды могут быть представлены с помощью осмотической загрузки. Предпочтительно пептиды добавляют к системной культуральной среде для хАРС. Пептиды можно добавлять к культуральной среде в виде интактного полипептида или белка, который последовательно деградирует в результате клеточных процессов, таких как, например, ферментативная деградация. Альтернативно интактный полипептид или белок может деградировать с помощью некоторых других средств, таких как химическое расщепление (например, цианогенбромид) или протеазы (например, трипсин и химотрипсин), перед добавлением к системной культуральной среде для хАРС. Альтернативно полная белковая или полипептидная последовательность может быть клонирована в соответствующий вектор и помещена в прокариотическую клетку, в результате чего клетка образует значительные количества антигенных полипептидов, которые затем собирают, очищают и расщепляют на пептиды, которые затем добавляют к системной культуральной среде для хАРС.
Достаточное количество каждого из выбранных пептидов можно добавить к клеточной культуре для предоставления возможности молекулам МНС Класса I связываться и в дальнейшем представлять высокую плотность пептида на поверхности экспрессирующих МНС Класса I клеток человека.
хАРС можно проверить на усиление функции АРС по сравнению с функцией АРС неэкзогенных или эндогенных антиген-представляющих клеток. Усиленную функцию АРС можно определить путем измерения любого из множества параметров CD8+ Т-клеточной активации, такого как, например, уровень экспрессии одного или нескольких белков клеточной поверхности, который свидетельствует об активации CD8+ Т-клеток, такие как экспрессия CD69 клеточной поверхности, уровень дифференцировки, уровень цитотоксической киллерной способности, уровень специфического клеточного лизиса и уровень продуцирования цитокинов.
Очистку белков и пептидов можно осуществлять при помощи различных методик, которые известны в данной области, таких как иммуноаффинная хроматография, аффинная хроматография, преципитация белка, смены буферов, ионообменная хроматография, хроматография гидрофобного взаимодействия, гель-фильтрация. Антиген-стимулированные ЦТЛ можно детектировать и выделять при помощи пептид-МНС рМНС тетрамерного окрашивания, где выявленные ЦТЛ являются специфическими для выбранного пептида, представленного хАРС.
Лейкоциты периферической крови (PBL) получают от субъекта, и предпочтительно в значительной степени очищают. Для этих целей можно применять способы очистки PBL, включая способы с использованием градиентов фиколла. Очищенные PBL затем смешивают с клетками хАРС, предварительно инкубированными с соответствующими антигенными пептидами. Предпочтительно PBL очищают при помощи систем очистки с магнитными бусами, которые известны в рассматриваемой области, такие как Miltenyi beads (Myltenyi Biotec) и Dynabead systems (Dynal Biotech). PBL также можно очищать при помощи методик сортировки клеток, таких как способы на основе использования клеточного сортера с возбуждением флуоресценции, или других подходящих приемов и методик клеточного сортинга. В таких способах сортировки клеток или сортинга эритроцитов в качестве маркера для различных клеточно-специфических белков используется зеленый флуоресцентный белок (GFP).
Первичные Т-клетки инкубируют в культуре с соответствующими хАРС и нагружают выбранным пептидом в течение периода времени, достаточного для активации и дополнительного обогащения популяцией СD8+-клеток. Например, патент США No. 4690915 описывает способ получения большого числа лимфоцитов при помощи лимфоцитофереза. Предпочтительно СD8+-клетки активируют антиген-специфическим образом. Соотношение покоящихся клеток или клеток-предшественников CD8+ (эффекторов) и антиген-представляющих клеток может варьировать от индивидуума к индивидууму и, кроме того, может зависеть от переменных характеристик, таких как подверженность лимфоцитов индивидуума условиям культивирования и природе и степени тяжести рака. Тем не менее предпочтительно, чтобы соотношение лимфоцит:антиген-представляющая клетка (например, клетка Drosophila) предпочтительно находилось в диапазоне примерно от 30:1 до 300:1. Например, в одном варианте осуществления смешивают 3×107 PBL человека и 1×106 живых клеток Drosophila и поддерживают в 20 мл культуральной среды RPMI 1640.
Культура эффекторов/антиген-представляющих клеток можно поддерживать сколь угодно долго для активации и обогащения популяции используемых для терапии или эффективного числа CD8+-клеток. При максимальном уровне активации специфических CD8+, наблюдаемом, как правило, после культивирования в течение от одного до десяти дней, например после пяти дней культивирования, предпочтительное время составляет от примерно трех до семи дней. В одном варианте осуществления по настоящему изобретению активацию in vitro CD8+ Т-клеток можно детектировать в течение короткого промежутка времени после трансфекции клеточной линии. В одном варианте осуществления временная экспрессия в трансфицированной линии клеток, способной активировать CD8+ Т-клетки, детектируется в течение 48 часов после трансфекции. Таким образом, для активации CD8+ Т-клеток эффективны либо стабильные, либо неустойчивые культуры трансформированных клеток, экспрессирующих молекулы МНС Класса I человека.
Активированные цитотоксические Т-лимфоциты можно эффективно отделить от хАРС (например, клеток Drosophila) с использованием подходящего способа, известного или доступного в рассматриваемой области. Например, моноклональные антитела, специфические для искусственных АРС, для пептидов, нагруженных на искусственные АРС, или для ЦТЛ (или их сегмента) могут быть использованы для связывания с их соответствующим комплементарным лигандом. Тагированные антителами клетки можно затем экстрагировать из смеси стимуляторных и эффекторных клеток любым из множества способов из рассматриваемой области, такими как, например, способы иммунопреципитации и иммунологического анализа. Альтернативно стадию разделения можно полностью опустить, и инактивированные хАРС можно оставить в культуре с активированными ЦТЛ.
Терапевтически эффективные, цитотоксические количества активированных ЦТЛ можно выбрать как подходящие для описанного применения in vitro и in vivo, например, в свете количества и типа клеток, которые представляют конечную мишень этих ЦТЛ-клеток. Количество следует также выбирать с учетом состояния пациента и может быть определено практикующим врачом путем рассмотрения всех соответствующих факторов. Предпочтительно примерно от 1×106 до приблизительно 1×1012, более предпочтительно примерно от 1×108 до приблизительно 1×1011 и даже более предпочтительно примерно от 1×109 до приблизительно 1×1010 активированных СD8+-клеток для применения у взрослых людей, по сравнению с примерно 5×106-5×107 клеток, используемых для мышей.
Предпочтительно активированные СD8+-клетки, которые являются ЦТЛ, собирают, как описано выше, из хАРС культуры перед введением ЦТЛ клеток подвергаемому лечению индивидууму. Система клеточной культуры предпочтительно не является опухолегенной. Таким образом, если полное разделение клеток Drosophila и активированных CD8+ клеток не достигается, это не должно быть неустранимым риском, связанным с введением малого числа клеток Drosophila.
Исходные CD4+ Т-клетки или CD8+ Т-клетки, или как CD4+ Т-клетки, так и CD8+ Т-клетки можно предпочтительно экстрагировать из субъекта перед инкубацией с культурами хАРС. Для сбора лейкоцитов субъекты могут подвергаться любой из множества известных или доступных методик разделения клеток крови (например, лейкаферезу).
Исходные Т-клетки можно отобрать у субъекта перед началом другого лечения или терапии, которое может препятствовать, ослаблять или, во всяком случае, ограничивать способы и применения специфической активации исходных Т-клеток, как предоставляется настоящим изобретением. Например, при лечении индивидуума с неоплазией или опухолью образцы исходных Т-клеток могут быть получены перед началом химиотерапевтического или радиационного лечения и поддерживаться в культуре. После активации исходных Т-клеток пептид-нагруженными хАРС исходные Т-клетки можно размножить и активировать, и активированные ЦТЛ можно вводить обратно субъекту. Альтернативно исходные Т-клетки могут быть активированы, и активированные ЦТЛ можно вводить обратно субъекту, от которого исходные Т-клетки были получены, перед, после или вместе с другими необязательными формами лечения, такими как химиотерапевтическая или радиационная.
Активированные ЦТЛ также можно суспендировать в соответствующем носителе для доставки и инфузии субъекту. Технические приемы повторного введения клеточных компонентов известны в данной области и включают методики, такие как представленные в качестве примера в патентах США Nos. 4844893 и 4690915. Например, можно использовать введение активированных ЦТЛ клеток с помощью внутривенной инфузии. Могут потребоваться множественные инфузии, и эти инфузии можно осуществлять в течение периода в несколько недель или более.
В режимах лечения по изобретению цитокины также вводят для достижения персистенции ЦТЛ и увеличения посредством этого времени полужизни, активности, эффективности и/или свойств селективности ЦТЛ, которые вводят субъекту. Такая персистенция может получаться в результате непосредственного действия на ЦТЛ или косвенного воздействия, которое включает в себя стимулирующую регуляцию экспрессии антигена на клетках-мишенях ЦТЛ. Предпочтительными цитокинами являются IFN-α-2b и IL-2.
Лимфоистощающие вещества кладрибин (2-CdA, Лейстатин®) и/или DAB IL-2 (ONTAK®) также вводят в режимы лечения по изобретению. Эти вещества не являются миелоаблативными и вызывают временную иммуносупрессию у субъектов, получающих ЦТЛ-терапию.
Расписание и продолжительность введения каждого из ЦТЛ, цитокина и лимфоистощающих веществ могут быть выбраны любым специалистом в рассматриваемой области на основе стандартной программы проведения опытов и этого руководства, включая приведенные ниже примеры.
Для иллюстрации различных аспектов и свойств по изобретению предоставлены следующие примеры.
ПРИМЕРЫ
Получение ЦТЛ ex-vivo
Линии ксеногенных АРС (хАРС) получают из клеток Schneider S2 (S2 клетки), которые были основаны в 1969 г. из нескольких сотен зародышей Oregon-R (дикого типа) Drosophila melanogaster (Oregon-R) в возрасте от 20 до 24 часов (АТСС CRL-1963), согласно опубликованным методикам (Schneider, J. Embryol. Morph. 27:353-365, 1972). Линия клеток S2 была определена на хранение в Американской коллекции типовых культур (CRL10974). Оригинальная поставка клеток S2, использованных для выведения линий клеток, из которых были выведены производные хАРС, получена из этого источника. Для образования хАРС клетки S2 трансфицируют векторами, производными от плазмидного вектора pRMHa-3 (см., например, патент США No. 6225042). Одну линию хАРС, обозначенную как клон А, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1 и ICAM-1. Вторую линию хАРС, обозначенную как клон В, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1, В7.2, ICAM-1 и LFA-3. Третью линию хАРС, обозначенную как клон С, трансфицируют векторами, кодирующими HLA-A2.1 Класса I, В7.1, ICAM-1, LFA-3, и CD70. Таким образом, клон А экспрессирует HLA-А2, В7.1 и ICAM-1, клон В экспрессирует HLA-A2.1 Класса I, В7.1, В7.2, ICAM-1 и LFA-3, и клон С экспрессирует HLA-A2.1 Класса I, В7.1, ICAM-1, LFA-3, и CD70.B7.2 и LFA-3.
Независимые непрерывные культуры клеток, происходящих от клона А и клона В, поддерживают в среде Schneider с добавлением 10% фетальной телячьей сыворотки и 500 мкг/мл генетицина (G418) и разводят два раза в неделю свежей средой, добавляемой во время каждого разделения, с доведением клеточной плотности до приблизительно 1×106 клеток/мл. Приблизительно за один день перед индукцией (день от -2 до -4; день 0 определен как день тестирования у клеток экспрессии экзогенных молекул и нагружения пептидом), 3×Т75-флаконов инокулируют объемом клеточной суспензии, подерживаемой в стоковой культуре, эквивалентным 1,5×107 клеток/флакон. Полную среду Drosophila-SFM без G418 добавляют для доведения объема до 15 мл/флакон. Флаконы затем инкубируют в камере при приблизительно 27°С. Приблизительно на -1 ÷ -3 день клетки затем индуцируют добавлением сульфата меди (CuSO4) до конечной концентрации 1,0 мМ (разведение 1:200 200 мМ стока CuSO4; 75 мкл CuSO4 в каждый Т75 флакон, содержащий 15 мл клеточной суспензии) и возвращают в камеру с 27°С. Время индукции составляет приблизительно от 24 до 72 часов.
В день 0 флаконы, содержащие индуцированные клеточные культуры, проверяют визуально и при помощи микроскопа для контроля контаминации. Содержимое незагрязненных флаконов объединяют в пул и подсчитывают жизнеспособные клетки. Образцы объединенных клеточных культур в приблизительно 6×106 клеток оценивают при помощи проточной цитометрии с использованием анализа в клеточном сортере с возбуждением флуоресценции (FACS) для определения уровня экспрессии экзогенных молекул. Клеточные культуры (приблизительно 1×107 клеток/мл) затем тестируют для проверки экспрессии экзогенных HLA-A2.1, В7.1 и ICAM-1 (для клеток клона А) или HLA-A2.1, В7.1, В7.2, ICAM-1 и LFA-3 для клеток клона В) перед нагружением пептида. После проверки экспрессии экзогенных молекул каждую клеточную культуру промывают при помощи раздела каждой культуры на части в две стерильные конические пробирки емкостью 50 мл. Каждую пробирку затем заполняют средой HYQ SFX-Insect (Hyclone) и центрифугируют при 1700 об./мин (600×g) в течение приблизительно семи минут для осаждения клеток. Супернатанты отбирают, и пробирки, содержащие клеточный осадок, снова центрифугируют при 1700 об./мин (600×g) в течение приблизительно одной минуты. Супернатанты удаляют при помощи пипетки с тонким наконечником. Осадки из каждой разделенной клеточной культуры затем воссоединяют и ресуспендируют в 8 мл среды SFX Insect до клеточной плотности приблизительно 1×107 клеток/мл. Приблизительно 40 мкл стокового раствора β2-микроглобулина с 1,0 мг/мл и 24 мкл разведения 1:50 стокового раствора пептидов combo с 1,67 мг/мл для каждого пептида добавляют к каждой ресуспендированной культуре. Таким образом, каждая суспензия клеточной культуры содержит β2-микроглобулин в конечной концентрации приблизительно 5 мкг/мл и каждый выбранный пептид, предназначенный для нагружения на хАРС, с конечной концентрацией приблизительно 0,1 мкг/мл на пептид. Клеточные культуры инкубируют в суспензии, содержащей β2-микроглобулин и пептиды, в течение, по меньшей мере, четырех часов и не более восьми часов, с мягким круговым взбалтыванием каждые 30 минут при комнатной температуре. После периода пептидной инкубации аликвоты по приблизительно 1 мл из каждой клеточной культуры распределяют по отдельности в восемь полипропиленовых пробирок (Falcon 2006). Любую оставшуюся суспензию клеточной культуры выбрасывают.
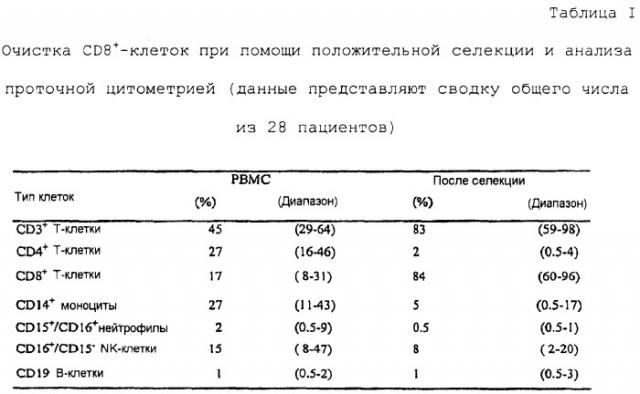
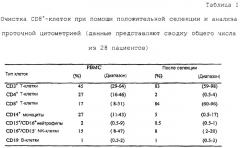
СD8+-клетки, выделенные из лейкаферезных образцов путем позитивной селекции с антителами против CD8, стимулировали в отношении ассоциированных с меланомой пептидов человека (тирозиназа-689369-377, тирозиназа-792369-377, MART-1-81927-35, gp100-817209-217, gp100-818280-288 и gp100-853154-162), представленных клетками Drosophila, экспрессирующими молекулы Класса I и молекулы кo-стимуляции/адгезии человека HLA-A2.1, B7.1, CD70, LFA-3 и ICAM-1. CD8+-клетки повторно стимулируют двумя раундами аутологичными моноцитами (импульсами с описанными эпитопами) в присутствии IL-2 и IL-7. Число эффекторных клеток затем увеличивают неспецифической стимуляцией моноклональными антителами к CD3 в присутствии гамма-облученных аутологичных питающих клеток и IL-2. Активность цитотоксических T-лимфоцитов измеряют в отношении пептид-нагруженных T2-клеток и панели клеток меланомы, тогда как чистоту in vitro-стимулированных CD8+ Т-клеток оценивают при помощи проточной цитометрии.
Материалы.
| Линия клеток | Источник |
| Drosophila S2 | АТСС |
| Malme 3 | АТСС (нормальные фибробласты кожи из меланомы пациента) |
| Malrac 3М | АТСС (метастатическая меланома легких, тот же пациент, что и Malme 3) |
| М14 | UCSD; смотри US 5,208,146 и Cahan et al., PNAS USA 1982, vol.79(24), pp.7629-7633 (HLA-A2.1 меланома человека) |
| 01-KN | J&JPRD; см. US 2004-0071671 (меланомная линия клеток HLA-A2.1, отрицательный на антигены меланомы) |
| К562 | АТСС (Эритролейкозная линия клеток человека; мишень для NK-клеток) |
| Т2-клетки | АТСС (Гибрид В- и Т-лимфобласта человека. Класс II-отрицательный) |
Реагенты
rhIL-7. Рекомбинантный интерлейкин-7 (IL-7) человека представляет собой лимфокин, производимый в Е.coli и очищенный при помощи подающего устройства (PeproTech) с использованием высокоэффективной жидкостной хроматографии (HPLC), а не антител. IL-7, полученный в качестве порошка, растворяют в стерильном DPBS, содержащем 1% сывороточного альбумина человека. Основной объем раствора затем фильтруют через фильтр 0,2 мкм, аликвоты (30000 Ед./мл, 1000Х концентрация) разливают в стерильные флаконы и хранят при -80°С перед использованием.
rhIL-2. Рекомбинантный интерлейкин-2 (IL-2) человека производится по технологии рекомбинантной ДНК и поставляется Chiron Corporation (Proleukin®). IL-2, полученный в качестве порошка, растворяют в IL-2-разбавителе (0,5% сывороточного альбумина человека в 50 мМ уксусной кислоте), фильтруют через фильтр 0,2 мкм, аликвоты (20000 Ед./мл, 1000Х концентрация) разливают в стерильные флаконы и хранят при -80°С перед использованием.
Пептид тирозиназы YMNGTMSQV (SEQ ID NO:1). Пептид тирозиназы (tyr 369-377), соответствующий аминокислотам 369-377 тирозиназы человека, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Порошок пептида, полученный от производителя (Synpep Corporation), растворяют в диметилсульфоксиде (DMSO) для получения стокового пептидного раствора с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием. Этот стоковый пептидный раствор смешивают в равных частях с другими пептидными стоковыми растворами (также с концентрацией 10 мг/мл) для образования комбинированных пептидных растворов для использования при нагружении хАРС. Комбинированные пептидные растворы разливают аликвотами в стерильные флаконы в камере с очищаемым воздухом Класса 10000 в стерильных условиях в застекленном шкафу биологической безопасности Класса II.
Пептид тирозиназы YMDGTMSQ (SEQ ID NO:2). Деамидированную форму описанного выше пептида tyr 369-377, которая содержит остаток аспарагиновой кислоты вместо остатка аспарагина в третьем положении пептида, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Эту диамидированную форму называют tyr 369-377d. Порошок пептида, полученный от производителя, растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хранят при температуре от -72°С до -88°С перед использованием.
Пептид gp100 ITDQVPFSV (SEQ ID NO:4). Пептид gp100 (gp100209-217), соответствующий аминокислотам 209-217 gp100 человека, производят и очищают с использованием стандартов соответствия GLP (Synpep Corporation). Порошок пептида растворяют в диметилсульфоксиде (DMSO) для получения стокового раствора пептида с концентрацией 10 мг/мл и хран