Способ получения налтрексона
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности, а именно к способу получения производного оксиморфона-налтрексона, являющегося опиатным антагонистом опиатов, обработкой налоксона диазометаном в присутствии ацетата палладия. Способ исключает использование труднодоступных и дорогих исходных соединений и характеризуется простотой выполнения. 3 пр.
Реферат
Изобретение относится к способу получения лекарственного препарата 17-(циклопропилметил)-4,5а-эпокси-3,14-дигидроксиморфинан-6-она (на-лтрексона) формулы (I)
Налтрексон является лекарственным препаратом (Машковский М.Д. Лекарственные средства. Изд.15 / Москва: Новая Волна, 2006. - С.157; Modesto-Lowe V., Van Kirk J. Clinical Uses of naltrexone: A review of the evidence. // Exp. Clin. Psychopharm. - 2002 - v.10. - p.213-227). По фармакологическому действию налтрексон отличается тем, что он является «чистым» опиатным антагонистом, лишенным побочных эффектов морфина.
Основной способ получения налтрексона описан в (The Organic Chemistry of Drug Synthesis. Vol.1, John Wiley&Sons, New-York, 1990. - p.289-291;
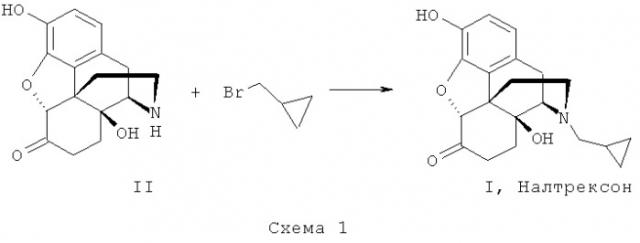
Blumberg H., Pachter I.J. US Pat. 3.332.950 (1967)) и включает целый ряд последовательных стадий: окисление тебаина с получением 14-гидроксикодеинона; его гидрирование до оксикодона; последовательное деалкилирование метальных групп у фенильного кольца [оксиморфон] и атома азота с получением нороксиморфона (II). Налтрексон получают N-алкилированием нороксиморфона (II) циклопропилметилбромидом.
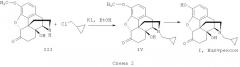
В патенте (РФ 2236412; СА, 141, 260924, 2005) описан способ получения налтрексона (I) из кодеина. Способ также включает ряд стадий: окисление кодеина до кодеинона; превращение кодеинона в диенолацетат кодеинона; окисление диенолацетата в 14-гидроксикодеинон; гидрирование 14-гидроксикодеинона до 14-гидроксикодона; силилирование гексаметилдисилазаном с получением 14-триметилсилоксикодона; деалкилирование 14-триметилсилоксикодона по атому азота действием бромциана с получением 17-нороксикодона (III). Конечные стадии процесса предусматривают N-алкилирование (III) хлорметилциклопропаном с получением метилового эфира налтрексона (IV) и O-деметилирование метилового эфира налтрексона (IV) с получением (I).
Недостатком обоих способов получения налтрексона, приведенных на схемах 1 и 2, является использование труднодоступных и дорогих соединений - бромметилциклопропана или хлорметилциклопропана. Их получают либо с использованием металлоорганических соединений (US 3959324), либо восстановлением алюмогидридом лития циклопропанкарбоновой кислоты (US 3454575) и последующим бромированием смесью брома и трифенил-фосфина (US 6008420), то есть также с использованием малодоступных соединений.
Задачей изобретения является создание технологичного и экономичного способа получения налтрексона, позволяющего исключить использование труднодоступных циклопропилметилгалогенидов.
Поставленная задача решается способом получения налтрексона обработкой доступного 17-аллил-4,5а-эпокси-3,14-дигидроксиморфинан-6-она (налоксона) диазометаном в присутствии ацетата палладия.
Препарат налоксон [гидрохлорид 17-аллил-4,5а-эпокси-3,14-дигидроксиморфинан-6-она] (V) выпускается фармацевтической промышленностью и представляет собой производное нороксиморфона, содержащее аллильную группу на атоме азота. Для его получения используется легкодоступный бромистый аллил, который производится крупным тоннажом в промышленном масштабе. Вследствие этого налоксон (V) является сравнительно доступным препаратом.
Синтез налтрексона (I) проводят обработкой налоксона (V) диазометаном в присутствии ацетата палладия. В процессе реакции происходит катализируемое палладием образование карбена (СН2:), который легко присоединяется по двойной связи аллильной группы с образованием циклопропил-метильной группы, то есть налтрексона. Палладий, используемый в синтезе, выступает в качестве катализатора и в процессе реакции полностью выделяется из реакционной массы в виде палладиевой черни. Это позволяет заново переводить его в ацетат и многократно использовать в синтезах. Проведение реакции в отсутствии катализатора (ацетата палладия) приводит к образованию трудноразделимой смеси целевого продукта и побочных продуктов.
Диазометан, используемый в предлагаемом способе, является широкоизвестным и доступным реагентом, который обычно получают действием щелочи на нитрозометилмочевину, нитрозометилуретан, нитрозометилбензамид и тому подобные нитрозопроизводные метиламина (Физер Л., Физер М. Реагенты для органического синтеза / Пер. с англ. Т.1. - М., 1970. - С.242-248).
Таким образом, применение разработанного метода позволяет исключить использование труднодоступных и дорогостоящих циклопропилметил-галогенидов и существенно снизить себестоимость получения целевого продукта.
Примеры, иллюстрирующие изобретение.
Приготовление эфирного раствора диазометана из нитрозометил-мочевины (Беккер Г., Бергер В., Домшке Г. и др. Органикум / Пер. с нем. Т.2. - М., 1979. - С.247-248).
В колбу Эрленмейера помещают 35 мл холодного 40%-го водного раствора гидроокиси калия и 50 мл эфира. Затем, постоянно встряхивая колбу, небольшими порциями прибавляют 0,5 моль нитрозометилмочевины при температуре не выше 5°С. Через 10 мин после внесения последней порции сливают желтый эфирный раствор диазометана в плоскодонную колбу, добавляют еще 50 мл охлажденного до 5°С эфира, вновь сливают, операцию повторяют с 50 мл эфира. Объединенные эфирные растворы диазометана сушат не более 2 ч над небольшим количеством едкого кали. Полученный раствор используют в синтезе налтрексона без какой-либо очистки.
Получение налтрексона
К раствору 0,78 г налоксона (V) в 50 мл безводного хлористого метилена добавляют 1 г ацетата палладия. Затем постепенно прикалывают эфирный раствор диазометана. Наблюдаются интенсивное выделение азота и образование устойчивой желтой окраски раствора и осадка палладиевой черни. После прикапывания всего раствора диазометана (выделение азота продолжается в течение всего времени) в реакционную смесь добавляют 50 мл хлористого метилена, перемешивают еще 30 мин, оставляют на ночь для полного выпадения палладиевой черни. Реакционную смесь декантируют с осадка, фильтруют через слой окиси алюминия (10 г), раствор упаривают на роторном испарителе, остаток (0,95 г) растворяют при нагревании в трет-бутилметиловом эфире. При охлаждении отфильтровывают 0,82 г осадка (Т.пл. 162-168°С). Перекристаллизация из этилацетата дает 0,64 г (78%) налтрексона (I), Т.пл. 167-169°С.
Получение налтрексона без ацетата палладия
К раствору 0,78 г налоксона (V) в 50 мл безводного хлористого метилена постепенно прикалывают эфирный раствор диазометана. Наблюдается выделение азота и образование устойчивой желтой окраски раствора. После прикапывания всего раствора диазометана (выделение азота продолжается в течение всего времени) в реакционную смесь добавляют 50 мл хлористого метилена, перемешивают еще 30 мин, оставляют на ночь для завершения выделения азота. Реакционную смесь упаривают на роторном испарителе досуха. Полученный остаток по данным высокоэффективной жидкостной хроматографии содержит смесь продуктов (в основном, исходный налоксон) с содержанием налтрексона около 10%.
Способ получения 17-(циклопропилметил)-4,5α-эпокси-3,14-дигидроксиморфинан-6-она формулы (I) ,отличающийся тем, что целевой продукт получают обработкой 17-аллил-4,5α-эпокси-3,14-дигидроксиморфинан-6-она диазометаном в присутствии ацетата палладия.