Анти-тат226 антитела и иммуноконъюгаты
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой варианты моноклональных анти-ТАТ226 антител, их иммуноконъюгаты и фармацевтические композиции. Антитела по изобретению могут эффективно применяться для ингибирования пролиферации опухолевых клеток. 6 н. и 35 з.п. ф-лы, 22 ил., 3 табл., 4 пр.
Реферат
По данной заявке испрашивается приоритет предварительной заявки США № 60/783746, поданной 17 марта 2006 года, описание которой включено в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к анти-TAT226 антителам и их иммуноконъюгатам. Изобретение дополнительно относится к способам применения анти-TAT226 антител и их иммуноконъюгатов.
УРОВЕНЬ ТЕХНИКИ
Антитела, которые связываются с полипептидами, экспрессируемыми на поверхности раковых клеток, оказались эффективными в способах противораковой терапии. Такие антитела действуют посредством разнообразных механизмов, включающих, например, активацию антителозависимой клеточно-опосредованной цитотоксичности (ADCC), индукцию антителом комплементзависимой цитотоксичности (CDC), усиление высвобождения цитокинов и индукцию апоптоза. См., например, Cardarelli et al. (2002) Cancer Immunol. Immunother. 51:15-24. Например, ГЕРСЕПТИН® и РИТУКСАН® (оба от Genentech Inc., South San Francisco, California) представляют собой антитела, которые успешно применяют для лечения рака молочной железы и неходжкинской лимфомы соответственно. ГЕРСЕПТИН® представляет собой полученное на основе рекомбинантной ДНК гуманизированное моноклональное антитело, которое селективно связывается с внеклеточным доменом протоонкогена рецептора 2 (HER2) эпидермального фактора роста человека. Сверхэкспрессию белка HER2 наблюдают в 25-30% первичных форм рака молочной железы. РИТУКСАН® представляет собой генно-инженерное химерное моноклональное антитело мыши/человека, направленное против антигена CD20, обнаруженного на поверхности нормальных и злокачественных B-лимфоцитов. Оба этих антитела получают рекомбинантным способом в клетках CHO. Предполагают, что ГЕРСЕПТИН® действует, по меньшей мере, частично, путем ингибирования ангиогенеза (Izumi et al. (2002) Nature 416:279-280) и, как предполагают, РИТУКСАН® действует, по меньшей мере, частично, путем индуцирования апоптоза (Cardarelli et al. (2002) Cancer Immunol. Immunother. 51:15-24).
Иммуноконъюгаты, или «конъюгаты антитело-лекарственное средство», пригодны для местной доставки цитотоксических средств при лечении рака. См., например, Syrigos et al. (1999) Anticancer Research 19:605-614; Niculescu-Duvaz et al. (1997) Adv. Drug Deliv. Rev. 26:151-172; патент США № 4975278. Иммуноконъюгаты позволяют обеспечить направленную доставку компонента лекарственного средства в опухоль, в то время как системное введение неконъюгированных цитотоксических средств может привести к нежелательным уровням токсичности не только в опухолевых клетках, которые необходимо удалить, но и в нормальных клетках. См. Baldwin et al. (Mar. 15, 1986) Lancet p. 603-05; Thorpe (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review», в Monoclonal Antibodies '84: Biological and Clinical Applications (A. Pinchera et al., eds.) p. 475-506. Иммуноконъюгаты, которые направлены против полипептидов на поверхности клеток, разрабатывали и продолжают разрабатывать для лечения рака. Для обзора см., например, Hamann et al. (2005) Expert Opin. Ther. Patents (2005) 15:1087-1103.
Очевидно, что постоянно существует потребность для диагностических и/или терапевтических целей в средствах, которые направлены против полипептидов на поверхности клеток. Описанное здесь изобретение отвечает этой потребности и предоставляет другие преимущества.
Все цитированные в настоящем описании ссылки, включая патентные заявки и публикации, приведены в качестве ссылки в полном объеме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к анти-TAT226 антителам и способам их применения.
Один из аспектов относится к антителу, которое связывается с TAT226, где антитело содержит, по меньшей мере, одну, две, три, четыре, пять или шесть HVR, выбранных из:
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:4;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:5;
(3) HVR-H3, содержащей аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:11;
(4) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:12;
(5) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:13; и
(6) HVR-L3, содержащей аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:19.
В другом аспекте антитело, которое связывается с TAT226, содержит (a) HVR-H3, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:11, и (b), по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из:
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:4;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:5;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:12;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:13; и
(5) HVR-L3, содержащей аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:19.
В одном из вариантов осуществления антитело содержит HVR-L3, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:19. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:4, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:5. В одном из вариантов осуществления антитело дополнительно содержит HVR-L1, содержащую аминокислотную последовательность SEQ NO:12, и HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:13.
В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO:6-10. В одном из вариантов осуществления антитело дополнительно содержит HVR-L3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO:14-18. В одном из вариантов осуществления HVR-H3 содержит аминокислотную последовательность SEQ ID NO:9 и HVR-L3 содержит аминокислотную последовательность SEQ ID NO:17. В одном из вариантов осуществления HVR-H3 содержит аминокислотную последовательность SEQ ID NO:10 и HVR-L3 содержит аминокислотную последовательность SEQ ID NO:18. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:4, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:5. В одном из вариантов осуществления антитело дополнительно содержит HVR-L1, содержащую аминокислотную последовательность SEQ NO:12, и HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:13.
Один аспект относится к антителу, которое связывается с TAT226, где антитело содержит, по меньшей мере, одну, две, три, четыре, пять или шесть HVR, выбранных из:
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO:3;
(4) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:12;
(5) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:13; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:14.
В другом аспекте антитело, которое связывается с TAT226, содержит (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:3, и (b), по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из:
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:1;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:2;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:12;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:13; и
(5) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO:14.
В одном из вариантов осуществления антитело содержит HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:14. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:1, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:2. В одном из вариантов осуществления антитело дополнительно содержит HVR-L1, содержащую аминокислотную последовательность SEQ NO:12, и HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:13.
В некоторых вариантах осуществления любое из вышеописанных антител дополнительно содержит, по меньшей мере, одну каркасную область, выбранную из консенсусной каркасной области VH подгруппы III и консенсусной каркасной области VL подгруппы I.
Один из аспектов относится к антителу, которое связывается с TAT226, где антитело содержит вариабельный домен тяжелой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO:21-25. В одном из вариантов осуществления антитело дополнительно содержит вариабельный домен легкой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO:26-31. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:24. В одном из вариантов осуществления антитело дополнительно содержит вариабельный домен легкой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:29. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:24 и вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO:29. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:25. В одном из вариантов осуществления антитело дополнительно содержит вариабельный домен легкой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:30. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:25 и вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO:30.
Один из аспектов относится к антителу, которое связывается с TAT226, где антитело содержит вариабельный домен тяжелой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:20. В одном из вариантов осуществления антитело дополнительно содержит вариабельный домен легкой цепи, обладающий, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:26. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:20 и вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO:26.
Некоторые варианты осуществления относятся к полинуклеотиду, кодирующему любое из вышеописанных антител. Один из вариантов осуществления относится к вектору, содержащему полинуклеотид. Один из вариантов осуществления относится к клетке-хозяину, содержащей вектор. В одном из вариантов осуществления клетка-хозяин является эукариотической. В одном из вариантов осуществления клетка-хозяин является клеткой CHO. Один из вариантов осуществления относится к способу получения анти-TAT226 антитела, где способ включает культивирование клетки-хозяина в условиях, подходящих для экспрессии полинуклеотида, кодирующего антитело, и выделение антитела.
Один из аспектов относится к антителу, которое связывается с TAT226, экспрессируемым на поверхности клетки. В одном из вариантов осуществления антитело связывается с эпитопом внутри области TAT226 из аминокислот 21-115 SEQ ID NO:75. В одном из вариантов осуществления клетка является раковой клеткой. В одном из вариантов осуществления раковая клетка является клеткой рака яичника, клеткой опухоли мозга или клеткой опухоли Вильмса.
В некоторых вариантах осуществления любое из вышеописанных антител представляет собой моноклональное антитело. В одном из вариантов осуществления антитело является фрагментом антитела, выбранным из фрагмента Fab, Fab'-SH, Fv, scFv или (Fab')2. В одном из вариантов осуществления антитело является гуманизированным. В одном из вариантов осуществления антитело является человеческим. В одном из вариантов осуществления антитело связывается с тем же эпитопом, что и антитело, выбранное из YWO.32, YWO.49, YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6.
Один из аспектов относится к способу детекции присутствия TAT226 в биологическом образце, где способ включает контактирование биологического образца с любым из вышеописанных антител в условиях, позволяющих антителу связываться с TAT226, и детекцию того, образован ли комплекс между антителом и TAT226. В одном из вариантов осуществления биологический образец содержит клетки опухоли яичника, клетки опухоли мозга или клетки опухоли Вильмса.
Один из аспектов относится к способу диагностики нарушения пролиферации клеток, связанного с повышенной экспрессией TAT226, где способ включает контактирование тестируемой клетки с любым из вышеописанных антител; определение уровня экспрессии TAT226 путем детекции связывания антитела с TAT226; и сравнение уровня экспрессии TAT226 тестируемой клеткой с уровнем экспрессии TAT226 контрольной клеткой, где более высокий уровень экспрессии TAT226 тестируемой клеткой по сравнению с контрольной клеткой указывает на наличие нарушения пролиферации клеток, связанного с повышенной экспрессией TAT226. В одном из вариантов осуществления тестируемая клетка представляет собой клетку пациента, у которого предполагают наличие нарушения пролиферации клеток. В одном из вариантов осуществления нарушение пролиферации клеток выбрано из рака яичника и опухоли Вильмса. В одном из вариантов осуществления способ включает определение уровня экспрессии TAT226 на поверхности тестируемой клетки и сравнение уровня экспрессии TAT226 на поверхности тестируемой клетки с уровнем экспрессии TAT226 на поверхности контрольной клетки.
Изобретение дополнительно относится к иммуноконъюгатам и способам их применения.
В одном из аспектов иммуноконъюгат содержит любое из вышеописанных анти-TAT226 антител, ковалентно присоединенное к цитотоксическому средству. В одном из вариантов осуществления цитотоксическое средство выбрано из токсина, химиотерапевтического средства, антибиотика, радиоактивного изотопа и нуклеолитического фермента.
Один из аспектов относится к иммуноконъюгату, имеющему формулу Ab-(L-D)p, где:
(a) Ab представляет собой любое из вышеописанных анти-TAT226 антител,
(b) L представляет собой линкер;
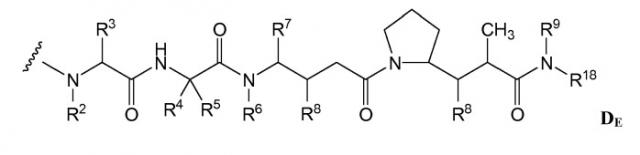
(c) D представляет собой лекарственное средство формулы DE или DF
,
и где каждый R2 и R6 представляет собой метил, каждый R3 и R4 представляет собой изопропил, R7 представляет собой втор-бутил, каждый R8 независимо выбран из CH3, O-CH3, OH и H; R9 представляет собой H; R10 представляет собой арил; Z представляет собой -O- или -NH-; R11 представляет собой H, C1-C8алкил или -(CH2)2-O-(CH2)2-O-(CH2)2-O-CH3; и R18 представляет собой -C(R8)2-C(R8)2-арил; и
(d) p варьирует приблизительно от 1 до 8.
В одном из вариантов осуществления антитело (Ab) содержит 1) HVR-H3, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:11, и 2) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из:
(i) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO:4;
(ii) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO:5;
(iii) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:12;
(iv) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO:13; и
(v) HVR-L3, содержащей аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:19.
В одном из вариантов осуществления антитело содержит HVR-L3, содержащую аминокислотную последовательность, которая соответствует консенсусной последовательности SEQ ID NO:19. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:9, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:17. В одном из вариантов осуществления антитело содержит HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:10, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:18. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:4, HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:5, HVR-L1, содержащую аминокислотную последовательность SEQ ID NO:12, и HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:13. В одном из вариантов осуществления антитело содержит вариабельную область тяжелой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO:21-25, и вариабельную область легкой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью, выбранной из SEQ ID NO:26-31. В одном из вариантов осуществления антитело содержит вариабельную область тяжелой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:24, и вариабельную область легкой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:29. В одном из вариантов осуществления антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:24, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:29. В одном из вариантов осуществления антитело содержит вариабельную область тяжелой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:25, и вариабельную область легкой цепи, обладающую, по меньшей мере, 90% идентичностью последовательности с аминокислотной последовательностью SEQ ID NO:30. В одном из вариантов осуществления антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:25, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:30.
Следующие варианты осуществления далее относятся к любому из вышеописанных иммуноконъюгатов. В одном из вариантов осуществления иммуноконъюгат обладает активностью в отношении уничтожения клеток in vitro или in vivo. В одном из вариантов осуществления линкер присоединен к антителу посредством тиольной группы на антителе. В одном из вариантов осуществления линкер является расщепляемым протеазой. В одном из вариантов осуществления линкер содержит дипептид val-cit. В одном из вариантов осуществления линкер содержит звено п-аминобензила. В одном из вариантов осуществления звено п-аминобензила расположено между лекарственным средством и расщепляемым протеазой участком линкера. В одном из вариантов осуществления звено п-аминобензила представляет собой п-аминобензилоксикарбонил (PAB). В одном из вариантов осуществления линкер содержит 6-малеимидокапроил. В одном из вариантов осуществления 6-малеимидокапроил расположен между антителом и расщепляемым протеазой участком линкера. Вышеописанные варианты осуществления можно осуществлять по отдельности или в любом сочетании друг с другом.
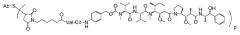
В одном из вариантов осуществления лекарственное средство выбрано из MMAE и MMAF. В одном из вариантов осуществления иммуноконъюгат имеет формулу
,
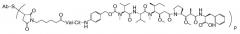
где Ab является любым из вышеописанных анти-TAT226 антител, S представляет собой атом серы и p варьирует от 2 до 5. В одном из вариантов осуществления иммуноконъюгат имеет формулу
,
где Ab является любым из вышеописанных анти-TAT226 антител, S представляет собой атом серы и p варьирует от 2 до 5.
Один из аспектов относится к фармацевтической композиции, содержащей любой из вышеописанных иммуноконъюгатов и фармацевтически приемлемый носитель. Один из аспектов относится к способу лечения нарушения пролиферации клеток, где способ включает введение индивидууму фармацевтической композиции. В одном из вариантов осуществления нарушение пролиферации клеток выбрано из рака яичника, рака тела матки, опухоли мозга и опухоли Вильмса. В одном из вариантов осуществления нарушение пролиферации клеток связано с повышенной экспрессией TAT226 на поверхности клетки.
Один из аспектов относится к способу ингибирования пролиферации клеток, где способ включает воздействие на клетку любым из вышеописанных иммуноконъюгатов в условиях, позволяющих иммуноконъюгату связываться с TAT226. В одном из вариантов осуществления клетка представляет собой опухолевую клетку. В одном из вариантов осуществления опухолевая клетка является клеткой опухоли яичников, клеткой опухоли тела матки, клеткой опухоли мозга или клеткой опухоли Вильмса. В одном из вариантов осуществления клетка представляет собой ксенотрансплантат. В одном из вариантов осуществления воздействие осуществляют in vitro. В одном из вариантов осуществления воздействие осуществляют in vivo.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 представлено выравнивание TAT226 человека, макака-крабоеда («cyno»), мыши и крысы. Остатки, заключенные в рамки, идентичны у данных видов. Остальные остатки отличаются, по меньшей мере, у двух из четырех видов. Процентная доля аминокислотной идентичности среди последовательностей TAT226 человека, макака-крабоеда, мыши и крысы представлена в таблице под выравниванием. Процентную идентичность вычисляли с использованием программы ClustalW.
На фигуре 2 представлены последовательности H1, H2 и H3 гипервариабельной области (HVR) тяжелой цепи моноклональных анти-TAT226 антител, обозначенных как YWO.32 и YWO.49, как описано в примере B. Положения аминокислот пронумерованы согласно системе нумерации по Kabat, как описано ниже.
На фигуре 3 представлены последовательности L1, L2 и L3 легкой цепи HVR моноклональных анти-TAT226 антител, обозначенных как YWO.32 и YWO.49, как описано в примере B. Положения аминокислот пронумерованы согласно системе нумерации по Kabat, как описано ниже.
На фигуре 4 представлены последовательности HVR-H3 и HVR-L3 YWO.49 и YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6, которые получены аффинным созреванием YWO.49 с использованием мягко рандомизированных библиотек на основе HVR-H3 и HVR-L3, как описано в примере B. Также представлены консенсусные последовательности HVR-H3 и HVR-L3.
На фигурах 5A и 5B представлены иллюстративные акцепторные последовательности вариабельной тяжелой (VH) консенсусной каркасной области человека для использования на практике настоящего изобретения с идентификаторами последовательностей, как следует далее:
- консенсусная каркасная область «A» VH подгруппы I человека за вычетом CDR по Kabat (SEQ ID NO:32, 33, 34, 35);
- консенсусные каркасные области «B», «C» и «D» VH подгруппы I человека за вычетом расширенных гипервариабельных областей (SEQ ID NO:36, 37, 34, 35; SEQ ID NO:36, 37, 38, 35; и SEQ ID NO:36, 37, 39, 35);
- консенсусная каркасная область «A» VH подгруппы II человека за вычетом CDR по Kabat (SEQ ID NO:40, 41, 42, 35);
- консенсусные каркасные области «B», «C» и «D» VH подгруппы II человека за вычетом расширенных гипервариабельных областей (SEQ ID NO:43, 44, 42, 35; SEQ ID NO:43, 44, 45, 35; и SEQ ID NO:43, 44, 46 и 35);
- консенсусная каркасная область «A» VH подгруппы III человека за вычетом CDR по Kabat (SEQ ID NO:47, 48, 49, 35);
- консенсусные каркасные области «B», «C» и «D» VH подгруппы III человека за вычетом расширенных гипервариабельных областей (SEQ ID NO:50, 51, 49, 35; SEQ ID NO:50, 51, 52, 35; и SEQ ID NO:50, 51, 53, 35);
- акцепторная каркасная область «A» VH человека за вычетом CDR по Kabat (SEQ ID NO:54, 48, 55, 35);
- акцепторные каркасные области «B» и «C» VH человека за вычетом расширенных гипервариабельных областей (SEQ ID NO:50, 51, 55, 35; и SEQ ID NO:50, 51, 56, 35);
- акцепторная каркасная область 2 «A» VH человека за вычетом CDR по Kabat (SEQ ID NO:54, 48, 57, 35);
- акцепторные каркасные области 2 «B», «C» и «D» VH человека за вычетом расширенных гипервариабельных областей (SEQ ID NO:50, 51, 57, 35; SEQ ID NO:50, 51, 58, 35; и SEQ ID NO:50, 51, 59, 35).
На фигурах 6A и 6B представлены иллюстративные акцепторные последовательности вариабельной легкой (VL) консенсусной каркасной области человека для использования на практике настоящего изобретения с идентификаторами последовательностей, как следует далее:
- консенсусная каркасная область (κv1) подгруппы I VL каппа человека: SEQ ID NO:60, 61, 62, 63;
- консенсусная каркасная область (κv2) подгруппы II VL каппа человека: SEQ ID NO:64, 65, 66, 63;
- консенсусная каркасная область (κv3) подгруппы III VL каппа человека: SEQ ID NO:67, 68, 69, 63;
- консенсусная каркасная область (κv4) подгруппы IV VL каппа человека: SEQ ID NO:70, 71, 72, 63.
На фигуре 7 представлены последовательности каркасной области легких и тяжелых цепей huMAb4D5-8. Числа в надстрочных индексах/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
На фигуре 8 представлены последовательности каркасной области легких и тяжелых цепей huMAb4D5-8 с указанными модификациями. Числа в надстрочных индексах/полужирным шрифтом указывают на положения аминокислот согласно Kabat.
На фигуре 9 представлены последовательности вариабельной области тяжелой цепи (VH) YWO.32, YWO.49, YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6. HVR подчеркнуты.
На фигуре 10 представлены последовательности вариабельной области легкой цепи (VL) YWO.32, YWO.49, YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6. VL-последовательности гуманизированного моноклонального антитела 4D5-8 («huMAb4D5-8») и «модифицированного» huMAb4D5-8 также представлены на SEQ ID NO:31 и SEQ ID NO:26 соответственно. YWO.32 и YWO.49 обладают такой же VL-последовательностью, как и «модифицированная» VL huMAb4D5-8 (SEQ ID NO:26), которая содержит следующие замещения относительно SEQ ID NO:31: N30S, R66G и H91S. HVR подчеркнуты.
На фигуре 11 представлено выравнивание последовательностей вариабельной области тяжелой цепи YWO.32, YWO.49, YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6. HVR заключены в рамки. Остатки HVR-H3 YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6, которые отличаются от соответствующих остатков HVR-H3 YWO.49, затенены.
На фигуре 12 представлено выравнивание последовательностей вариабельной области легкой цепи YWO.32, YWO.49, YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6. HVR заключены в рамки. Остатки HVR-L3 YWO.49.B7, YWO.49.C9, YWO.49.H2 и YWO.49.H6, которые отличаются от соответствующих остатков HVR-L3 YWO.49, затенены.
На фигуре 13 показано графическое представление уровней экспрессии гена TAT226 человека в различных тканях, как описано в примере A.
На фигуре 14 показано графическое представление уровней экспрессии гена TAT226 человека в нормальном яичнике; нормальной фаллопиевой трубе; раке яичника светлоклеточного, муцинозного и серозного подтипов цистоаденокарциномы; метастатическом раке яичника и других типах рака яичника, как описано в примере A.
На фигуре 15 представлены результаты сортировки клеток с активацией флюоресценции (FACS) клеток OVCAR3 в отсутствие или присутствии указанных анти-TAT226 антител, как описано в примере D.
На фигуре 16 показана экспрессия мРНК и белка TAT226, как определено анализом с использованием 5'-нуклеазы (TaqMan®) и иммуногистохимией (IHC), выполненной на клетках OVCAR3 и панели образцов рака яичника, как описано в примере F.
На фигуре 17 представлена активность in vitro различных конъюгатов антитело-лекарственное средство (ADC) YWO.49.H2 и YWO.49.H6 в анализе уничтожения клеток OVCAR3, как описано в примере H.
На фигуре 18 представлена активность in vitro различных ADC YWO.49.H2 и YWO.49.H6 в анализе уничтожения клеток с использованием стабильных трансфектантов HCT116#9-4, как описано в примере H.
На фигуре 19 представлена активность in vivo ADC YWO.49.H6 с использованием ксенотрансплантатов у мышей, как описано в примере H.
На фигуре 20 представлена активность in vivo ADC YWO.49.H6 с использованием ксенотрансплантатов у мышей, полученных из опухолей пациентов-людей, как описано в примере H.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Предложены выделенные антитела, которые связываются с TAT226. Дополнительно предложены иммуноконъюгаты, содержащие анти-TAT226 антитела. Антитела и иммуноконъюгаты по изобретению пригодны, например, для диагностики или лечения нарушений, связанных с измененной экспрессией, например повышенной экспрессией, TAT226. В некоторых вариантах осуществления антитела или иммуноконъюгаты по изобретению пригодны для диагностики или лечения нарушения пролиферации клеток, такого как опухоль или рак. В некоторых вариантах осуществления антитела или иммуноконъюгаты по изобретению пригодны для детекции TAT226, например TAT226, экспрессируемого на клеточной поверхности.
Предложены полинуклеотиды, кодирующие анти-TAT226 антитела. Предложены векторы, содержащие полинуклеотиды, кодирующие анти-TAT226 антитела, и предложены клетки-хозяева, содержащие такие векторы. Также предложены композиции, включающие фармацевтические составы, содержащие что-либо из одного или нескольких полинуклеотидов, анти-TAT226 антител или иммуноконъюгатов по изобретению.
I. ОБЩИЕ СПОСОБЫ
Способы и процедуры, описанные или цитированные здесь, как правило, хорошо понятны и применяются в общепринятой практике с использованием общепринятых способов специалистами в данной области, такие как, например, широко используемые способы, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F. M. Ausubel et al. eds., (2003)); серия Methods in Enzymology (Academic Press, Inc.): Pcr 2: A Practical Approach (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane eds. (1988) Antibodies, A Laboratory Manual, и Animal Cell Culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999)); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J.B. Lippincott Company, 1993).
II. ОПРЕДЕЛЕНИЯ И СОКРАЩЕНИЯ
A. Определения
«Выделенное» антитело представляет собой антитело, которое было идентифицировано и выделено и/или извлечено из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые могут препятствовать применению антитела для исследования, диагностики или лечения, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления антитело очищают (1) до более чем 95% масс. антитела, как определяют, например, способом Лоури, и в некоторых вариантах осуществления до более чем 99% масс., (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием, например, секвенатора с вращающимся стаканом, или (3) до гомогенности при SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием, например, кумасси голубого или окрашивания серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку в этом случае отсутствует, по меньшей мере, один компонент природного окружения антитела. Однако, как правило, выделенное антитело получают посредством, по меньшей мере, одной стадии очистки.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которую отделяют, по меньшей мере, от одной другой молекулы нуклеиновой кислоты, с которой она обычно ассоциирована, например, в своем природном окружении. Выделенная молекула нуклеиновой кислоты дополнительно включает молекулу нуклеиновой кислоты, содержащуюся в клетках, в которых обычно экспрессируется молекула нуклеиновой кислоты, но расположение молекулы нуклеиновой кислоты вне хромосомы или на хромосоме отличается от ее природного расположения на хромосоме.
«Очищенный» означает, что молекула присутствует в образце в концентрации, по меньшей мере, 95% масс., или, по меньшей мере, 98% масс. образца, в котором она содержится.
Термин «по существу сходный» или «по существу одинаковый», как используют в настоящем документе, обозначает достаточно высокую степень сходства между двумя числовыми величинами (например, одной величиной, связанной с антителом по изобретению, и другой величиной, связанной со стандартным антителом/антителом для сравнения) так, что специалист в данной области может считать, что различие между двумя величинами является незначительным, или отсутствует биологическая и/или статистическая значимость в контексте биологической характеристики, измеренной при помощи указанных величин (например, величин Kd). Различие между указанными двумя величинами составляет, например, менее чем приблизительно 50%, менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20% и/или менее чем приблизительно 10% в виде функции от стандартной величины/величины для сравнения.
Фраза «по существу сниженный» или «по существу отличающийся», как используют в настоящем документе, обозначает достаточно высокую степень отличия между двумя числовыми величинами (как правило, одной величиной, связанной с молекулой, и другой величиной, связанной со стандартной молекулой/молекулой для сравнения) так, что специалист в данной области может считать, что различие между двумя величинами является статистически значимым в контексте биологической характеристики, измеренной при помощи указанных величин (например, величин Kd). Различие между указанными двумя величинами составляет, например, более чем приблизительно 10%, более чем приблизительно 20%, более чем приблизительно 30%, более чем приблизительно 40% и/или более чем приблизительно 50% в виде функции от величины для стандартной молекулы/молекулы для сравнения.
Термин «вектор», как используют в настоящем документе, предназначен для обозначения молекулы нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она связана. Один тип вектора представляет собой «плазмиду», которая обозначает кольцевую двухцепочечную ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другой тип вектора представляет собой фаговый вектор. Другой тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК можно лигировать в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, обладающие бактериальной точкой начала репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяина, и, таким образом, они реплицируются вместе с геномом хозяина. Более того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы обозначают в настоящем документе как «рекомбинантные экспрессирующие векторы» или просто «экспрессирующие векторы». Как правило, экспрессирующие векторы, которые используют в способах рекомбинантных ДНК, часто находятся в форме плазмиды. В настоящем описании «плазмида» и «вектор» можно использовать взаимозаменяемо, так как плазмида является наиболее широко используемой формой вектора.
«Полинуклеотид» или «нуклеиновая кислота», как используют взаимозаменяемо в данном описании, относится к полимерам нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут являться дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями, и/или их аналогами, или любым веществом, которое можно встроить в полимер с помощью ДНК- или РНК-полимеразы, или с помощью синтетической реакции. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификацию структуры нуклеотида можно осуществить перед сборкой полимера или после нее. Последовательность нуклеотидов можно прерывать ненуклеотидными компонентами. Полинуклеотид может содержать модификацию(и), полученную(ые) после синтеза, как, например, кон