Антитела против ephb4 и способы их применения
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой варианты антител против EphB4. Также представлены полинуклеотид, кодирующий антитело, экспрессионный вектор, клетка-хозяин, композиции, содержащие антитело, способы получения антитела, способ обнаружения EphB4, способ диагностики нарушения, ассоциированного с экспрессией EphB4, а также применение антитела для приготовления лекарственного средства. Изобретение может эффективно использоваться для диагностики и лечения заболеваний, ассоциированных с экспрессией EphB4. 12 н. и 24 з.п. ф-лы, 8 ил., 3 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет согласно § 119 раздела 35 свода законов США предварительной заявки на патент США № 60/756889, поданной 5 января 2006 г., и предварительной заявки на патент США № 60/760892, поданной 20 января 2006 г., полное содержание которых таким образом включено посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в основном к областям молекулярной биологии. Более конкретно настоящее изобретение касается антител против EphB4 и их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Для многих физиологических и патологических процессов фундаментальным требованием является развитие обеспечения сосудами. Для активно растущих тканей, таких как эмбрионы и опухоли, требуется адекватное обеспечение кровью. Они удовлетворяют эту потребность с помощью продуцирования проангиогенных факторов, которые усиливают образование новых кровеносных сосудов через процесс, называемый ангиогенезом. Образование сосудистых трубок является сложным, но организованным биологическим событием, в которое вовлечены все или многие из следующих стадий: а) эндотелиальные клетки (ЕС) пролиферируют из существующих ЕС или дифференцируются из клеток-предшественников; b) ЕС мигрируют и соединяются с образованием структур, подобных тяжам; с) сосудистые тяжи затем подвергаются процессу развития трубок с образованием сосудов с центральным просветом; d) от существующих тяжей или сосудов отходят отростки с образованием вторичных сосудов; е) недифференцированное сосудистое сплетение подвергается далее реконструкции и восстановлению формы; и f) периэндотелиальные клетки привлекаются к обшивке эндотелиальных трубок, что обеспечивает поддерживание и модулируемые функции сосудов; причем такие клетки включают перициты для небольших капилляров, гладкомышечные клетки для более больших сосудов и миокардиальные клетки в сердце (Hanahan, Science 277: 48-50 (1997); Hogan & Kolodziej, Nat. Rev. Genet. 3: 513-23 (2002); Lubarsky & Krasnow, Cell 112: 19-28 (2003)).
В настоящее время уже хорошо известно, что ангиогенез вовлечен в патогенез ряда нарушений. Они включают солидные опухоли и метастаз, атеросклероз, ретролентальную фиброплазию, гемангиомы, хроническое воспаление, внутриглазные неоваскулярные поражения, такие как пролиферативные ретинопатии, например диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунное отторжение трансплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз (Folkman et al., J. Biol. Chem. 267: 10931-34 (1992); Klagsbrun et al., Annu. Rev. Physiol. 53: 217-39 (1991); и Garner A., “Vascular diseases”, In: Pathobiology of Ocular Disease. A Dynamic Approach, Garner A., Klintworth GK, eds., 2nd Edition (Marcel Dekker, NY, 1994), pp 1625-1710).
В случае роста опухолей ангиогенез, по-видимому, является решающим для перехода от гиперплазии к неоплазии и для обеспечения питания для роста и метастазирования опухоли (Folkman et al., Nature 339: 58 (1989)). Неоваскуляризация позволяет опухолевым клеткам приобретать преимущества роста и автономность пролиферации по сравнению с нормальными клетками. Опухоль обычно начинается в виде одной аберрантной клетки, которая может пролиферировать только до размера нескольких кубических миллиметров благодаря удаленности от имеющихся капиллярных русел, и она может оставаться «скрытой» без дальнейшего роста и распространения в течение длительного периода времени. Некоторые опухолевые клетки затем переключаются на ангиогенный фенотип с активацией эндотелиальных клеток, которые пролиферируют и созревают в новые капиллярные кровеносные сосуды. Эти вновь образованные кровеносные сосуды не только делают возможным непрерывный рост первичной опухоли, но также распространение и реколонизацию метастатических опухолевых клеток. Соответственно, наблюдалась корреляция между плотностью микрососудов в отделах опухолей и выживанием пациента при раке молочной железы, а также при некоторых других опухолях (Weidner et al., N. Engl. J. Med. 324 1-6 (1991); Horak et al., Lancet 340: 1120-24 (1992); Macchiarini et al., Lancet 340: 145-46 (1992)). Точные механизмы, контролирующие ангиогенное переключение, недостаточно поняты, но полагают, что образование новых сосудов в массе опухоли является результатом сальдо множества ангиогенных стимуляторов и ингибиторов (Folkman, Nat. Med. 1(1): 27-31 (1995)).
Процесс развития сосудов плотно регулируется. На сегодняшний день продемонстрировано, что значительное число молекул, главным образом секретируемые факторы, продуцируемые окружающими клетками, регулируют дифференциацию, пролиферацию, миграцию и соединение в структуры, подобные тяжам, ЕС. Например, фактор роста эндотелия сосудов (VEGF) был идентифицирован в качестве основного фактора, вовлеченного в стимуляцию развития кровеносных сосудов и индукцию проницаемости сосудов (Ferrara et al., Endocr. Rev. 18: 4-25 (1997)). Обнаружение, что утрата даже одной аллели VEGF приводит к летальности эмбриона, указывает на незаменимую роль, которую этот фактор играет в развитии и дифференциации сосудистой системы. Более того, показано, что VEGF является основным медиатором образования новых сосудов, связанного с опухолями и внутриглазными поражениями (Ferrara et al., Endocr. Rev., см. выше). мРНК VEGF сверхэкспрессируется в большинстве проверенных опухолей человека (Berkman et al., J. Clin. Invest. 91: 153-59 (1993); Brown et al., Human Pathol. 26: 86-91 (1995); Brown et al., Cancer Res. 53: 4727-35 (1993); Mattern et al., Brit. J. Cancer 73: 931-34 (1996); Dvorak et al., Am. J. Pathol. 146: 1029-39 (1995)).
Также уровни концентраций VEGF в глазных жидкостях сильно коррелируют с наличием активной пролиферации кровеносных сосудов у больных диабетической и другими связанными с ишемией ретинопатиями (Aiello et al., N. Engl. J. Med. 331: 1480-87 (1994)). Кроме того, в исследованиях продемонстрировано местоположение VEGF в оболочках новых сосудов в сосудистой оболочке глаза у пациентов, пораженных AMD (Lopez et al., Invest. Ophtalmol. Vis. Sci. 37: 855-68 (1996)).
Нейтрализующие антитела против VEGF подавляют рост множества линий опухолевых клеток человека у бестимусных мышей (Kim et al., Nature 362: 841-44 (1993); Warren et al., J. Clin. Invest. 95: 1789-97 (1995); Borgstrom et al., Cancer Res. 56: 4032-39 (1996); Melnyk et al., Cancer Res. 56: 921-24 (1996)), а также ингибируют развитие кровеносных сосудов внутри глаза в моделях ишемических ретинальных нарушений (Adamis et al., Arch. Ophtalmol. 114: 66-71 (1996)). Следовательно, моноклональные антитела против VEGF или другие ингибиторы действия VEGF являются многообещающими кандидатами для лечения опухолей и различных внутриглазных неоваскулярных поражений. Такие антитела описаны, например, в ЕР 817648, опубликованном 14 января 1998 г., и в заявках WO 98/45331 и WO 98/45332, обе их которых опубликованы 15 октября 1998 г. Одно из антител против VEGF, бевацизумаб, разрешено Управлением по контролю за продуктами и медикаментами для использования в комбинации с химиотерапевтической программой для лечения метастатического рака ободочной и прямой кишки (CRC). Бевацизумаб исследуется во многих проводящихся клинических испытаниях для лечения различных признаков рака.
Рецептор EphB4 (“EphB4” или “EphB4R”) является членом семейства рецепторов eph, которое является самым большим семейством тирозинкиназных рецепторов в геноме человека (обзор приведен Dodelet, Oncogene 19: 5614-5619, 2000). Тирозинкиназы рецепторов eph человека распределяют по идентичности последовательностей на класс А и класс В с соответствующими лигандами А-типа и В-типа, на которые приводятся ссылки в виде эфринов. Передача сигнала может происходить в прямом направлении, когда тирозинкиназа рецептора активируется с помощью лиганда, и в обратном направлении, когда лиганды трансмембранных эфринов-В активируются при взаимодействии с рецепторами. Взаимодействия лиганд - рецептор Еph вовлечены в широкий ряд биологических функций, включающих направление аксонов, образование границ тканей, образование и развитие сосудов и подвижность клеток (Kullander et al. Nat. Rev. Mol. Cell. Biol., 3: 475-486, 2002; Cheng et al. Cytokine Growth Factor Rev., 13: 75-85, 2002; Coulthand et al. Int. J. Dev. Biol., 46: 375-384, 2004). EphB4 связывает лиганды, такие как эфрин-В1, эфрин-В2 и эфрин-В3. Рецептор EphB4 имеет экстраклеточный район с богатым цистеином мотивом, тянущийся через его амино-концевую половину, за которым следуют два мотива фибронектина типа II. Существуют внутриклеточный домен, имеющий признаки консервативного киназного района, и трансмембранный домен.
Ясно, что продолжает существовать потребность в агентах, имеющих клинические признаки, которые являются оптимальными для разработки терапевтических агентов. Описанное здесь изобретение удовлетворяет эту потребность и обеспечивает другие преимущества.
Все приведенные здесь ссылки, в том числе заявки на патенты и публикации, полностью включены посредством ссылки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение отчасти основано на идентификации множества связывающих EphB4 агентов (таких как иммуноконъюгаты, антитела и их фрагменты). EphB4 представляет важную и полезную терапевтическую мишень, и настоящим изобретением обеспечиваются композиции и способы, основанные на связывании EphB4. Связывающие EphB4 агенты настоящего изобретения, описанные здесь, обеспечивают важные терапевтические и диагностические агенты, используемые в нацеливании на патологические состояния, ассоциируемые с экспрессией и/или активностью путей EphB4 - лиганд EphB4. Соответственно, настоящим изобретением обеспечиваются способы, композиции, наборы и изделия производства, связанные со связыванием EphB4.
Настоящим изобретением обеспечиваются антитела, которые связываются (например, специфически связываются) с EphB4.
В одном аспекте настоящим изобретением обеспечивается выделенное антитело против EphB4, причем полноразмерная IgG-форма антитела специфически связывает EphB4 человека с аффинностью связывания, составляющей 50 пМ или меньше. Как хорошо установлено в данной области, аффинность связывания лиганда с его рецептором можно определить, используя какой-либо из множества анализов, и выразить в терминах множества количественных величин. Соответственно, в одном варианте осуществления настоящего изобретения аффинность связывания выражается в виде величин Kd и отражает присущую аффинность связывания (например, с минимизированными эффектами авидности). Как правило и предпочтительно, аффинность связывания измеряют in vitro, или в бесклеточной, или в связанной с клетками установке. Для измерения аффинности связывания можно использовать любое число анализов, известных в данной области, в том числе тех, которые здесь описаны, включающих, например, Biacore, радиоиммуноанализы (RIA) и ELISA (твердофазный иммуноферментный анализ).
В одном аспекте настоящим изобретением обеспечивается выделенное антитело, которое связывается с лигандсвязывающим районом EphB4. В некоторых вариантах осуществления настоящего изобретения выделенное антитело связывается с полипептидом, включающим, состоящим и по существу состоящим из экстраклеточного домена EphB4.
В одном аспекте настоящим изобретением обеспечивается выделенное антитело против EphB4, которое конкурирует с лигандом EphB4 за связывание EphB4.
В одном аспекте настоящим изобретением обеспечивается выделенное антитело против EphB4, которое ингибирует, уменьшает и/или блокирует активность EphB4. В некоторых вариантах осуществления настоящего изобретения ингибируется, уменьшается и/или блокируется аутофосфорилирование EphB4.
В одном аспекте антитело против EphB4 настоящего изобретения включает
(а) по крайней мере одну, две, три, четыре или пять последовательностей гипервариабельных участков (HVR), выбираемых из группы, состоящей из
(i) HVR-L1, включающего последовательность А1-А11, где А1-А11 представляет собой RASQDVSTAVA (SEQ ID NO: 9),
(ii) HVR-L2, включающего последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID NO: 11),
(iii) HVR-L3, включающего последовательность C1-C9, где C1-C9 представляет собой QESTTTPPT (SEQ ID NO: 15),
(iv) HVR-H1, включающего последовательность D1-D10, где D1-D10 представляет собой GFSISNYYLH (SEQ ID NO: 2),
(v) HVR-H2, включающего последовательность E1-E18, где E1-E18 представляет собой GGIYLYGSSSEYADSVKG (SEQ ID NO: 4), и
(vi) HVR-H3, включающего последовательность F1-F17, где F1-F17 представляет собой ARGSGLRLGGLDYAMDY (SEQ ID NO: 7), и
(b) по крайней мере один вариант HVR, где последовательность варианта HVR включает модификацию по крайней мере одного остатка последовательности, изображенной в SEQ ID NO: 1-17.
В одном аспекте настоящим изобретением обеспечивается антитело, включающее один, два, три, четыре, пять или шесть HVR, причем каждый HVR включает, состоит или по существу состоит из последовательности, выбираемой из группы, состоящей из SEQ ID NO: 1-17, и где SEQ ID NO: 9 или 10 соответствуют HVR-L1, SEQ ID NO: 11 или 12 соответствуют HVR-L2, SEQ ID NO: 13, 14, 15, 16 или 17 соответствуют HVR-L3, SEQ ID NO: 1 или 2 соответствуют HVR-Н1, SEQ ID NO: 3, 4, 5 или 6 соответствуют HVR-Н2 и SEQ ID NO: 7 или 8 соответствуют HVR-Н3.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, причем каждый по порядку включает SEQ ID NO: 9, 11, 13, 1, 3, 7.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, причем каждый по порядку включает SEQ ID NO: 10, 12, 14, 1, 3, 8.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, причем каждый по порядку включает SEQ ID NO: 9, 11, 15, 2, 4, 7.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, причем каждый по порядку включает SEQ ID NO: 9, 11, 16, 1, 5, 7.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, причем каждый по порядку включает SEQ ID NO: 9, 11, 17, 1, 6, 7.
Варианты HVR в антителе настоящего изобретения могут иметь модификации одного или нескольких (например, двух, трех, четырех, пяти или более) остатков в пределах HVR.
В одном варианте осуществления настоящего изобретения вариант HVR-L1 включает 1-5 (1, 2, 3, 4 или 5) замен в любой комбинации следующих положений: А6 (V или S), А7 (S или E), А8 (T или I), А9 (A или F) и А10 (V или L).
В одном варианте осуществления настоящего изобретения вариант HVR-L2 включает 1-2 (1 или 2) замен в любой комбинации следующих положений: В4 (F или N) и В6 (Y или E).
В одном варианте осуществления настоящего изобретения вариант HVR-L3 включает 1-7 (1, 2, 3, 4, 5, 6 или 7) замен в любой комбинации следующих положений: C2 (Q, E или K), C3 (S или T), C4 (Y, N, T, E или A), C5 (T, A или Q), C6 (T, V или I), C8 (P, L или E) и C9 (T или S).
В одном варианте осуществления настоящего изобретения вариант HVR-Н1 включает 1-3 (1, 2 или 3) замен в любой комбинации следующих положений: D3 (T или S), D6 (G или N) и D9 (I или L).
В одном варианте осуществления настоящего изобретения вариант HVR-H2 включает 1-5 (1, 2, 3, 4 или 5) замен в любой комбинации следующих положений: E5 (P или L), E7 (S или G), E8 (G или S), E10 (T, S или R) и E11 (D, E или G).
В одном варианте осуществления настоящего изобретения вариант HVR-H3 включает 1 замену в следующем положении: F3 (G или S). Буква(ы) в скобках после каждого положения указывает иллюстративное замещение (т.е. замену) аминокислоты; как очевидно для квалифицированного в данной области специалиста, пригодность других аминокислот в качестве аминокислот-замещений в описанном здесь контексте может быть рутинным образом определена с использованием методов, хорошо известных в данной области и/или описанных здесь.
В одном аспекте настоящим изобретением обеспечивается антитело, включающее участок HVR-H1, включающий последовательность SEQ ID NO: 1 или 2. В одном аспекте настоящим изобретением обеспечивается антитело, включающее участок HVR-H2, включающий последовательность SEQ ID NO: 3, 4, 5 или 6. В одном аспекте настоящим изобретением обеспечивается антитело, включающее участок HVR-H3, включающий последовательность SEQ ID NO: 7 или 8. В одном варианте осуществления настоящим изобретением обеспечивается антитело, включающее участок HVR-L1, включающий последовательность SEQ ID NO: 9 или 10. В одном варианте осуществления настоящим изобретением обеспечивается антитело, включающее участок HVR-L2, включающий последовательность SEQ ID NO: 11 или 12. В одном варианте осуществления настоящим изобретением обеспечивается антитело, включающее участок HVR-L3, включающий последовательность SEQ ID NO: 13, 14, 15, 16 или 17.
В одном аспекте настоящим изобретением обеспечивается антитело, включающее по крайней мере одну, по крайней мере две или все три из следующих последовательностей:
(i) последовательность HVR-Н1, включающую последовательности SEQ ID NO: 2;
(ii) последовательность HVR-Н2, включающую последовательности SEQ ID NO: 4;
(iii) последовательность HVR-Н3, включающую последовательности SEQ ID NO: 7.
В одном аспекте настоящим изобретением обеспечивается антитело, включающее по крайней мере одну, по крайней мере две или все три из следующих последовательностей:
(i) последовательность HVR-L1, включающую последовательности SEQ ID NO: 9;
(ii) последовательность HVR-L2, включающую последовательности SEQ ID NO: 11;
(iii) последовательность HVR-L3, включающую последовательности SEQ ID NO: 15.
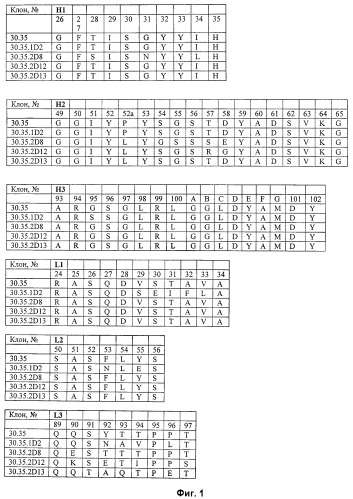
Аминокислотные последовательности SEQ ID NO: 1-17 пронумерованы относительно отдельных HVR (т.е. Н1, Н2 или Н3), как указано на фиг. 1, при этом нумерация согласуется с системой нумерации по Kabat, как описано ниже.
В одном аспекте настоящим изобретением обеспечиваются антитела, включающие последовательности HVR тяжелой цепи, как изображено на фиг. 1.
В одном аспекте настоящим изобретением обеспечиваются антитела, включающие последовательности HVR легкой цепи, как изображено на фиг. 1.
Некоторые варианты антител настоящего изобретения включают вариабельную область легкой цепи гуманизированного антитела 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, США) (на которое также ссылаются в патенте США № 6407213 и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93), изображенную SEQ ID NO: 18 ниже:
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO: 18) (остатки HVR подчеркнуты).
В одном варианте осуществления настоящего изобретения последовательность вариабельной области легкой цепи huMAb4D5-8 модифицирована в одном или нескольких положениях 30, 66 и 91 (Asn, Arg и His, указанные жирным/курсивом выше, соответственно). В одном варианте осуществления настоящего изобретения модифицированная последовательность huMAb4D5-8 включает Ser в положении 30, Gly в положении 66 и/или Ser в положении 91. Соответственно, в одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность, изображенную SEQ ID NO: 52 ниже:
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO: 52) (остатки HVR подчеркнуты)
Замененные остатки относительно huMAb4D5-8 отмечены жирным/курсивом выше.
Антитела настоящего изобретения могут включать любую подходящую последовательность каркасной области вариабельной области при условии, что активность связывания с EphB4 по существу сохраняется. Например, в некоторых вариантах осуществления настоящего изобретения антитела настоящего изобретения включают консенсусную последовательность каркасной области тяжелой цепи подгруппы III человека. В одном варианте этих антител консенсусная последовательность каркасной области включает замену в положении 71, 73 и/или 78. В других вариантах этих антител положение 71 представляет собой А, 73 - Т и/или 78 - А. В одном варианте осуществления настоящего изобретения антитела включают последовательности каркасных областей вариабельной области тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, США) (на которое также ссылаются в патентах США № 6407213 и 5821337 и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93). В одном варианте осуществления настоящего изобретения эти антитела, кроме того, включают консенсусную последовательность каркасной области легкой цепи κI человека. В одном варианте осуществления настоящего изобретения эти антитела включают последовательности HVR легкой цепи huMAb4D5-8, как описано в патентах США № 6407213 и 5821337. В одном варианте осуществления настоящего изобретения эти антитела включают последовательности вариабельных областей легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, США) (на которое также ссылаются в патентах США № 6407213 и 5821337 и Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93).
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, и последовательностями HVR-Н1, -Н2 и -Н3 являются SEQ ID NO: 9, 11 и/или 15 соответственно. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 38, 39, 40 и/или 41, и последовательностями HVR-L1, -L2 и -L3 являются SEQ ID NO: 2, 4 и/или 7 соответственно.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 46, 47, 48 и/или 49, и последовательностями HVR-Н1, -Н2 и -Н3 являются SEQ ID NO: 2, 4 и/или 7 соответственно. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 42, 43, 44 и/или 45, и последовательностями HVR-L1, -L2 и -L3 являются SEQ ID NO: 9, 11 и/или 15 соответственно.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 46, 47, 51 и 49, и последовательностями HVR-Н1, -Н2 и -Н3 являются SEQ ID NO: 2, 4 и/или 7 соответственно. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, причем последовательность каркасной области включает последовательность SEQ ID NO: 42, 43, 50 и 45, и последовательностями HVR-L1, -L2 и -L3 являются SEQ ID NO: 9, 11 и/или 15 соответственно.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения является антителом с созревшей аффинностью для получения желаемой аффинности связывания мишени. В одном примере антитело с созревшей аффинностью настоящего изобретения включает замену по крайней мере одной или нескольких аминокислот в положениях Н28, Н31, Н34, Н52а, Н54, Н55, Н57, Н58, Н95, L29, L30, L31, L32, L33, L53, L55, L90, L91, L92, L93, L94, L96 или L97. В одном примере антитело с созревшей аффинностью настоящего изобретения включает одну или несколько из следующих замен: (а) в тяжелой цепи, T28S, G31N, I34L, P52aL, S54G, G55S, T57S или R, D58, E или G, G95S, или (b) в легкой цепи, V29S, S30E, T31I, A32F, V33L, F53N, Y55E, Q90E или K, S91T, Y92N, T, E или A, T93V или I, T94V или I, P96L или E, или T97S.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 53. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 54. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 53, и вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 54.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 55. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 56. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 55, и вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 56.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 57. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 58. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 57, и вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 58.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 59. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 60. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 59, и вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 60.
В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 61. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 62. В одном варианте осуществления настоящего изобретения антитело настоящего изобретения включает вариабельную область тяжелой цепи, включающую последовательность SEQ ID NO: 61, и вариабельную область легкой цепи, включающую последовательность SEQ ID NO: 62.
В одном аспекте настоящим изобретением обеспечивается антитело, которое конкурирует с любым из вышеупомянутых антител за связывание с EphB4. В одном аспекте настоящим изобретением обеспечивается антитело, которое связывается с тем же самым эпитопом EphB4, что и вышеупомянутые антитела.
Как известно в данной области и описано более подробно здесь ниже, положение аминокислоты/граница, определяющее гипервариабельный участок антитела, может варьировать в зависимости от контекста и различных определений, известных в данной области (как описано ниже). Некоторые положения в пределах вариабельной области могут рассматриваться в качестве гибридных гипервариабельных положений, поскольку можно считать, что эти положения находятся в пределах гипервариабельного участка согласно одному набору критериев, в то время как согласно отличному набору критериев можно считать, что они находятся вне гипервариабельного участка. Одно или несколько из этих положений можно также обнаружить в удлиненных гипервариабельных участках (дополнительно определенных ниже).
В некоторых вариантах осуществления настоящего изобретения антитело является моноклональным антителом. В некоторых вариантах осуществления настоящего изобретения антитело является поликлональным антителом. В некоторых вариантах осуществления настоящего изобретения антитело выбирают из группы, состоящей из химерного антитела, антитела с созревшей аффинностью, гуманизированного антитела и антитела человека. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой фрагмент антитела. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой Fab, Fab', Fab'-SH, F(ab')2 или scFv.
В одном варианте осуществления настоящего изобретения антитело является химерным антителом, например антителом, включающим антигенсвязывающие последовательности не являющегося человеком донора, пересаженные в гетерологичную нечеловеческую, человеческую или гуманизированную последовательность (например, последовательности каркасных областей и/или константных областей). В одном варианте осуществления настоящего изобретения не являющимся человеком донором является мышь. В одном варианте осуществления настоящего изобретения антигенсвязывающая последовательность является синтетической, например полученной с помощью мутагенеза (например, скринирования фагового дисплея и т.п.). В одном варианте осуществления настоящего изобретения химерное антитело настоящего изобретения имеет крысиные V-области и человеческую С-область. В одном варианте осуществления настоящего изобретения V-область легкой цепи крысиных слита с легкой цепью каппа человека. В одном варианте осуществления настоящего изобретения V-область тяжелой цепи крысиных слита с С-областью IgG1 человека.
Гуманизированные антитела настоящего изобретения включают антитела, которые имеют аминокислотные замены в FR, и варианты с созревшей аффинностью с заменами в пересаженных CDR. Замещаемые аминокислоты в CDR или FR не ограничиваются аминокислотами, присутствующими в донорском или реципиентном антителе. В других вариантах осуществления настоящего изобретения антитела настоящего изобретения, кроме того, включают замены аминокислотных остатков Fc-фрагмента, что приводит к увеличению эффекторной функции, в том числе увеличению функции CDC (комплементзависимой цитотоксичности) и/или ADCC (антителозависимой клеточноопосредованной цитотоксичности) и цитолиза В-клетками. Другие антитела настоящего изобретения включают антитела, имеющие специфические изменения, увеличивающие стабильность. В других вариантах осуществления настоящего изобретения антитела настоящего изобретения включают изменения аминокислотных остатков Fc-фрагмента, которые приводят к снижению эффекторной функции, например снижению функции CDC и/или ADCC и/или снижению цитолиза В-клетками. В некоторых вариантах осуществления настоящего изобретения антитела настоящего изобретения характеризуются снижением связывания (например, отсутствием связывания) с фактором комплемента человека C1q и/или рецептором Fc человека на природных киллерах (NK). В некоторых вариантах осуществления настоящего изобретения антитела настоящего изобретения характеризуются снижением связывания (например, отсутствием связывания) с FcγRI, FcγRIIА и/или FcγRIIIА. В некоторых вариантах осуществления настоящего изобретения антитела настоящего изобретения являются классом IgG (например, IgG1 или IgG4) и включают по крайней мере одну мутацию в E233, L234, G236, D265, D270, N297, E318, K320, К322, A327, A330, P331 и/или P329 (нумерации в соответствии с EU-индексом). В некоторых вариантах осуществления настоящего изобретения антитела включают мутацию L234A/L235A или D265А/N297A.
В одном аспекте настоящим изобретением обеспечиваются анти-EphB4 полипептиды, включающие любую из антигенсвязывающих последовательностей, предоставленных здесь, причем анти-EphB4 полипептиды специфически связываются с EphB4.
Антитела настоящего изобретения связывают (например, специфически связывают) EphB4 и в некоторых вариантах осуществления настоящего изобретения могут модулировать один или несколько аспектов ассоциируемых с EphB4 эффектов, включающих, но без ограничения, активацию EphB4, молекулярную передачу сигнала в прямом направлении от EphB4, активацию лиганда EphB4, молекулярную передачу сигнала в прямом направлении от лиганда EphB4, нарушение связывания лиганда (например, эфрина-В1, эфрина-В2 и/или эфрина-В3) с EphB4, фосфорилирования EphB4, и/или образования мультимеров EphB4, и/или фосфорилирования лиганда EphB4, и/или нарушение любого биологически значимого биологического пути EphB4 и/или лиганда EphB4, ингибирование развития кровеносных сосудов, и/или лечение, и/или предотвращение опухоли, нарушения пролиферации клеток или рака, и/или лечение или предотвращение нарушения, ассоциируемого с экспрессией и/или активностью EphB4 (например, увеличенной экспрессией и/или активностью EphB4). В некоторых вариантах осуществления настоящего изобретения антитело настоящего изобретения специфически связывается с EphB4. В некоторых вариантах осуществления настоящего изобретения антитело специфически связывается с экстраклеточным доменом (ECD) EphB4. В некоторых вариантах осуществления настоящего изобретения антитело специфически связывается с полипептидом, состоящим или по существу состоящим из экстраклеточного домена EphB4. В некоторых вариантах осуществления настоящего изобретения антитело специфически связывает EphB4 с Kd, составляющей 50 пМ или меньше. В некоторых вариантах осуществления настоящего изобретения антитело уменьшает, ингибируют и/или блокируют активность EphB4 in vivo и/или in vitro. В некоторых вариантах осуществления настоящего изобретения антитело настоящего изобретения уменьшает, ингибируют и/или блокируют аутофосфорилирование EphB4. В некоторых вариантах осуществления настоящего изобретения антитело конкурирует за связывание с лигандом EphB4 (уменьшает и/или блокирует связывание лиганда EphB4 с EphB4).
В одном аспекте настоящим изобретением обеспечивается применение антитела настоящего изобретения для приготовления лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или нарушение пролиферации клеток. В некоторых вариантах осуществления настоящего изобретения нарушением является невропатия или нейродегенеративное заболевание.
В одном аспекте настоящим изобретением обеспечивается применение антитела настоящего изобретения для приготовления лекарственного средства для ингибирования развития кровеносных сосудов.
В одном аспекте настоящим изобретением обеспечиваются композиции, содержащие одно или несколько антител настоящего изобретения и носитель. В одном варианте осуществления настоящего изобретения носитель является фармацевтически приемлемым.
В одном аспекте настоящим изобретением обеспечиваются нуклеиновые кислоты, кодирующие антитело против EphB4 настоящего изобретения.
В одном аспекте настоящим изобретением обеспечиваются векторы, включающие нуклеиновую кислоту настоящего изобретения.
В одном аспекте настоящим изобретением обеспечиваются композиции, содержащие одну или несколько нуклеиновых кислот настоящего изобретения и носитель. В одном варианте осуществления настоящего изобретения носитель является фармацевтически приемлемым.
В одном аспекте настоящим изобретением обеспечиваются клетки-хозяева, включающие нуклеиновую кислоту или вектор настоящего изобретения. Вектор может быть любого типа, например рекомбинантным вектором, таким как экспрессирующий вектор. Можно использовать любую из множества клеток-хозяев. В одном варианте осуществления настоящего изобретения клетка-хозяин является прокариотической клеткой, например E.coli. В одном варианте осуществления настоящего изобретения клетка-хозяин является эукариотической клеткой, например клеткой млекопитающего, такой как клетка яичника китайского хомячка (СНО).
В одном аспекте настоящим изобретением обеспечиваются способы получения антитела настоящего изобретения. Например, настоящим изобретением обеспечиваются способы получения антитела против EphB4 (которое, как здесь определено, имеет полную длину) и его фрагментов или иммуноконъюгатов, при этом указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора настоящего изобретения, кодирующего указанное антитело (или его фрагмент) и извлечение указанного антитела.
В одном аспекте настоящим изобретением обеспечивается изделие производства, включающее контейнер и композицию, содержащуюся внутри контейнера, причем композиция содержит одно или несколько антител против EphB4 настоящего изобретения. В одном варианте осуществления настоящего изобретения композиция содержит нуклеиновую кислоту настоящего изобретения. В одном варианте осуществления настоящего изобретения композиция, содержащая антитело, содержит, кроме того, носитель, который в некоторых вариантах осуществления настоящего изобретения является фармацевтически приемлемым. В одном варианте осуществления настоящего изобретения изделие производства настоящего изобретения содержит, кроме того, инструкции в отношении введения композиции (