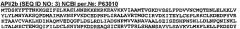Способы и материалы для обнаружения апоптоза
Иллюстрации
Показать всеИзобретение относится к медицине и касается способа детектирования апоптоза в клетке млекопитающего, где апоптоз инициирован рецептором "гибели" 4, рецептором "гибели" 5 или Fas. Изобретение обеспечивает обнаружение апоптоза для оценки чувствительности раковой клетки млекопитающего к апоптоз-индуцирующим агентам. 2 н. и 15 з.п. ф-лы, 1 пр., 12 ил., 1 табл.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается преимущество предварительной заявки на патент США № 60/814955, поданной 20 июня 2006, содержание которой во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к способам наблюдения апоптоза в клетках млекопитающих, таких как человеческие раковые клетки, обработанные апоптоз-индуцирующим агентом.
Предшествующий уровень техники
Регуляция числа клеток у млекопитающих частично определяется балансом между пролиферацией клеток и гибелью клеток. Одна из форм гибели клеток, иногда называемая некротической гибелью клеток, обычно характеризуется как патологическая форма гибели клеток в результате некоторых травм или поражений клеток. В противоположность этому существует и другая «физиологическая» форма гибели клеток, которая обычно представляет собой упорядоченный или регулируемый процесс. Такая упорядоченная или регулируемая форма гибели клеток часто называется «апоптозом» (см., например, Barr et al., Bio/Technology, 12:487-493 (1994); Steller et al., Science, 267:1445-1449 (1995)). Апоптотическая гибель клеток обычно происходит во многих физиологических процессах, включая развитие эмбриона и клональный отбор в иммунной системе (Itoh et al., Cell, 66:233-243 (1991)).
Различные молекулы, такие как фактор некроза опухоли-α («TNF-α»), фактор некроза опухоли-β («TNF-β» или «лимфотоксин-α»), лимфотоксин-β («LT-β»), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, лиганд Apo-1 (также называемый лигандом Fas или лигандом CD95), лиганд Apo-2 (также называемый TRAIL), лиганд Apo-3 (также называемый TWEAK), остеопротегерин (OPG), APRIL, лиганд RANK (также называемый TRANCE) и TALL-1 (также называемый BlyS, BAFF or THANK), были идентифицированы как цитокины, являющиеся членами семейства факторов некроза опухоли («TNF») (см. например, Gruss and Dower, Blood, 85:3378-3404 (1995); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Armitage et al. Nature, 357:80-82 (1992), заявку WO 97/01633, опубликованную 16 января, 1997; заявку WO 97/25428, опубликованную 17 июля, 1997; Marsters et al., Curr. Biol., 8:525-528 (1998); Simonet et al., Cell, 89:309-319 (1997); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp Med., 188:1185-1190 (1998); заявку WO98/28426, опубликованную 2 июля, 1998; заявку WO98/46751, опубликованную 22 октября, 1998; заявку WO/98/18921, опубликованную 7 мая, 1998; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)). Сообщалось, что из этих молекул такие молекулы, как TNF-α, TNF-β, лиганд CD30, лиганд 4-1BB, лиганд Apo-1, лиганд Apo-2 (Apo2L/TRAIL) и лиганд Apo-3 (TWEAK), участвуют в апоптотической гибели клеток. Сообщалось, что TNF-α и TNF-β индуцируют апоптотическую гибель восприимчивых опухолевых клеток (Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987)).
Сообщалось, что в апоптозе, очевидно, участвуют и другие молекулы, которые являются членами цитокинового семейства TNF. Так, например, в публикации Pitti et al., J. Biol. Chem., 271:12687-12690 (1996) описана молекула, называемая лигандом Apo-2. См. также заявку WO 97/25428, опубликованную 17 июля, 1997. Сообщалось, что полноразмерный человеческий лиганд Apo-2 представляет собой полипептид из 281 аминокислоты, который индуцирует апоптоз различных клеток млекопитающих. Другими исследователями были описаны родственные полипептиды, называемые TRAIL (см. Wiley et al., Immunity, 3:673-682 (1995); заявку WO 97/01633, опубликованную 16 января, 1997) and AGP-1 (см. заявку WO 97/46686, опубликованную 11 декабря, 1997).
Считается, что различные молекулы семейства TNF также играют определенную роль в функционировании или развитии иммунной системы (Gruss et al., Blood, 85:3378 (1995)). В публикации Zheng et al. сообщалось, что TNF-α участвует в апоптозе CD8-позитивных Т-клеток после их стимуляции (Zheng et al.. Nature, 377:348-351 (1995)). Другие исследователи сообщали, что лиганд CD30 может вызывать элиминацию аутореактивных Т-клеток в тимусе (Amakawa et al., Cold Spring Harbor Laboratory Symposium on Programmed Cell Death, Abstr. No. 10, (1995)). Лиганд CD40 активирует множество функций В-клеток, включая пролиферацию клеток, секрецию иммуноглобулина и выживание клеток (Renshaw et al., J. Exp. Med., 180:1889 (1994)). Сообщалось, что другое недавно идентифицированное цитокиновое семейство TNF, TALL-1 (BlyS), в определенных условиях индуцирует пролиферацию В-клеток и секрецию иммуноглобулина (Moore et al., см. выше; Schneider et al., см. выше; Mackay et al., J. Exp. Med., 190:1697 (1999)).
Мутации в генах мышиного рецептора или лиганда Fas/Apo-1 (обозначаемых lpr и gld, соответственно) ассоциируются с некоторыми аутоиммунными расстройствами, что указывает на то, что лиганд Apo-1 может играть определенную роль в регуляции клональной делеции аутореактивных лимфоцитов в периферических органах (Krammer et al., Curr. Op. Immunol., 6:279-289 (1994); Nagata et al., Science, 267:1449-1456 (1995)). Также сообщалось, что лиганд Apo-1 индуцирует апоптоз CD4-позитивных Т-лимфоцитов и В-лимфоцитов после их стимуляции, и может участвовать в элиминации активированных лимфоцитов, если их функция больше не требуется (Krammer et al., см. выше; Nagata et al., см. выше). Сообщалось, что мышиные моноклональные антитела-агонисты, специфически связывающиеся с рецептором Apo-1, обладают цитолитической активностью, сравнимой с цитолитической активностью TNF-α или аналогичной активностью (Yonehara et al., J. Exp. Med., 169:1747-1756 (1989)).
Индуцирование различных клеточных ответов, опосредуемых такими лигандами семейства TNF, обычно инициируется их связыванием со специфическими клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF связываются с присутствующими на поверхности клеток «рецепторами гибели» и, посредством таких рецепторов, индуцируют различные биологические активности, что приводит к активации каспаз или ферментов, которые участвуют в пути гибели или апоптоза клеток (Salvesen et al., Cell, 91:443-446 (1997)). В настоящее время считается, что членами суперсемейства рецепторов TNF являются TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также называемые Apo-1 или CD95), DR4 (также называемый TRAIL-R1), DR5 (также называемый Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также называемый DR3 или TRAMP) (см., например, Ashkenazi, Nature Reviews, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol, 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, pages 377-411; Locksley et al., Cell, 104:487-501 (2001); Gruss and Dower, Blood, 85:3378-3404 (1995); HohMan et al., J.Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 87: 3127-3131 (1990); патент EP 417563, опубликованный 20 марта, 1991; Loetscher et al.. Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis al., Proc. Natl. Acad. Sci., 88: 2830-2834 (1991); Goodwin et al., Cell. Biol., 11:3020-3026 (1991); Stamenkovic et al., EMBO J., 8:1403-1410 (1989); Mallett al., EMBO J., 9:1063-1068 (1990); Anderson al., Nature, 390:175-179 (1997); Chicheportiche et al., J. Biol. Chem., 272:32401-32410 (1997); Pan al.. Science, 276:111-113 (1997); Pan et al., Science, 277:815-818 (1997); Sheridan et al., Science 277: 818-821 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); Marsters et al., Curr. Biol., 7:1003-1006 (1997); Tsuda et al., BBRC, 234: 137-142 (1997); Nocentini et al., Proc. Natl. Acad. Sci., 94: 6216-6221 (1997); von Bulow et al., Science, 278:138-141 (1997)).
Многие из этих членов семейства рецепторов TNF имеют общую структуру, типичную для рецепторов клеточной поверхности, включая внеклеточные, трансмембранные и внутриклеточные области, а другие члены этого семейства существуют в природе как растворимые белки, не содержащие трансмембранного и внутриклеточного домена. Внеклеточная часть типичных TNFR содержит повторяющуюся аминокислотную последовательность, состоящую из множества богатых цистеином доменов (CRD), начиная с NН2-конца.
Лиганд, называемый Apo-2L или TRAIL, был идентифицирован несколько лет назад как член цитокинового семейства TNF (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem.. 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США 5763223, выданный 9 июня, 1998; патент США 6284236, выданный 4 сентября, 2001). Полноразмерная нативная последовательность человеческого полипептида Apo2L/TRAIL представляет собой трансмембранный белок типа II длиной в 281 аминокислоту. Некоторые клетки могут продуцировать природную растворимую форму полипептида посредством ферментативного расщепления внеклеточной области полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)).
Кристаллографические исследования растворимых форм Apo2L/TRAIL выявили гомотримерную структуру, аналогичную структурам TNF и других родственных белков (Hymowitz et al., Molec Cell, 4:563-571 (1999); Cha et al.. Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако было обнаружено, что Apo2L/TRAIL, в отличие от других членов семейства TNF, имеет уникальную структурную особенность, заключающуюся в том, что в нем три цистеиновых остатка (в положении 230 каждой субъединицы гомотримера), взятые вместе, координируют атом цинка, и в том, что такое связывание с цинком играет важную роль в стабильности тримера и в биологической активности (Hymowitz et al., см. выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
В литературе сообщалось, что Apo2L/TRAIL может играть определенную роль в модуляции иммунной системы, включая развитие аутоиммунных заболеваний, таких как ревматоидный артрит (см., например, Thomas et al., J. Immunol., 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191: 1095-1103 (2000)).
Также сообщалось, что растворимые формы Apo2L/TRAIL индуцируют апоптоз различных раковых клеток, включая опухоли толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичника и головного мозга, а также меланому, лейкоз и множественную миелому (см., например, Wiley et al., см. выше; Pitti et al., см. выше; патент США 6030945, выданный 29 февраля, 2000; патент США 6746668, выданный 8 июня, 2004; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104: 155-162 (1999); Walczak et al., Nature Med., 5: 157-163 (1999); Keane et al.. Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). In vivo исследования, проводимые на мышах с моделью опухолей, также дают основание предположить, что Apo2L/TRAIL, используемый отдельно или в комбинации с химиотерапией или лучевой терапией, может обладать значительным противоопухолевым действием (см., например, Ashkenazi et al., см.выше; Walczak et al., см.выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., см.выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); заявку PCT US/00/15512; заявку PCT US/01/23691). В отличие от раковых клеток многих типов большинство нормальных человеческих клеток очевидно обладают резистентностью к индуцированию апоптоза некоторыми рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., см. выше; Walczak et al., см. выше). В публикации Jo и др. сообщалось, что меченная полигистидином растворимая форма Apo2L/TRAIL индуцирует in vitro апопотоз нормальных выделенных человеческих гепатоцитов, но не индуцирует апопотоз нечеловеческих гепатоцитов (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Очевидно, что некоторые рекомбинантныые Apo2L/TRAIL-препараты могут обладать различными биохимическими свойствами и биологическими активностями по отношению к патологическим, но не по отношению к нормальным, клеткам, в зависимости, например, от присутствия или отсутствия молекулы-метки, содержания цинка и процентного содержания тримеров (см. Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter the Editor, 7:385-386 (2001)).
Было обнаружено, что Apo2L/TRAIL связывается по меньшей мере с пятью различными рецепторами. По меньшей мере два из этих рецепторов, которые связываются с Apo2L/TRAIL, содержат функциональный цитоплазматический домен «гибели». Один из таких рецепторов называется «DR4» (и альтернативно, TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также заявку W098/32856, опубликованную 30 июля 1998; заявку W099/37684, опубликованную 29 июля 1999; заявку WO 00/73349, опубликованную 7 декабря 2000; заявку США 2003/0036168, опубликованную 20 февраля 2003; патент США 6433147, выданный 13 августа 2002; патент США 6461823, выданный 8 октября 2002, и патент США 6342383, выданный 29 января 2002).
Другой такой рецептор для Apo2L/TRAIL получил название DR5 (он также имеет и другие названия, а именно Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER) (см., например, Sheridan et al.. Science, 277:818-821 (1997), Pan et al.. Science, 277:815-818 (1997), заявку W098/51793, опубликованную 19 ноября 199.., заявку W098/41629, опубликованную 24 сентября 1998; Screaton et al., Curr. Biol., 7:693-696 (1997); Walcak et al., EMBO J., 16:5386-5387 (1997); Wu et al.. Nature Genetics, 17:141-143 (1997), заявку W098/35986, опубликованную 20 августа 1998; EP 870827, опубликованный 14 октября 1998; заявку W098/46643, опубликованную 22 октября 1998; заявку W099/02653, опубликованную 21 января 1999; заявку W099/09165, опубликованную 25 февраля 1999, заявку W099/11791, опубликованную 11 марта 1999; заявку WO 03/042367, опубликованную 22 мая 2003; заявку WO 02/097033, опубликованную 5 декабря 2002; заявку WO 03/038043, опубликованную 8 мая 2003; заявку США 2002/0072091, опубликованную 13 августа 2002; заявку США 2002/0098550, опубликованную 7 декабря 2001; патент США 6313269, выданный 6 декабря 2001; заявку США 2001/0010924, опубликованную 2 августа 2001; заявку США 2003/01255540, опубликованную 3 июля 2003; заявку США 2002/0160446, опубликованную 31 октября 2002, заявку США 2002/0048785, опубликованную 25 апреля 2002; заявку США 2004/0141952, опубликованную 21 июля 2004; заявку США 2005/0129699, опубликованную 16 июня 2005; заявку США 2005/0129616, опубликованную 16 июня 2005; патент США 6342369, выданный в феврале 2002; патент США 6569642, выданный 27 мая 2003, патент США 6072047, выданный 6 июня 2000, патент США 6642358, выданный 4 ноября 2003; патент США 6743625, выданный 1 июня 2004). Сообщалось, что DR5, аналогично DR4, содержит цитоплазматический домен гибели и обладает способностью передавать сигнал на апоптоз после связывания с лигандом (или после связывания с молекулой, такой как антитело-агонист, которая имитирует активность лиганда). Кристаллическая структура комплекса, образованного между Apo-2L/TRAIL и DR5, описана в публикации Hymowitz al., Molecular Cell, 4:563-571 (1999). Другой идентифицированный рецептор, содержащий «домен гибели», называется DR6 (Pan et al., FEBS Letters, 431:351-356 (1998)).
После связывания с лигандом DR4 и DR5 могут независимо запускать апоптоз путем рекрутинга и активации инициатора апоптоза, каспазы-8, под действием молекулы-адаптора, содержащей домен «гибели» и называемой FADD/Mortl (Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer Nature Cell Biol., 2:241-243 (2000)).
Сообщалось, что Apo2L/TRAIL также связывается с рецепторами, называемыми DcR1, DcR2 и OPG, которые, очевидно, функционируют как ингибиторы, а не как трансдукторы передачи сигнала (см., например, DCR1 (также называемый TRID, LIT или TRAIL-R3) (Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEES Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); и Mongkolsapaya et al., J. Immunol, 160:3-6 (1998); DCR2 (также называемый TRUNDD или TRAIL-R4) (Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEES Letters, 424:4l-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)) и OPG (Simonet et al., см. выше)). В отличие от DR4 и DR5 рецепторы DcR1 и DcR2 не передают сигнал апоптоза.
В литературе имеются сообщения о некоторых антителах, которые связываются с рецепторами DR4, DR5 и/или Fas. Так, например, анти-DR4-антитела, направленные против рецептора DR4 и обладающие агонистической или апоптотической активностью в некоторых клетках млекопитающих, описаны, например, в заявке WO 99/37684, опубликованной 29 июля 1999; в заявке WO 00/73349, опубликованной 12 июля 2000; и в заявке WO 03/066661, опубликованной 14 августа 2003. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); заявку WO 02/097033, опубликованную 2 декабря 2002; заявку WO 03/042367, опубликованную 22 мая 2003; заявку WO 03/038043, опубликованную 8 мая 2003; заявку WO 03/037913, 8 мая 2003; заявку США 2003/0073187, опубликованную 17 апреля 2003; и заявку США 2003/0108516, опубликованную 12 июня 2003. Были также описаны некоторые анти-DR5-антитела, см., например, заявку WO 98/51793, опубликованную 8 ноября 1998; Griffith et al., J. Immunol., 162:2597-2605 (1999); Ichikawa et al., Nature... Med., 7:954-960 (2001); Hylander et al., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; заявку WO 03/038043, опубликованную 8 мая 2003; заявку WO 03/037913, опубликованную 8 мая 2003; и заявку США 2003/0180296, опубликованную 25 сентября 2003. Кроме того, были описаны некоторые антитела, перекрестно реагирующие с рецепторами DR4 и DR5 (см., например, патент США 6252050, выданный 26 июня 2001). Анти-Fas-антителами-агонистами, которые индуцируют апоптоз клеток-мишеней, экспрессирующих Fas, являются, но не ограничиваются ими, MAb M2 и M3 (IgG; Alderson et al., 1995, J. Exp. Med. 181:71-77); анти-Fas MAb (IgM; Yonehara et al., 1989, J. Exp. Med. 169:1747-1756); MAb CH1l (IgM; Alderson et al., 1994, Int. Immunol. 6:1799-806); и анти-Apo-1 антитело (IgG; Dhein et al., 1992, J. Immunol., 149:3166-3173).
Апоптоз играет решающую роль в развитии и в гомеостазе многоклеточных организмов (см, например, Danial, N.N. et. al., Cell 116, 205-19 (2004)). Индуцирование апоптоза регулируется двумя основными механизмами передачи сигнала по внутриклеточному и внеклеточному пути (см., например, Strasser, A., et. al., Annu. Rev. Biochem. 69, 217-45 (2000)). Эти пути активируют цистеиновые протеазы, называемые каспазами, которые расщепляют различные клеточные белки, играющие важную роль в целостности клетки. Каспазы распознают специфические тетрапептидные последовательности, содержащие аспартат, и расщепляют связь с соседним пептидом (см., например, Thornberry, N.A. et. al., Science 281, 1312-6 (1998)). Активация внеклеточного пути происходит в ответ на действие лигандов, таких как лиганд Fas (FasL) и лиганд Аро-2/лиганд, индуцирующий TNF-опосредуемый апоптоз (Apo2L/TRAIL), через их соответствующие «рецепторы гибели» Fas, присутствующие на клеточной поверхности (Apol/CD95) и DR4 или DR5 (см., например, Nagata, S. Cell 88, 355-65 (1997) & LeBlanc, H.N. et. al., Cell Death Differ 10, 66-75 (2003)). Cвязывание с лигандом запускает присоединение адаптора FADD (Fas-ассоциированного домена «гибели») к домену «гибели», присутствующему в цитоплазматическом «хвосте» рецептора. FADD стимулирует присоединение протеазы-инициатора, каспазы-8, с образованием «сигнального комплекса, иниицирующего гибель клеток» (DISC) (см., например, Kischkel, F. C. et al. Embo J. 14, 5579-88 (1995)). Близость молекул каспазы-8 в DISC стимулирует ферментативную активность, что приводит к аутопроцессингу (см., например, Boatright, K.M. et al. Mol Cell 11, 529-41 (2003)). Затем отщепленная каспаза-8 высвобождается из DISC в цитоплазму и протеолитически активирует эффекторные каспазы, такие как каспаза-3 и -7. В клетках некоторых типов стимуляция DR генерирует сильную активность каспазы-8, которая в высокой степени активирует эффекторные каспазы и передает клеткам сигнал на апоптоз (см., например, Scaffidi, C, et. al., J Biol Chem 274, 1541-8 (1999)). Клетки других типов требуют амплификации сигнала по его внутреннему пути: каспаза-8 расщепляет гомологичный домену Bcl-2 домен 3 (BH3), присутствующий только в белке Bid, который стимулирует внутренний путь посредством белков Bax и Bak со множеством доменов ВН, что приводит к усилению активации эффекторной каспазы и к апоптозу (см., например, Danial, N.N. et. al., Cell 116, 205-19 (2004) и Strasser, A., et. al., Annu Rev Biochem 69, 217-45 (2000)).
Апоптоз обычно характеризуется конденсацией и скоплением ядерного хроматина на периферии и фрагментацией ядерной структуры в так называемые апоптотические тельца. Такая апоптотическая морфология может быть идентифицирована с помощью стандартных окрашивающих веществ, то есть красителей, которые селективно аккумулируются в ядрах, например, с помощью иодида пропидия или Hoechst 33258, или с помощью электронной микроскопии. Межнуклеосомная фрагментация ДНК, которая часто ассоциируется с клеточной гибелью в результате апопотоза, но не является диагностическим фактором клеточной гибели вследствие апоптоза, может быть также использована для идентификации и количественной оценки апоптоза.
Описание сущности изобретения
Заявителями были идентифицированы фрагменты белков, которые образуются в клетках во время апоптоза, и которые могут быть использованы в качестве биомаркеров апоптотической гибели клеток. В некоторых своих вариантах настоящее изобретение относится к способам и к материалам, используемым в целях идентификации указанных фрагментов белков, например, для выявления апоптотической гибели клеток млекопитающих, обработанных одним или несколькими апоптоз-индуцирующими агентами. В иллюстративном варианте изобретения такие биомаркеры апоптоза идентифицируют в человеческих раковых клетках для оценки эффективности терапии, включающей введение апоптоз-индуцирующего агента, такого как Apo2L/TRAIL, FasL или Apo2L/TRAIL или агонист FasL.
Заявленное изобретение может быть осуществлено в различных вариантах. Одним из вариантов изобретения является способ детектирования апоптоза в клетках млекопитающих, включающий: контактирование компонентов клетки с антителом, которое связывается с фрагментом белка, образующегося в процессе апоптоза, где указанное антитело связывается с фрагментом белка AP2-α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2-β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4); определение количества антитела, которое связывается с фрагментом белка, образующегося в процессе апоптоза; и сравнение количества связанного антитела на этой стадии с количеством антитела, которое связывается с фрагментом белка в клетках млекопитающих, не подвергающихся апоптозу, где апоптоз детектируют в том случае, если указанное количество такого фрагмента превышает количество фрагмента, присутствующего в клетках, не подвергающихся апоптозу. Клетками млекопитающих, оцениваемыми таким способом, являются, но необязательно, клетки раковых опухолей человеческой толстой кишки, ободочной кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичника и головного мозга, а также клетки меланомы, лейкоза или миеломы.
Как подробно описано ниже, способы согласно изобретению могут быть применены для обнаружения апоптоза, инициированного различными клеточными рецепторами. В некоторых вариантах такого способа апоптоз клетки инициируют посредством рецептора гибели-4 (SEQ ID NO:5) или рецептора гибели-5 (SEQ ID NO:6), например, путем контактирования клетки с Apo2L/TRAIL (SEQ ID NO: 7) или с антителом, которое связывается с рецептором «гибели» 4 (SEQ ID NO: 5) или с рецептором «гибели» 5 (SEQ ID NO: 6). В других вариантах изобретения апоптоз клеток инициируют посредством Fas (SEQ ID NO: 8), например, путем контактирования клеток с FasL (SEQ ID NO: 9) или с антителом, которое связывается с Fas.
Способы согласно изобретению могут быть также адаптированы для их применения в различных целях. Так, например, такие способы наблюдения апоптоза могут быть применены для оценки чувстивтельности клеток к Apo2L/TRAIL (SEQ ID NO: 7) или к антителу, которое связывается с рецептором гибели 4 (SEQ ID NO: 5) или рецептором гибели 5 (SEQ ID NO: 6). В конкретном иллюстративном варианте изобретения такие способы могут быть применены для оценки эффективности терапии, включающей введение Apo2L/TRAIL (SEQ ID NO: 7) или антитела, которое связывается с рецептором гибели 4 (SEQ ID NO: 5) или рецептором гибели 5 (SEQ ID NO: 6). Аналогичным образом другие варианты настоящего изобретения могут быть использованы для оценки чувствительности клеток к FasL (SEQ ID NO: 9) или к антителу, которое связывается с Fas, например, для оценки эффективности терапии, включающей введение FasL (SEQ ID NO: 9) или антитела, которое связывается с Fas.
Как подробно обсуждается ниже, способы согласно изобретению могут быть применены для наблюдения апоптотической фрагментации различных белков в клетках путем осуществления любого из ряда методов, известных специалистам, таких как иммуноанализы, проводимые с использованием антител против одного или нескольких указанных апоптотических фрагментов. Так, например, в некоторых вариантах изобретения, антитело связывается с фрагментом белка AP2-α (SEQ ID NO: 1), например с фрагментом, имеющим массу примерно 64 кДа или 33 кДа. В некоторых вариантах изобретения фрагмент белка AP2α, связанного с антителом, содержит DVFD SEQ ID NO: 1 или GPAA SEQ ID NO: 1. В других вариантах изобретения может быть использовано антитело, связывающееся с фрагментом белка тяжелой цепи клатрина (SEQ ID NO: 2). В других вариантах изобретения может быть использовано антитело, связывающееся с фрагментом белка AP1/2β (SEQ ID NO: 3). В других вариантах изобретения может быть использовано антитело, связывающееся с фрагментом белка динамина (SEQ ID NO: 4).
В некоторых своих вариантах настоящее изобретение относится к способу оценки апоптотической активности специфического типа и/или апоптоза в конкретных физиологических условиях. Так, например, варианты согласно изобретению могут быть использованы для наблюдения апоптоза клеток млекопитающих, опосредуемого рецетором гибели 4 (SEQ ID NO: 5), рецептором гибели 5 (SEQ ID NO: 6) или Fas (SEQ ID NO: 8). Обычно такие способы включают обработку клеток рецептором гибели 4, рецептором гибели 5 или лигандом Fas; анализ клеток, обработанных таким лигандом, на присутствие фрагментов белка AP2-α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4); сравнение количества фрагмента белка в клетках с количеством фрагмента белка в контрольных клетках, не обработанных таким лигандом, где апоптоз детектируют в том случае, если количество фрагмента белка, присутствующего в клетках, обработанных лигандом, превышет количество фрагмента белка, присутствующего в контрольных клетках, не обработанных лигандом. Обычно, в таких способах, лигандом для рецептора гибели 4, рецептора гибели 5 или Fas является Apo2L/TRAIL (SEQ ID NO: 7), антитело, которое связывается с рецептором гибели 4 или рецептором гибели 5, FasL (SEQ ID NO: 9) или антитело, которое связывается с Fas.
Другие варианты осуществления изобретения включают анализ на чувствительность клеток млекопитающего к Apo2L/TRAIL (SEQ ID NO: 7) или FasL (SEQ ID NO: 8) индуцированному апоптозу, проводимый путем обработки клеток млекопитающих Apo2L/TRAIL или FasL; оценку клеток, обработанных Apo2L/TRAIL или FasL на присутствие фрагмента белка AP2α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4); сравнение количества фрагмента белка в клетках млекопитающих с количеством фрагмента белка в контрольных клетках млекопитающих, не обработанных Apo2L/TRAIL или FasL, при этом считается, что наблюдаемые клетки млекопитающих являются чувствительными к Apo2L/TRAIL- или FasL-опосредуемому апоптозу в том случае, если количество фрагмента белка, присутствующего в Apo2L/TRAIL- или FasL-обработанных клетках млекопитающих превышает количество фрагмента белка в контрольных клетках млекопитающих, не обработанных Apo2L/TRAIL или FasL.
В некоторых своих вариантах, настоящее изобретение также относится к промышленным изделиям и к наборам, включающим антитела, которые связываются с фрагментом белка AP2-α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4). Иллюстративным вариантом настоящего изобретения является набор для характеризации клеток млекопитающих, где указанный набор включает: первое антитело, которое связывается с фрагментом белка AP2-α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4); второе антитело, которое связывается с фрагментом белка AP2-α (SEQ ID NO: 1), тяжелой цепи клатрина (SEQ ID NO: 2), AP1/2β (SEQ ID NO: 3) или динамина (SEQ ID NO: 4), где указанные первое и второе антитела не связываются с одним и тем же эпитопом (и не связываются необязательно с одним и тем же белком); контейнер для (a) и (b); и инструкции по применению данного набора.
Краткое описание графического материала
На фиг.1 проиллюстрировано, что Apo2L/TRAIL индуцирует селективное расщепление по механизму клатрин-зависимого эндоцитоза. (a) Клетки обрабатывали при 37°С либо тримерным Apo2L/TRAIL (Colo205, HCT8), либо перекрестно связанным с антителом и меченным Apo2L/TRAIL (BJAB, HeLa-M), и клеточные лизаты анализировали с помощью иммуноблоттинга на отщепление каспазы-3 (C8), каспазы-3 (C3), адаптина (AP)2α, AP1/2β (антитело не распознает изоформы AP1 и 2), тяжелой цепи клатрина (CHC) или рецептора Tf (TfR). (b) Клетки Colo205 обрабатывали, как описано в (a), и анализировали с помощью иммуноблоттинга на процессинг специфических компонентов различного типа, действующих на пути клатрин-ассоциированного эндоцитозного транспорта.
На фиг.2 проиллюстрировано участие различных каспаз в расщеплении AP2α и CHC. (a) Клетки BJAB обрабатывали ингибитором пан-каспазы zVAD-fmk (20 мкM, 30 мин), а затем перекрестно связанным Apo2L/TRAIL (1 мкг/мл) и анализировали с помощью иммуноблоттинга на процессинг каспазы-8, каспазы-3, AP2α и CHC. Незаштрихованные стрелки указывают на продукты расщепления, а заштрихованные стрелки указывают на полноразмерные белки. (b-d) Baх-/-- или Bax+/--клетки HCT116 или дефицитные по каспазе-3 клетки MCF-7 обрабатывали Apo2L/TRAIL и анализировали, как описано в (a).
На фиг.3 показано, что предварительная обработка Apo2L/TRAIL ингибирует эндоцитоз Tf. (a, b) Клетки BJAB (a) или Colo205 (b) предварительно обрабатывали при 37°С или не обрабатывали в присутствии или в отсутствие перекрестносвязанного (a) или неперекрестносвязанного (b) Apo2L/TRAIL в течение определенного времени и охлаждали на льду. Затем клетки уравновешивали на льду в течение 30 минут Alexa-647-конъюгированным Tf (647ТF), и поглощение определяли при 37°С с помощью проточной цитометрии. Скорость эндоцитоза для каждого случая определяли по углу наклона кривой начальной линейной фазы на графике кинетики поглощения в течение 4 минут (а, вставка). Степени эндоцитоза нормализовали по данным наблюдения в отсутствие Apo2L/TRAIL (белые кружки), которые сравнивали с данными, полученными в случае отсутствия лиганда в стадии предварительного инкубирования, но его присутствия в стадии инкубирования Tf в данном анализе (черные ромбы, 0 минут). (c) клетки BJAB предварительно обрабатывали носителем ДМСО или zVAD-fmk в течение 30 минут, а затем обрабатывали в течение 4 часов перекрестно связанным Apo2L/TRAIL, охлаждали на льду и анализировали на скорость эндоцитоза 647Tf, как описано в (а) и (b). Скорость эндоцитоза нормализовали по ДМСО-обработанному образцу (± ср.кв.ош.).
На фиг.4 представлена характеризация эндоцитоза DR5. (a, b) Клетки Colo205, содержащие на своей поверхности mAb 6475С7, инкубировали на льду в течение 30 минут в отсутствие (ромбы) или в присутствии 10 мкг/мл тримерного (квадраты) или перекрестно связанного (треугольники) Apo2L/TRAIL, а затем инкубировали при 37°С в течение указанного времени и быстро охлаждали на льду. Поверхностную флуоресценцию элиминировали путем обработки кислотой, и поглощение DR5 количественно оценивали с помощью проточной цитометрии. Затем по средним величинам строили график (± ср.кв.ош. в (b)). (c) Клетки Hela-m инкубировали при 37°С с 5 мкг/мл 6475С7 и 5 мкг/мл перекрестно связанного Apo2L/TRAIL, а затем обрабатывали для наблюдения под иммунофлуоресцентным микроскопом (столбец: 20 мкM). (d) Клетки Colo205 предварительно уравновешивали при 37°С немеченным mAb 5C7 в течение 30 минут для связывания с поверхностью, и пулы DR5 подвергали рециклингу. Инкубировали осуществляли в присутствии или в отсутствие 10 мкг/мл Apo2L/TRAIL, а затем клетки быстро охлаждали на льду. mAb 5C7, присутствующее на клеточной поверхности, зондировали CY5- конъюгированным антителом против мышиных IgG, количественно оценивали с помощью проточной цитометрии, и по средним значениям (± ср.кв.ош.) строили график. (e) клетки Colo205 предварительно обрабатывали при 37°С 10 мкг/мл Apo2L/TRAIL, а затем быстро охлаждали на льду и анализировали на эндоцитоз, как показано в (а) (6475С7) и на фиг.3b (647Tf). Скорости эндоцитоза нормализовали на величину, полученную без предварительной обработки Apo2L/TRAIL (± ср.кв.ош.). Аналогичные результаты наблюдались в том случае, когда клетки приготавливали, как описано в (с), и эндоцитоз анализировали с использованием связанного с поверхностью CY5-конъюгированного антитела против мышиных Fab. (f-h) Клетки Colo205, имеющие на своей поверхности mAb 5C7, инкубировали на льду вместе с Apo2L/TRAIL, а затем доводили до 37°С в течение 5 минут и фиксировали. Сверхтонкие криосрезы метили кроличьими антителами против мышиных IgG и белком А-золотом (10 нм). Типичное электронно-плотное клатриновое покрытие показано стрелками. P, плазматическая мембрана. Масштабная линия, 200 нм.
На фиг.5 показано, что инактивация динамина приводит к ингибированию эндоцитоза DR5. (a-d) DynG273D-трансдуцированные клетки HeLa-M отбирали с помощью пуромицина, индуцировали доксициклином, предварительно инкубировали в течение 20 минут при указанной температуре, а затем инкубировали еще 20 минут в присутствии Alexa-488-конъюгированного Tf (488Tf). Затем клетки обрабатывали для анализа под иммунофлуоресцентном микроскопом с использованием динамин-1-специфического антитела. (е, f) Нетрансдуцированные (родительские) или клональные Dyn1G273D-трансдуцированные клетки BJAB, индуцированные доксициклином (+dox) или не индуцированные доксициклином (-dox), анализировали на поглощение 488Tf или 6475С7 в течение 20 минут при 30°С (белые столбцы) или 38°С (черные столбцы) с помощью проточной цитометрии, и по полученным средним значениям (± ср.кв.ош) строили график.
На фиг.6 показано, что инактивация динамина приводит к усилению DR-опосредуемой активации каспазы и апоптоза. (a) DynG273D-трансдуцированные клетки BJAB, индуцированные или не индуцированные доксициклином, инкубировали при 38°С в течение 20 минут для инактивации динамина, как показано на фиг.5, а затем инкубировали еще 4 часа в присутствии или в отсутствие перекрестно связанного Apo2L/TRAIL и анализировали с помощью иммуноблоттинга на процессинг указанных белков. (b) DynG273D-трансдуцированные клетки BJAB, индуцированные или не индуцированные доксициклином, инкубировали при 30°С или при 38°С в течение 20 минут, а затем инкубировали еще 2 часа в присутствии или в отсутствие перекрестно связанного Apo2L/TRAIL и анализировали на активность каспазы-3/7. (с) DynG273D-трансдуцированные клетки BJAB, индуцированные или не индуцированные доксициклином, предварительно инкубировали при 38°С в течение 20 минут, а затем инкубировали еще 4 часа в присутствии или в отсутствие перекрестно связанного Apo2L/TRAIL или DR5-селективного мутанта Apo2L/TRAIL (D5-сел.) и анализировали на фрагментацию ДНК (± ср.кв.ош).
На фиг.7 проиллюстрирован процессинг компонентов клатринового пути в раковых клеточных линиях. (a) Указанные клеточные линии обрабатывали Apo2L/TRAIL и анализировали на расщепление AP2α или CHC с помощью иммуноблоттинга. (b) Клетки BJAB обрабатывали перекрестно связанным Apo2L/TRAIL или FasL и процессинг AP2α или CHC анализировали с помощью иммуноблоттинга. (c) Клетки BJAB обрабатывали перекрестно связанным Apo2L/TRAIL и процессинг динамина оценивали с помощью иммуноблоттинга.
На фиг.8 проиллюстрированы условия, необходимые для расщепления AP2α и CHC каспазой. (a) Клетки BJAB предварительно инкубировали в присутствии или в отсутствие zVAD-fmk (20 мкM, 30 минут) и обрабатывали перекрестно связанным Apo2L/TRAIL (1 мкг/мл), как указано выше, в течение 24 часов. Клетки анализировали с помощью иммуноблоттинга на процессинг каспазы-8, каспазы-9, каспазы-3 и AP2α. (b) Т-клеточные линии Jurkat: A3 (дикого типа), 19.2 (дефицитные по каспазе-8) and El (FADD-дефицитные) обрабатывали перекрестно связанным Apo2L/TRAIL или FasL в течение указанного периода времени и анализировали на процессинг компонентов клатрин-зависимого эндоцитозного пути, как показано на фиг.1. (c) Клетки фибросаркомы HT1080 трансфецировали специфичной к каспазе-3 киРНК (C3) или контрольной киРНК, обрабатывали Apo2L/TRAIL в течение указанного периода времени и анализировали на отщепление AP2α или CHC или киРНК-истощение каспазы-3 с помощью иммуноблоттинга.
Фиг.9. Определение сайта отщепления AP2α. (a) C-концевой фрагмент отщепленного AP2α подвергали иммунопреципитации из Apo2L/TRAIL-стимулированных клеток BJAB, а затем либо подвергали гидролизу трипсином и анализировали с помощью масс-спектрометрии для подтверждения его идентичности, либо выделяли с помощью гель-электрофореза и вестерн-блоттинга и подвергали N-концевому секвенированию. Трипсиновые пептиды, идентифицированные с помощью тандемной масс-спектрометрии, выравнивали с С-концевой последовательностью AP2α. С помощью N-концевого секвенирования сайт расщепления был идентифицирован как мотив распознавания DXXD каспазой (подчеркнут). (b) Сайт расщепления картировали по «шарнирной» области AP2α, которая связывает функционально отличающиеся домены «ухо» и «туловище».
Фиг.10. Термочувствительные Dyn1 G273D и доминанто-негативные Dyn1 K44A -мутанты ингибируют эндоцитоз Tf и DR5 в клетках HeLa-M. (a, b) Две клональных линии, происходящие от трансдуцированной ретровирусом клеточной популяции HeLa-M, фиг.6, ts3 и tsl, и индуцированные (+dox) или не индуцированные (-dox) доксициклином, анализировали на поглощение 488Tf (А) или 6475С7 (b) в течение 20 минут при 30°С (белые столбцы) или при 38°С (черные столбцы) с помощью проточной цитометрии, как описано в разделе «Экспериментальные методы», и по средним значениям (± ср.кв.ош) строили график. (c) DynK44A-трансдуцированные и нетрансдуцированные (родительские) клетки HeLa-M, которые были индуцированы или не индуцированы доксициклином, анализировали на скорость эндоцитоза 488Tf и 6475С7 (± ср.кв.ош), как показано на фиг.5d без нормализации.
На фиг.11 проиллюстрирована сборка DISC в отсутствие эндоцитоза. (a) клетки BJAB уравновешивали 647Tf на льду, инкубировали в течение указанного периода времени для поглощения при 37°С или на льду, а затем количественно оценивали флуоресценцию с помощью проточной цитометрии. (b) Клетки BJAB обрабатывали перекрестно связанным Apo2L/TRAIL (1 мкг/мл) при 37°С или на льду в течение указанного периода времени, и DISC подвер