Ингибитор хронического отторжения
Иллюстрации
Показать всеГруппа изобретений относится к области медицины. Средство для подавления хронической реакции отторжения содержит в качестве активного ингредиента моноклональное антитело, которое распознает рецептор IL-6 и ингибирует связывание IL-6 с рецептором IL-6. Изобретение относится также к способу подавления хронической реакции отторжения и к применению для получения средства. Изобретение обеспечивает избирательность действия, меньшие побочные эффекты. 3 н. и 15 з.п. ф-лы, 2 ил.
Реферат
Область техники
Настоящее изобретение относится к средствам для подавления реакции хронического отторжения, которые содержат ингибитор IL-6 в качестве активного ингредиента, и их применениям. Настоящее изобретение также относится к способам подавления реакции хронического отторжения, которые включают стадию введения реципиентам ингибитора IL-6.
Предпосылки изобретения
IL-6 является цитокином, который также называют В-клеточным стимулирующим фактором 2 (BSF2) или интерфероном β2. IL-6 был открыт как фактор дифференцировки, вовлеченный в активацию В-клеточных лимфоцитов (непатентный документ 1), а позднее было выявлено, что он является многофункциональным цитокином, который влияет на функции различных клеток (непатентный документ 2). Было опубликовано, что IL-6 вызывает созревание Т-лимфоцитов (непатентный документ 3).
Биологическая активность IL-6 передается через два типа белков на клетках. Первый представляет собой рецептор IL-6, являющийся лиганд-связывающим белком с молекулярным весом примерно 80 кДа, с которым связывается IL-6 (непатентные документы 4 и 5). В клетке рецептор IL-6 присутствует в мембраносвязанной форме, которая проникает в клеточную мембрану и экспрессирована на ней, а также присутствует в виде растворимого рецептора IL-6, состоящего главным образом из внеклеточной области мембраносвязанной формы.
Другим типом белка является мембранный белок gp130, который имеет молекулярный вес около 130 кДа и участвует в сигнальной трансдукции без связывания с лигандом. Передача биологической активности IL-6 в клетку происходит через образование комплекса IL-6 с рецептором IL-6 с последующим связыванием комплекса с gp130 (непатентный документ 6).
Ингибиторы IL-6 представляют собой вещества, которые ингибируют передачу биологической активности IL-6. На сегодняшний день известные ингибиторы IL-6 включают антитела против IL-6 (антитела к IL-6), антитела против рецептора IL-6 (антитела к рецептору IL-6), антитела против gp130 (антитела к gp130), варианты IL-6, частичные пептиды IL-6 или рецептора IL-6, и т.п.
Было опубликовано несколько сообщений, касающихся антител к рецептору IL-6 (непатентные документы 7 и 8, и патентные документы 1-3). В одном таком сообщении подробно описано гуманизированное антитело РМ-1, которое получают переносом в антитело человека определяющей комплементарность области (CDR) мышиного антитела РМ-1 (непатентный документ 9), являющегося антителом к рецептору IL-6 (патентный документ 4).
Благодаря достигнутым успехам в мультилекарственной терапии и применению в клинической практике различных иммуносупрессантов, терапевтические схемы при острой реакции отторжения после трансплантации органов уже практически установлены, а продолжительность времени выживания после трансплантации различных органов значительно превышает 1 год. Однако хроническая реакция отторжения, которая вызывает проблемы через год после трансплантации, возникает даже в тех клинических случаях, когда острая реакция отторжения была купирована стандартной иммуносупрессивной терапией, и в тех случаях, когда терапию проводили в течение длительного периода времени. Таким образом, в отношении хронической реакции отторжения на сегодняшний день не установлено ни профилактических, ни терапевтических способов лечения. Кроме того, механизм, лежащий в основе этого патологического состояния, полностью не описан, и его диагностика затруднена по сравнению с острой реакцией отторжения. Таким образом известно, что хроническая реакция отторжения является осложнением, влияющим на отдаленные прогнозы у реципиентов (непатентные документы 10 и 11).
Известные патологические признаки, характерные для хронической реакции отторжения, включают фиброз интерстиции и сужение просветов вследствие утолщения интимы просветных тканей в трансплантированных органах. В частности, важным патологическим признаком является ангиостеноз, называемый посттрансплантационным поражением сосудов или посттрансплантационным артериосклерозом. Полагают, что на развитие патологического состояния комплексно влияют различные факторы, как, например, продолжение реакции отторжения в результате действия клеточного и гуморального иммунитета, ишемически-реперфузионные нарушения органов, функциональные нарушения сосудистого эндотелия, общие факторы риска при артериосклерозе (диабет, гиперлипидемия, гипертония и т.п.) у реципиентов, побочные эффекты иммуносупрессантов, генетические факторы и посттрансплантационное заражение цитомегаловирусом (непатентные документы 12 и 13).
Среди существующих фармацевтических средств ингибиторы кальцинеурина, такие как, в частности, циклоспорин и такролимус, являются неэффективными в отношении хронической реакции отторжения, а их побочные эффекты, такие как гипертония, гиперлипидемия и диабет, считаются проблематичными. Кроме того, после трансплантации требуется, в частности, для детей продолжительная иммуносупрессивная терапия. Поэтому ожидалась разработка фармацевтических средств, эффективных в отношении хронической реакции отторжения и имеющих незначительные побочные эффекты (непатентные документы 13 и 14).
Описанная выше необходимость разработки новой иммуносупрессивной терапии для подавления хронической реакции отторжения является предпосылкой настоящего исследования.
Документы предшествующего уровня настоящего изобретения описаны ниже.
[Патентный документ 1] Публикация международной патентной заявки № WO 95/09873
[Патентный документ 2] Патентная заявка Франции № FR 2694767
[Патентный документ 3] Патент США № 5216128
[Патентный документ 4] WO 92/19759
[Непатентный документ 1] Hirano, T. et al., Nature (1986) 324, 73-76
[Непатентный документ 2] Akira, S. et al., Adv. in Immunology (1993) 54, 1-78
[Непатентный документ 3] Lotz, M. et al., J. Exp. Med. (1988) 167, 1253-1258
[Непатентный документ 4] Taga, T. et al., J. Exp. Med. (1987) 166, 967-981
[Непатентный документ 5] Yamasaki, K. et al., Science (1988) 241, 825-828
[Непатентный документ 6] Taga, T. et al., Cell (1989) 58, 573-581
[Непатентный документ 7] Novick, D. et al., Hybridoma (1991) 10, 137-146
[Непатентный документ 8] Huang, Y. W. et al., Hybridoma (1993) 12, 621-630
[Непатентный документ 9] Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906
[Непатентный документ 10] Wong, B. W. et al., Cardiovasc. Pathol. (2005) 14, 176-80
[Непатентный документ 11] Hornick, P. et al., Methods Mol. Biol. (2006) 333, 131-44
[Непатентный документ 12] Ramzy, D. et al., Can. J. Surg., (2005) 48, 319-327
[Непатентный документ 13] Valantine, H., J. Heart Lung Transplant (2004) 23(5 Suppl), S187-93
[Непатентный документ 14] Webber, S. A. et al., Lancet (2006) 368, 53-69
[Непатентный документ 15] Izawa, A., et al., Circ. J. (2007) 71(Suppl I), 392 (Annual Scientific Meeting of the Japanese Circulation Society, Kobe, Mar 15-Mar 17, 2007; Abstract PE-269)
[Непатентный документ 16] Izawa, A., et al., Am. J. Transplant. (2007) 7 (Suppl 11), 426 (American Transplant Congress, San Francisco, CA, Mar 5-Mar 9, 2007; Abstract 1084)
Описание изобретения
[Проблемы, решаемые изобретением]
Настоящее изобретение было выполнено при условиях, описанных выше. Целью настоящего изобретения является предоставление средств для подавления хронической реакции отторжения, которые содержат ингибитор IL-6 в качестве активных ингредиентов.
Дополнительной целью настоящего изобретения является предоставление способов подавления хронической реакции отторжения, которые включают стадию введения субъектам ингибитора IL-6.
[Средства решения проблем]
Для достижения описанных выше целей авторы изобретения проводили исследование антител к рецептору IL-6 в отношении их эффекта подавления хронической реакции отторжения.
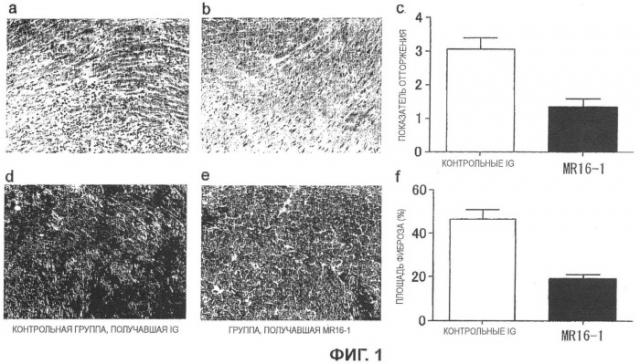
Авторы изобретения оценивали эффект подавления хронической реакции отторжения при введении антител к рецептору IL-6 мыши (MR16-1), используя для этого мышиную модель хронического отторжения после трансплантации сердца. В результате гистопатологического анализа трансплантированных сердец, удаленных через 60 дней после трансплантации, было выявлено, что фиброз миокарда и стенотические поражения сосудов, являющиеся патологическими состояниями, характерными для хронической реакции отторжения, были значительно подавлены у группы, получавшей MR16-1, по сравнению с контрольной группой. Таким образом, было продемонстрировано, что MR16-1 обладает эффектом подавления хронической реакции отторжения.
Таким образом, авторы впервые обнаружили, что введение антител к рецептору IL-6 подавляет реакцию отторжения в хронической фазе после трансплантации органов, и, таким образом, изобретение было завершено.
Более конкретно, настоящее изобретение касается следующего:
[1] средства для подавления хронической реакции отторжения, которое содержит ингибитор IL-6 в качестве активного ингредиента;
[2] средства для подавления хронической реакции отторжения по п.[1], в котором ингибитор IL-6 представляет собой антитело, распознающее IL-6;
[3] средства для подавления хронической реакции отторжения по п.[1], в котором ингибитор IL-6 представляет собой антитело, распознающее рецептор IL-6;
[4] средства для подавления хронической реакции отторжения по пп.[2] или [3], в котором антитело представляет собой моноклональное антитело;
[5] средства для подавления хронической реакции отторжения по пп.[2] или [3], в котором антитело представляет собой антитело, распознающее IL-6 человека или рецептор IL-6 человека;
[6] средства для подавления хронической реакции отторжения по пп.[2] или [3], в котором антитело представляет собой рекомбинантное антитело;
[7] средства для подавления хронической реакции отторжения по любому из пп.[2]-[6], в котором антитело представляет собой химерное, гуманизированное антитело или антитело человека;
[8] средства для подавления хронической реакции отторжения по любому из пп.[1]-[7], которое используют для подавления хронической реакции отторжения при трансплантации сердца;
[9] способа подавления хронической реакции отторжения, который включает стадию введения субъекту ингибитора IL-6;
[10] способа по п.[9], в котором ингибитор IL-6 представляет собой антитело, распознающее IL-6;
[11] способа по п.[9], в котором ингибитор IL-6 представляет собой антитело, распознающее рецептор IL-6;
[12] способа по пп.[10] или [11], в котором антитело представляет собой моноклональное антитело;
[13] способа по пп.[10] или [11], в котором антитело представляет собой антитело, распознающее IL-6 человека или рецептор IL-6 человека;
[14] способа по пп.[10] или [11], в котором антитело представляет собой рекомбинантное антитело;
[15] способа по любому из пп.[10]-[14], в котором антитело представляет собой химерное, гуманизированное антитело или антитело человека;
[16] способа по любому из пп.[9]-[15], который подавляет хроническую реакцию отторжения при трансплантации сердца;
[17] применения ингибитора IL-6 при получении средства, подавляющего хроническую реакцию отторжения;
[18] применения по п.[17], в котором ингибитор IL-6 представляет собой антитело, распознающее IL-6;
[19] применения по п.[17], в котором ингибитор IL-6 представляет собой антитело, распознающее рецептор IL-6;
[20] применения по пп.[18] или [19], в котором антитело представляет собой моноклональное антитело;
[21] применения по пп.[18] или [19], в котором антитело представляет собой антитело, распознающее IL-6 человека или рецептор IL-6 человека;
[22] применения по пп.[18] или [19], в котором антитело представляет собой рекомбинантное антитело;
[23] применения по любому из пп.[18]-[22], в котором антитело представляет собой химерное, гуманизированное антитело или антитело человека; и
[24] ингибитора IL-6 для применения при подавлении хронической реакции отторжения.
Способ осуществления изобретения
Авторы изобретения обнаружили, что введение антител к рецептору IL-6 может подавлять хроническую реакцию отторжения. Настоящее изобретение основано на этом открытии.
Настоящее изобретение относится к средствам для подавления хронической реакции отторжения, которые содержат в качестве активного ингредиента ингибитор IL-6.
В настоящем описании «ингибитор IL-6» представляет собой вещество, которое блокирует опосредуемую IL-6 сигнальную трансдукцию и ингибирует биологическую активность IL-6. Предпочтительным ингибитором IL-6 является вещество, которое ингибирует связывание IL-6, рецептора IL-6 или gp130.
Ингибиторы IL-6 по настоящему изобретению включают, но не ограничены, например, антитела к IL-6, антитела к рецептору IL-6, антитела к gp130, варианты IL-6, растворимые варианты рецептора IL-6 и частичные пептиды IL-6 или рецептора IL-6, и низкомолекулярные соединения и белки (например, C326 Avimer (Nature Biotechnology (2005) 23, 1556-61)), для которых показана аналогичная активность. Предпочтительные ингибиторы IL-6 по настоящему изобретению включают антитела, узнающие рецепторы IL-6.
В настоящем изобретении источник антител особо не ограничен; однако, предпочтительно, чтобы антитела были получены от млекопитающих, или, более предпочтительно, были получены от человека.
Антитела к IL-6, используемые в настоящем изобретении, можно получить в виде поликлональных или моноклональных антител с использованием известных способов. В частности, в настоящем изобретении в качестве антител к IL-6 предпочтительно использовать моноклональные антитела, полученные от млекопитающих. Моноклональные антитела, полученные от млекопитающих, включают антитела, полученные из гибридом, и антитела, полученные генно-инженерными способами из хозяев, трансформированных экспрессионным вектором, который содержит ген антитела. Связывая IL-6, антитело ингибирует связывание IL-6 с рецептором IL-6, и, таким образом, блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают антитела MH166 (Matsuda, T. et al., Eur. J. Immunol. (1988) 18, 951-956), антитело SK2 (Sato, K. et al., transaction of the 21st Annual Meeting of the Japanese Society for Immunology (1991) 21, 166) и т.п.
Главным образом, гибридомы, продуцирующие антитела к IL-6, можно получить с использованием известных методик, как описано ниже: а именно, такие гибридомы можно получить, используя IL-6 в качестве сенсибилизирующего антигена для проведения иммунизации с помощью обычного способа иммунизации, далее осуществляя слияние полученных иммунных клеток с известными родительскими клетками обычным способом слияния клеток, и проводя скрининг на клетки, продуцирующие моноклональные антитела с помощью обычного способа скрининга.
Конкретнее, антитела к IL-6 можно получить, как описано ниже: например, IL-6 человека для использования в качестве сенсибилизирующего антигена при получении антител можно получить, используя ген и/или аминокислотные последовательности IL-6, раскрытые в Eur. J. Biochem. (1987) 168, 543-550; J. Immunol. (1988) 140, 1534-1541; и/или Agr. Biol. Chem. (1990) 54, 2685-2688.
После трансформации подходящей клетки-хозяина известной экспрессионной векторной системой, в которую встроена последовательность гена IL-6, проводят с помощью известных способов очистку целевого белка IL-6 из содержимого клеток-хозяев или из культурального супернатанта. Этот очищенный белок IL-6 можно использовать в качестве сенсибилизирующего антигена. В альтернативном варианте в качестве сенсибилизирующего антигена можно использовать слитый белок, состоящий из белка IL-6 и другого белка.
Антитела к рецептору IL-6, используемые в настоящем изобретении, можно получить в виде поликлональных или моноклональных антител с помощью известных способов. В частности, в настоящем изобретении в качестве антител к рецептору IL-6 предпочтительно использовать моноклональные антитела, полученные от млекопитающих. Моноклональные антитела, полученные от млекопитающих, включают антитела, полученные из гибридом, и антитела, полученные генно-инженерными способами из хозяев, трансформированных экспрессионным вектором, который содержит ген антитела. Связывая рецептор IL-6, антитело ингибирует связывание IL-6 с рецептором IL-6, и, таким образом, блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают: антитело MR16-1 (Tamura, T. et al., Proc. Natl. Acad. Sci. USA (1993) 90, 11924-11928); антитело PM-1 (Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906); антитело AUK12-20, антитело AUK64-7 и антитело AUK146-15 (Публикация международной патентной заявки № WO 92/19759)и т.п. Из этих антител РМ-1 может представлять собой пример предпочтительного моноклонального антитела против рецептора IL-6 человека, а MR16-1 - пример предпочтительного моноклонального антитела против рецептора IL-6 мыши.
В общем, гибридомы, продуцирующие моноклональные антитела к рецептору IL-6, можно получить с помощью известных методик, как описано ниже: а именно, такие гибридомы можно получить, используя рецептор IL-6 в качестве сенсибилизирующего антигена для проведения иммунизации с помощью обычного способа иммунизации, далее осуществляя слияние полученных иммунных клеток с известными родительскими клетками обычным способом слияния клеток, и проводя скрининг на клетки, продуцирующие моноклональные антитела, с помощью обычного способа скрининга.
Более конкретно, антитела к рецептору IL-6 можно получить, как описано ниже: например, рецептор IL-6 человека или рецептор IL-6 мыши для использования в качестве сенсибилизирующего антигена при получении антител можно получить, используя гены и/или аминокислотные последовательности рецепторов IL-6, раскрытые в публикации европейской патентной заявки № EP 325474 и в публикации японской патентной заявки Kokai № (JP-A) H03-155795 (нерассмотренная, опубликованная японская патентная заявка), соответственно.
Существует два типа белков-рецепторов IL-6: один, экспрессированный на клеточной мембране, а другой - не прикрепленный к клеточной мембране (растворимые рецепторы IL-6) (Yasukawa, K. et al., J. Biochem. (1990) 108, 673-676). Растворимый рецептор IL-6 состоит преимущественно из внеклеточной области связанного с клеточной мембраной рецептора IL-6 и отличается от мембраносвязанного рецептора IL-6 тем, что у него отсутствуют трансмембранная область или и трансмембранная, и внутриклеточная области. В качестве белка-рецептора IL-6 можно использовать любой рецептор IL-6, если его можно взять в качестве сенсибилизирующего антигена для получения антител к рецептору IL-6, используемых в настоящем изобретении.
После трансформации подходящей клетки-хозяина известной экспрессионной векторной системой, в которую встроена последовательность гена рецептора IL-6, с помощью известного способа проводят очистку целевого белка рецептора IL-6 из содержимого клеток-хозяев или из культурального супернатанта. Этот очищенный белок рецептор IL-6 можно использовать в качестве сенсибилизирующего антигена. В альтернативном варианте в качестве сенсибилизирующего антигена можно использовать клетку, экспрессирующую рецептор IL-6, или слитый белок, состоящий из белка-рецептора IL-6 и другого белка.
Антитела к gp130, используемые в настоящем изобретении, можно получить в виде поликлональных или моноклональных антител с помощью известных способов. В частности, в настоящем изобретении в качестве антител к gp130 предпочтительно использовать моноклональные антитела, полученные от млекопитающих. Моноклональные антитела, полученные от млекопитающих, включают антитела, полученные из гибридом, и антитела, полученные генно-инженерными способами из хозяев, трансформированных экспрессионным вектором, который содержит ген антитела. Связывая gp130, антитело ингибирует связывание gp130 с комплексом IL-6 и рецептора IL-6, и, таким образом, блокирует передачу биологической активности IL-6 в клетку.
Такие антитела включают: антитело АМ64 (JP-A (Kokai) H03-219894), антитело 4B11 и антитело 2H4 (US 5571513), антитело B-S12 и антитело B-P8 (JP-A (Kokai) H08-291199) и т.п.
Главным образом, гибридомы, продуцирующие моноклональные антитела к gp130, можно получить с помощью известных методик, как описано ниже: а именно, такие гибридомы можно получить, используя gp130 в качестве сенсибилизирующего антигена для проведения иммунизации с помощью обычного способа иммунизации, далее осуществляя слияние полученных иммунных клеток с известными родительскими клетками обычным способом слияния клеток, и проводя скрининг на клетки, продуцирующие моноклональные антитела, с помощью обычного способа скрининга.
Конкретнее, моноклональные антитела можно получить, как описано ниже: например, gp130 для использования в качестве сенсибилизирующего антигена при получении антител можно получить, используя ген и/или аминокислотную последовательность gp130, раскрытые в публикации европейской патентной заявки № EP 411946.
После трансформации подходящей клетки-хозяина известной экспрессионной векторной системой, в которую встроена последовательность гена gp130, с помощью известного способа проводят очистку целевого белка gp130 из содержимого клеток-хозяев или из культурального супернатанта. Этот очищенный белок gp130 можно использовать в качестве сенсибилизирующего антигена. В альтернативном варианте в качестве сенсибилизирующего антигена можно использовать клетку, экспрессирующую gp130, или слитый белок, состоящий из белка gp130 и другого белка.
Выбор млекопитающих животных для иммунизации сенсибилизирующим антигеном конкретно не ограничен, но предпочтительно выбирать млекопитающее с учетом совместимости его В-клеток с родительской клеткой, используемой при слиянии клеток. Обычно используют грызунов, таких как мыши, крысы и хомячки.
Иммунизацию животных сенсибилизирующими антигенами проводят известными способами. Например, в качестве общего способа, животных иммунизируют внутрибрюшинной или подкожной инъекцией сенсибилизирующего антигена. А именно, предпочтительно разводить или ресуспендировать сенсибилизирующий антиген в соответствующем количестве фосфатного буфера (PBS), физиологического раствора или аналогичного раствора, смешанного с соответствующим количеством обычного адъюванта (например, полного адъюванта Фрейнда), эмульгировать и затем вводить млекопитающему несколько раз, через интервалы от 4 до 21 дней. В дополнение, для иммунизации сенсибилизирующим антигеном можно использовать подходящий носитель.
После иммунизации подтверждают повышенный уровень целевого антитела в сыворотке, а затем получают от млекопитающего иммунные клетки для слияния клеток. Предпочтительные иммунные клетки для слияния включают, в частности, клетки селезенки.
Клетки миеломы млекопитающих, используемые в качестве родительских клеток, т.е. в качестве клеток-партнеров для слияния с полученными иммунными клетками, включают различные известные клеточные штаммы, например, P3X63Ag8.653 (Kearney, J. F. et al., J. Immunol (1979) 123, 1548-1550), P3X63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler, G. and Milstein, C., Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies, D. H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), F0 (de St. Groth, S. F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I. S., J. Exp. Med. (1978) 148, 313-323), R210 (Galfre, G. et al., Nature (1979) 277, 131-133) и т.п.
В общем, слияние вышеупомянутых иммунных клеток и миеломных клеток можно осуществить, используя известные способы, например способ Milstein et al. (Kohler, G. and Milstein, C., Methods Enzymol. (1981) 73, 3-46) и т.п.
Более конкретно, вышеупомянутое слияние клеток проводят в обычной питательной культуральной среде в присутствии средства, усиливающего слияние клеток. Например, в качестве средств, усиливающих слияние клеток, используют полиэтиленгликоль (ПЭГ), вирус Сендай (HVJ) и т.п. Кроме того, при необходимости, для увеличения специфичности слияния можно добавить вспомогательные средства, такие как диметилсульфоксид.
Используемое соотношение иммунных клеток к миеломным, предпочтительно, составляет, например, от 1 до 10 иммунных клеток на каждую миеломную клетку. Для вышеупомянутого слияния клеток используют культуральную среду, например RPMI1640 или MEM, которая подходит для пролиферации вышеупомянутых миеломных клеток. Также можно использовать обычную культуральную среду, используемую для культивирования этого типа клеток. Кроме того, вместе со средой можно использовать различные сывороточные добавки, такие как фетальная телячья сыворотка (FCS).
При слиянии клеток представляющие интерес слитые клетки (гибридомы) образуются при смешивании определенных количеств вышеупомянутых иммунных клеток и миеломных клеток в вышеупомянутой культуральной среде, а затем добавлении и смешивании до концентрации от 30% до 60% (вес/объем) раствор ПЭГ (например, раствор ПЭГ со средним молекулярным весом примерно от 1000 до 6000), нагретого до примерно 37°С. Затем можно удалить средства для клеточного слияния и т.п., которые не подходят для роста гибридом, добавляя несколько раз подходящую культуральную среду, а затем удаляя супернатант центрифугированием.
Вышеуказанные гибридомы отбирают, культивируя клетки в обычной культуральной среде для селекции, например культуральной среде НАТ (культуральной среде, содержащей гипоксантин, аминоптерин и тимидин). Культивирование в культуральной среде НАТ продолжают в течение достаточного периода времени, обычно от нескольких дней до нескольких недель, для того, чтобы уничтожить клетки (неслитые клетки), отличные от представляющих интерес гибридом. Затем с помощью стандартного метода предельных разведений проводят скрининг и клонирование гибридом, продуцирующих представляющие интерес антитела.
Помимо способов иммунизации животных (кроме человека) антигенами, для того чтобы получить вышеупомянутые гибридомы, целевые антитела человека, связывающие целевой антиген или антиген-экспрессирующую клетку, можно получить сенсибилизацией лимфоцитов человека целевым антигенным белком или антиген-экспрессирующей клеткой in vitro, и слиянием сенсибилизированного В-лимфоцита с клеткой миеломы человека (например, U266) (смотри публикацию японской патентной заявки (Kokoky) № (JP-B) H01-59878 (рассмотренная, одобренная японская патентная заявка, опубликованная для опротестования)). Кроме того, целевое антитело человека можно получить введением антигена или антиген-экспрессирующей клетки трансгенному животному, которое имеет репертуар генов антител человека, и затем следуя вышеупомянутому способу (смотри публикации международных патентных заявок №№ WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735).
Полученные таким образом гибридомы, продуцирующие моноклональные антитела, можно субкультивировать в обычной культуральной среде и хранить в жидком азоте в течение длительного периода времени.
При получении моноклональных антител из вышеупомянутых гибридом можно использовать следующие способы: (1) способы, в которых гибридомы культивируют обычными способами, а антитела получают в виде культурального супернатанта; (2) способы, в которых гибридомы размножают введением их совместимому млекопитающему, а антитела получают в виде асцитов; и т.п. Первый способ предпочтителен для получения антител с большой чистотой, а последний предпочтителен для крупномасштабного получения антител.
Например, гибридомы, продуцирующие антитела к рецептору IL-6, можно получить способом, раскрытым в JP-A (Kokai) H03-139293. Такие гибридомы можно получить инъекцией гибридомы, продуцирующей РМ-1, в брюшную полость мыши BALB/с, получением асцитов, и затем очисткой антитела РМ-1 из асцитов; или культивированием гибридомы в подходящей культуральной среде (например, среде RPMI1640, содержащей 10% фетальной бычьей сыворотки и 5% BM-Condimed H1 (Boehringer Mannheim), гибридомной среде SFM (GIBCO-BRL), среде PFHM-II (GIBCO-BRL) и т.д.), и затем получением антител РМ-1 из культурального супернатанта.
В качестве моноклональных антител по настоящему изобретению можно использовать рекомбинантные антитела, где антитела получают с использованием методик генетической рекомбинации клонированием гена антитела из гибридомы, встраиванием гена в соответствующий вектор и, затем, введением вектора хозяину (смотри, например, Borrebaeck, C. A. K. and Larrick, J. W., Therapeutic Monoclonal Antibodies, опубликовано в Соединенном Королевстве Macmillan Publishers Ltd, 1990).
Более конкретно, молекулы мРНК, кодирующие вариабельные (V) области антитела, выделяют из клеток, продуцирующих представляющие интерес антитела, таких как гибридомы. мРНК можно выделить, получая тотальную РНК известными способами, таким как способ ультрацентрифугирования в гуанидине (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299) и AGPC-способ (Chomczynski, P. et al., Anal. Biochem. (1987) 162, 156-159), и получая мРНК с помощью набора для очистки мРНК - mRNA Purification Kit (Pharmacia), и т.п. В качестве альтернативы, мРНК можно выделить напрямую, используя набор для выделения мРНК QuickPrep mRNA Purification Kit (Pharmacia).
Молекулы кДНК V-областей антитела синтезируют из полученных мРНК с использованием обратной транскриптазы. кДНК можно синтезировать с использованием набора для синтеза первой цепи кДНК с обратной транскриптазой AMV (AMV Reverse Transcriptase First-strand cDNA Synthesis Kit) и т.п. Кроме того, для синтеза и амплификации кДНК можно применить метод 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932), используя набор 5'-Ampli FINDER RACE Kit (Clontech) и ПЦР. Представляющий интерес фрагмент ДНК очищают из полученных ПЦР-продуктов и затем лигируют с векторной ДНК. Затем, используя вышеописанную ДНК, получают рекомбинантный вектор и вводят в Escherichia coli (E. coli) или аналогичные бактерии, а затем отбирают колонии для получения целевого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК подтверждают, например, дидезокси-методом (секвенированием по Сэнгеру).
После получения ДНК, кодирующей V-область представляющего интерес антитела, ДНК лигируют с ДНК, которая кодирует желаемую константную область антитела (С-область), и встраивают в экспрессионный вектор. В качестве альтернативы, ДНК, кодирующую V-область антитела, можно встроить в экспрессионный вектор, содержащий ДНК С-области антитела.
Чтобы получить антитело для применения в настоящем изобретении, как описано ниже, ген антитела встраивают в экспрессионный вектор таким образом, что его экспрессию контролирует область регуляции экспрессии, например энхансер и промотор. Затем антитело можно экспрессировать, трансформируя клетку-хозяина этим экспрессионным вектором.
Чтобы снизить гетероантигенность против человека и т.п. в настоящем изобретении можно использовать искусственно модифицированные генно-инженерные антитела, например химерные антитела, гуманизированные антитела или антитела человека. Эти модифицированные антитела можно получить с использованием известных способов.
Химерное антитело можно получить лигированием ДНК, кодирующей V-область антитела, полученной, как описано выше, с ДНК, кодирующей С-область антитела человека, затем встраиванием ДНК в экспрессионный вектор и введением его в хозяина для продукции антитела (смотри публикацию европейской патентной заявки № EP 125023; публикацию международной патентной заявки № WO 92/19759). Этот известный способ можно использовать для получения химерных антител, пригодных для настоящего изобретения.
Гуманизированные антитела также называют реконструированными антителами человека, и они представляют собой антитела, в которых определяющие комплементарность области (CDR) антитела из млекопитающего (кроме человека) (например, мышиного антитела) переносят в CDR антител человека. Общие способы для данной рекомбинации генов также известны (смотри публикацию европейской патентной заявки № EP 125023, публикацию международной патентной заявки № WO 92/19759).
Более конкретно, последовательности ДНК, сконструированные таким образом, что CDR мышиного антитела лигированы с каркасными областями (FR) антитела человека, синтезируют с помощью ПЦР из нескольких олигонуклеотидов, которые содержат перекрывающиеся участки на своих концах. Полученную ДНК лигируют с ДНК, кодирующей С-область антитела человека, и затем встраивают в экспрессионный вектор. Экспрессионный вектор вводят хозяину для получения гуманизированного антитела (смотри публикацию европейской патентной заявки № EP 239400, публикацию международной патентной заявки № WO 92/19759).
Молекулы FR антитела человека, которые лигируют через CDR, выбирают так, чтобы CDR образовали подходящие антиген-связывающие участки. Аминокислоту (аминокислоты) в FR вариабельных областей антитела можно, при необходимости, заменить таким образом, чтобы CDR реконструированного антитела человека образовали соответствующий антиген-связывающий участок (Sato, K. et al., Cancer Res. (1993) 53, 851-856).
В химерных и гуманизированных антителах используют С-области антител человека, включающие Cγ. Например, можно использовать Сγ1, Сγ2, Сγ3 и Сγ4. Кроме того, для увеличения стабильности антител и их продукции С-области антитела человека можно модифицировать.
Химерные антитела состоят из вариабельной области антитела, полученного из млекопитающего (кроме человека) и константной области антитела, полученного из человека; гуманизированные антитела состоят из CDR антитела, полученного из млекопитающего (кроме человека) и каркасных областей и константных областей, полученных из антитела человека. Оба эти антитела обладают пониженной антигенностью у человека, и, поэтому, пригодны в качестве антител для применения в настоящем изобретении.
Предпочтительные конкретные примеры гуманизированных антител для применения в настоящем изобретении включают гуманизированное антитело РМ-1 (смотри публикацию международной патентной заявки № WO 92/19759).
Кроме того, в дополнение к вышеупомянутым способам получения антител человека также известны методики получения антител человека паннингом с использованием библиотеки антител человека. Например, с помощью фагового дисплея можно экспрессировать на поверхности фагов вариабельные области антител человека в виде одноцепочечных антител (scFv), а затем можно отбирать фаги, связывающие антиген. Анализом генов отобранных фагов можно определить последовательности ДНК, кодирующие вариабельные области антитела человека, которые связываются с антигеном. После выявления последовательности ДНК scFv, которое связывается с антигеном, можно сконструировать соответствующий экспрессионный вектор, содержащий данную последовательность, чтобы получить антитело человека. Эти способы уже известны, и в качестве ссылок можно использовать публикации WO 92/01047, WO 92/20791, WO93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388.
Гены антител, сконструированных описанным выше способом, можно экспрессировать стандартными способами. В клетках млекопитающих ген антитела можно экспрессировать, используя ДНК, в которой ген антитела функционально лигирован с пригодным обычно используемым промотором и поли-А сигналом ниже гена антитела, или можно использовать вектор, содержащий ДНК. Примеры промотора/энхансера включают ранний промотор/энхансер цитомегаловируса человека.
Кроме того, другие промоторы/энхансеры, которые можно использовать для экспрессии антител, используемых в настоящем изобретении, включают вирусные промоторы/энхансеры ретровирусов, полиомавирусов, аденовирусов, вируса обезьян 40 (SV40) и т.п.; а также включают промоторы/энхансеры клеток млекопитающих, такие как промотор/энхансер фактора элонгации 1α человека (HEF1α).
Например, при использовании промотора/энхансера SV40 экспрессию легко проводить следующим способом по Mulligan et al. (Mulligan, R. C. et al., Nature (1979) 277, 108-114). В качестве альтернативы, при использовании промотора/энхансера HEF1α можно использовать способ Mizushima et al. (Mizushima, S. and Nagata S., Nucleic Acids Res. (1990) 18, 5322).
В E. coli ген антитела можно экспрессировать, функционально лигируя экспрессируемый ген антитела со стандартным промотором и сигнальной последовательностью для секреции антитела. Примеры промоторов включают промотор lacZ, промотор araB и т.п. При использовании промотора lacZ гены можно экспрессировать по способу Ward et al. (Ward, E. S. et al., Nature (1989) 341, 544-546; Ward, E. S. et al., FASEB J. (1992) 6, 2422-2427); а промотор araB можно использовать по способу Better et al. (Better, M. et al., Science (1988) 240, 1041-1043).
Если антитело получают в периплазме E. coli, то в качестве сигнальной последовательности для секреции антитела можно использовать сигнальную последовательность pel B (Lei, S. P. et al., J. Bacteriol. (1987) 169, 4379-4383). Полученные в периплазме антитела выделяют и затем используют после соответствующего рефолдинга структуры антитела (смотри, например, WO 96/30394).
В качестве точки инициации репликации можно использовать точки инициации репликации SV40, полиомавируса, аденовируса, вируса бычьей папилломы (BPV) и т.п. Дополнительно, для увеличения числа копий гена в клетках-хозяевах, экспрессионный вектор может содержать в качестве маркера селекции ген аминогликозид-фосфотрансферазы (АРН), ген тимидин-киназы (ТК), ген ксантин-гуанидин фосфорибозилтрансферазы E. coli (Ecogpt), ген дегидрофолат-редуктазы (dhfr) или аналогичный ген.
Для применения в настоящем изобретении антитела можно получать с помощью лю