Анти-глипикан 3-антитело, имеющее модифицированную сахарную цепь
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Описаны варианты композиций антител класса IgGl, направленных к человеческому глипикану 3. Каждая композиция содержит в эффективном количестве смесь антител к человеческому глипикану 3. Смесь состоит из антител стандартного строения и либо более 20% антител, лишенных фукозы, либо антител, имеющих двурассекающй N-ацетилглюкозамид. Каждое из антител характеризуется определенной аминокислотной последовательностью. В одном варианте композиции антитело содержит три CDR легкой и три CDR тяжелой цепи. В другом варианте каждое из антител характеризуется наличием вариабельных областей тяжелой и легкой цепей. Описаны варианты способа получения антитела к глипикану 3 человека с использованием клетки с уменьшенной способностью присоединения фукозы к сахарным цепям, в которую введен ген, кодирующий антитело из композиции. Предложено противораковое средство на основе композиции антител. Использование изобретения обеспечивает увеличение ADCC цитотоксической активности, что может найти применение в терапии рака. 5 н. и 5 з.п. ф-лы, 7 ил., 2 табл., 9 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к антителу к антигену глипикану 3 (т.е. анти-глипикан 3-антителу), в котором цитотоксическая активность, в частности антителозависимая клеточноопосредованная цитотоксичность (ADCC), является усиленной, а также к способу получения этого антитела.
УРОВЕНЬ ТЕХНИКИ
Глипикан 3 (GPC3) является членом семейства гепарансульфат-протеогликанов, присутствующих на поверхности клеток. Было предположено, что GPC3 может участвовать в клеточном делении при развитии и в росте раковых клеток.
Было обнаружено, что тип антитела, который связывается с GPC3, ингибирует рост клеток вследствие активности ADCC (антителозависимой клеточноопосредованной цитотоксичности) и активности CDC (комплементзависимой цитотоксичности) (WO 2003/00883). Кроме того, поскольку GPC3 расщепляется в теле и секретируется в кровь в виде растворимой формы GPC3, было сделано предположение, что рак может диагностироваться с использованием антитела, которое может детектировать растворимую форму GPC3 (WO 2004/022739, WO 2003/100429, WO 2004/018667).
При развитии противоракового агента, который использует цитотоксическую активность антитела, используемое антитело предпочтительно будет иметь высокий уровень активности ADCC. Таким образом, требовалось анти-GPC3-антитело с высоким уровнем цитотоксической активности.
Известно, что модификация сахарных цепей антитела усиливает его ADCC-активность. Например, в WO 99/54342 описано, что ADCC-активность усиливается модификацией гликозилирования антитела. Кроме того, в WO 00/61739 описано, что ADCC-активность регулируется контролированием присутствия или отсутствия фукозы в сахарных цепях антитела. В WO 02/31140 описано получение антитела, имеющего сахарные цепи, которые не содержат α-1,6-фукозы основной структуры (кора) сахарной цепи, продуцированием этого антитела в клетках YB2/0. В WO 02/79255 описано антитело с сахарными цепями, имеющими двурассеченный GlcNAc. Однако анти-GPC3-антитело с повышенной активностью ADCC вследствие модификации сахарной цепи до сих пор не было описано.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает композицию анти-GPC3-антител с повышенной ADCC-активностью, обусловленной изменением его представляющего сахарную цепь компонента, а также способ получения такого антитела.
После многочисленных исследований авторы данного изобретения обнаружили, что антитела против GPC3 с сахарными цепями, лишенными α-1,6-фукозы основной структуры (кора), имеют высокий уровень цитотоксической активности. Таким образом, данное изобретение обеспечивает композицию анти-GPC3-антител, в которых представляющий сахарную цепь компонент антитела был изменен, и, более конкретно, композицию антител с большей фракцией фукоза-недостаточных анти-GPC3-антител. Композиция анти-GPC3-антител с модифицированной сахарной цепью данного изобретения имеет высокий уровень цитотоксической активности и, следовательно, применима в качестве ингибитора роста клеток, такого как противораковый агент.
Данное изобретение обеспечивает также способ получения композиции анти-GPC3-антител, в которых сахарная цепь антитела является модифицированной, предусматривающий стадии: введения нуклеиновой кислоты, кодирующей анти-GPC3-антитело, в клетку-хозяина с уменьшенной способностью присоединения фукозы, такую как клетки YB2/0, и культивирования этой клетки-хозяина для получения этого антитела. Предпочтительно, клеткой с уменьшенной способностью присоединения фукозы к сахарным цепям является клетка, лишенная транспортера фукозы.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1 показывает основную структуру N-гликозид-связанных сахарных цепей;
Фиг. 2 показывает активность ADCC химерного антитела, когда мишенями являются клетки НерG2, с использованием моноцитов периферической крови человека (PBMC);
Фиг. 3 показывает активность ADCC химерного антитела, когда мишенью являются клетки HuH-7, с использованием PBMC человека;
Фиг. 4 показывает активность ADCC антител, когда мишенями являются клетки HuH-7, с использованием PBMC человека;
Фиг. 5 показывает хроматограммы ВЖХ с нормальной фазой сахарных цепей, модифицированных α-галактозил-2-АВ, полученных из антител (a, b, c), продуцируемых клетками FT-KO и клетками СНО;
Фиг. 6 показывает предсказанные структуры для пиков G(0)- и G(0)-Fuc, показанных на фиг. 5; и
Фиг. 7 показывает график измерений дифференциальной сканирующей калориметрии (DSC) для антител, продуцируемых клетками FT-KO (а) и клетками СНО (b).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение описывает композицию анти-GPC3-антител, в которых компонент, представляющий сахарную цепь, этого антитела был модифицирован. Известно, что структура сахарной цепи, связанной с антителом, оказывает существенное влияние на проявление цитотоксической активности антитела. Сахарные цепи, которые связаны с антителом, включают в себя N-гликозид-связанные сахарные цепи, которые присоединены к атому азота на боковой цепи остатка аспарагина, и О-гликозид-связанные сахарные цепи, которые присоединены к гидроксильной группе на боковой цепи остатка серина или треонина на молекуле антитела. Данное изобретение сфокусировано на присутствии или отсутствии фукозы в N-гликозид-связанной сахарной цепи.
Фиг. 1 показывает основную структуру N-гликозид-связанных сахарных цепей, присоединенных к антителу. Как показано в основных сахарных цепях IgG (1) и (3) фиг. 1, N-гликозид-связанные сахарные цепи имеют основную структуру (кор), в которой один остаток маннозы (Man) и два остатка N-ацетилглюкозамина (GlcNAc) связаны β-1,4-связями [-Man β1-4GlcNAc β-1-4GlcNAc-]. «GlcNAc» на правой стороне этой структуры называют восстанавливающим концом, а “Man” на левой стороне этой структуры называют невосстанавливающим концом. Когда фукоза связана с восстанавливающим концом, она обычно принимает форму α-связи между положением 6 N-ацетилглюкозамина на восстанавливающем конце и положением 1 фукозы. С другой стороны, в сахарной цепи, показанной в основной сахарной цепи IgG (2) фиг. 1, наряду с вышеупомянутыми двумя сахарными цепями, N-ацетилглюкозамин (GlcNAc) связан с невосстанавливающим концом основной структуры (кора) через β-1,4-связь. Этот тип N-ацетилглюкозамина (GlcNAc) называют «двурассекающим N-ацетилглюкозамином». Сахарной цепью, имеющей двурассекающий N-ацетилглюкозамин, может быть О-гликозид-связанная сахарная цепь или N-гликозид-связанная сахарная цепь, и она образуется переносом N-ацетилглюкозамина к сахарной цепи N-ацетилглюкозаминтрансферазой III (GnTIII). Ген, кодирующий этот фермент, уже был клонирован, и сообщались как аминокислотная последовательность, так и нуклеотидная последовательность ДНК, кодирующей этот фермент (База данных NCBI (ACCESSION D13789)).
В данном изобретении композицией антител с модифицированным или измененным компонентом, представляющим сахарную цепь, (композицией антител с модифицированной сахарной цепью) называют композицию антител, имеющих компонент, представляющий сахарную цепь, которая отличается от композиции антител, продуцируемых клеткой-хозяином, служащей в качестве референсного стандарта.
В данном изобретении можно определить, был или не был представляющий сахарную цепь компонент модифицирован с использованием в качестве референсного стандарта композиции антител, продуцируемых клеткой-хозяином, служащей в качестве референсного стандарта. Если композиция антител имеет представляющий сахарную цепь компонент, отличающийся от композиции антител из референсного стандарта, то эту композицию антител считают композицией антител с модифицированным компонентом, представляющим сахарную цепь.
Клеткой-хозяином, служащей в качестве ссылочного стандарта в данном изобретении, является клетка СНО DG44. Клетка СНО DG44 может быть получена, например, из Invitrogen Corporation.
Примеры композиции антител с модифицированным компонентом, представляющим сахарную цепь, включают в себя, например, композицию антител с увеличенной долей фукоза-недостаточных (например, недостаточных в отношении α-1,6-фукозы кора (основной структуры)) антител в этой композиции антител, и композицию антител с увеличенной долей антител, имеющих присоединенный двурассекающий N-ацетилглюкозамин (GlcNAc) в этой композиции антител.
В предпочтительном варианте осуществления данного изобретения, эта композиция антител имеет более высокую долю фукоза-недостаточных антител, чем композиция антител, используемая в качестве референсного стандарта.
Поскольку некоторые антитела имеют множество N-гликозидных сахарных цепей, фукоза-недостаточное антитело данного изобретения включает в себя не только антитела, в которых фукоза не присоединена, но также антитела, в которых количество фукозных остатков, присоединенных к антителу, является уменьшенным (антитела, имеющие по меньшей мере одну или более сахарных цепей, в которых не присутствует фукоза).
При получении антитела с модифицированной сахарной цепью с использованием клеток-хозяев часто трудно получить композицию, содержащую однородные антитела, в которой все антитела имеют идентичные сахарные цепи. Таким образом, если композиция антител с модифицированным компонентом, представляющим сахарную цепь, является, например, композицией антител с увеличенной долей фукоза-недостаточных антител, то эта композиция антител с модифицированным компонентом, представляющим сахарную цепь, данного изобретения может содержать как антитела, недостаточные в отношении фукозы, так и антитела, не являющиеся недостаточными в отношении фукозы, но общая доля антител, недостаточных в отношении фукозы, будет более высокой, чем в композиции антител, продуцируемых клетками-хозяевами, служащими в качестве референсного стандарта. Данное изобретение особо не ограничивается в отношении конкретной доли фукоза-недостаточных антител в композиции антител с высокой долей фукоза-недостаточных антител данного изобретения, но предпочтительно эта доля равна не менее чем 20%, более предпочтительно, не менее чем 50% и наиболее предпочтительно, не менее чем 90%.
Данное изобретение особо не ограничивается в отношении конкретной доли антител с добавленным двурассекающим N-ацетилглюкозамином в композиции антител, имеющих высокую долю антител с добавленным двурассекающим N-ацетилглюкозамином, но предпочтительно эта доля равна не менее чем 20%, более предпочтительно, не менее чем 50% и наиболее предпочтительно, не менее чем 90%.
Композиция анти-GPC3-антител с модифицированным компонентом, представляющим сахарную цепь, данного изобретения может быть получена способами, известными квалифицированному специалисту в данной области.
Например, фукоза-недостаточное антитело может быть получено экспрессией анти-GPC3-антитела в клетках-хозяевах либо лишенных способности, либо имеющих низкую способность присоединять α-1,6-фукозу кора (основной структуры).
Данное изобретение особо не ограничивается в отношении клеток-хозяев, лишенных способности или имеющих низкую способность присоединять фукозу, но клетки-хозяева без активности фукозотрансферазы или с уменьшенной активностью фукозотрансферазы, клетки-хозяева с более низкой концентрацией фукозы в тельцах Гольджи и т.п. могут быть использованы в данном изобретении. Более конкретно, примеры клеток-хозяев включают в себя клетки миеломы крысы YB2/3HL.P2.G11.16Ag.20 (сокращенно YB2/0) (хранящиеся как АТСС CRL 1662), клетки СНО с нокаутом FTVIII (WO 02/31140), клетки Lec13 (WO 03/035835) и недостаточные в отношении транспортера фукозы клетки (WO 2005/017155).
В данном контексте, термин «недостаточные в отношении транспортера фукозы клетки» относится к клетке, в которой количество транспортера фукозы в клетке меньше, чем в нормальных клетках, или функция транспортера фукозы является ослабленной вследствие отклонения от нормы в структуре транспортера фукозы. Примеры клеток, недостаточных в отношении транспортера фукозы, включают в себя, например, клетки, в которых разрушен ген транспортера фукозы (т.е. клетки с нокаутом этого гена) (далее называемые клетками FT-KO), клетки, в которых либо отсутствует, либо является мутированной часть гена транспортера фукозы, клетки, недостаточные в отношении системы экспрессии гена транспортера фукозы, и т.п. Нуклеотидная последовательность гена, кодирующего транспортер фукозы Китайского хомячка, и его аминокислотная последовательность показаны в SEQ ID NO:126 и 127, соответственно.
Кроме того, можно получить недостаточную в отношении транспортера фукозы клетку данного изобретения с использованием интерференции РНК (RNAi) с применением нуклеотидной последовательности, представленной SEQ ID NO:126. RNAi представляет собой следующий феномен: при введении двухцепочечной РНК (dsRNA) в клетку внутриклеточная мРНК, соответствующая этой последовательности РНК, специфически разрушается и не может экспрессироваться в виде белка. Обычно dsRNA используется с RNAi, но данное изобретение не ограничивается этим, и, например, может быть использована также двухцепочечная РНК, образованная самокомплементарными одноцепочечными молекулами РНК. Что касается районов, образующих двухцепочечную молекулу, эта молекула может быть двухцепочечной во всех районах или может быть одноцепочечной в некоторых районах (например, в одном или обоих концах). Данное изобретение не ограничивается конкретной длиной олиго-РНК, используемого в RNAi. Длина олиго-РНК в данном изобретении может быть равна, например, 5-1000 оснований (или 5-1000 пар оснований в двухцепочечной молекуле), предпочтительно, 10-100 основаниям (или 10-100 парам оснований в двухцепочечной молекуле) и, наиболее предпочтительно, 15-25 основаниям (15-25 парам оснований в двухцепочечной молекуле); однако особенно предпочтительной является длина 19-23 основания (19-23 пар оснований в двухцепочечной молекуле).
Вышеуказанный процесс RNAi использует феномен, в котором dsRNA, состоящая как из смысловой РНК, так и антисмысловой РНК, гомологичных конкретному гену, будет разрушать гомологичную часть транскрипта (мРНК) этого гена. Может быть использована dsRNA, соответствующая всей последовательности гена транспортера фукозы, или более короткая dsRNA (например, 21-23 п.н.), соответствующая части этой последовательности (малая интерферирующая РНК; siRNA). dsRNA может быть непосредственно перенесена в клетку, или может быть получен вектор, продуцирующий dsRNA и перенесен в клетку-хозяина, и затем эта dsRNA может быть продуцирована в этой клетке. Например, вся ДНК или часть ДНК, кодирующей транспортер фукозы, может быть встроена в вектор таким образом, что она образует последовательность обращенного повтора, и этот вектор может быть затем перенесен в клетку-хозяина. Процедура RNAi может проводиться в соответствии с описаниями в следующих ссылках: Fire A. et al., Nature (1998), 391, 806-811; Montgomery M. K. et al., Proc. Natl. Acad. Sci. USA (1998), 95, 15502-15507; Timmons L. et al., Nature (1998), 395, 854; Sanchez A. et al., Proc. Natl. Acad. Sci. USA (1999), 96, 5049-5054; Misquitta L. et al., Proc. Natl. Acad. Sci. USA (1999), 96, 1451-1456; Kennerdell J. R. et al., Cell (1998), 95, 1017-1026; Waterhouse P. M. et al., Proc. Natl. Acad. Sci. USA (1998), 95 13959-13964; and Wianny F. et al., Nature Cell Biol. (2000), 2, 70-75.
Недостаточные в отношении транспортера фукозы клетки, полученные процедурой RNAi, могут быть подвергнуты скринингу, как указано, посредством активности транспортера фукозы. Скрининг может также проводиться на основе транскрипции и экспрессии гена транспортера фукозы с использованием Вестерн-блоттинга или Нозерн-блоттинга.
Антитело с двурассекающим N-ацетилглюкозамином (GlcNAc), добавленным к сахарной цепи, может быть получено экспрессией анти-GPC3-антитела в клетке-хозяине, способной образовывать структуру двурассекающего N-ацетилглюкозамина (GlcNAc) на сахарной цепи.
Способ получения антитела с сахарной цепью, имеющей добавленный N-ацетилглюкозамин, уже известен (WO 02/79255). Клетка-хозяин, способная образовывать структуру двурассекающего N-ацетилглюкозамина (GlcNAc) на сахарной цепи, особо не ограничивается в данном изобретении, но может включать в себя, например, клетку-хозяина, имеющую экспрессирующий вектор, содержащий ДНК, кодирующую GnTIII. Таким образом, анти-GPC3-антитело, имеющее сахарную цепь с добавленным двурассекающим N-ацетилглюкозамином, может быть получено с использованием клетки-хозяина, содержащей как экспрессирующий вектор с ДНК, кодирующей GnIII, так и экспрессирующий вектор, кодирующий анти-GPC3-антитело. Как ДНК, кодирующая GnIII, так и ген, кодирующий анти-GPC3-антитело, могут присутствовать на одном и том же векторе или могут присутствовать на разных векторах.
Другим способом увеличения доли композиции фукоза-недостаточных антител или антител с присоединенным двурассекающим N-ацетилглюкозамином в этой композиции антител является увеличение доли этих антител в композиции очисткой фукоза-недостаточных антител или антител с присоединенным двурассекающим N-ацетилглюкозамином.
Анализ сахарных цепей может проводиться любыми способами, известными квалифицированным в данной области специалистам. Например, сахарная цепь может быть высвобождена из антитела реакцией этого антитела с N-гликозидазой F (Roche) и т.п. Затем эти сахарные цепи могут быть обессолены твердофазной экстракцией с использованием целлюлозного картриджа (Shimizu Y. et al., Carbohydrate Research 332 (2001), 381-388), сконцентрированы и высушены, и помечены флуоресцентно 2-аминопиридином (Kondo A. et al., Agricultural and Biological Chemistry 54:8 (1990), 2169-2170). Реагент удаляют из пиридиламиносахарных цепей (РА-сахарных цепей) твердофазной экстракцией с использованием целлюлозного картриджа, затем сахарные цепи концентрируют центрифугированием с получением очищенных РА-сахарных цепей. Эти сахарные цепи могут анализироваться ВЖХ с обращенной фазой с использованием колонки с октадецилсиланом (ODS). Полученные таким образом РА-сахарные цепи могут анализироваться двухмерным картированием с использованием комбинирования ВЖХ-анализа с обращенной фазой с ODS-колонкой и ВЖХ-анализа с нормальной фазой с амино-колонкой.
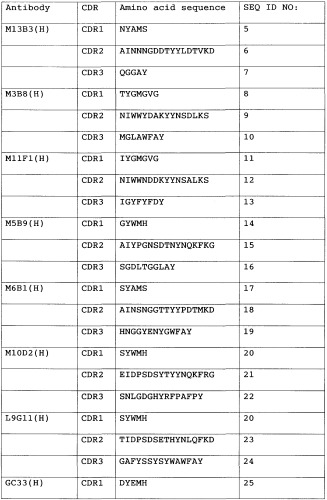
Анти-GPC3-антитело с модифицированной сахарной цепью данного изобретения не ограничивается какими-либо конкретными антителами при условии, что оно связывается с GPC3. Предпочтительно, связывание с GPC3 может быть специфическим. Предпочтительные анти-GPC3-антитела данного изобретения включают в себя антитела, которые имеют последовательность определяющего комплементарность района (CDR), показанную в таблице 1 ниже.
Таблица 1
1) Антитело, 2) Аминокислотная последовательность
Антитела с последовательностью CDR из списка, приведенного в таблице выше, имеют высокий уровень цитотоксической активности. Антитела с последовательностью CDR из списка, приведенного в таблице выше, узнают эпитопы аминокислот 524-563 на GPC3. Поскольку антитела, которые узнают эпитопы аминокислот 524-563, имеют высокий уровень цитотоксической активности, они являются предпочтительными в качестве анти-GPC3-антител данного изобретения.
В одном предпочтительном варианте осуществления данного изобретения, композиция антител, имеющих модифицированный компонент, представляющий сахарную цепь, данного изобретения, характеризуется проявлением повышенной активности ADCC. В данном изобретении присутствие или отсутствие повышенной активности ADCC можно определить сравнением активности ADCC композиции антител данного изобретения с активностью ADCC композиции антител референсного стандарта. Если композиция антител данного изобретения обнаруживает более высокую активность ADCC, чем референсный стандарт, то считают, что активность ADCC является повышенной.
Активность ADCC может быть измерена способом, известным квалифицированным в данной области специалистам, например, смешиванием анти-GPC3-антитела с эффекторными клетками и клетками-мишенями и затем определением уровня ADCC. Более конкретно, клетки селезенки мыши, моноциты человека, выделенные из периферической крови (PBMC) и костного мозга и т.п., могут быть использованы в качестве эффекторных клеток, а клетки человека, экспрессирующие GPC3, такие как линия клеток HuH-7 печеночно-клеточного рака человека, могут быть использованы в качестве клеток-мишеней. Сначала эти клетки-мишени метят 51Сr, добавляют анти-GPC3-антитело, клетки инкубируют и затем добавляют эффекторные клетки в подходящем соотношении с клетками-мишенями и их инкубируют вместе. После инкубации супернатант собирают и активность ADCC измеряют счетом радиоактивности в этом супернатанте.
Анти-GPC3-антитело
Анти-GPC3-антитело может быть получено способом, известным квалифицированным в данной области специалистам. Например, это антитело может быть получено с использованием GPC3 в качестве сенсибилизирующего антигена для иммунизации в соответствии с обычным способом иммунизации, слиянием этих иммунных клеток с известными исходными клетками при помощи обычной процедуры слияния клеток и скринингом на продуцирующее моноклональное антитело клеток при помощи обычного способа скрининга. Более конкретно, моноклональные антитела могут быть получены следующим образом. Сначала GPC3 для использования в качестве сенсибилизирующего антигена получают экспрессией GPC3 (MXR7) на основе последовательности гена/аминокислотной последовательности, описанных в Lage, H. et al., Gene 188 (1997), 151-156. Другими словами, последовательность гена, кодирующую GPC3, встраивают в известный экспрессирующий вектор. После трансформации подходящих клеток-хозяев этим вектором белок-мишень глипикан 3 человека очищают из клеток-хозяев или супернатанта культуральной среды известным способом. Затем очищенный белок GPC3 используют в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена может быть использован частичный пептид GPC3. В таком способе этот частичный пептид может быть получен химическим синтезом в соответствии с аминокислотной последовательностью GPC3 человека. Эпитопы на молекуле GPC3, узнаваемые анти-GPC3-антителом данного изобретения, не ограничиваются, и анти-GPC3-антитело данного изобретения может узнавать любой эпитоп, присутствующий на молекуле GPC3. Это объясняется тем, что анти-GPC3-антитело проявляет ингибирующую рост клеток активность через его ADCC-активность, CDC-активность или ингибирование активности фактора роста, и тем, что рост клеток также ингибируется действием цитотоксического вещества, такого как радиоактивный изотоп, химиотерапевтическое лекарственное средство, бактериальный токсин, присоединенные к анти-GPC3-антителу. Таким образом, антигеном для получения анти-GPC3-антитела данного изобретения может быть любой фрагмент GPC3 при условии, что он содержит эпитоп, присутствующий на молекуле GPC3.
В особенно предпочтительном варианте осуществления, в качестве сенсибилизирующего антигена для генерирования антитела, которое узнает эпитоп из аминокислот 524-563 GPC3, может быть использован пептид, содержащий аминокислоты 524-563.
Млекопитающее, используемое для иммунизации сенсибилизирующим антигеном, особо не ограничивается в данном изобретении, но предпочтительно оно должно быть выбрано с учетом совместимости с исходными клетками, которые должны быть использованы в слиянии клеток, и может включать в себя грызуна, например мышь, крысу или хомяка, или кролика, обезьяну и т.п. Это животное может быть иммунизировано сенсибилизирующим антигеном с использованием известного способа. Обычно, например, млекопитающее может быть инъецировано внутрибрюшинно или подкожно сенсибилизирующим антигеном. Более конкретно, сенсибилизирующий антиген может быть разбавлен и суспендирован в подходящем количестве забуференного фосфатом солевого раствора (ЗФР) или физиологического солевого раствора, смешан с подходящим количеством общепринятого адъюванта, такого как полный адъювант Фрейнда, если желательно, эмульгирован и введен млекопитающему многократно каждые 4 дня - 21 день. Кроме того, при иммунизации сенсибилизирующим антигеном может быть использован подходящий носитель.
После иммунизации млекопитающего описанным выше образом и детектирования уровня желаемого антитела в сыворотке иммунные клетки собирают из этого млекопитающего и подвергают клеточному слиянию. Клетки селезенки являются особенно предпочтительными иммунными клетками для слияния клеток. Клетки миеломы млекопитающих используют в качестве исходных клеток-партнеров для слияния с иммунными клетками. Известные клеточные линии, подходящие для использования в качестве клеток миеломы, включают в себя P3 (P3x63Ag8.653) (J. Immnol. (1979) 123, 1548-1550), P3x63Ag8U.l (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies. D.H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), FO (de St. Groth, S. F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I. S. J. Exp. Med. (1978) 148, 313-323), R210 (Galfre, G. et al., Nature (1979) 277, 131-133).
Слияние иммунных клеток и клеток миеломы в основном может проводиться в соответствии с известным способом, например способом, описанным Kohler and Milstein (Kohler, G. And Milstein, C., Methods Enzymol. (1981) 73, 3-46). Более конкретно, слияние клеток может проводиться, например, в общепринятой жидкой культуральной среде, содержащей стимулятор слияния клеток. Примеры стимулирующих слияние клеток химических веществ включают в себя полиэтиленгликоль (PEG) и вирус Сендай (HVJ) и т.п. Если желательно, для увеличения эффективности слияния может быть добавлен дополнительный агент, такой как диметилсульфоксид и т.п. Отношение иммунных клеток к клеткам миеломы может быть установлено произвольно. Например, предпочтительной является установка отношения иммунных клеток к клеткам миеломы 1:1-10:1. Общепринятая жидкая культуральная среда, используемая для культивирования этих типов клеток, такая как жидкая среда RPMI-1640, жидкая среда МЕМ или другая жидкая среда, подходящая для роста линии клеток миеломы, может быть использована в качестве жидкой среды в процедуре слияния клеток. Вместе со средой может быть также использована сывороточная добавка, такая как фетальная телячья сыворотка. В процедуре слияния клеток указанные количества иммунных клеток и миеломных клеток тщательно смешивают в жидкой культуральной среде и затем раствор PEG (например, со средней молекулярной массой приблизительно 1000-6000), который был нагрет до 37ºС, добавляют обычно при концентрации 30-60% (масса/объем) и перемешивают для создания возможности образования слитых клеток (гибридом). Затем добавляют подходящую жидкую среду и центрифугируют для удаления супернатанта. Посредством повторения этой процедуры удаляют любые химикалии, использованные для клеточного слияния, неблагоприятные для роста гибридом. Полученные таким образом гибридомы отбирают культивированием их в общепринятой жидкой селективной среде, такой как среда НАТ (культуральная среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в среде НАТ продолжают в течение достаточного периода времени (обычно в течение нескольких дней - нескольких недель), пока клетки, другие, чем гибридомы-мишени (неслитые клетки), не погибнут. Затем, проводят общепринятую процедуру лимитирующего разведения с последующим скринингом и моноклонированием гибридом, которые продуцируют антитело-мишень. Наряду с иммунизацией животного, не являющегося человеком, антигеном для получения гибридом, как описано выше, желаемые антитела человека, имеющие GPC3-связывающую активность, могут быть получены сенсибилизацией лимфоцитов человека GPC3 in vitro и затем слиянием этих сенсибилизированных лимфоцитов с иммортализованными клетками миеломы человека (см. Публикацию патента Японии с номером Н1-59878). Кроме того, можно ввести GPC3 в качестве антигена трансгенному животному, имеющему полный репертуар генов антител человека, для генерирования клеток, продуцирующих анти-GPC3-антитела, и собрать антитела к GPC3 человека из иммортализованных клеток (см. Международные заявки на патент с номерами WO 94/25585, WO 93/12227, WO 92/03918 и WO 94/02602). Гибридомы, продуцирующие моноклональные антитела, полученные вышеуказанным образом, могут быть субкультивированы в общепринятой жидкой культуральной среде и могут храниться в течение продолжительного периода времени в жидком азоте.
Рекомбинантные антитела
Моноклональное антитело, использованное в данном изобретении, является рекомбинантным моноклональным антителом, которое может быть получено клонированием гена этого антитела из гибридомы, встраиванием этого гена в подходящий вектор и интеграцией этого вектора в клетку-хозяина (например, см. Vandamme, A.M. et al., Eur. J. Biochem. (1990) 192: 767-775, 1990). Более конкретно, мРНК, кодирующую вариабельную (V) область анти-GPC3-антитела, выделяют из гибридомы, продуцирующей анти-GPC3-антитело. мРНК может быть выделена с использованием известного способа, такого как способ центрифугирования с гуанидином (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299) и AGPC-способ (Chomczynski, P., et al., Anal. Biochem. (1987) 162, 156-159), для получения тотальной РНК и затем получения мРНК с использованием набора для очистки мРНК (Pharmacia) и т.п. мРНК может быть также получена непосредственно с использованием набора для получения мРНК QuickPrep (Pharmacia). Затем синтезируют кДНК вариабельной (V) области этого антитела из полученной таким образом мРНК с использованием обратной транскриптазы. кДНК может быть синтезирована с использованием набора для синтеза кДНК первой цепи обратной транскриптазой AMV (Seikagaku Corporation), и т.п. Может быть также использован 5'-RACE-способ с использованием набора 5'-AmpliFINDER RACE Kit (Clontech) и ПЦР для синтеза и амплификации кДНК (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002, Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932). ДНК-фрагмент-мишень очищают из продукта ПЦР и лигируют с ДНК-вектором. Желаемый рекомбинантный вектор готовят встраиванием этих векторов. Его вводят в E. coli и желаемую колонию отбирают для приготовления желаемого рекомбинантного вектора. Нуклеотидную последовательность ДНК-мишени подтверждают известным способом, таким как способ терминации цепи с использованием дидезоксинуклеотида. После получения ДНК, кодирующей вариабельную (V) область анти-GPC3-антитела-мишени, ее встраивают в экспрессирующий вектор, содержащий ДНК, кодирующую константную область желаемого антитела (С-область). Для получения анти-GPC3-антитела, используемого в данном изобретении, ген этого антитела встраивают в этот экспрессирующий вектор таким образом, что он будет экспрессироваться под контролем района регуляции экспрессии, такого как энхансер, промотор и т.п. Затем это антитело экспрессируют трансформацией клетки-хозяина этим экспрессирующим вектором. Ген этого антитела может быть экспрессирован в клетках-хозяевах встраиванием ДНК, кодирующей тяжелую цепь (Н-цепь) и легкую цепь (L-цепь) антитела, в отдельные экспрессирующие векторы и одновременной трансформацией клеток-хозяев или встраиванием ДНК, кодирующей как Н-цепь, так и L-цепь, в единый экспрессирующий вектор и трансформацией клеток-хозяев (см. WO 94/11523). Кроме того, рекомбинантное антитело может быть получено не только с использованием вышеупомянутых клеток-хозяев, но также с использованием трансгенного животного. Например, ген антитела может быть встроен в середину гена, кодирующего белок, продуцируемый специфически в молоке (такой как β-казеин козы), с получением слитого гена. Затем ДНК-фрагмент, содержащий ген этого антитела, инъецируют в зародыш козы и этот зародыш имплантируют в козу. Желаемое антитело может быть получено из молока, продуцируемого трансгенной козой, рожденной козой, имплантированной этим зародышем, и ее потомством. Кроме того, могут быть использованы подходящие гормоны в трансгенной козе для увеличения количества молока, содержащего желаемое антитело, которой продуцируется этой трансгенной козой (Ebert, K.M. et al., Bio/Technology (1994) 12, 699-702).
Измененные антитела
Кроме описанных выше антител, в данном изобретении может быть использовано искусственно измененное рекомбинантное антитело, например химерное антитело, гуманизированное антитело и т.п., с целью уменьшения ксеноантигенности относительно людей. Такие модифицированные антитела могут быть получены в соответствии с известными способами. Химерное антитело может быть получено лигированием ДНК, кодирующей V-область антитела, полученной, как описано выше, с ДНК, кодирующей С-область антитела человека, и затем встраиванием этих ДНК в экспрессирующий вектор. Вектор, в котором встроены эти ДНК, интегрируют в клетки-хозяева для получения этого антитела. Химерное антитело, применимое в данном изобретении, может быть получено с использованием такого общепринятого способа. Гуманизированное антитело, также называемое реконструированным антителом человека, содержит CDR антитела из млекопитающего не человека, такого как мышь, трансплантированный на CDR антитела человека. Общие способы генной инженерии для получения гуманизированных антител известны в данной области (см. ЕР 125023 и WO 96/02576). Более конкретно, ДНК-последовательность, предназначенную для связывания CDR мышиного антитела и каркасной области (FR) антитела человека, синтезируют при помощи ПЦР с использованием в качестве праймеров множества олигонуклеотидов, приготовленных таким образом, что они перекрывают концевые районы CDR и FR (этот способ описан в WO 98/13388). Каркасную область антитела, которая должна быть связана через CDR, выбирают таким образом, что этот CDR будет образовывать подходящий сайт связывания антитела. Если необходимо, аминокислоты этой каркасной области в вариабельном районе антитела могут быть заменены таким образом, что этот реконструированный CDR антитела человека будет образовывать подходящий сайт связывания антитела (Sato, K. et al., Cancer res. (1993) 53, 851-856). Для С-области химерного антитела и гуманизированного антитела используют С-область антитела человека. Например, Cy1, Cy2, Cy3 и Cy4 могут быть использованы в Н-цепи, а Сκ и Сλ могут быть использованы в L-цепи. Кроме того, С-область антитела человека может быть модифицирована для улучшения стабильности или производительности этого антитела. Химерное антитело содержит вариабельную область антитела из млекопитающего не человека и константную область из антитела человека. С другой стороны, гуманизированное антитело содержит CDR антитела из млекопитающего не человека и каркасную область и С-область из антитела человека. Поскольку гуманизированное антитело имеет более низкую антигенность в теле человека, оно является более применимым в качестве активного ингредиента в терапевтическом агенте данного изобретения.
Модифицированные антитела
Антитело, используемое в данном изобретении, не ограничивается целой молекулой антитела и может быть фрагментом антитела или модифицированной формой антитела, при условии, что оно связывается с GPC3 и ингибирует активность GPC3. Данное изобретение включает в себя также бивалентные антитела, а также моновалентные антитела. Примеры фрагмента антитела включают в себя Fab, F(ab')2, Fv, Fab/с, имеющий один Fab и полный Fc, или одноцепочечный Fv (scFv), где Fv Н-цепи или L-цепи связан подходящим лигандом. Более конкретно, для получения фрагмента антитела это антитело может быть обработано ферментом, таким как папаин или пепсин, или ген, кодирующий такой фрагмент антитела, может быть сконструирован, встроен в экспрессирующий вектор и экспрессирован в подходящей клетке-хозяине (см., например, Co, M.S. et al., J. Immunol. (1994) 152, 2968-2976, Better, M. & Horwitz, A. H. Methods in Enzymology (1989) 178, 476-496, Academic Press, Inc., Plueckthun, A. & Skerra, A. Methods in Enzymology (1989) 178, 476-496, Academic Press, Inc., Lamoyi, E., Methods in Enzymology (1989) 121, 652-663, Rousseaux, J. et al., Methods in Enzymology (1989) 121, 663-669, Bird, R. E. et al., TIBTECH (1991) 9, 132-137). scFv может быть получен соединением V-области Н-цепи и V-области L-цепи антитела. В scFv V-область Н-цепи и V-область L-цепи соединяют посредством линкера, предпочтительно пептидного линкера (Huston, J.S. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 5879-5883). V-область Н-цепи и V-область L-цепи в scFv могут происходить из любых описанных здесь антител. Любой одноцепочечный пептид, содержащий 12-19 аминокислотных остатков, может быть использован в качестве пептидного линкера, соединяющего эти V-области. ДНК, кодирующая scFv, может быть получена амплификацией фрагмента при помощи ПЦР с использованием в качестве матрицы части ДНК, кодирующей всю или желаемую аминокислотную последовательность, из последовательностей ДНК, кодирующей Н-цепь или V-область Н-цепи вышеупомянутого антитела, и ДНК, кодирующей L-цепь или V-область L-цепи вышеупомянутого антитела, с парой праймеров, которая определяет оба его конца. Затем этот фрагмент амплифицируют с комби