Процесс периодической ферментации с подпиткой при высокой плотности клеток для получения рекомбинантного белка
Иллюстрации
Показать всеОписаны способы - варианты получения рекомбинантных менингококковых белков 2086 посредством периодической ферментации бактериальной культуры с подпиткой с непрерывной подачей индуктора в суммарном количестве от приблизительно 7 г/л до приблизительно 15 г/л после достижения порогового параметра и с непрерывной подачей источника углерода, например подачей при постоянной скорости с последующим выделением менингококкового белка из бактериальной культуры. Способ культивирования можно осуществлять с использованием бактериальной клетки-хозяина, содержащей вектор экспрессии, кодирующий рекомбинантный белок под контролем индуцируемого промотора, или последовательность нуклеиновых кислот, при непрерывной подаче источника углерода, например глюкозы, и индуктора, например, арабинозы. Описаны композиции для выделения менингококкового белка из бактериальной культуры, полученные указанными способами, с высокой плотностью белка 2086, при этом белок может быть липидированный и нелипидированный. Изобретение обеспечивает улучшение выхода менингококкового белка 2086. 6 н. и 73 з.п. ф-лы, 20 ил., 7 табл., 3 пр.
Реферат
Родственные заявки
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США, серийный номер 60/833,479, озаглавленной ПРОЦЕСС ПЕРИОДИЧЕСКОЙ ФЕРМЕНТАЦИИ С ПОДПИТКОЙ ПРИ ВЫСОКОЙ ПЛОТНОСТИ КЛЕТОК ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА, поданной 27 июля 2006 г., описание которой полностью включено в данную заявку посредством ссылки.
Область изобретения
[0002] Настоящая заявка относится в целом к новым способам периодической ферментации с подпиткой, которые обеспечивают улучшенную экспрессию белка в бактериальных системах, а также к композициям с высокой плотностью белков и к композициям, которые применяют в новых способах периодической ферментации с подпиткой.
Уровень техники
[0003] Различные стратегии ферментации применяют для получения белков в достаточных количествах для лабораторного, клинического или коммерческого применения. Периодическую ферментацию с подпиткой применяют, чтобы обеспечить повышенный выход белков по сравнению с таковым, который обеспечивают простые способы периодической ферментации. Периодическая ферментация с подпиткой представляет собой процесс, в котором за первоначальной периодической фазой следует фаза, в которой одно или более питательных веществ подаются в культуру путем подпитки.
[0004] Обычно, во время периодической фазы, клетки сначала выращивают до требуемой концентрации. В этой фазе рост клеток увеличивается, и, обычно, целевой белок не продуцируется до тех пор, пока не добавят индуктор, такой как арабиноза, лактоза или изопропил-бета-D-тиогалактозид (ИПТГ), в зависимости от промотора, или продуцируется, если присутствует некоторое неполное блокирование промотора. Во время фазы с подпиткой, источник углерода и другие требуемые питательные вещества обычно подают в ферментер в относительно концентрированном потоке жидкости при определенной скорости подачи. Как только достигается целевая плотность клеток, в подпитку добавляют индуктор или индуктор и другие питательные вещества. В этой фазе основное внимание уделяется продукции белка выращенными клетками. Субстрат (а именно питательные вещества и индуктор), который подается в ферментер на этой стадии, применяют, как правило, для роста клеток и синтеза продукта. Рост клеток контролируется скоростью подачи для получения оптимального роста клеток и продукции белка. Во время стадии продукции белка нужно добавлять индуктор к рекомбинантным организмам.
[0005] Экспрессия белка в среде, включающей общепринятый источник углерода, такой как глюкоза, или другой источник углерода на основе сахаров и индуктор, удовлетворительна до возникновения ограничивающих условий в конце фазы с подпиткой. Примеры ограничивающих условий включают пониженную концентрацию кислорода, уменьшение питательных веществ, таких как витамины, углерод, азот, и накопление токсичных соединений в ростовой среде.
[0006] Стратегии периодической ферментации с подпиткой часто включают различные формы регуляции с обратной связью, включая непрямую и прямую обратную связь для контроля подачи питательных веществ. Один такой способ периодической ферментации с подпиткой включает применение алгоритма регуляции с обратной связью с помощью подачи питательных веществ, чтобы поддерживать параметр процесса на определенной заданной величине. Например, прямой контроль подачи может быть основан на измерении концентрации питательных веществ. Регуляция с обратной связью тогда непосредственно связана с активностью клеток во время ферментации. Контрольные параметры, которые применялись для регуляции ферментации с обратной связью, включают значение pH, измеренную в реальном времени плотность клеток или давление растворенного кислорода (DOT).
[0007] Тем не менее, применение алгоритмов обратной связи сопровождается рядом недостатков. Одним из таких недостатков является зависимость скорости подачи от текущих параметров процесса. Любое нарушение процесса может повлиять на указанный параметр, изменяя тем самым скорость подачи и конечный выход белка. Подобные недостатки увеличиваются при масштабировании процесса для получения повышенных количеств белка.
[0008] Другим недостатком ранее применяемой стратегии с подпиткой является то, что при использовании регуляции с обратной связью конкретную скорость роста невозможно точно предопределить или контролировать, что приводит к субоптимальному выходу процессов, в которых образование продукта зависит от роста.
[0009] Дополнительно, когда приток углерода (например, при высокой концентрации глюкозы) в основной метаболический путь превышает максимальную мощность цикла трикарбоновых кислот (ЦТК), могут накапливаться побочные продукты. Накопление побочных продуктов может ингибировать рост клеток и продукцию белка в процессе ферментации.
[0010] Дополнительно, различные недостатки способов периодической ферментации с подпиткой часто приводят к неэффективному использованию компонентов питательных веществ. По этой причине указанные способы могут быть экономически невыгодными, в частности для широкомасштабной коммерческой продукции белка.
[0011] Используемые ранее подходы к рекомбинантной экспрессии белка посредством периодической ферментации с подпиткой, как описано выше, имеют различные недостатки. Учитывая важность экономически эффективного получения достаточных количеств белка для различных целей, существует потребность в эффективном способе периодической ферментации с подпиткой, который приводил бы к более высокому росту клеток, повышенному образованию продукта (то есть более высокому выходу белка) и пониженному накоплению побочного продукта.
Краткое описание изобретения
[0012] Настоящее изобретение относится к новым способам периодической ферментации с подпиткой для получения неожиданно высокого выхода рекомбинантного белка.
[0013] Некоторый вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка, включающий непрерывное добавление источника углерода в культуру, содержащую указанную рекомбинантную бактериальную клетку, и непрерывное добавление индуктора в указанную культуру после того, как в культуре достигнут пороговый параметр, и выделение указанного рекомбинантного белка из культуры клеток.
[0014] Некоторый дополнительный вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий: (а) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный белок под контролем индуцируемого промотора, для получения рекомбинантной бактериальной клетки; (b) введение указанной рекомбинантной бактериальной клетки в культуральную среду для получения культуры клеток; (с) добавление источника углерода в указанную культуру клеток в виде непрерывной подачи; (а) слежение за достижением ростом клеток в указанной культуре клеток пороговой оптической плотности (OD600); (e) добавление индуктора указанного индуцируемого промотора в указанную культуру клеток в виде непрерывной подачи, как только достигнута указанная пороговая оптическая плотность (OD600); и (f) получение рекомбинантного белка из культуры клеток.
[0015] Еще дополнительный вариант реализации настоящего изобретения обеспечивает способ получения рекомбинантного белка, включающий культивирование рекомбинантной бактериальной клетки для экспрессии рекомбинантного белка путем непрерывного добавления индуктора в культуру, включающую указанную бактериальную клетку, после того, как указанная культура достигла порогового параметра, отличающийся тем, что указанная бактериальная клетка включает последовательность нуклеиновых кислот, соответствующую гену из N. meningitidis серологической группы В.
[0016] Согласно сходному дополнительному варианту реализации, настоящее изобретение обеспечивает способ получения рекомбинантного белка 2086 (rP2086), включающий: (а) введение в бактериальную клетку-хозяина вектора экспрессии, кодирующего рекомбинантный менингококковый белок 2086 под контролем индуцируемого промотора для получения рекомбинантной бактериальной клетки; (b) введение указанной рекомбинантной бактериальной клетки в культуральную среду для получения культуры; (с) добавление источника углерода в культуру; (d) слежение за достижением ростом клеток в указанной культуре пороговой оптической плотности (OD); (е) непрерывное добавление индуктора указанного индуцируемого промотора в указанную культуру, как только плотность клеток в указанной культуре достигла оптической плотности, равной приблизительно от 70 до 110; и (f) получение указанного рекомбинантного менингококкового белка 2086 из указанной культуры через промежуток времени от приблизительно 3 часов до приблизительно 6 часов после начала непрерывного добавления индуктора.
[0017] Согласно другому варианту реализации, настоящее изобретение обеспечивает композицию, включающую бактериальную культуру, включающую рекомбинантный белок 2086 (rP2086) при плотности, равной по меньшей мере приблизительно 1.5 г/л, в общем объеме указанной бактериальной культуры.
[0018] Согласно еще другому варианту реализации, настоящее изобретение обеспечивает композицию, включающую бактериальную культуральную среду, включающую рекомбинантный менингококковый белок 2086 (rP2086), полученный согласно способам настоящего изобретения.
Краткое описание чертежей
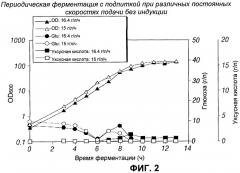
[0019] Фигура 1 - периодическая ферментация с подпиткой при различных постоянных скоростях подачи без индукции.
[0020] Фигура 2 - периодическая ферментация с подпиткой при различных постоянных скоростях подачи без индукции.
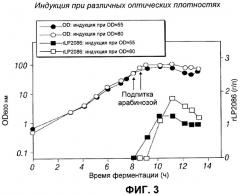
[0021] Фигура 3 - индукция при различных оптических плотностях.
[0022] Фигура 4 - индукция различными уровнями арабинозы.
[0023] Фигура 5 - влияние способа добавления арабинозы на выход rLP2086.
[0024]. Фигура 6 - влияние скорости подачи арабинозы на продукцию rLP2086.
[0025] Фигура 7 - влияние времени индукции на экспрессию.
[0026] Фигура 8 - периодическая ферментация с подпиткой для получения rLP2086 подсемейства В.
[0027] Фигуры 9А и 9B - анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (ПААГ/ДСН) и анализ методом вестерн-блот индукции rLP2086 подсемейства В соответственно.
[0028] Фигура 10 - периодическая ферментация с подпиткой для получения rLP2086 подсемейства А.
[0029] Фигуры 11А и 11B - ПААГ/ДСН и анализ методом вестерн-блот индукции rLP2086 подсемейства А соответственно.
[0030] Фигура 12А, 12B и 12С - одновременная подача глюкозы и арабинозы в процессе индукции.
[0031] Фигура 13А - периодическая ферментация E. coli с подпиткой для получения rLP2086 подсемейства В в масштабе 100 л.
[0032] Фигура 13B - периодическая ферментация Е. coli с подпиткой для получения rLP2086 подсемейства А в масштабе 100 л.
[0033] Фигура 14А - периодическая ферментация Е. coli с подпиткой для получения rIP2086 подсемейства В с одновременной подачей глюкозы и арабинозы в масштабе 100 л.
[0034] Фигура 14B - периодическая ферментация Е. coli с подпиткой для получения rIP2086 подсемейства А с одновременной подачей глюкозы и арабинозы в масштабе 100 л.
Подробное описание изобретения
[0035] Указанные способы настоящего изобретения основаны на неожиданном открытии, что неожиданно был получен высокий выход белка с помощью периодической ферментации с подпиткой при непрерывной подаче индуктора в процессе индукции культуральной среды. Возможно, источник углерода непрерывно подается перед и/или в процессе непрерывной подачи индуктора. При индукции арабинозой получали приблизительно 2-3 г/л рекомбинантного 2086 липопротеина (rLP2086) (который экспрессируется микроорганизмом и имеет последовательность, соответствующую 2086 гену N. meningitidis серологической группы В) в соответствии с некоторым вариантом реализации настоящего изобретения. Это представляет приблизительно 2-3-кратное повышение выхода rLP2086 с помощью периодической ферментации с подпиткой для обоих подсемейств А и В указанного белка 2086 по сравнению со сравнительным процессом периодической ферментации. Более того, указанные способы настоящего изобретения можно легко приспособить к получению в коммерческом масштабе этих и других белков.
[0036] С целью повышения понимания указанных вариантов реализации, описанных в данной заявке, будут сделаны ссылки на различные варианты реализации и будет использован конкретный язык для описания этого. Терминология, которая используется в данной заявке, используется исключительно с целью описания конкретных вариантов реализации и не предназначена для ограничения объема настоящего изобретения. Как используется по всему данному описанию, все единичные формы включают ссылку на множественную форму, если только контекст не указывает четко на противоположное. Подобным образом, единичные формы терминов, таких как "среда", включают ссылку на множественную форму "среды", и наоборот. Таким образом, например, ссылка на "некоторую культуральную среду" включает множество таких сред, а также одну среду; и ссылка на "культуральную среду" включает множество сред, а также одну среду.
[0037] Термин "индуктор", как используется в данной заявке, относится к любому агенту, который индуцирует, усиливает или вызывает экспрессию некоторого рекомбинантного белка, в результате чего экспрессию генов под контролем индуцируемого промотора можно непосредственно регулировать с помощью концентрации этого агента.
[0038] Термин "источник углерода", как используется в данной заявке, относится к источнику углерода и энергии для клеток.
[0039] Термины "подача", "подается", "подпитка" или "непрерывное добавление", как используется взаимозаменяемо в данной заявке, относятся к добавлению вещества непрерывно в течение некоторого промежутка времени, в отличие от добавления всего количества за один раз. Указанные термины предполагают единичное начало и/или окончание или множество точек пуска и/или остановки для непрерывного добавления указанного вещества в процессе ферментации.
[0040] Термин "рекомбинантный белок", как используется в данной заявке, относится к любому белку или биологически активной его части (например, части, которая сохраняет биологическую активность целого белка), которая не является репортерным или маркерным геном (например, зеленый флуоресцентный белок), экспрессируемым с рекомбинантного генетического материала, кодирующего аминокислоты, включая пептиды, полипептиды, белки, олигопротеины и/или слитые белки. Рекомбинантный белковый продукт может включать терапевтический, профилактический или диагностический продукт.
Способы настоящего изобретения
[0041] Указанные способы настоящего изобретения обеспечивают неожиданно высокий выход белка посредством нового процесса ферментации с подпиткой, включающего непрерывное добавление индуктора, такого как арабиноза, в культуральную среду после того, как указанная культура достигла порогового параметра. Источник углерода, такой как глюкоза, обычно добавляют в культуру, включающую рекомбинантную бактериальную клетку, перед фазой индукции. Указанный источник углерода можно подавать вместе с индуктором. Указанный индуктор может также служить вторичным источником углерода.
[0042] Источник углерода, такой как глюкоза, непрерывно добавляют в указанную культуральную среду, перед и/или в процессе непрерывной подачи указанного индуктора в культуральную среду, в соответствии с некоторым вариантом реализации настоящего изобретения. Таким образом, непрерывная подача источника углерода перекрывается с непрерывной подачей индуктора, согласно некоторому варианту реализации. Непрерывная подача источника углерода может продолжаться во время всего процесса непрерывной подачи индуктора или только во время части (частей) этого процесса. В другом варианте реализации, непрерывная подача источника углерода не перекрывается с непрерывной подачей индуктора. Согласно некоторому варианту реализации настоящего изобретения, указанный индуктор и/или источник углерода могут подаваться в культуру при постоянной скорости.
[0043] Указанный процесс ферментации с подпиткой включает несколько этапов, в результате которых происходит продукция необходимого белка в соответствии с некоторым вариантом реализации настоящего изобретения. На начальном этапе получают вектор экспрессии, который кодирует рекомбинантный белковый продукт под контролем индуцируемого промотора, и затем вводят в бактериальную клетку-хозяина. Указанную бактериальную клетку-хозяина вводят в культуральную среду. Индуктор индуцируемого промотора подают в культуру (а именно индуктор добавляют в культуру непрерывно в течение некоторого промежутка времени). Указанный индуктор можно подавать в культуру при постоянной скорости. Затем указанный рекомбинантный белковый продукт собирают из указанной культуры. Рекомбинантный белок, полученный таким способом, можно затем очистить как необходимо и/или использовать любым подходящим образом, таким как в профилактической, терапевтической или диагностической лекарственной форме.
[0044] Высокая плотность клеток и повышенный выход белка были неожиданно достигнуты с помощью периодической ферментации с подпиткой при постоянной скорости подачи индуктора, которая обеспечивает выход рекомбинантного белкового продукта приблизительно в 2-3 раза выше по сравнению с периодической ферментацией, как проиллюстрировано в примерах, приведенных ниже. Способы настоящего изобретения применимы к широкомасштабной ферментации, а также к маломасштабной ферментации. "Широкомасштабная" ферментация, как используется в данной заявке, относится к ферментации в ферментере, который имеет по меньшей мере приблизительно 1000 л объемной вместимости, а именно рабочий объем, оставляющий достаточно места для наличия свободного пространства над продуктом. "Маломасштабная" ферментация относится обычно к ферментации в ферментере, который обычно имеет не более, чем приблизительно 100 л объемной вместимости, таком как 5 л, 10 л, 50 л или 100 л. Доказанным преимуществом настоящего процесса ферментации с подпиткой является то, что его можно применять для получения рекомбинантного белкового продукта в масштабе ферментера 5-10 л и можно масштабировать до любого объема, например, 100 л, 150 л, 250 л, 500 л, 1000 л или более, без ограничения.
Индукторы
[0045] Способы, описанные в данной заявке, относятся к продукции рекомбинантного белка, отличающегося тем, что экспрессия указанного рекомбинантного белка находится под транскрипционным контролем индуцируемого промотора, в результате чего экспрессия генов под контролем указанного индуцируемого промотора может непосредственно регулироваться концентрацией индуктора, присутствующего в культуральной среде. Указанный индуктор непрерывно подается в культуральную среду, возможно при постоянной скорости. Указанный индуктор добавляют в культуральную среду, как только был достигнут пороговый параметр. Например, рекомбинантный белок может быть под контролем araB промотора (например, ParaB), который можно непосредственно регулировать концентрацией арабинозы, которую добавляют при постоянной скорости в культуральную среду. Подходящие индукторы для применения в соответствии с настоящим изобретением хорошо известны специалистам в данной области. Примеры индукторов согласно настоящему изобретению приведены ниже, без ограничения.
| Промотор | Индуктор |
| Арабинозный промотор, такой как ParaB | Арабиноза |
| Ингибитор-1 активатора плазминогена человека, Hpai-1 | Фактор некроза опухоли, |
| TNF | |
| Цитохром Р-450 | Токсины |
| CYP1A1 элемент, отвечающий на индукцию глюкокортикоиды металлом, МОЭ железы | Тяжелые металлы вируса опухоли молочной мыши |
| Коллагеназа | Форболовый эфир |
| Стромолизин | Форболовый эфир |
| SV40 | Форболовый эфир |
| Пролиферин | Форболовый эфир |
| α-2-макроглобулин | IL-6 |
| MX ген мыши ньюкаслской | Интерферон, вирус болезни |
| Вимектин | Сыворотка |
| Ген тиреостимулирующего гормона α | Тиреоидный гормон |
| HSP70 | Ela, большой Т-антиген SV40 |
| Фактор некроза опухоли | FMA |
| Интерферон | Вирусная инфекция, днРНК |
| Соматостатин | Циклический АМФ |
| Фибронектин | Циклический АМФ |
| lac промотор/оператор | ИПТГ |
Источник углерода
[0046] Любой подходящий источник углерода, например глицерин, сукцинат, лактат или источник углерода на основе сахаров, например глюкоза, лактоза, сахароза и фруктоза, предусматривается для применения в настоящем изобретении, что должно быть очевидно для среднего специалиста в данной области. Например, источники углерода на основе сахаров, которые можно применять в настоящем изобретении, включают, без ограничения, разветвленные или неразветвленные полисахариды, которые включают мономеры сахаридов D-маннозу, D- и L-галактозу, фукозу, фруктозу, D-ксилозу, L-арабинозу, D-глюкуроновую кислоту, сиаловую кислоту, D-галактуроновую кислоту, D-маннуроновую кислоту (например, полиманнуроновую кислоту, или альгиновую кислоту), D-глюкозамин, D-галактозамин, D-глюкозу и нейраминовую кислоту, включая гомополисахариды и гетерополисахариды, например лактозу, амилопектин, крахмал, гидроксиэтиловый крахмал, амилозу, сульфат декстрана, декстран, декстрины, гликоген или полисахаридную субъединицу кислых мукополисахаридов, например гиалуроновой кислоты; полимеры сахарных спиртов, такие как полисорбит и полиманнит; гепарин или гепаран; или любую их комбинацию, без ограничения. Глюкоза представляет собой первичный источник углерода согласно некоторому варианту реализации настоящего изобретения. Арабиноза, если используется в качестве индуктора, может также служить вторичным источником углерода, хотя она также может быть первичным источником углерода. Согласно некоторому варианту реализации, указанные источники углерода включают любой из D-глюкозы, L-арабинозы, сахарозы, I-инозита, D-маннита, β-D-фруктозы, α-L рамнозы, D-ксилозы, целлюлозы, или любую их комбинацию. Один или более чем один источник углерода можно применять в настоящем изобретении.
Бактериальные экспрессионные системы и плазмиды
[0047] Настоящее изобретение также обеспечивает рекомбинантные бактериальные клетки, включающие вектор экспрессии, такой как плазмиду, включающую последовательность, контролирующую экспрессию, имеющую промоторные последовательности и инициаторные последовательности и последовательность нуклеотидов, которая кодирует необходимый полипептид, указанная последовательность нуклеотидов расположена с 3′ стороны от промоторных и инициаторных последовательностей. Предусмотрены любая подходящая последовательность, контролирующая экспрессию, и клетка-хозяин/переносчик генетического материала, что должно быть очевидно для специалиста в данной области на основании описания, приведенного в данной заявке.
[0048] Подходящие последовательности, контролирующие экспрессию, и комбинации клеток-хозяев/переносчиков генетического материала хорошо известны в данной области и описаны в качестве примера в Sambrook, J., E.F.Fritsch, и Т.Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, Нью-Йорк. Как правило, методики рекомбинантной ДНК включают получение посредством синтеза или выделения последовательности ДНК, которая кодирует интересующий рекомбинантный белок, и ее введение в подходящую экспрессионную систему вектор/клетка-хозяин, где она экспрессируется, предпочтительно под контролем индуцируемого арабинозой промотора. Любой из указанных способов, описанных для вставки ДНК в вектор экспрессии, можно применять для лигирования промотора и других регуляторных элементов в определенные сайты внутри выбранного рекомбинантного вектора. Подходящие клетки-хозяева затем трансформируют, инфицируют, трансдуцируют или трансфецируют такими векторами или плазмидами с помощью традиционных методик.
[0049] Множество систем клетка-хозяин-вектор (плазмида) можно применять для экспрессии интересующего рекомбинантного белка. Указанная векторная система, такая как, например, система, включающая промотор, индуцируемый арабинозой, совместима с используемой клеткой-хозяином. ДНК, кодирующую интересующий рекомбинантный белковый продукт, вставляли в экспрессионную систему, и промотор (предпочтительно, промотор, индуцируемый арабинозой) и другие регуляторные элементы лигировали в специфичные сайты внутри указанного вектора таким образом, что когда вектор вводится в клетку-хозяина (путем трансформации, трансдукции или трансфекции, в зависимости от используемой системы клетка - хозяин - вектор), ДНК, кодирующая интересующий рекомбинантный белковый продукт, экспрессируется клеткой-хозяином.
[0050] Вектор может быть выбран из одного из вирусных векторов или невирусных векторов, описанных выше, но он должен быть совместим с используемой клеткой-хозяином. Рекомбинантный ДНК вектор можно вводить в подходящие клетки-хозяева (бактерию, вирус, дрожжи, клетки млекопитающего или тому подобные) путем трансформации, трансдукции или трансфекции и т.д. (в зависимости от системы вектор/клетка - хозяин). Системы хозяин-вектор включают, но не ограничены перечисленными, бактерию, трансформированную ДНК бактериофага, плазмидной ДНК или космидной ДНК.
[0051] Экспрессию в прокариотах интересующего рекомбинантного белкового продукта можно вести в любом подходящем виде или штамме бактерии, таком как E. coli, применяя векторы, включающие конститутивные или индуцируемые промоторы, направляющие экспрессию либо слитых, либо неслитых белков.
[0052] Гибридные векторы (для получения слитых белков) добавляют некоторое количество аминокислот к закодированному на них белку, к амино- или карбоксильному концу рекомбинантного белка. Такие гибридные векторы, как правило, служат трем целям: 1) повышению экспрессии рекомбинантного белка; 2) повышению растворимости рекомбинантного белка; и 3) способствованию очистки рекомбинантного белка путем действия в качестве лиганда при аффинной очистке. Часто, в гибридные векторы экспрессии вводят сайт протеолитического расщепления в месте соединения рекомбинантного белка и слитой с ним молекулы, чтобы облегчить отделение рекомбинантного белка от слитой с ним молекулы после очистки слитого белка. Такие ферменты и их последовательности когнатного распознавания включают фактора Ха, тромбин и энтерокиназу.
[0053] Типичные гибридные векторы экспрессии включают Pgex (Pharmacia Biotech Inc; Smith и Johnson, 1988), Pmal (New England Biolabs, Беверли, Массачусетс) и Prit5 (Pharmacia, Пискатавей, Нью-Джерси), которые присоединяют глутатион-6-трансферазу (GST), мальтоза-Е-связывающий белок или белок А соответственно к целевому рекомбинантному белку.
[0054] Примеры подходящих индуцируемых негибридных векторов экспрессии в Е. coli включают pTrc (Amann и др. (1988) Tightly regulated tac promoter vectors useful for the expression of unfused and fused proteins in Escherichia coli, Gene, 69, 301-315), и Pet lid (Studier и др. (1990) Use of T7 RNA polymerase to direct expression of cloned genes, Methods in Enzymology, 185, 60-89). Экспрессия целевого гена с pTrc вектора полагается на транскрипцию РНК-полимеразой хозяина с гибридного trp-lac слитого промотора. Экспрессия целевого гена с вектора Pet lid полагается на транскрипцию с T7 gn1 0-lac слитого промотора, опосредуемую совместно экспрессируемой вирусной РНК-полимеразой J7 gnl. Эта вирусная полимераза обеспечивается штаммами хозяина BL21 (DE3) или HMS I 74(DE3) из присутствующего в них профага, несущего ген T7 gnl под транскрипционным контролем lacUV 5 промотора.
[0055] Регуляторной последовательностью векторной конструкции является индуцируемый промотор, согласно некоторому варианту реализации. Применение индуцируемого промотора позволит клетке продуцировать активированный белок на низком основном уровне в процессе обычного культивирования и размножения. Впоследствии, клетки можно индуцировать для экспрессии больших количеств требуемого белка в процессе продукции или скрининга. Индуцируемый промотор можно выделить из генома клетки или вируса.
[0056] Индуцируемые промоторы, которые регулируются с помощью экзогенно вносимых соединений, включают, без ограничения, арабинозный промотор, цинк-индуцируемый промотор металлотионина овцы (МТ), дексаметазон (Dex)-индуцируемый промотор вируса опухоли молочной железы мыши (MMTV), промоторную систему Т7-полимеразы (WO 98/10088); промотор экдизона насекомых (No и др., 1996 Proc. Natl. Acad. Sci. USA, 93:3346-3351), тетрациклин-репрессируемую систему (Gossen и др., 1992 Proc. Natl. Acad. Sci. USA, 89:5547-5551), тетрациклин-индуцируемую систему (Gossen и др., 1995 Science, 268:1766-1769, см. также Harvey и др., 1998 Curr. Opin. Chem Biol, 2:512-518), RU486-индуцируемую систему (Wang и др., 1997 Nat. Biotech., 15:239-243 и Wang и др., 1997 Gene Ther., 4:432-441) и рапамицин-индуцируемую систему (Magari и др., 1997 J. Clin. Invest., 100:2865-2872). Согласно некоторому варианту реализации настоящего изобретения, указанным промотором является промотор, индуцируемый арабинозой.
[0057] Любая подходящая бактериальная клетка-хозяин предусмотрена для применения в рамках настоящего изобретения, что должно быть очевидно для специалиста в данной области на основании описания, приведенного в данной заявке. Например, подходящие бактерии для этих целей включают Escherichia, Enterobacter, Azotobacter, Erwinia, Bacillus, Pseudomonas, Klebsiella, Proteus, Salmonella, Serratia, Shigella, Rhizobia, Vitreoscilla, Paracoccus, или их комбинацию, без ограничения. Любой подходящий штамм любой такой подходящей бактерии также предполагается настоящим изобретением. Дополнительно, применение подходящих мутированных клеток, что должно быть очевидно для специалиста в данной области, также предполагается настоящим изобретением. Специалист в данной области с легкостью сможет выбрать подходящую клетку-хозяина для использования при конкретных обстоятельствах, на основании руководства, приведенного в данной заявке.
[0058] Примеры подходящих индуцируемых векторов экспрессии в Е. coli включают, без ограничения, pTrc (Amann и др., 1988 Gene, 69:301-315), арабинозные векторы экспрессии (например, Pbad18, Guzman и др., 1995 J. Bacteriol., 177:4121-4130) и pETIId (Studier и др., 1990 Methods in Enzymology, 185:60-89). Экспрессия целевого гена с указанного pTrc вектора полагается на транскрипцию РНК-полимеразой хозяина с гибридного trp-lac слитого промотора. Экспрессия целевого гена с указанного pETIId вектора полагается на транскрипцию с Т7 gn10-lac слитого промотора, опосредуемую совместно экспрессируемой вирусной РНК-полимеразой Т7 gn1. Эта вирусная полимераза обеспечивается штаммами хозяина BL21 (DE3) или HMS I 74(DE3) из присутствующего в них профага, несущего ген Т7 gn1 под транскрипционным контролем lacUV5 промотора. PBAD система полагается на индуцируемый арабинозный промотор, который регулируется araC геном. Указанный промотор индуцируется в присутствии арабинозы.
[0059] В других вариантах реализации настоящего изобретения используются регулируемые арабинозой векторы экспрессии или векторы, в которых экспрессия интересующего рекомбинантного белка находится под контролем арабинозного промотора, например промотора для арабинозного оперона Е. coli, PBAD или PARA, без ограничения.
[0060] Последовательность нуклеиновых кислот (нуклеотидов), кодирующая любой требуемый белок, предусмотрена настоящим изобретением. Указанная последовательность нуклеотидов может быть полностью или частично встречающейся в природе последовательностью нуклеотидов или полностью или частично измененной последовательностью нуклеотидов, или любой последовательностью, которая гибридизируется с ней при строгих условиях. Ссылки в данной заявке на последовательности нуклеиновых кислот, которые соответствуют гену, относятся к любой последовательности нуклеиновых кислот, экспрессируемой в виде необходимого белка.
[0061] Например, такие измененные последовательности нуклеиновых кислот включают делецию, замену, включая транзицию и трансверсию, или вставку одного нуклеотида, и отличающиеся тем, что указанные изменения могут встречаться в 5′- или 3′-концевых положениях эталонной последовательности нуклеотидов или в любом месте между этими концевыми положениями, рассеянные либо отдельно среди нуклеотидов эталонной последовательности, либо в виде одной или более непрерывных групп внутри эталонной последовательности. Количество измененных нуклеотидов определяют путем умножения общего количества нуклеотидов в любой последовательности на числовой процент соответствующего процента идентичности (деленный на 100) и вычитания этого произведения из указанного общего количества нуклеотидов в указанной последовательности.
[0062] Например, в настоящем изобретении предполагается применение последовательности нуклеотидов, которая по меньшей мере на 70% идентична некоторой последовательности нуклеиновых кислот, вырожденному ее варианту или ее фрагменту, отличающейся тем, что указанная последовательность может включать вплоть до nn изменений нуклеиновых кислот по всему полинуклеотидному участку указанной последовательности нуклеиновых кислот, при этом nn представляет собой максимальное количество изменений и рассчитывается по формуле:
nn=xn-(xn·y),
в которой xn представляет собой общее количество нуклеиновых кислот любой последовательности и у имеет значение 0.70, отличающейся тем, что любое нецелочисленное произведение xn и y округляется до ближайшего целого значения перед вычитанием этого произведения из xn. Конечно, у может также иметь значение 0.80 для 80%, 0.85 для 85%, 0.90 для 90%, 0.94 для 94%, 0.95 для 95%, 0.96 для 96%, 0.97 для 97%, 0.98 для 98% или 0.99 для 99%, и т.д. Изменения в последовательности могут приводить к нонсенс-, миссенс-мутациям или мутациям со сдвигом рамки считывания в этой кодирующей последовательности и, тем самым, к изменению полипептида, кодируемого указанным полинуклеотидом, после таких изменений.
[0063] В настоящем изобретении предполагается применение вырожденных вариантов, или их фрагментов. Как определено в данной заявке, "вырожденный вариант" представляет собой полинуклеотид, который отличается от указанной последовательности нуклеотидов (и ее фрагментов) вследствии вырожденности генетического кода, но еще кодирует тот же белок.
[0064] Указанная нуклеиновая кислота может включать ДНК, хромосомную ДНК, кДНК и РНК, и может дополнительно включать гетерологичные нуклеотиды. В соответствии с различными вариантами реализации, указанная нуклеиновая кислота гибридизируется с некоторой нуклеиновой кислотой, с комплементарной ей, с вырожденным ее вариантом, или ее фрагментом, при высоко строгих условиях гибридизации. В еще других вариантах реализации, указанный полинуклеотид гибридизируется при средне строгих условия гибридизации.
[0065] Должно быть очевидно, что указанные нуклеиновые кислоты можно получить из природных, синтетических или полусинтетических источников; более того, указанная последовательность нуклеотидов может быть встречающейся в природе последовательностью, или она может быть родственной вследствии мутации, включая единичные или множественные замены, делеции, вставки и инверсии оснований, по отношению к такой встречающейся в природе последовательности. Указанная молекула нуклеиновой кислоты может быть РНК, ДНК, однонитевой или двунитевой, линейной или ковалентно замкнутой циркулярной формы.
[0066] Примеры условий строгости приведены в Таблице Условий строгости, ниже: высоко строгими условиями являются такие условия, которые по меньшей мере настолько строгие, как, например, условия A-F; строгие условия по меньшей мере настолько строгие, как, например, условия G-L; и условия пониженной строгости по меньшей мере настолько строгие, как, например, условия M-R.
УСЛОВИЯ СТРОГОСТИ
| Условие строгости | Полинуклеотидный гибрид | Длина гибрида (п.о.)I | Температура и буферII для гибридизации | Температура и буферII для промывки |
| А | ДНК:ДНК | >50 | 65°С; 1×SSC или 42°С; 1×SSC, 50% формамид | 65°С; 0.3×SSC |
| В | ДНК:ДНК | <50 | TB; 1×SSC | TB; 1×SSC |
| С | ДНК:РНК | >50 | 67°С; 1×SSC или 45°С; 1×SSC, 50% формамид | 67°С; 0.3×SSC |
| D | ДНК:РНК | <50 | TD; 1×SSC | TD; 1×SSC |
| Е | РНК:РНК | >50 | 70°С; 1×SSC |