Противовирусное средство в капсулах и способ его получения
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности, в частности к составу лекарственного средства, обладающего противовирусным действием, выпускаемого в твердых желатиновых капсулах, а также к способу его получения. Противовирусное средство по изобретению содержит гранулы, включающие активное вещество - натриевую соль 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, и физиологически приемлемые вспомогательные добавки - в качестве наполнителя и дезинтегранта - крахмал, а в качестве антифрикционного вещества - тальк. Размер гранул находится в диапазоне от 0,5 до 0,63 мм. Желатиновые капсулы выполнены массой от 0,290 до 0,300 г. Способ получения противовирусного средства в виде гранул в желатиновых капсулах осуществляется путем влажного гранулирования. Лекарственное средство по изобретению обладает выраженным вирусоингибирующим действием, удовлетворительными органолептическими свойствами и фармакологической безопасностью, а также расширяет арсенал противовирусных лекарственных средств. 2 н. и 10 з.п. ф-лы, 3 ил., 7 табл., 3 пр.
Реферат
Заявляемое изобретение относится к химико-фармацевтической промышленности, в частности к составам лекарственных средств, обладающих противовирусным действием, преимущественно выпускаемых в твердых желатиновых капсулах, а также к способам их получения.
Из уровня техники известно значительное количество противовирусных препаратов, таких как арбидол, амиксин (тилорон), рибавирин, ацикловир и другие, большинство из которых выпускается в виде твердых лекарственных форм, а именно таблеток и капсул (см. Машковский М.Д. Лекарственные средства. - 15-е изд. М.: ООО «Новая волна». - 2006 г.).
Наибольшее распространение и применение получили лекарственные препараты, состоящие из желатиновых капсул, включающих частично или полностью прозрачную мягкую желатиновую капсулу, внутренний объем которых заполнен гранулами или гранулами в твердой желатиновой капсуле, содержащими полезный агент, при этом используют гранулы диаметром приблизительно от 149 до 1190 мкм, причем полезный агент является лекарственным веществом. Гранулы высвобождают лекарственное вещество немедленно или являются гранулами с постепенным высвобождением лекарственного вещества для лечения кашля, простуды и/или аллергических симптомов (см. заявку на изобретение №96102843 «Частицы, заключенные в мягкие желатиновые капсулы», дата подачи 09.02.1996 г., дата публикации 20.05.1998 г.).
Известен состав противовирусного и иммуномодулирующего перорального препарата, содержащего в качестве активного вещества низкомолекулярный синтетический индуктор интерферона - амиксин и физиологически приемлемые наполнители, включая лактозу, магния или кальция стеарат, при следующих соотношениях компонентов по массе: капсулы 0,125 г, % - амиксин 47,6-52,4%, лактоза - 51,6-45,4%, кальция или магния стеарат - 0,8-2,2%; капсулы 0,250 г, % - амиксин - 81,6-88,33%, лактоза - 14,8-16,7%, кальция или магния стеарат - 0,52-0,66% (см. заявку на изобретение №2000121621 «Способ получения противовирусного препарата «амиксин» (тилорон дигидрохлорида) (варианты)»).
Известно лекарственное средство, обладающее вирусингибирующим действием в отношении вируса А и В, выполненное в виде желатиновой капсулы, содержащей арбидол и вспомогательные добавки, в качестве которых используют крахмал картофельный, метилцеллюлозу, поливинилпирролидон низкомолекулярный, аэросил, кальций стеариновокислый, твин-80, при следующем соотношении компонентов, мас.%:
| Арбидол | 47-52 |
| Метилцеллюлоза | 1,0-1,5 |
| Поливинилпирролидон низкомолекулярный | 0,02-0,05 |
| Аэросил | 0,8-1,2 |
| Твин-80 | 0,02-0,025 |
| Кальций стеариновокислый | 0,3-0,5 |
| Крахмал картофельный | остальное. |
При этом желатиновая капсула содержит желатин, глицерин и воду при следующем соотношении ингредиентов, мас.%:
| Желатин | 15-20 |
| Глицерин | 2-5 |
| Вода | остальное |
(см. патент РФ на изобретение №2240784 «Лекарственное средство на основе арбидола», дата подачи 02.09.2003 г., опубликовано 27.11.2004 г.).
Из уровня техники известно вещество - натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, предназначенное для лечения и профилактики заболеваний, вызываемых патогенными для человека и животных вирусами, в том числе вирусами лихорадки долины Рифт, вируса ЗЭЛ, парагриппа, респираторно-синцитиального вируса, вируса болезни Ауески (см. патент РФ на изобретение №2294936 «Натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат», дата подачи 29.06.2005 г., опубликовано 10.03.2007 г.).
Кроме того, известен близкий структурный аналог вышеуказанной соли, защищенный патентом РФ №2404182 «Натриевая соль 2-этилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат», дата подачи 14.07.2008 г., опубликовано 20.11.2010 г.
Известные технические решения, обладающие биологической активностью, относятся к таким химическим соединениям, как соли, являющиеся продуктом взаимодействия кислот и оснований.
При получении нового химического соединения с установленным видом биологической активности следует учитывать, что при его синтезе, как правило, проводят ограниченный набор исследований в области фармацевтического применения. Далее при разработке применяемого для лечения лекарственного препарата должны быть проведены дополнительные исследования. И совсем не очевидно, что из нового соединения, для которого установлен лишь вид биологической активности, можно получить препарат, на который будет выдано соответствующее разрешение на его применение для лечения млекопитающих (животного или человека).
Применение же соединения для лечения заболевания включает как клиническое использование, так и изготовление лекарственного средства, поскольку перед лечением соединение необходимо ввести в ту или иную лекарственную форму (таблетка, капсула и т.д.) (см. А.А.Полякова, Е.А.Уткина «Достаточность сведений, представляемых в материалах заявки, для оценки соответствия изобретения в области медицины условиям патентоспособности», Москва, ОАО ИНИЦ «ПАТЕНТ», 2007 г.).
Кроме того, данные соли биологически активны по отношению к определенным видам вирусов, например вирусов ВЭЛ (венесуэльский энцефаломиэлит лошадей), ЛДР (лихорадка долины Рифт), Синдбис, ВБА (вирус болезни Ауески) (патент №2294936), и в отношении вируса Западного Нила и вируса ТОРС (патент №2404182).
Наиболее близким по технической сущности к заявляемому изобретению является пероральный лекарственный препарат в виде капсул, заполненных массой для капсулирования, содержащей активное вещество - тилорон, физиологически приемлемые наполнитель и антифрикционное вещество, при этом масса для капсулирования представляет собой смесь порошков, которая дополнительно содержит дезинтегрант, например, при следующем соотношении компонентов массы для капсулирования, мас.%:
| Тилорон | 35,0-50,0 |
| Дезинтегрант | 2,0-30,0 |
| Антифрикционное вещество | 0,1-1,0 |
| Наполнитель | остальное. |
В качестве дезинтегранта данный лекарственный препарат содержит, например, крахмал картофельный, или карбонат кальция, или аэросил, в качестве антифрикционного вещества, например, тальк или стеарат магния или кальция, в качестве физиологически приемлемого наполнителя, например, лактозу, или микрокристаллическую целлюлозу (МКЦ), или глюкозу, или сахарозу (см. заявку на изобретение №2007100160 «Пероральный лекарственный препарат тилорон и способ его получения», дата подачи 10.01.2007 г., дата публикации 20.07.2008 г.).
Недостатки известного лекарственного средства связаны с наличием в составе наполнителя, а именно лактозы, применение которой приводит к увеличению массы капсулы и, как следствие, ухудшает возможность использования данного средства потребителями - больными, особенно детского и пожилого возраста, так как затрудняет проглатывание капсулы.
Техническим результатом, на который направлено заявляемое изобретение, является получение капсулированного лекарственного средства с улучшенными органолептическими свойствами, фармакологической безопасностью при условии полного соответствия требованиям фармакопеи, а также расширение ассортимента лекарственных средств, обладающих противовирусным действием.
Указанный результат достигается тем, что в противовирусном средстве в капсулах, содержащих гранулы активного вещества, физиологически приемлемых вспомогательных добавок, а именно наполнителя, антифрикционного вещества и дезинтегранта, согласно изобретению в качестве активного вещества используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат (далее - Соль), в качестве наполнителя и дезинтегранта - крахмал, а в качестве антифрикционного вещества - тальк, при следующем соотношении компонентов, мас.%:
| Натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат | 75,7-92,3 |
| Крахмал | 4,0-15,0 |
| Тальк | 1,1-7,0. |
Размер гранул препарата находится в диапазоне от 0,5 до 0,63 мм.
Желатиновые капсулы выполнены массой от 0,290 до 0,300 г.
Заявляемое противовирусное средство обладает широким спектром вирусингибирующей активности, в том числе в отношении вируса птичьего и «свиного» гриппа и многих других.
В предлагаемом составе крахмал выполняет одновременно две роли, а именно наполнителя и дезинтегранта, благодаря которому состав приобретает стабильную, защищенную от деструкции, равномерно диспергированную структуру с устойчивой формой. Введение крахмала в состав лекарственного средства в заявляемых переделах является оптимальным, так как в этом диапазоне обеспечиваются наилучшие показатели, увеличение его содержания приводит к более продолжительному времени растворимости гранул и, как следствие, уменьшению биодоступности активного вещества из гранул, а уменьшение его содержания приводит к хрупкости гранул.
Тальк - антифрикционное вещество - является своеобразной смазкой, предотвращающей слипание гранул. Превышение заявленного предела приводит к запыленности и увеличению внутрипроизводственных отходов, а уменьшение - к слипанию желатиновых гранул.
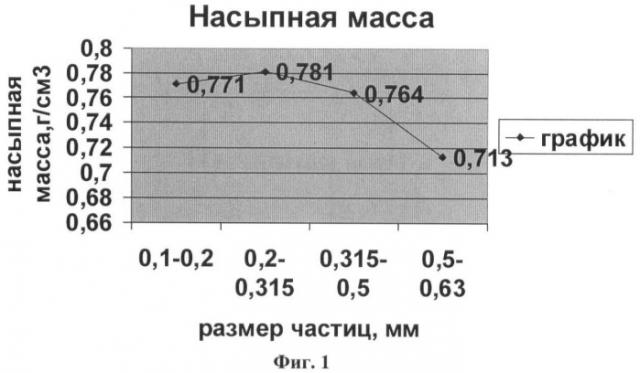
Известно, что порошки, используемые в фармацевтическом производстве, должны обладать оптимальными технологическими свойствами, такими как сыпучесть, насыпная масса, содержание влаги и др. Так, например, фракции одного и того же порошка с разными размерами частиц имеют различные насыпные массы (см. фиг.1).
Как видно из графика, наилучшими показателями обладают частицы, размер которых составляет 0,5-0,63 мм.
Постоянство насыпной массы и, следовательно, постоянство размера частиц обеспечивают минимизацию погрешности дозирования (массы содержимого капсул) (см. Белоусов В.А., Вальтер М.Б. Основы дозирования и таблетирования лекарственных порошков. М.: Медицина, 1980. - 216 с.).
Все компоненты, входящие в состав, разрешены к применению в медицинской практике и выпускаются в соответствии с требованиями, предъявляемыми фармакопейными статьями предприятия и Государственной фармакопеей, а именно внешний вид; распадаемость - не более 20 минут; растворение - не менее 75% действующего вещества за 45 минут; отклонение в массе содержимого капсул не более 10% (см. Государственная фармакопея XI изд., вып.2. Москва, 1990, с.143).
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «новизна».
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного применения.
Для подтверждения достижения заявленного технического результата при осуществлении изобретения были использованы составы с содержанием ингредиентов во всем заявленном интервале значении количественных признаков, мас.%, в частности:
Состав №1:
| Соль | 75,7 |
| Крахмал | 15,0 |
| Тальк | 4,05 |
Состав №2:
| Соль | 84,0 |
| Крахмал | 9,5 |
| Тальк | 7,0 |
Состав №3:
| Соль | 92,3 |
| Крахмал | 15,0 |
| Тальк | 1,1. |
На основании экспериментальных данных и в соответствии с требованиями ГФ XI в ФСП введена норма для теста «Высвобождение»: за 45 мин из капсулы должно перейти в раствор не менее 75% активного вещества, в данном случае натриевой соли 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат - Соли.
Данные исследования высвобождения Соли из капсул приведены в Таблице 1.
| Таблица 1 | |||||||
| № серии | Содержание Соли, г (состав №2) | Количество Соли, перешедшее из капсулы в раствор, г/мин | |||||
| 15 минут | 30 минут | 45 минут | |||||
| г | % | г | % | г | % | ||
| 1 | 0,2522 | 0,1261 | 50,0 | 0,1803 | 71,5 | 0,2113 | 83,8 |
| 2 | 0,2515 | 0,1210 | 48,1 | 0,1763 | 70,1 | 0,2125 | 84,5 |
| 3 | 0,2491 | 0,1138 | 45,7 | 0,1751 | 70,3 | 0,2187 | 87,8 |
| 4 | 0,2502 | 0,1108 | 44,3 | 0,1724 | 68,9 | 0,2024 | 80,9 |
| 5 | 0,2496 | 0,1253 | 50,2 | 0,1847 | 74,0 | 0,2067 | 82,8 |
| Среднее значение, % | 47,7±2,5 | 71,00±2,0 | 84,0±3,2 |
Все показатели соответствуют фармакопейной статье предприятия.
Ниже приведены показатели, которые характеризуют физико-химические свойства средства в капсулах.
«Распадаемость» - не более 30 минут. Определение проводят согласно Государственной фармакопее XI издания, выпуск 2, с.143. Капсулы, предназначенные для внутреннего применения, должны распадаться или растворяться в желудочно-кишечном тракте. Определение распадаемости проводят на лабораторном идентификаторе процесса распадаемости. Для проведения испытаний отбирают 18 образцов исследуемой лекарственной формы, помещают по одному в каждую трубку, прикрепляют к верхнему диску сетку из нержавеющей стали с размером отверстий 2 мм и помещают в сосуд с водой при температуре (37±2)°С. Включают прибор и проводят определение. Все образцы должны полностью распадаться, о чем судят по отсутствию частиц на сетке диска. Если 1 или 2 образца не распались, повторяют испытание на оставшихся 12 образцах. Не менее 16 из 18 образцов должны полностью распасться.
«Растворение». Определение проводят в соответствии с требованиями ОФС 42-0003-04, используя прибор типа "Вращающаяся корзинка". Среда растворения - вода, объем среды растворения - 900 мл, скорость вращения корзинки - 100 об/мин, время растворения - 45 мин.
Для испытания в корзинку помещают 1 капсулу. Через 45 минут отбирают 50 мл из центра сосуда для растворения, фильтруют через фильтр, например, типа "Миллипор" с диаметром пор 0,45 мкм, отбрасывая первые 15 мл фильтрата.
Количество Соли, прошедшее в раствор из капсулы, (X) в процентах вычисляют по формуле:
,
где S1 - среднее значение площади пика Средства на хроматограмме испытуемого раствора;
S0 - среднее значение площади пика Соли на хроматограмме раствора стандартного образца;
а0 - навеска СО Соли, в граммах;
а1 - содержание Соли в капсуле, заявленное на этикетке, в граммах;
900, 100 - разведение, в миллилитрах;
100 - пересчет в проценты.
Количество Соли, перешедшее из капсулы в раствор через 45 мин, должно быть не менее 75% от заявленного на этикетке (выдерживает требования, см. Таблицу 1).
Предлагаемый к защите состав, содержащий натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат (Соль), крахмал и тальк в указанных соотношениях, обеспечивает лекарственному средству улучшенные органолептические свойства, обладает фармакологической безопасностью и соответствует требованиям фармакопеи, а также расширяет ассортимент отечественных лекарственных средств, обладающих противовирусным действием.
Заявляется способ получения предлагаемого к защите противовирусного средства в капсулах.
Из уровня техники известен способ получения противовирусного лекарственного препарата, включающий просеивание порошков активного вещества и вспомогательных добавок, а именно наполнителя, антифрикционного вещества, взвешивание и смешивание, причем при смешивании дополнительно вводят дезинтегрант, после чего полученной массой для капсулирования наполняют желатиновые капсулы, при следующем соотношении компонентов, мас.%:
| Тилорон | 35,0-50,0 |
| Дезинтегрант | 2,0-3,0 |
| Антифрикционное вещество | 0,1-1,0 |
| Наполнитель | остальное. |
При этом в качестве активного вещества используют тиролон, в качестве наполнителя лактозу, или микрокристаллическую целлюлозу, или глюкозу, или сахарозу, в качестве антифрикционного вещества - тальк или стеарат магния или кальция, а в качестве дезинтегранта - крахмал картофельный, или карбонат кальция, или аэросил (см. заявку на изобретение РФ №2007100160 «Пероральный лекарственный препарат тиролон и способ его получения», дата подачи 10.01.2007 г.).
Технический результат, на который направлено заявляемое изобретение, заключается в оптимизации технологии получения противовирусного препарата, обладающего повышенными органолептическими свойствами, фармакологической безопасностью при условии соответствия требованиям фармакопеи.
Указанный результат достигается тем, что в способе получения противовирусного средства в капсулах, осуществляемом с использованием активного вещества и физиологически приемлемых добавок: наполнителя, антифрикционного вещества и дезинтегратора и включающем просеивание порошков активного вещества и наполнителя, их взвешивание и смешивание, наполнение полученной массой желатиновых капсул, согласно изобретению при смешивании проводят влажное гранулирование массы, после которого осуществляют первичную протирку увлажненной массы через перфорированное устройство, затем сушат и осуществляют вторичную протирку, после чего полученный гранулят опудривают тальком, при этом в качестве активного вещества используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат (Соль), в качестве наполнителя и антифрикционного вещества - крахмал, а в качестве дезинтегранта - тальк, при следующем соотношении компонентов, мас.%:
| Натриевая соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат (Соль) | 75,7-92,3 |
| Крахмал | 4,0-15,0 |
| Тальк | 1,1-7,0. |
При проведении влажного гранулирования используют 5%-ный крахмальный клейстер.
Используют натриевую соль 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, размер частиц которой находится в интервале 0,1-0,6 мм.
В качестве перфорированного устройства используют перфорированную пластину.
Первичную протирку осуществляют через перфорированную пластину с отверстиями 1,5 мм.
Сушку проводят до остаточной влажности не более 0,5%.
При вторичной протирке используют перфорированную пластину с отверстиями 0,5 мм.
Получают желатиновые капсулы с массой от 0,290 до 0,300 г.
Благодаря проведению влажной грануляции, достигается однородность размера частиц массы.
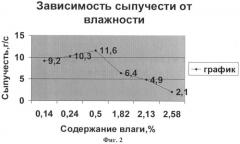
Гранулят сушат при температуре 40-45°С до остаточной влажности не более 0,5%. Использовать полученный заявляемым способом гранулят с более высокими показателями влажности нецелесообразно, так как это приводит к ухудшению сыпучести (см. фиг.2).
Как видно из графика, наилучшие показатели получают при показателе остаточной влажности, равном 0,5%.
Вторичная протирка через перфорированную пластину, размер отверстий которой равен 0,5 мм, позволяет получить гранулы, обладающие улучшенной сыпучестью (см. фиг.3).
У частиц с размером от 0,5 до 0,63 мм определена максимальная сыпучесть.
Опудривание гранул тальком предотвращает их слипание.
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «новизна».
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного осуществления способа получения противовирусного средства в капсулах.
Способ осуществляется следующим образом. Просеивают и взвешивают порошки активного вещества - натриевой соли 2-метилтио-6-нитро-1,2-4-триазоло[5,1-с]-1,2,4-триазин-7-она, дигидрат, и наполнителя - крахмала. После этого в смеситель загружают полученную соль с размером частиц 0,1-0,6 мм и наполнитель. Затем небольшими порциями постепенно добавляют 5%-ный крахмальный клейстер. Полученную увлажненную массу протирают через перфорированную пластину с отверстиями 1,5 мм. Проводят сушку при температуре 40-45°С до остаточной влажности не более 0,5%. После сушки осуществляют вторичную протирку с использованием перфорированной пластины с отверстиями 0,5 мм. Затем полученный гранулят опудривают тальком и фасуют в готовые твердые желатиновые капсулы массой 0,290-0,300 г, которые затем помещают в упаковку.
Осуществление заявляемой группы изобретений подтверждено на примерах конкретного выполнения.
Пример 1
Изучение противовирусной эффективности Средства на основе структурных аналогов пуриновых оснований в отношении возбудителя гриппа A (H5N1)
В работе использовали вирус гриппа, штамм А (H5N1), выделенный из биопроб, доставленных из очага заболевания (пало и было уничтожено более 460 тысяч кур).
Использованы перевиваемые культуры клеток почек свиньи - СПЭВ и почек собаки - MDCK. В качестве ростовой среды и среды поддержания использовали полусинтетическую среду (ПС-4) на растворе Хенкса, содержащую 7,5 и 2% сыворотки крупного рогатого скота соответственно.
Использованы составы №№1-3 Средства.
Контрольные препараты: Озельтамивир (тамифлю) - производства фирмы Хоффманн - Ля Рош Лтд., Швейцария; арбидол - производства ЗАО «Мастерлек», Россия, ремантадин - производства ООО «РОЗФАРМ», Россия.
Противовирусную эффективность препаратов in vitro оценивали по следующим показателям:
- снижение уровня накопления вируса под воздействием препарата (Δ, lg);
- коэффициент ингибирования (Ки, %);
- подавление цитотоксической активности вируса, (%).
Критериями эффективности препаратов являются: снижение инфекционного титра возбудителя более чем на 1,8 lg, Ки более 98,3% соответственно.
Основными критериями оценки эффективности in vivo являлись:
- показатели защиты лабораторных животных от гибели;
- среднее время животных в группе (см., например, Методические подходы к поиску антивирусных препаратов, их испытание и оценка / Н. А.Лагушкин, Н.И.Митин, В.А.Старовойтова и др. // Вирусные ингибиторы и механизм их действия. - Рига, 1977. - С.138-149).
Статистическую обработку полученных результатов проводили общепринятыми методами (см., например, Лакин Г.Ф. Биометрия. - М., «Высшая школа». - 1990).
В качестве объекта исследования использовались 9-10-суточные развивающиеся куриные эмбрионы (РКЭ), белые мыши массой 12-14 г и цыплята 6-8-недельного возраста.
Оценку эффективности различных составов №№1-3 во всем заявленном интервале значений количественных признаков Средства в отношении вируса гриппа, штамм A (H5N1), проводили in vitro в культуре клеток МДСК. В качестве инфицирующего препарата использовали аллантоисную жидкость инфицированных РКЭ с биологической активностью 5,5 lg ЦПД/мл. Множественность инфицирования составила 0,01 ЦПД/клетку. Адсорбцию вируса проводили в течение 60 мин при температуре плюс (37,0±0,5)°С. После адсорбции вируса монослой трижды промывали питательной средой типа ПС-4 на растворе Хенкса, содержащей 2% сыворотки КРС и по 100 ЕД/мл пенициллина и стрептомицина, затем вносили свежую среду, содержащую препараты в исследуемых концентрациях, и инкубировали в течение 3 суток при температуре плюс (37,0±0,5)°С. В течение всего срока наблюдения визуально учитывали цитопатический эффект, вызванный в культуре клеток вирусом, с использованием светового микроскопа (объектив ×10, окуляр ×15), а также определяли уровень специфического гемагглютинина. В качестве референс-препаратов использовали тамифлю, ремантадин и арбидол. На каждую дозу препарата использовали не менее 10 пробирок с монослоем культуры клеток двухсуточного возраста.
Результаты изучения подавления репродукции вируса гриппа, штамм А (H5N1) в динамике, представленные в Таблицах 2 и 3, свидетельствуют о том, что Средство (состав №1) в культуре клеток MDCK в концентрации, соответствующей МПК (128 мкг/мл), полностью подавляет цитопатическую активность вируса гриппа, штамм А (H5N1), при внесении препарата через 1 час после инфицирования монослоя клеток. В концентрациях 64 мкг/мл и 32 мкг/мл Средство подавляет 90% цитопатической активности вируса.
| Таблица 2 | |||
| Результаты оценки эффективности Средства по подавлению цитопатической активности вируса гриппа, штамм А (H5N1), в культуре клеток MDCK через 48 часов после инфицирования (п=3) | |||
| Препарат | Доза препарата, мкг/мл | Частота выявления ЦПД, Х | Коэффициент подавления ЦПД, %, X |
| Заявляемое Средство, состав №1 | 128,0 | 0/30 | 100 |
| 64,0 | 3/30 | 90 | |
| 32,0 | 3/30 | 90 | |
| Арбидол | 25,0 | 21/30 | 30 |
| Тамифлю | 100,0 | 0/30 | 100 |
| Ремантадин | 50,0 | 4/30 | 87 |
| Контроль без препарата | 100 | - |
Как видно из Таблицы 2, наиболее низкую противовирусную эффективность выявил арбидол. В максимально переносимой концентрации коэффициент ингибирования составил 30%.
Озельтамивир в максимально переносимой концентрации полностью подавляет цитопатическую активность вируса гриппа птиц, а эффективность ремантадина составила 87%.
В результате изучения способности Средства подавлять формирование специфического гемагглютинина выявлено, что средство в максимально переносимой концентрации подавляет репродукцию вируса гриппа на 93,8%, в концентрации 64 мкг/мл - на 89,6%, в дозе 32 мкг/мл - на 87,5%. Наиболее эффективно подавляет тамифлю репродукцию вируса в максимально переносимой концентрации.
| Таблица 3 | |||
| Результаты оценки эффективности Средства по подавлению образования специфического гемагглютинина вируса гриппа, штамм A (H5N1), в культуре клеток MDCK через 48 часов после инфицирования (n=3) | |||
| Препарат | Доза препарата | Уровень гемагглютинина, ГА, X±σ | Коэффициент подавления ГА, %, X±a |
| Заявляемое Средство, состав №1 | 128,0 | 8,0±0,0 | 93,8±0,0 |
| 64,0 | 13,3±2,5 | 89,6±2,1 | |
| 32,0 | 16,0±0,0 | 87,5±0,0 | |
| Арбидол | 25,0 | 53,3±10,6 | 58,3±8,3 |
| Тамифлю | 100,0 | отсутствует | 100,0±0,0 |
| Ремантадин | 50,0 | 1,3±0,7 | 98,9±0,5 |
| Контроль (без препарата) | 128±0,0 | - |
Как видно из Таблицы 3, заявляемое Средство в высоких концентрациях эффективно подавляет репродукцию вируса гриппа, штамм А (H5N1), в культуре клеток MDCK.
Результаты изучения подавления репродукции вируса гриппа, штамм А (H5N1), представленные в Таблице 4, свидетельствуют о том, что Средство в культуре клеток MDCK в концентрации, соответствующей 1/16 МПК (8 мкг/мл), подавляет цитопатическую активность вируса гриппа, штамм А (H5N1), при внесении его через 1 час после инфицирования монослоя клеток на 80% - составы №№1, 2, состав №3 - на 90%.
Наиболее низкую противовирусную эффективность выявил арбидол. В максимально переносимой концентрации коэффициент ингибирования составил 50%. Озельтамивир и ремантадин в максимально переносимой концентрации полностью подавляют цитопатическую активность вируса гриппа птиц.
В результате изучения способности Средства подавлять формирование специфического гемагглютинина выявлено, что препарат в 1/16 максимально переносимой концентрации подавляет репродукцию вируса гриппа полностью, составы №№1, 2, 3. Тамифлю и ремантадин эффективно подавляют репродукцию вируса в максимально переносимой концентрации.
| Таблица 4 | |||
| Оценка противовирусной эффективности различных составов Средства в отношении вируса гриппа, штамм А (H5N1), в культуре клеток MDCK (по цитопатической активности) (п=3) | |||
| Препарат | Доза препарата, мкг/мл | Частота выявления ЦПД, X | Коэффициент подавления ЦПД, %, X±σx |
| Заявляемое Средство, состав №1 | 8,0 | 6/30 | 80 |
| 4,0 | 9/30 | 70 | |
| 2,0 | 12/30 | 60 | |
| 1,0 | 15/30 | 50 | |
| 0,5 | 18/60 | 40 | |
| Заявляемое Средство, состав №2 | 8,0 | 6/30 | 80 |
| 4,0 | 12/30 | 60 | |
| 2,0 | 15/30 | 50 | |
| 1,0 | 18/30 | 40 | |
| 0,5 | 18/30 | 40 | |
| Заявляемое Средство, состав №3 | 8,0 | 3/30 | 90 |
| 4,0 | 18/30 | 80 | |
| 2,0 | 12/30 | 60 | |
| 1,0 | 15/30 | 50 | |
| 0,5 | 15/30 | 50 | |
| Арбидол | 25 | 15/30 | 50 |
| Тамифлю | 100 | 0/30 | 100 |
| Ремантадин | 50 | 0/30 | 100 |
| I Контроль | - | 30/30 | - |
Таким образом, оценка противовирусной эффективности различных составов Средства показала их воспроизводимость в процессе подавления репродукции вируса гриппа.
Пример 2
Изучение эффективности Средства в отношении вируса гриппа, штамм A (H5N1) in vivo
Оценку эффективности заявляемого средства в отношении вируса гриппа, штамм А (H5N1), проводили in vivo с использованием белых мышей массой 12-15 г. В качестве инфицирующего препарата использовали аллантоисную жидкость инфицированных РКЭ с биологической активностью 5,5 lg ЦПД50/мл, 8,3 lg ЭВД50/мл, 6,3 lg ЛД50/мл.
Препараты вводили белым мышам перорально по профилактической и лечебной схемам, а также по схеме экстренной профилактики.
Полученные результаты изучения профилактической эффективности Средства в отношении экспериментальной формы гриппа у белых мышей, интраназально инфицированных вирусом гриппа, представлены в Таблице 5.
Защита от гибели при использовании этого соединения в дозе 100 мг/кг массы животного составила в среднем 35,0%, увеличение среднего времени жизни (СВЖ) - 2,6 суток.
| Таблица 5 | ||||||
| Изучение профилактической эффективности Средства в отношении экспериментальной формы гриппа у белых мышей, интраназально инфицированных вирусом гриппа, штамм A (H5N1) | ||||||
| Препарат | Схема введения препарата | Доза препарата, мг/кг | Частота гибели животных | Защитная эффективность от гибели, % | Среднее время жизни животных в группе, дни | Увеличение средней продолжительности жизни, Δ, дни |
| Заявляемое Средство. Состав №2 | - 120 ч, | 100 | 10/20 | 50 | 11,2 | 2,7 |
| - 96 ч; | 50 | 14/20 | 30 | 10,8 | 2,3 | |
| - 72 ч; | 10 | 13/20 | 35 | 10,8 | 2,3 | |
| - 48 ч; | 1 | 10/20 | 50 | 11,4 | 2,9 | |
| Тамифлю | - 24 ч; | 50 | 4/20 | 80 | 10,0 | 4,0 |
| - 1 ч | 13 | 8/20 | 60 | 12,5 | 4,0 | |
| 10 | 10/20 | 50 | 11,5 | 3,0 | ||
| Арбидол контроль лозы | - 24 ч, | 60 | 11/20 | 45 | 11,1 | 2,6 |
| - 1 ч | 30 | 12/20 | 40 | 11,0 | 2,5 | |
| Контроль дозы | - | - | 20/20 | - | 8,5 | - |
| Контроль стада | - | - | 0/20 | - | 14,0 | - |
| Примечание. 1 Здесь и в таблице 13 инфицирующая доза составляла 10ЛД50 |
Использование Средства по профилактической схеме в дозе 50 мг/кг защищало от гибели инфицированных животных в среднем на 31,7%; в дозе 10 мг/кг - 33,3%; 1 мг/кг - 45,0%. Увеличение показателя СВЖ составило в среднем по результатам опытов на 2,4 суток, 2,6 суток и 2,8 суток соответственно.
Для выбора наиболее эффективной схемы применения Средства препарат вводили животным перорально за 2 суток и сутки до инфицирования. Результаты исследования представлены в Таблице 6.
При применении Средства двукратно за 48 часов и 24 часа до инфицирования более эффективную защиту животным препарат оказывал в дозах 1 и 10 мг/кг. Защита от гибели составила 40,0%, а увеличение показателя СВЖ - 3 суток. Противовирусная эффективность Средства сопоставима с таким же показателем для арбидола. При этом следует подчеркнуть, что доза препарата была значительно ниже, чем референс-препарата арбидол, и на сутки больше СВЖ в группе.
| Таблица 6 | ||||||
| Изучение профилактической эффективности Средства в отношении экспериментальной формы гриппа у белых мышей, интраназально инфицированных вирусом гриппа, штамм A (H5N1) | ||||||
| Препарат | Схема введения препарата | Доза препара-та, мг/кг | Частота гибели животных | Защитная эффективность от гибели, % | Среднее время жизни животных в группе, дни | Увеличение средней продолжительности жизни, Δ, дни |
| Заявляемое Средство, состав №2 | -24 ч | 100 | 15/20 | 25 | 11,0 | 2,3 |
| 50 | 14/20 | 30 | 11,2 | 2,5 | ||
| 10 | 14/20 | 30 | 11,3 | 2,6 | ||
| 1 | 14/20 | 30 | 11,4 | 2,7 | ||
| Тамифлю | - 120 ч, - 96 ч, - 78 ч, - 48 ч, - 24 ч, - 1 ч | 50 | 2/20 | 90 | 13,6 | 4,9 |
| 13 | 7/20 | 65 | 13,2 | 4,5 | ||
| 10 | 10/20 | 50 | 12,5 | 3,8 | ||
| Арбидол | - 24 ч, - 1 ч | 60 | 11/20 | 45 | 11,5 | 2,8 |
| 30 | 12/20 | 40 | 11,0 | 2,3 | ||
| Контроль дозы | - | - | 20/20 | - | 8,7 | - |
| Контроль стада | - | 0/20 | - | 14,0 | - |
При применении Средства за сутки и 1 час до инфицирования показатель защитной эффективности Средства снизился на 10%.
В качестве референс-препаратов использовали арбидол и тамифлю. Арбидол в дозе 30 мг/кг (соответствует профилактической дозе для человека - 200 мг/сутки) защищал от гибели в среднем 38% инфицированных белых мышей. Увеличение среднего времени жизни составило в среднем 2,2 суток. В дозе 60 мг/кг (соответствует равноэффективной дозе человека - 400 мг/сутки) защитная эффективность в среднем составила 45%, увеличение показателя среднего времени жизни - 2,6 суток.
Защитная эффективность тамифлю в дозе 10 мг/кг составила в среднем 51%, в дозе 13 мг/кг (соответствует ½ дозы для человека - 75 мг/сутки) - 62%, в дозе 50 мг/кг - 86%. При этом наблюдали удлинение среднего времени жизни на 3,4; 4,3 и 4,7 суток соответственно.
Следовательно, наибольший противовирусный эффект Средство проявило при применении его в диапазоне доз от 1 до 10 мг/кг массы животного по профилактическим схемам за 5 суток до инфицирования, ежедневно, и за 2 суток до инфицирования, ежедневно.
При применении Средства по схеме экстренной профилактики в дозе 50 мг/кг массы препарат защищал от гибели в среднем 42,5% инфицированных животных, в дозе 100 мг/кг - 47,5%. При этом наблюдали увеличение СВЖ на 2,7 суток и 3,0 суток соответственно.
Арбидол в дозе 135 мг/кг при использовании его по схеме экстренной профилактики защищал от гибели 30% инфицированных вирусом гриппа белых мышей. Увеличение СВЖ составило в среднем 1,7 суток.
Пример 3
Испытания противовирусной активности Средства в отношении вируса «свиного» гриппа
Исследование протективной активности Средства в отношении вируса «свиного» гриппа проведены на базе НИИ гриппа. В задачи исследования входило воспроизведение инфекционного процесса, вызванного этим вирусом, у белых мышей и тестирование противовирусной активности Средства в сравнении с противовирусным препаратом Ремантадин.
В работе аликвоты Средства разводили в среде для клеточных культур Игла MEM. Из полученного раствора были приготовлены необходимые разведения на среде MEM для экспериментов на животных. В качестве референс-препарата использовали Ремантадин (1-(1-адамантил)-аминоэтил гидрохлорид, Aldrich Chem. Co., Milw., WI). В качестве модельного вируса использовали вирус гриппа A/California/07/09 (HlNl)v из коллекции вирусных штаммов НИИ гриппа СЗ РАМН. Вирус пассировали в аллантоисной полости 10-12-дневных куриных эмбрионов в течение 48 часов при 36°С.
Исследуемые препараты вводили животным внутрибрюшинно в объеме 0,2 мл в следующих дозах: Средство 200 и 70 мг/кг, Ремантадин - 50 мг/кг. Препараты вводили по лечебно-профилактической схеме: за 24 часа и 1 час до заражения и через 24, 48 и 72 часа после заражения. В качестве плацебо контрольной группе животных вводили физиологический фосфатный буфер. В качестве отрицательного контроля использовали интактных животных, которые содержались в тех же условиях, что и опытные группы. Вирусы вводили животным интраназально под легким эфирным наркозом в дозе 1 LD50. В каждую группу наблюдения брали по 15 мышей. На 3 день