Твердая фармацевтическая композиция (варианты) и способ контроля концентрации глюкозы с ее помощью, способ получения твердой фармацевтической композиции (варианты), таблетка (варианты) и способ получения амфорных частиц
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложена твердая фармацевтическая композиция для перорального применения, включающая приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных C4-C12 жирных кислот, их сложных эфиров или солей и по меньшей мере один фармацевтически приемлемый наполнитель, выбранный из группы, включающей по меньшей мере 10 мас.% разрыхлителя, 10 мас.% маннита и 0,5 мас.% смазывающего вещества. Предложены способ контроля концентрации глюкозы в крови с помощью указанной композиции, способы ее получения и таблетки массой 5÷500 мг. Предложены твердая фармацевтическая композиция, стабильная при интервале температур 2÷40°С и разных показателях относительной влажности в течение по меньшей мере 6 месяцев, и инсулинотропная фармацевтическая композиция с пониженной в три раза митогенностью по сравнению со своим нативным аналогом, включающие указанную композицию. Предложен также способ получения аморфных высушенных распылительной сушкой частиц. Изобретение обеспечивает изготовление фармацевтической композиции для перорального применения, включающей конъюгат инсулина с повышенной биодоступностью и пониженной митогенностью. 13 н. и 52 з.п. ф-лы, 16 ил., 16 табл., 14 пр.
Реферат
Область техники к которой относится изобретение
Изобретение относится к нестандартным фармацевтическим композициям, обеспечивающим введение путем пероральной доставки белков/пептидов или их конъюгатов и/или комплексов катион-конъюгат инсулина, демонстрирующих требуемые фармакокинетические профили и активность на эффективных моделях диабета на собаках и у человека. Предпочтительный препарат содержит 0,01÷20 мас.% инсулина, конъюгатов соединений инсулина и/или катион-конъюгатов инсулина, 10÷60 мас.% одного или более компонентов жирных кислот, выбранных из насыщенных или ненасыщенных С4-С12 жирных кислот и/или солей данных жирных кислот, и дополнительно содержит оптимальные количества других фармацевтически приемлемых полимерных наполнителей, которые обеспечивают повышенную растворимость, скорость растворения и эффективную биодоступность слабо растворимых в воде композиций и совместимых профилей высвобождения in-vivo при масштабируемости в процессе изготовления. Другой аспект изобретения характеризует способ получения вышеуказанных препаратов.
Уровень техники
Принятые способы подкожного введения инсулина все в большей степени исследуют в плане замены пероральными механизмами доставки лекарственных препаратов, которые не изменяли бы его физиологической клинической активности. Проблемы, с которыми сталкиваются в данной области техники при создании эффективной системы пероральной доставки лекарственного препарата для биологических макромолекул, в основном приписывают его чувствительности к ферментативному разложению и низкой проницаемости через эпителий. Кроме того, структура и конформация инсулина легко изменяются при приготовлении лекарственного средства и условиях этого процесса, приводя к потере биологической активности. Некоторые подходы к преодолению данных ограничений включают использование аналогов инсулина, введение таких пептидов, как амилин, глюкагоноподобный пептид, С-пептиды, ингаляционные формы, интраназальные формы, которые удовлетворительным образом не направлены индивидуально на ограничения биодоступности.
В области техники существует потребность в фармацевтически приемлемых комплексах, включая дериватизированные конъюгаты инсулина, обладающие повышенной биодоступностью или другими усовершенствованными фармацевтическими свойствами относительно имеющихся конъюгатов. Более того, требуется, чтобы данные усовершенствованные конъюгаты доставлялись в форме стабильного и нестандартного препарата, который легко максимально увеличивает преимущества пероральной доставки белков. В настоящем изобретении применяют комбинированный подход использования усовершенствованного конъюгата инсулина с повышенной биодоступностью и усовершенствованной лекарственной формы в отношении ограничений доставки инсулина.
Примеры соединений инсулина включают человеческий инсулин, лизпро-инсулин, дез30-инсулин, нативный проинсулин, искусственные проинсулины и т.п. Катионный компонент может, например, представлять собой катион двухвалентного металла, выбранный из группы, состоящей из Zn++, Mn++, Ca++, Fe++, Ni++, Сu++, Со++ и Мg++. Комплексы катион-конъюгат соединения инсулина также включают модифицированную группу, связанную (например, ковалентно или ионно) с соединением инсулина с образованием конъюгата соединения инсулина. Кроме того, модифицирующую группу выбирают так, чтобы она делала конъюгат соединения инсулина настолько же или более растворимым, чем соответствующее неконъюгированное соединение инсулина, и чтобы растворимость в воде конъюгата соединения инсулина снижалась при добавлении цинка. Модифицирующую группу выбирают так, чтобы она делала конъюгат соединения инсулина настолько же или более растворимым, чем соответствующее неконъюгированное соединение инсулина; растворимость в воде конъюгата соединения инсулина снижают добавлением цинка, и растворимость в воде комплекса превышает растворимость в воде соединения инсулина.
Примеры подходящих модифицирующих групп и конъюгатов инсулина, используемых для получения композиций, можно найти в патентах США № 7060675, 6303569, 6214330, 6113906, 5985263, 5900402, 5681811, 5637749, 5612640, 5567422, 5405877, 5359030, полные описания которых включены в данном контексте в виде ссылки. Дополнительные примеры данных комплексов катион-конъюгат соединения инсулина приведены в патентных заявках США US 2003/083232, US 2006/0019873 и US 2006/0019874.
В противоположность существующему предшествующему уровню техники соединения, соответствующие настоящему изобретению, проявляют пониженный митогенный потенциал, который почти в три раза ниже, чем у Insugen®.
Инсулин связывается и активирует свой родственный инсулиновый рецептор (ИР) с субнаномолярной аффинностью. Инсулин связывается также с структурно близким рецептором инсулиноподобного фактора роста (рецептор ИФР-1), но с приблизительно в 1000 раз более низкой аффинностью, чем инсулиновый рецептор. Вследствие этого при физиологических концентрациях инсулина рецептор ИФР-1 не играет никакой роли в опосредовании эффектов инсулина. Однако при высоких концентрациях инсулина (у больных диабетом, получающих инсулин) он дает митогенные эффекты посредством рецептора ИФР-1, который передает сигналы роста более эффективно, чем инсулиновый рецептор (см. статью Lammers R, et al., EMBO 1989).
Один из ранее идентифицированных аналогов инсулина с модификацией по остатку аспарагиновой кислоты В10 направлен на получение эффекта инсулина быстрого действия, однако модификация, в свою очередь, привела к существенному повышению митогенности данного аналога [см. статью Drejer, К., The bioactivity of insulin analogues from in vitro receptor binding to in vivo glucose uptake. (Биоактивность аналогов инсулина от связывания рецептора in vitro до поглощения глюкозы in vivo) Diabetes Metab Rev, 1992. 8(3): стр. 259-85]. Исследование проведено с целью изучения связывания ряда аналогов инсулина с рецептором инсулиноподобного фактора роста-1 и инсулиновым рецептором. Константы связывания измеряют и соотносят с метаболической и митогенной активностью исследуемых аналогов инсулина [см. статью Kurtzhals, P., et al., Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use. (Корреляции связывания рецептора и метаболической и митогенной активности аналогов инсулина, созданных для применения в клинике), Diabetes, 2000. 49(6): стр. 999-1005.] Согласно проведенным исследованиям, по сравнению с нормальным инсулином инсулин лизпро, инсулин аспарт и инсулин гларгин имели минимальное изменение в связывании инсулинового рецептора, тогда как инсулин детемир был существенно менее активным. Каждый из данных аналогов имел близкие или повышенные скорости диссоциации с рецептором ИФР-1, которые коррелировали с его митогенным поведением.
Митогенная активность белков/пептидов и их конъюгатов, комплексов катион-конъюгат пептида, комплексов катион-конъюгат инсулина представляет собой важную проблему, приписываемую риску повышенной митогенности и росту эпителиальных клеток молочной железы человека. Исследования показали, что связывание ИФР-1 инсулина аспарт аналогично связыванию нативного человеческого инсулина. Инсулин лизпро и инсулин гларгин имеют 1,5÷6,5-кратное повышение аффинности связывания с рецептором ИФР-1, соответственно, позволяя предположить, что инсулин гларгин обладает существенно более сильным митогенным ответом.
Длительные эффекты митогенных свойств аналогов инсулина, его конъюгатов, комплексов катион-конъюгат пептида, комплексов катион-конъюгат инсулина продолжают оставаться важным фактором, который следует принимать во внимание. Пункты, по которым рассматривают документ CPMP/SWP/372/01 касательно неклинической оценки канцерогенного потенциала аналогов инсулина, утверждают: "Нативный человеческий инсулин в дополнение к метаболическим действиям имеет слабый митогенный эффект. Данный эффект становится важным в плане безопасности аналогов инсулина, поскольку структурные модификации молекулы инсулина могли бы повысить его митогенную активность, возможно, приводящую к стимуляции роста ранее существующих новообразований". "Хотя предполагают повышенную активацию рецептора инсулиноподобного фактора роста 1 и/или аберрантную передачу сигнала через инсулиновый рецептор, механизм(ы), ответственный за митогенную активность аналогов инсулина, остается невыясненным".
Поскольку накапливаются доказательства того, что ИФР-1 стимулирует рост рака толстой кишки, молочной железы, простаты и легкого, имеется необходимость создания белков/пептидов и их конъюгатов, комплексов катион-конъюгат пептида, комплексов катион-конъюгат инсулина с минимальным митогенным риском, который оценивают в анализе пролиферации клеток и который можно назвать безопасным в течение длительного лечения.
Настоящее изобретение относится к белкам/пептидам, их конъюгатам и/или комплексам катион-конъюгат полипептида, проявляющим в три раза более низкие митогенные свойства по сравнению с Insugen®. Следующие аспекты настоящего изобретения направлены на тот факт, что наполнители в лекарственном продукте статистически не воздействуют на характеристики митогенной активности лекарственной субстанции.
Другой аспект изобретения относится к нестандартным фармацевтическим композициям, обеспечивающим введение путем пероральной доставки белков/пептидов или их конъюгатов и/или комплексов катион-конъюгат инсулина, демонстрирующих требуемые фармакокинетические профили и активность на эффективных моделях диабета на собаках и у человека.
WO 00/50012 раскрывает твердые пероральные лекарственные формы, содержащие лекарственный препарат и усиливающий агент, причем усиливающий агент представляет собой соль жирной кислоты с цепью средней длины с углеродной цепью из приблизительно 6-20 атомов углерода. US 2006/0018874 покрывает твердые фармацевтические композиции, приготовленные для перорального введения путем проматывания, имеющие 0,1÷75 мас.% компонента жирной кислоты, где компонент жирной кислоты включает насыщенные или ненасыщенные жирные кислоты и/или соли и лечебный фактор.
Несмотря на вышеизложенное, еще существует потребность в изготовлении "жизнеспособных" пероральных препаратов инсулина, которые могут преодолевать проблемы, связанные с потерей биологической активности в процессе изготовления, и в то же самое время проявлять повышенную устойчивость к ферментному разложению in vivo после приема. Настоящее изобретение направлено на оба требования. Вследствие этого изобретение направлено на проблемы, с которыми сталкиваются в области техники при создании высокоэффективного механизма пероральной доставки лекарственных препаратов типа конъюгатов инсулина.
Изобретение демонстрирует различные преимущества в плане дозирования и удобного способа введения. Изобретение создает еще одно преимущество относительно композиций, соответствующих предшествующему уровню техники, поскольку авторы предполагают, что заявленный рационально разработанный пероральный препарат IN-105 с измеренными компонентами других наполнителей и способ изготовления таблеток для перорального применения легко масштабируются. Кроме того, за счет данного рационально разработанного перорального препарата и способа его получения фактор масштабируемости не влияет на действие лекарственного препарата in vivo или его профиль высвобождения in vivo.
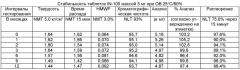
Имеющиеся в настоящее время пероральные препараты инсулина проявляют низкие уровни стабильности, исключая возможности перорального введения данных лекарственных средств. Один из наиболее важных аспектов настоящего изобретения характеризуется тем фактом, что настоящий пероральный препарат инсулина стабилен в интервале температур без вредного воздействия на различные параметры стабильности таблеток, такие как твердость, время распада, накопление высокомолекулярных примесей и скорость растворения. Изготовленные таким образом таблетки показывают высокую стабильность даже в ускоренных условиях стабильности при относительной влажности (ОВ) 75% при 40°С (далее 40°С/75%). Свойственные молекуле характеристики стабильности и способы изготовления обусловливают стабильную природу препарата.
Другой аспект изобретения относится к усовершенствованным фармацевтическим композициям комплексов катион-конъюгат инсулина, полученных с помощью масштабируемого способа распылительной сушки, причем указанный способ включает стадии получения водной суспензии комплекса катион-конъюгат инсулина и по меньшей мере одного компонента жирной кислоты необязательно с одним или более фармацевтически приемлемых наполнителей.
В типичном способе получения тонких частиц с использованием способа распылительной сушки материал, такой как ингредиент, который предназначен для образования массы частиц, растворяют в подходящем растворителе с образованием раствора. Альтернативно материал, предназначенный для распылительной сушки, можно суспендировать в нерастворителе с образованием суспензии или эмульсии. На данной стадии необязательно добавляют другие компоненты, такие как лекарственные препараты, фармацевтически приемлемые наполнители или порообразующие агенты. Затем раствор разбрызгивают с образованием тонкого капельного аэрозоля. Капли немедленно проходят в сушильную камеру, в которой они контактируют с сушильным газом. Раствор упаривают из капель в сушильный газ для затвердевания капель с образованием, таким образом, частиц. Затем данные частицы отделяют от сушильного газа и собирают.
При масштабировании данного способа распылительной сушки, например, с масштаба лабораторной или пилотной установки до масштаба промышленной установки, можно столкнуться с рядом проблем. Если скорость сушки и объем сушки не оптимизированы адекватным образом, можно встретиться с нежелательными проблемами, такими как неправильная сушка частиц растворителя, пониженный выход продукта, чистота и т.п. С другой стороны, повышение скорости сушки, которое неадекватно масштабировано, может дать в результате неподходящую морфологию и/или распределение по размеру некоторых частиц продукта, таких как частицы, имеющие критически определенные технические характеристики. Более существенно, что оно может также изменить процесс осаждения материала, образующего твердое вещество, по мере упаривания растворителя, изменяя тем самым структуру (например, пористость) частицы так, что она выходит за границы стандартов технических условий, делая частицу неспособной включать и доставлять надлежащим образом диагностический или лечебный фактор.
В связи с этим в области техники существует необходимость в усовершенствованном способе распылительной сушки, который приводит в результате к получению однородных твердых аморфных суспензий с высокой частотой при улучшенных характеристиках сыпучести, повышенной однородности содержания и повышенной эффективности сбора.
Одним из объектов настоящего изобретения является получение высушенных распылительной сушкой композиций комплексов катион-конъюгат инсулина, включающее способ сушки, который предусматривает улучшенную сушку частиц без вредного воздействия на чистоту, выход и стабильность продукта. Настоящий способ дает однородные высушенные распылительной сушкой твердые частицы направленного лечебного фактора, которые далее готовят с другими необходимыми наполнителями с получением пероральных фармацевтических композиций комплексов катион-конъюгат инсулина.
Другие объекты и преимущества настоящего изобретения будут более очевидны для обычного специалиста в области техники в свете последующего описания и прилагаемой формулы изобретения.
Раскрытие изобретения
Главным объектом настоящего изобретения является разработка твердой фармацевтической композиции для перорального применения в виде комплекса катион-конъюгат инсулина, включающей насыщенные или ненасыщенные С4-С12 жирные кислоты, сложные эфиры жирных кислот или их соли и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, включающей связующие компоненты, разрыхлители, разбавители, смазывающие вещества, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы.
Другим объектом настоящего изобретения является разработка твердой фармацевтической композиции для перорального применения, причем пероральная лекарственная форма находится в форме таблетки, капсулы, частиц, порошка или саше либо сухих суспензий.
Еще одним объектом настоящего изобретения является разработка способа изготовления твердой фармацевтической композиции для перорального применения IN-105.
Еще одним объектом настоящего изобретения является разработка композиции таблетки IN-105.
Еще одним объектом настоящего изобретения является разработка дозы твердой фармацевтической композиции для перорального применения, предназначенной для достижения максимального контроля концентрации глюкозы в крови после приема пищи у больных диабетом в течение 5-60 минут после приема.
Еще одним объектом настоящего изобретения является разработка стабильной фармацевтической композиции для перорального применения IN-105, отличающейся тем, что указанная композиция остается стабильной.
Еще одним объектом настоящего изобретения является разработка способа получения аморфных высушенных распылительной сушкой частиц.
Еще одним объектом настоящего изобретения является разработка фармацевтической композиции IN-105, причем она проявляет пониженную в три раза митогенность по сравнению со своим нативным аналогом.
Еще одним объектом настоящего изобретения является разработка фармацевтической композиции, содержащей комплекс катион-конъюгат пептида, в котором наполнители не влияют на митогенную активность конъюгата.
Настоящее изобретение предусматривает твердую фармацевтическую композицию для перорального применения IN-105, содержащую приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; фармацевтическую композицию для перорального применения, причем пероральная лекарственная форма находится в виде таблетки, капсулы, частицы, порошка или саше либо сухих суспензий; способ изготовления твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, включающий стадии а) перемалывания подходящих насыщенных или ненасыщенных С4-С12 жирных кислот и/или солей данных жирных кислот, b) грануляции результирующей жирной кислоты, полученной на стадии (а), с использованием органического растворителя, с) сушки на воздухе гранул, полученных на стадии (b), d) протирания высушенных гранул через сито для получения гранул с требуемым размером частиц, е) перемешивания гранул жирных кислот с комплексом катион-конъюгат инсулина с другими наполнителями, f) прессования перемешанной смеси для формирования таблеток; способ изготовления твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, включающий стадии а) перемалывания подходящих насыщенных или ненасыщенных С4-С12 жирных кислот и/или солей данных жирных кислот и связующего компонента, b) суспендирования комплекса катион-конъюгат инсулина в органическом растворителе при использовании связующего компонента с целью формирования мокрой массы, с) грануляции компонентов, полученных на стадии (b) с использованием связующего компонента, d) перетирания высушенных гранул, полученных на стадии (с), е) смешивания гранул с другими наполнителями, f) прессования перемешанной смеси для формирования таблеток; причем способ, в котором используемый органический растворитель выбран из группы, включающей изопропанол, ацетон, метиловый спирт, метилизобутилкетон, хлороформ, 1-пропанол, 2-пропанол, ацетонитрил, 1-бутанол, 2-бутанол, этиловый спирт, циклогексан, диоксан, этилацетат, диметилформамид, дихлорэтан, гексан, изооктан, метиленхлорид, трет-бутиловый спирт, толуол, четыреххлористый углерод или их комбинации; таблетку массой 5-500 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; таблетку массой 50 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; таблетку массой 100 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; таблетку массой 150 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10-60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; таблетка массой 200 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; таблетку массой 250 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы; дозу принимаемой перорально твердой фармацевтической композиции, предназначенную для достижения максимального контроля концентрации глюкозы в крови после приема пищи у больных диабетом в течение 5-60 минут после введения; стабильную принимаемую перорально твердую фармацевтическую композицию IN-105, содержащую приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающую связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, отличающуюся тем, что указанная композиция остается стабильной после воздействия условий, выбранных из группы, включающей (а) интервал температур приблизительно 2÷40°С, (b) относительную влажность 25±2°С/60±5%, относительную влажность 30±2°С/65±5%, относительную влажность 40±2°С/75±5% в период по меньшей мере 6 месяцев; способ получения аморфных высушенных распылительной сушкой частиц, содержащих приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, причем указанный способ включает стадии а) получения раствора или суспензии, включающих катион-конъюгат соединения инсулина и компонент жирной кислоты в растворителе, b) разбрызгивания раствора в камере в условиях, которые позволяют удалить существенное количество растворителя, с) представления полученных распылительной сушкой частиц катион-конъюгата соединения инсулина; инсулинотропную фармацевтическую композицию IN-105, содержащую приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, отличающуюся тем, что она проявляет пониженную в три раза митогенность по сравнению со своим нативным аналогом; и фармацевтическую композицию, содержащую приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающую связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, причем указанная композиция, отличается тем, что наполнители не влияют на митогенную активность конъюгата.
Настоящее изобретение относится к твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы.
В другом варианте осуществления настоящего изобретения компонент жирной кислоты представляет каприновую кислоту и/или лауриновую кислоту или их соли.
В еще одном варианте осуществления настоящего изобретения жирная кислота представляет собой капрат натрия.
В еще одном варианте осуществления настоящего изобретения связующий компонент выбран из группы, включающей поливинилпирролидон, карбоксиметилцеллюлозу, метилцеллюлозу, крахмал, желатин, сахара, природные и синтетические камеди или их комбинации.
В еще одном варианте осуществления настоящего изобретения связующий компонент представляет собой поливинилпирролидон.
В еще одном варианте осуществления настоящего изобретения разбавители выбраны из группы, включающей соли кальция, целлюлозу или производные целлюлозы, палатинозу, органические кислоты, сахар и сахароспирты, соли пектиновой кислоты или их комбинации.
В еще одном варианте осуществления настоящего изобретения разбавитель представляет собой маннит.
В еще одном варианте осуществления настоящего изобретения разрыхлитель выбран из группы, включающей поперечно сшитый поливинилпирролидон, карбоксиметилцеллюлозу, метилцеллюлозу, катионобменные смолы, альгиновую кислоту, гуаровую камедь или их комбинации.
В еще одном варианте осуществления настоящего изобретения смазывающее вещество выбрано из группы, включающей стеарат магния, стеарат натрия, бензоат натрия, ацетат натрия, фумаровую кислоту, полиэтиленгликоли, аланин и глицин.
В еще одном варианте осуществления настоящего изобретения смазывающее вещество представляет собой стеарат магния.
В еще одном варианте осуществления настоящего изобретения агент, усиливающий проницаемость, выбран из группы, включающей лаурилсульфат натрия, лаурат натрия, пальмитоилкарнитин, фосфатидилхолин, циклодекстрин и его производные, карнитин и их производные, мукоадгезивные полимеры, ZOT-токсин (токсин zonula occludens - "плотных контактов"), желчные кислоты, жирные кислоты или их комбинации.
В еще одном варианте осуществления настоящего изобретения, агент, усиливающий проницаемость, представляет собой лаурилсульфат натрия.
В еще одном варианте осуществления настоящего изобретения агент, усиливающий проницаемость, представляет собой β-циклодекстрин.
В еще одном варианте осуществления настоящего изобретения пластификатор выбран из группы, включающей полиэтиленгликоль, пропиленгликоль, ацетилцитрат, триацетин, ацетилированный моноглицерид, рапсовое масло, оливковое масло, кунжутное масло, ацетилтриэтилцитрат, глицеринсорбитол, диэтилоксалат, диэтилмалат, диэтилфумарат, дибутилсукцинат, дибутилфталат, диоктилфталат, дибутилсебацинат, триэтилцитрат, трибутилцитрат, глицеролтрибутират, глицерилтриацетат или их смеси.
В еще одном варианте осуществления настоящего изобретения пластификатор представляет собой полиэтиленгликоль.
Настоящее изобретение относится также к фармацевтической композиции для перорального применения, причем пероральная лекарственная форма находится в форме таблетки, капсулы, частиц, порошка или саше либо сухих суспензий.
Настоящее изобретение относится также к способу изготовления твердой фармацевтической композиции в виде комплекса катион-конъюгат инсулина для перорального применения, содержащей насыщенные или ненасыщенные С4-С12 жирные кислоты или их соли и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, содержащей связующие компоненты, разрыхлители, разбавители, смазывающие вещества, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы.
Настоящее изобретение относится также к способу изготовления твердой фармацевтической композиции для перорального применения, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, включающему стадии
а) перемалывания подходящих насыщенных или ненасыщенных С4-С12 жирных кислот и/или солей данной жирной кислоты;
b) грануляции результирующей жирной кислоты, полученной на стадии (а), с использованием органического растворителя;
с) сушки на воздухе гранул, полученных на стадии (B);
d) протирания высушенных гранул через сито для получения гранул с требуемым размером частиц;
е) перемешивания гранул жирных кислот с комплексом катион-конъюгат инсулина с другими наполнителями;
f) прессования перемешанной смеси для формирования таблеток.
Настоящее изобретение относится также к способу изготовления твердой фармацевтической композиции для перорального применения, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы, включающему стадии
a) перемалывания подходящих насыщенных или ненасыщенных С4-С12 жирных кислот и/или солей данных жирных кислот и связующего компонента;
b) суспендирования комплекса катион-конъюгат инсулина в органическом растворителе при использовании связующего компонента с целью формирования мокрой массы;
c) грануляции компонентов, полученных на стадии (B) с использованием связующего компонента;
d) перетирания высушенных гранул, полученных на стадии (с);
e) смешивания гранул с другими наполнителями;
f) прессования перемешанной смеси для формирования таблеток.
В еще одном варианте осуществления настоящего изобретения органический растворитель выбран из группы, включающей изопропанол, ацетон, метиловый спирт, метилизобутилкетон, хлороформ, 1-пропанол, 2-пропанол, ацетонитрил, 1-бутанол, 2-бутанол, этиловый спирт, циклогексан, диоксан, этилацетат, диметилформамид, дихлорэтан, гексан, изооктан, метиленхлорид, трет-бутиловый спирт, толуол, четыреххлористый углерод или их комбинации.
Настоящее изобретение относится также к таблетке массой 5-500 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10÷60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие компоненты, пластификаторы, агенты, усиливающие проницаемость, и солюбилизаторы.
Настоящее изобретение относится также к таблетке массой 50 мг твердой фармацевтической композиции для перорального применения IN-105, содержащей приблизительно 0,01÷20 мас.% IN-105, приблизительно 10 - 60 мас.% насыщенных или ненасыщенных С4-С12 жирных кислот, сложных эфиров жирных кислот или их солей и по меньшей мере три фармацевтически приемлемых наполнителя, выбранных из группы, состоящей из по меньшей мере 10 мас.% разрыхлителя, 10 мас.% разбавителя, 0,5 мас.% смазывающего вещества, необязательно включающей связующие к