Биопрепарат балис для профилактики и лечения инфекционных болезней
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к биопрепаратам. Биопрепарат для профилактики и лечения инфекционных болезней и дисбиозов различной этиологии, включающий живую микробную массу из штаммов Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610, фильтрат живых культур штаммов Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610 и лектинсвязывающую субстанцию из супернатанта культуральной жидкости живой микробной массы штамма Lactobacillus fermentum 90 TS-4(21) с молекулярной массой более 20 кДа, при определенном содержании компонентов. Вышеописанный биопрепарат повышает эффективность лечения инфекционных болезней и дисбиозов различной этиологии, туберкулезной инфекции, в том числе XDR ТВ, обусловленной полирезистентными туберкулезными микобактериями. 2 з.п. ф-лы, 1 ил., 7 табл., 5 пр.
Реферат
Изобретение относится к биотехнологии и касается создания новых пробиотических препаратов на основе бактерий рода Bacillus, которые могут быть использованы для профилактики и лечения инфекционных болезней человека и дисбиозов различной этиологии.
Известно, что большой проблемой в лечении туберкулеза является мультирезистентность микобактерий к антибиотикам, что создает непреодолимую преграду к снижению заболеваемости туберкулезом с широкой лекарственной устойчивостью (т.н. XDR-TB или ШЛУ-ТБ). При ШЛУ-ТБ, в дополнение к лекарственной устойчивости, свойственной мультирезистентности, добавляется устойчивость ко всем фторхинолонам, и, как минимум, к одному из трех инъекционных лекарств второй линии (капреомицину, канамицину или амикацину) (Отчет ВОЗ № WHO/HTM/TB/2010.3). В настоящее время встречаются штаммы микобактерий туберкулеза, обладающие устойчивостью к трем-четырем-пяти и даже шести антибиотикам, в том числе антибиотикам резерва, в связи с чем остро встает вопрос о поисках препаратов, позволяющих решить эту проблему.
Описано лечебно-профилактическое пробиотическое средство (RU 2314819 С1, Лялик и др., 20.01.2008), использующее биомассу спор бактерий рода Bacillus. Содержит штамм бактерий Bacillus subtilis ВКПМ В-7048, и/или штамм бактерий Bacillus subtilis ВКПМ В-7092, и/или штамм бактерий Bacillus licheniformis ВКПМ В-7038. Обеспечивает расширение спектра и увеличение биологической активности лечебно-профилактического пробиотического средства, однако не указывается на возможность восстановления чувствительности к антибиотикам под действием этого средства.
Известен препарат (RU 2403260 С2, СПОДСБЕРГ и др., 10.11.2010, WO 2006/097110 от 21.09.2006), продуцентом которого является Bacillus licheniformis, который по химической структуре относится к пептидам. Этот препарат обладает широкой антимикробной активностью по отношению к инфекционным возбудителям как прокариотам, так и эукариотам. Однако не сообщается о возможности лечения лекарственно-устойчивых штаммов микобактерий туберкулеза при совместном применении с антибиотиками.
Задачей настоящего изобретения является создание препарата для лечения инфекционных болезней и в первую очередь хронического туберкулеза XDR ТВ, вызванного микобактериями с широкой лекарственной устойчивостью.
Биопрепарат для профилактики и лечения инфекционных болезней, преимущественно туберкулеза и сопутствующего кандидоза, а также дисбиозов различной этиологии, включающий живую микробную массу из штаммов Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610, отличается тем, что дополнительно содержит фильтраты живых культур упомянутых штаммов Bacillus subtilis и Bacillus licheniformis и лектинсвязывающую субстанцию из супернатанта культуральной жидкости живой микробной массы штамма Lactobacillus fermentum 90 TS-4(21) при следующем содержании компонентов:
живая микробная масса штамма Bacillus subtilis VKPM В-8611 - не менее 5×108 КОЕ;
живая микробная масса штамма Bacillus licheniformis VKPM B-8610 - не менее 1×107 КОЕ;
фильтрат живой микробной массы штамма Bacillus subtilis VKPM В-8611, лиофилизированный - 2,5-4,5 мг;
фильтрат живой микробной массы штамма Bacillus licheniformis VKPM B-8610, лиофилизированный - 2,5-4,5 мг;
лектинсвязывающая субстанция из супернатанта культуральной жидкости живой микробной массы штамма Lactobacillus fermentum 90 TS-4(21) с молекулярной массой более 20 кДа, лиофилизированный - 5,5-7,5 мг.
Инфекционные болезни включают хронический туберкулез, кишечные инфекции, в том числе геморрагический колит, вызванный E.coli O-157, нозокомиальные хирургические инфекции, кандидоз, дисбиозы. Хронический туберкулез может быть вызван микобактериями XDR ТВ с широкой лекарственной устойчивостью.
Технический результат изобретения - повышение эффективности антибиотикотерапии туберкулезной инфекции, в том числе XDR ТВ, обусловленной полирезистентными туберкулезными микобактериями.
Входящие в состав биопрепарата штаммы Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610 депонированы в ФГУ ГОСНИИГЕНЕТИКА (FGUPGosNIIgenetika), дата международного депонирования 12.08.2004). Живые культуры обоих штаммов характеризуются широким спектром антагонистической активности, высокой протеолитической активностью, способностью к продукции бактериоцинов, ферментов лизоцима, амилазы, пептидов. Бактериальные фильтраты живых культур обоих штаммов, содержащие вышеуказанные экстрацеллюлярные продукты их жизнедеятельности, проявляли неожиданное действие в отношении патогенных микобактерий - возбудителей туберкулеза. Помимо антагонистического действия - способности задерживать рост микобактерий, изменяли чувствительность возбудителей к антибиотикам, повышая спектр активности антибиотика, восстанавливая чувствительность к 1, 2, 3, 4 или 5 антибиотикам. Следует отметить, что общей проблемой для туберкулезных больных, получающих длительную антибиотикотерапию, является развитие дисбиозов и кандидозов, как крайней степени дисбиоза. Настоящий препарат представляет поликомпонентный пробиотик. Он содержит дополнительно введенный лектинсвязывающий комплекс, который блокирует адгезию кандид на эпителиоцитах терминальных экологических ниш макроорганизма, тем самым препятствует развитию кандидозов. Для приготовления лектинсвязывающей субстанции, входящей в состав пробиотического препарата, использован продуцент пробиотического препарата лактобактерина. Был отобран вариант Lactobacillus fermentum 90-TS-4 (21) (клон 3), агглютинирующийся в присутствии конканавалина-А и обладающий высокой способностью экспрессировать лектинсвязывающий компонент в среду культивирования. Именно этот гликопротеиновой комплекс предотвращает колонизацию дрожжеподобных грибов рода Candida на эпителии (см. RU 2367686 С1, Анохина и др., 20.09.2009). Под действием пробиотической композиции Балис около 80% лекарственно-устойчивых патогенных микобактерий восстанавливают свою чувствительность к антибиотикам, при этом у штаммов XDR ТВ повышается чувствительность к 1-5 антибиотикам.
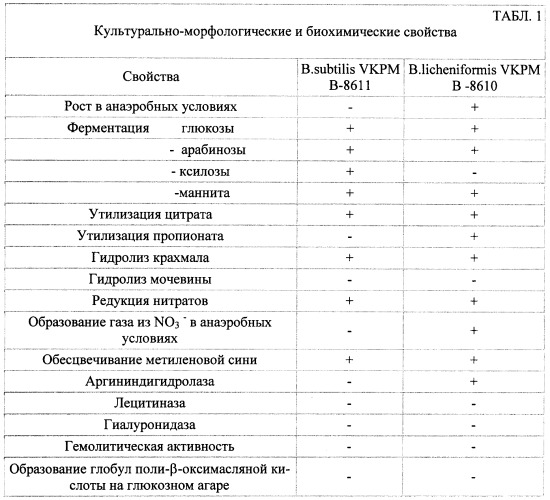
Штаммы B.subtilis 07 (VKPM В-8611) и B.licheniformis 09 (VKPM В-8610) выделены из здорового растения пшеницы, депонированы во Всероссийской коллекции промышленных микроорганизмов и характеризуются следующими свойствами.
Bacillus subtilis VKPM В-8611 - грамположительные аэробные спорообразующие палочки размером 2,7-0,6×0,8-0,7 мкм, расположенные одиночно или в виде цепочек. Клетки подвижны, образуют в аэробных условиях споры овальной формы, которые располагаются в клетке центрально. При спорообразовании клетки не раздуваются.
На среде Гаузе №2, сусло-агаре, среде Громыко штамм растет обильно, образует матовые складчатые колонии телесного цвета с изрезанными краями, легко снимаются петлей с агара.
В протоплазме штамма после роста на глюкозном агаре не обнаруживаются включения поли-β-оксимасляной кислоты. На МПБ культура образует пленку.
Не растет в анаэробных условиях, не гидролизует мочевину, не образует газ из нитратов в анаэробных условиях, не продуцирует аргининдигидролазу. Культура образует каталазу. Дает положительную реакцию Фогес-Проскауэра, растет в присутствии 7% NaCl. Гидролизует крахмал и казеин, разжижает желатину. Ферментирует глюкозу, арабинозу, ксилозу, маннит с образованием кислоты без газа. Редуцирует нитраты, обесцвечивает метиленовую синьку. Не обладает коагулазной и лецитиназной активностью, обладает высокой протеолитической и амилазной активностью.
Bacillus licheniformis VKPM B-8610 - грамположительные спорообразующие палочки, размером 2,6-0,7×0,5-06 мкм. Клетки подвижные, перитрихи, располагаются в основном в виде цепочек. Споры овальной формы, располагаются в клетке центрально. Клетки при спорообразовании не раздуваются. После роста на глюкозном агаре в протоплазме не обнаруживаются включения поли-β-оксимасляной кислоты.
На МПА образует колонии с тусклой грубой поверхностью, непрозрачные, плотно прикрепленные к агару: нередко на поверхности обнаруживается слизь. На МПБ образуется морщинистая пленка, иногда с кремовым оттенком.
Культура образует каталазу, характеризуется способностью расти на агаре в анаэробных условиях. Дает положительную реакцию Фогес-Проскауэра, растет при 7% NaCl. Гидролизует крахмал, казеин, не гидролизует мочевину. Желатин разжижает медленно. Ферментирует глюкозу, арабинозу, ксилозу, маннит с образованием кислоты без газа. Редуцирует нитраты, в анаэробных условиях из нитратов образует газ. Продуцирует аргининдигидролазу, лизоцим. Не обладает коагулазной и лецитиназной активностью.
Основные свойства штаммов В. licheniformis VKPM В-8610 и В. subtilis VKPM В-8611 представлены в Табл.1.
Штаммы B.subtilis VKPM В-8611 и B.licheniformis VKPM В-8610 характеризуются высокой антагонистической активностью в отношении широкого спектра патогенных и условно-патогенных микроорганизмов и устойчивостью к ряду антибиотиков (Табл.2, 3). Эти свойства позволяют применять Балис одновременно с антибиотиками, с усилением общего антибактериального эффекта.
В составе предлагаемого биопрепарата Балис указанные штаммы могут быть использованы в различных сочетаниях, например в равных соотношениях (по титру клеток): биомасса штамма В.subtilis VKPM В-8611 в титре 1·109 КОЕ/мл и биомасса штамма B.licheniformis в титре 1·109 КОЕ/мл или в любых соотношениях в пределах (1-100):(100-1), например биомасса штамма В.subtilis VKPM В-8611 в титре 5·109 КОЕ/мл и биомасса штамма B.licheniformis VKPM В-8610 в титре 1·109 КОЕ/мл, или биомасса штамма В.subtilis в титре 1·1010 КОЕ/мл и биомасса штамма B.licheniformis ВКПМ №В-8610 в титре 5·109 КОЕ/мл, или биомасса штамма В.subtilis VKPM В-8611 в титре 1·109 КОЕ/мл и биомасса штамма B.licheniformis VKPM В-8610 в титре 1·107 КОЕ/мл и т.д.
Для получения стерильных фильтратов живых культур штаммы В subtilis VKPM В-8611 и B.licheniformis VKPM В-8610 культивируют по отдельности при постоянном шуттелировании при температуре 37°С. Биомассу фильтруют через стерилизующие фильтры с предварительным центрифугированием (g=9859,6 м/сек2). Значение pH доводят до 6,0±0,05.
Целевой продукт - экстрацеллюлярные продукты жизнедеятельности штаммов В. subtilis VKPM В-8611 и B.licheniformis VKPM В-8610. Фильтраты живых культур подвергают лиофилизации и полученные субстанции хранят при температуре не выше 20°С. Субстанции стабильны, не изменяются в процессе лиофилизации, а также при хранении в течение 2 лет.
При изготовлении препарата использовали лиофилизированную субстанцию, но возможно и использование фильтратов в жидкой форме. В составе предлагаемого препарата Балис указанная субстанция может быть использована в количестве 3 мг/мл.
Для получения лектинсвязывающей субстанции в качестве продуцента использовали Lactobacillus fermentum штамм 90-NS-4(21) (штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером В-7573). После рассева штамма L. fermentum 90-TS-4(21) проводился отбор колоний по признаку агглютинации с конА на стекле в концентрации не ниже 1,75·10-3 мг/мл.
Отобранный вариант штамма L. fermentum 90-TS-4 (21) культивировали на жидкой среде МРС-1 в объеме 1000 мл в СО2-условиях, в течение 15-17 часов при температуре 37(±0,05)°С и постоянном перемешивании.
Через 15-17 часов культуру клеток с помощью центрифугирования (14-16 мин, 3000 об/мин (g=9859,6 м/сек2)) отделяли от культуральной жидкости.
Супернатант культуральной жидкости переносили на ячейки фирмы AMICON (США) (2000 мл) и освобождали от низкомолекулярных компонентов и остаточного количества бактериальных клеток с помощью стерилизующих мембран марки «Мили-пор» с диаметром пор 0,02 мкм.
Очищенную культуральную жидкость концентрировали на ячейки фирмы AMICON (США) (2000 мл) с использованием мембран «Диафло» марки UM-20 до объема 100 мл. Одновременно супернатант культуральной жидкости трехкратно отмывали дистиллированной водой от молочной кислоты, доводя pH до значения 6,0±0,05.
Полученный концентрат культуральной жидкости штамма L. fermentum 90 TS-4 (21) инкубировали 24 часа при комнатной температуре с конА-сефарозой. По истечении суток надосадок удаляли, а конА-сефарозу трехкратно отмывали фосфатным буфером (pH 8,2). Далее добавляли физиологический раствор (pH 3,0) и инкубировали 3 часа при комнатной температуре. Собирали надосадок и доводили его до pH 7,2 с помощью 0,1М NaOH. Наличие лектинсвязывающей субстанции контролировали с помощью 0,1% раствора конА в реакции кольцепреципитации.
Целевой продукт - антиадгезивный компонент на основе лектинсвязывающих структур штамма L. fermentum 90 TS-4(21) имеет следующие характеристики:
компонент, содержащий 150,0 мкг/мл белка, аггрегативно неустойчив при значениях pH выше 6,0;
молекулярная масса, определенная с помощью электрофореза в полиакриламидном геле, составляет от 25 до 30 кДа;
свойства лектинсвязывающей субстанции стабильны и не изменяются при хранении и в процессе лиофилизации.
Лектинсвязывающая субстанция оказывает модулирующее действие на адгезивную активность тест-культур дрожжеподобных грибов вида C.albicans и условно-патогенных штаммов микроорганизмов вида E.coli (см. RU 2367686).
Модулирующее свойство фракции, лишенной способности реагировать с конА, и фракции, способной реагировать с конА концентрата культуральной жидкости (КЖ) L.fermentum штамм 90 TS-4 (21) в тесте торможения адгезии тест-культур на эпителиоцитах влагалища (ЭВ), показало следующее (см. Табл.4). Хроматографически очищенная фракция лектинсвязывающей субстанции активно ингибирует адгезию вагинального изолята дрожжеподобных грибов вида C.albicans штамм 04.703 Б на эпителиоцитах и в меньшей степени влияет на адгезию орального изолята дрожжеподобных грибов вида C.albicans. На адгезию E.coli штамм К 12 фракция не оказывает никакого эффекта, но значительно блокирует адгезию E.coli штамм 89-1449 на эпителиоцитах влагалища. В то же время при удалении лектинсвязывающего компонента усиливается адгезивная активность части тест-культур E.coli к эпителиоцитам влагалища. Адгезия вагинального изолята дрожжеподобных грибов вида С.albicans штамм 04.703 в этой модельной системе достоверно уменьшается. Эти данные подтверждают, что получен лектинсвязывающий компонент с выраженной модулирующей активностью в отношении высокоадгезивных штаммов дрожжеподобных грибов вида С.albicans и других условно-патогенных микроорганизмов.
При составлении композиции поликомпонентного пробиотического препарата Балис соотношения живых штаммов VKPM В-8611 и В.licheniformis VKPM В-8610 можно было изменять в определенных интервалах, как указано выше. Фильтраты живых культур штаммов VKPM В-8611 и В.licheniformis VKPM В-8610 (экстрацеллюлярные субстанции) добавлялись в количестве в среднем по 3 мг. Лектинсвязывающую субстанцию Lactobacillus fermentum 90 TS-4 (21) добавляли в количестве около 6 мг. Биопрепарат Балис содержит также защитную среду для обеспечения сохранности бактерий в процессе технологической переработки, получения конечной рецептурной формы и последующего хранения. В качестве защитной среды он может содержать, например, сахарозо-желатиновую среду, сухое молоко, желатозу, лактозу, сахарозу и т.п. Биопрепарат Балис может дополнительно содержать растворитель. В качестве растворителя может быть использована, например, дистиллированная или кипяченая вода, физиологический раствор и т.п.
Биопрепарат Балис может дополнительно также содержать наполнитель, обычно применяемый при изготовлении различных рецептурных форм. При формовании таблеток он может содержать, например, декстраны, полиглюкин, крахмал, поливинил-пирролидон, сахарозу, лактозу, стеарат кальция, глюкозу, гидрокарбонат натрия, гидроокись алюминия, метилцеллюлозу, тальк и т.п. При получении суппозиторий или свечей в качестве наполнителя он содержит, например, кондитерский жир, парафин, ланолин, масло какао, гель гидроокиси алюминия и т.п.
Биопрепарат может быть инкапсулирован или иммобилизирован на различных типах носителей или сорбентах, например на аэросиле, целлюлозе, активированном угле, карбоксиметилцеллюлозе, гидроксиэтилцеллюлозе, хитозане и т.п.
Биопрепарат может также быть лиофилизирован.
Биопрепарат Балис может быть использован для перорального, или вагинального, или ректального, или наружного применения в виде водной суспензии. Механизм действия биопрепарата Балис основан на адгезивной и антагонистической активности бактерий-пробиотиков. Этот эффект обусловлен продуцированием различных физиологически активных веществ, вытесняющих патогенные и условно-патогенные микроорганизмы из пищеварительного тракта и оказывающих стимулирующее действие на специфические и неспецифические защитные реакции макроорганизма.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение жидкого препарата
Штаммы культивируют по отдельности или на плотных или на жидких питательных средах.
При стационарной технологии культивирование штаммов проводят на плотных агаризованных средах в матрацах, либо в стеклянных бутылях на термостатируемой качалке при температуре от 22 до 38°С в течение от 12-16 ч до 7 сут. По окончании инкубации смывают биомассу, выросшую на поверхности питательной среды, стабилизатором - защитной средой, содержащей 5%-ный раствор лактозы, сводят вместе в соотношении 10:1, разливают во флаконы. Получают биопрепарат с содержанием биомассы штамма В. subtilis VKPM В-8611 в титре 1·1010 КОЕ/мл и биомассы штамма В. licheniformis VKPM В-8610 - 1·109 КОЕ/мл. К полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21).
При промышленной технологии культивирование штаммов проводят в реакторе/ферментере с питательной средой для культивирования при температуре 35-38°С в течение от 10-18 ч. Процесс считают законченным, если концентрация клеток составляет 4-5 млрд/мл и соотношение спор и вегетативных клеток 1:1. По окончании инкубации раздельно выращенные культуры сводят вместе в соотношении 1:1 и добавляют сахарозо-желатиновую защитную среду, разливают во флаконы. Получают биопрепарат с содержанием биомассы штамма В.subtilis VKPM В-8611 в титре 5·109 КОЕ/мл и биомассы штамма В.licheniformis VKPM В-8610 - 5·109 КОЕ/мл. К полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21).
Пример 2. Получение препарата в форме лиофилизата
При стационарной технологии культивирование штаммов проводят на плотных агаризованных средах в матрацах либо в стеклянных бутылях на термостатируемой качалке при температуре от 22 до 38°С в течение от 12-16 ч до 7 сут. По окончании инкубации смывают биомассу, выросшую на поверхности питательной среды, защитной средой, содержащей 10%-ный раствор глицерина, к полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21).
Разливают в ампулы (флаконы) или в кассеты из нержавеющей стали, после чего подвергают замораживанию и обезвоживанию на вакуум-сушильной установке или высушивают распылительным способом.
При промышленной технологии культивирование штаммов проводят в реакторе/ферментере с питательной средой для культивирования при температуре 35-38°С в течение от 10-18 ч. Процесс считают законченным, если концентрация клеток составляет 4-5 млрд/мл и соотношение спор и вегетативных клеток 1:1. По окончании инкубации раздельно выращенные культуры сводят вместе в соотношении 2:1 и добавляют стабилизатор, к полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21).
Разливают в ампулы (флаконы) или в кассеты из нержавеющей стали, после чего подвергают замораживанию и обезвоживанию на вакуум-сушильной установке или высушивают распылительным способом.
Пример 3. Получение препарата в таблетированной форме
Выращенные культуры штаммов В.subtilis VKPM В-8611 и В.licheniformis VKPM В-8610 после добавления компонентов среды суспендирования, к полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21), обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с сахарным гранулятом, скользящими веществами (крахмалом или стеаратом кальция) и прессуют на ротационных прессах.
Пример 4. Получение препарата в форме суппозиториев
Выращенные культуры штаммов В.subtilis VKPM В-8611 и В.licheniformis VKPM В-8610 после добавления компонентов среды суспендирования, к полученной бактериальной композиции добавляют по 2,5-4,5 мг/мл фильтратов указанных штаммов и 5,5-7,5 мг лектинсвязывающей субстанции Lactobacillus fermentum 90 TS-4 (21); обезвоживают на вакуум-сушильной или на распылительной сушильной установке, соединяют с наполнителями (кондитерским жиром, парафином, и др.) и отливают на специальной установке суппозитории.
Пример 5. Все полученные по примерам 1, или 2, или 3, или 4 варианты и формы биопрепарата Балис проверяют на безвредность на лабораторных животных, специфическую антагонистическую активность в отношении тест-культур - представителей различных групп патогенных и условно-патогенных микроорганизмов и устойчивость к антибиотикам.
Биопрепарат Балис характеризуется безвредностью. Определение безвредности проводили на 2 группах мышей: 1-ю группу использовали для исследования препарата Балис. Во 2-й группе исследовали на безвредность фильтраты живых культур. Для каждого варианта опыта и контроля использовали не меньше 10 мышей массой 15-16 г. Для определения безвредности препарата Балис содержимое флакона разводили в 0,5 мл физиологического раствора и вводили эту дозу перорально мышам 1-й группы. Препарат считают безвредным, если все мыши остаются живыми в течение 5 суток наблюдения и ни у одной из них не выявлено заболевания. Мышам 2 группы вводили внутрибрюшинно инъекцией стерильные фильтраты из препарата Балис, еженедельно в течение 4-х недель в объеме 0,3 мл. В начале и в конце опыта из хвостовой вены мышей брали каплю крови для исследования лейкограммы путем подсчета лейкоцитов в мазках с окрашиванием по Романовскому - Гимза; в конце опыта проводили взвешивание мышей и сравнивали с первоначальным весом, также проводили патологоанатомическое исследование животных. Мыши 1-й группы в течение 5 суток наблюдения были живы, ни у одной из них не выявлено заболеваний. Мыши 2-й группы в течение 30 дней были живы и прибавили в весе 2,0-2,5 г. При патологоанатомическом исследовании было выявлено незначительное увеличение селезенки, другие органы без видимых изменений. Морфологическое исследование клеток белой крови дало следующие результаты: у мышей 1 и 2 групп (кровь взята в последний день опыта) показатели лейкограммы практически не отличались от исходных.
Биопрепарат Балис характеризуется широким спектром антагонистической активности в отношении тест-штаммов культур патогенных и условно-патогенных микроорганизмов. Исследование осуществляют методом отсроченного антагонизма. Для этого содержимое флакона растворяют в 1 мл физиологического раствора. Полученную взвесь выявляют штрихом по диаметру чашки Петри с агаризованной средой Гаузе №2. Посев инкубируют в термостате при 37°С в течение 72 ч. Затем к выросшей культуре подсевают штрихом тест-микроорганизмы (500-миллионные суспензии суточных культур в физиологическом растворе). Учет результатов проводят через 18 часов инкубирования при 37°С по величине зон отсутствия роста тест-культур.
Контролем роста тест-культур служит параллельное выращивание их на чашках с агаризованной средой Гаузе №2 без исследуемой культуры.
Оптимальным количеством живых клеток в одной дозе препарата является 1-5×109. Дальнейшее увеличение количества микробных клеток не изменяет существенным образом антагонистическую активность препарата в отношении тест-культур микроорганизмов (см. Табл.3).
Лектинсвязывающая субстанция оказывает модулирующее действие на адгезивную активность тест-культур дрожжеподобных грибов вида С.albicans и условно-патогенных штаммов микроорганизмов из вида E.coli к эпителиоцитам влагалища клинически здоровых женщин. Данное утверждение иллюстрируют следующие результаты (см. Табл.4).
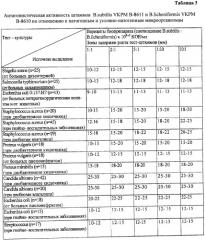
Споровые пробиотики обладают набором свойств, позволяющих конкурировать с патогенными и условно-патогенными микроорганизмами. К таким свойствам относятся: антагонистическая активность, способность к адгезии на эпителиоцитах, определенный уровень резистентности к соляной кислоте, желчи и др. Однако до сих пор не изучалось действие этих препаратов на возбудителей туберкулезной инфекции. В последние годы наряду с ростом показателей заболеваемости и смертности от туберкулеза отмечается увеличение количества мультирезистентных (MDR-TB) и штаммов с широкой лекарственной устойчивостью (XDR-TB) микобактерий туберкулеза. Клиническая картина лекарственно-устойчивого туберкулеза проявляется у больного, когда популяция полирезистентных микобактерий значительно превосходит популяцию бацилл, чувствительных к противотуберкулезным препаратам. При изучении антагонистической активности препарата Балис использовали референс-штаммы Academia (M.tuberculosis), Vallee (M.bovis), Ravenal (M.bovis), ГИСК (M.avium), полученные из ГИСК им. Л.А.Тарасевича. В качестве индикаторных штаммов также применяли выделенные от крупного рогатого скота и идентифицированные нами культурально-биохимическими и хемотаксономическими методами штаммы М.bovis (№3, Рязань) - см. Табл.5, 6. Кроме того, от 20 пациентов, больных туберкулезом, были выделены и идентифицированы 20 лекарственно-устойчивых штаммов M.tuberculosis (Табл.7). Метод изучения антагонистической активности пробиотических штаммов против микобактерий туберкулеза предусматривал использование фильтратов культуральных жидкостей, полученных с помощью стерилизующих фильтров (см. Лазовская А.Л. и др., Действие пробиотиков на патогенные микобактерии // Проблемы туберкулеза и болезней легких. Издательство «Медицина» М., 2006. - №7. - 25-27). Учет результатов проводили в течение 25-30 дней инкубации при температуре 37°С по индексу блокирования роста (ИБР) микобактерий. ИБР определяли путем вычисления отношения числа колоний, выросших на контрольной среде без пробиотика, к числу колоний, выросших на среде с пробиотиком. Максимумом ИБР считали число 10.
Влияние споровых пробиотиков на лекарственную чувствительность микобактерий изучали на 20 клинических штаммах, выделенных от больных туберкулезом людей. Применяли указанные выше способы обработки споровых пробиотиков. Чувствительность к лекарственным препаратам определяли в соответствии с Приказом №109 от 21.09.03. «О совершенствовании противотуберкулезных мероприятий в РФ». Результаты представлены на фигуре. В этом опыте были использованы следующие лекарственные препараты в разных концентрациях: 1, 2 - стрептомицин 10 и 25 мкг/мл, соответственно; 3, 4 - изониазид 1 и 10 мкг/мл; 5 - канамицин 30 мкг/мл; 6 - этамбутол 2 мкг/мл; 7 - рифампицин 40 мкг/мл; 8 - этионамид 30 мкг/мл; 9 - офлоксацин 2 мкг/мл; 10 - капреомицин 30 мкг/мл; 11 - ПАСК (парааминосалициловая кислота) 1 мкг/мл.
Ко всем референс-штаммам исследуемые пробиотики проявляли антагонистическую активность. Как представлено в Табл.5-7, споровые пробиотики тормозили рост. M.tuberculosis. Индекс блокирования роста (ИБР) у 20 штаммов микобактерий туберкулеза колебался от 1 до 10.
Изучение лекарственной чувствительности изолятов, выращенных на средах со стерильным фильтратом, показало, что восстановление лекарственной чувствительности происходило в 80% случаев, причем 95% исходных культур были устойчивы к 1, 2, 3, 4, 5, 6 или даже 7 противотуберкулезным препаратам. 20% штаммов были резистентными к 7-8 антибиотикам, т.е. относились к XDR-TB и MDR-TB. Из 20 лекарственно-устойчивых клинических штаммов микобактерий у 16 (80% случаев) восстановилась чувствительность к одному, двум, трем, четырем или пяти лекарственным препаратам.
1. Биопрепарат для профилактики и лечения инфекционных болезней и дисбиозов различной этиологии, включающий живую микробную массу из штаммов Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610, отличающийся тем, что дополнительно содержит фильтраты живых культур упомянутых штаммов Bacillus subtilis VKPM В-8611 и Bacillus licheniformis VKPM B-8610 и лектинсвязывающую субстанцию из супернатанта культуральной жидкости живой микробной массы штамма Lactobacillus fermentum 90 TS-4(21) с молекулярной массой более 20 кДа при следующем содержании компонентов на 1 единицу биопрепарата:живая микробная масса из штамма Bacillus subtilis VKPM В-8611 - не менее 5×108 КОЕ;живая микробная масса из штамма Bacillus licheniformis VKPM B-8610 - не менее 2×108 КОЕ;фильтрат живой микробной массы штамма Bacillus subtilis VKPM B-8611, лиофилизированный - 2,5-4,5 мг;фильтрат живой микробной массы штамма Bacillus licheniformis VKPM B-8610, лиофилизированный - 2,5-4,5 мг;лектинсвязывающая субстанция из супернатанта культуральной жидкости живой микробной массы штамма Lactobacillus fermentum 90 TS-4(21), лиофилизированная - 5,5-7,5 мг.
2. Биопрепарат по п.1, предназначенный для лечения инфекционных болезней: хронический туберкулез, кишечные инфекции, нозокомиальные хирургические инфекции, кандидоз и дисбиоз.
3. Биопрепарат по п.2, предназначенный для лечения хронического туберкулеза, вызванного микобактериями XDR ТВ с широкой лекарственной устойчивостью.