Производные фенилуксусной кислоты, как ингибиторы цог-2 (циклооксигеназы-2)
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I) и их фармацевтически приемлемым солям, обладающим ингибирующей активностью в отношении циклооксигеназы-2 (ЦОГ-2). В формуле (I)
R обозначает метил или этил; R3 обозначает галоген; R4 обозначает C1-С6-алкил; R5 обозначает галоген; указанный выше C1-С6-алкил в качестве R4 необязательно замещен одной или более галогенидными группами. Изобретение относится также к фармацевтической композиции, способу лечения нарушений, зависящих от ЦОГ-2, в частности, ревматоидного артрита, остеоартрита, дисменореи, боли, опухолей или воспаления, способу селективного ингибирования активности ЦОГ-2 и применению соединений формулы (I) для приготовления лекарственного средства, предназначенного для лечения указанных выше заболеваний. 6 н. и 4 з.п. ф-лы, 6 пр.
Реферат
Настоящее изобретение относится к фенилуксусным кислотам и их производным, определенным в настоящем изобретении, которые являются особенно активными и селективными ингибиторами циклооксигеназы-2 (ЦОГ-2), к способам их получения, фармацевтическим композициям, включающим указанные соединения, к способам селективного ингибирования активности ЦОГ-2 и лечения у млекопитающих патологических состояний, которые реагируют на ингибирование ЦОГ-2, с применением указанных соединений или фармацевтических композиций, включающих указанные соединения, предлагаемые в настоящем изобретении.
Настоящее изобретение относится к новым фенилуксусным кислотам и их производным, которые ингибируют ЦОГ-2 без значительного ингибирования циклооксигеназы-1 (ЦОГ-1). Таким образом, настоящее изобретение относится к новым нестероидным противовоспалительным средствам, которые, как неожиданно оказалось, не приводят к нежелательным побочным эффектам, обычно проявляющимся при использовании классических нестероидных противовоспалительных средств, таким как побочные эффекты, связанные с желудочно-кишечным трактом и почками.
Поэтому соединения, предлагаемые в настоящем изобретении, являются особенно подходящими или путем метаболизма могут превратиться в соединения, которые являются особенно подходящими для применения в качестве селективных ингибиторов ЦОГ-2. Поэтому они являются особенно подходящими для лечения зависящих от ЦОГ-2 нарушений у млекопитающих, включая воспаление, нагноения, боли, остеоартрита, ревматоидного артрита, дисменореи, мигрени, рака (такого как рак пищеварительного тракта, например, колоректального рака и меланомы), боли при раке, острой боли, хронической боли, нейродегенеративных заболеваний (таких как рассеянный склероз, болезнь Паркинсона и болезнь Альцгеймера), сердечно-сосудистых заболеваний (таких как атеросклероз, ишемическая болезнь сердца и артериосклероз), остеопороза, подагры, острой подагры, астмы, волчанки и псориаза в основном с исключением нежелательного изъязвления желудочно-кишечного тракта, проявляющегося при использовании обычных ингибиторов циклооксигеназы (ЦОГ). Соединения, предлагаемые в настоящем изобретении, также являются поглотителями УФ-излучения, в особенности поглотителями излучения УФ-В, и применимы для защиты от УФ-излучения или поглощения УФ-излучения, например, для лечения и предупреждения солнечных ожогов, например, в средствах для загара.
Применение соединений, предлагаемых в настоящем изобретении, в офтальмологии включает лечение воспаления глаз, мокрой формы возрастной дегенерации желтого пятна, боли глаз, включая боль после операции глаз, такой как фоторефракционная кератэктомия или операция по поводу катаракты, аллергических заболеваний глаз, фотофобии разной этиологии, повышенного внутриглазного давления (при глаукоме) путем ингибирования продуцирования индуцируемого трабекулярной сетью глюкокортикоидного ответного белка и сухого кератита.
Соединения, предлагаемые в настоящем изобретении, применимы для лечения неоплазии, в особенности неоплазии, при которой продуцируются простагландины или экспрессируется ЦОГ, включая злокачественные и раковые опухоли, наросты и полимы, в частности, неоплазии, образующейся из эпителиальных клеток. Соединения, предлагаемые в настоящем изобретении, в частности, применимы для лечения рака печени, мочевого пузыря, поджелудочной железы, яичников, предстательной железы, шейки матки, легких и молочной железы и в особенности рака желудочно-кишечного тракта, например, рака ободочной кишки и рака кожи, например, плоскоклеточного и базальноклеточного рака и меланомы, как указано выше.
Термин "лечение" при использовании в настоящем изобретении включает и терапевтические, и профилактические режимы лечения, например, лечение неоплазии, лечение с целью предупреждения начала клинически или доклинически диагностируемой неоплазии или предупреждение инициирования злокачественных клеток или остановки или обращения прогрессирования превращения предраковых клеток в раковые, а также предупреждения или подавление роста или метастазирования неоплазии. В этом контексте настоящее изобретение, в частности, следует понимать как включающее применение соединений, предлагаемых в настоящем изобретении, для предупреждения или подавления развития рака кожи, например, плоскоклеточной или базальноклеточной карциномы, вызванной воздействием УФ-излучения, например, вызванной длительным воздействием солнечного света. Соединения можно применять для людей и других млекопитающих.
Первым объектом настоящего изобретения является соединение формулы (I)
в которой
R обозначает метил или этил;
R3 обозначает галоген или С1-С6-алкил;
R4 обозначает C1-С6-алкил;
R5 обозначает галоген;
указанный выше C1-С6-алкил по R3 и R4 необязательно замещен одной или большим количеством галогенидных групп;
его фармацевтически приемлемые соли; и его фармацевтически приемлемые сложные эфиры.
Предпочтительно, если в соединениях формулы (I) R3 обозначает галоген, метил или этил. Более предпочтительно, если он обозначает галоген. Альтернативно предпочтительно, если он обозначает хлор.
Предпочтительно, если в соединениях формулы (I) R4 обозначает C1-С3 алкил, необязательно замещенный одним или большим количеством галогенидных групп. Более предпочтительно, если он обозначает метил, этил, изопропил или трифторметил. Еще более предпочтительно, если он обозначает метил. Альтернативно предпочтительно, если он обозначает трифторметил.
Предпочтительно, если в соединениях формулы (I) R5 обозначает хлор или фтор.
Еще более предпочтительно, если оба R3 и R5 независимо выбраны из группы, включающей хлор и фтор.
Предпочтительно, если соединение выбрано из следующего перечня соединений:
5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилуксусная кислота
5-этил-2-(2',4'-дихлор-3'-метиланилино)фенилуксусная кислота
5-метил-2-(2'-фтор-3'-трифторметил-4'-этиланилино)фенилуксусная кислота
5-этил-2-(2'-фтор-3'-трифторметил-4'-этиланилино)фенилуксусная кислота
5-метил-2-(2'-фтор-3'-трифторметил-4'-метиланилино)фенилуксусная кислота
5-этил-2-(2'-фтор-3'-трифторметил-4'-метиланилино)фенилуксусная кислота
5-метил-2-(2'-фтор-3'-метил-4'-хлоранилино)фенилуксусная кислота
5-этил-2-(2'-фтор-3'-метил-4'-хлоранилино)фенилуксусная кислота
5-метил-2-(2'-фтор-3'-этил-4'-хлоранилино)фенилуксусная кислота
5-этил-2-(2'-фтор-3'-этил-4'-хлоранилино)фенилуксусная кислота
5-метил-2-(2',4'-дихлор-3'-этиланилино)фенилуксусная кислота
5-этил-2-(2',4'-дихлор-3'-этиланилино)фенилуксусная кислота
5-этил-2-(2'-фтор-3'-изопропил-4'-хлоранилино)фенилуксусная кислота
соль 5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилуксусной кислоты с диэтиламином
5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилацетат натрия
соль 5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилуксусной кислоты с трометамином
моногидрат 5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилацетата кальция
моногидрат 5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилацетата лизина
моногидрат 5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилацетата холина
5-метил-2-(2',4'-дихлор-3'-метиланилино)фенилацетат калия.
Вторым объектом настоящего изобретения является фармацевтическая композиция, включающая эффективное количество соединения формулы (I) в комбинации с одним или большим количеством фармацевтически приемлемых носителей.
Третьим объектом настоящего изобретения является способ лечения зависящих от циклооксигеназы-2 (ЦОГ-2) нарушений у млекопитающих, который включает введение нуждающемуся в нем млекопитающему эффективного количества соединения формулы (I).
Четвертым объектом настоящего изобретения является способ селективного ингибирования активности ЦОГ-2 у млекопитающего без значительного ингибирования ингибирования активности циклооксигеназы-1, который включает введение нуждающемуся в нем млекопитающему эффективно ингибирующего ЦОГ-2 количества соединения формулы (I).
Пятым объектом настоящего изобретения является способ лечения ревматоидного артрита, остеоартрита, дисменореи, боли, опухолей или воспаления у млекопитающих, который включает введение нуждающемуся в нем млекопитающему соответствующего эффективного количества соединения формулы (I).
Шестым объектом настоящего изобретения является применение соединения формулы (I) для приготовления лекарственного средства, предназначенного для лечения ревматоидного артрита, остеоартрита, дисменореи, боли, опухолей или воспаления.
Седьмым объектом настоящего изобретения является соединение формулы (I), предназначенное для применения для лечения зависящего от ЦОГ-2 нарушения.
Восьмым объектом настоящего изобретения является способ получения соединения формулы (I) по пункту 1 формулы изобретения, который включает стадии:
(а) проведения сочетания соединения формулы (II) или (III)
или
в которой
Z обозначает бром или йод;
R обладает определенным выше значением;
Ra обозначает водород, катион щелочного металла или низш. алкил, предпочтительно - изопропил и
R6 и R7 обозначают низш. алкил или R6 и R7 вместе с атомом азота обозначают морфолиновую, пиперидиновую или пирролидиновую группу,
с соединением формулы (IV)
в которой R3-R5 обладают определенными выше значениями, в присутствии меди и йодида меди (I) с получением соединения формулы (V) или (VI)
или
и гидролиза полученного соединения формулы (V) или (VI) с получением соединения формулы (I); или
(b) конденсации соединения формулы (VII)
в которой R3-R7 обладают значениями, определенными в настоящем изобретении, с реакционноспособным функциональным производным кислоты, например, уксусной кислоты, таким как ацетилхлорид, по реакции ацилирования Фриделя-Крафтса с получением, например, соединения формулы (VIII)
в которой R3-R7 обладают значениями, определенными в настоящем изобретении, которое, в свою очередь, подвергают гидрогенолизу, а затем гидролизу с получением соединения формулы (I), в которой R обозначает, например, этил; или
(с) гидролиза лактама формулы (IX)
в которой R и R3-R5 обладают значениями, определенными в настоящем изобретении, сильным основанием; и в указанных выше реакциях при необходимости защиты любых мешающих реакционноспособных групп с последующим выделением полученного соединения, предлагаемого в настоящем изобретении; и при необходимости превращения любого полученного соединения в другое соединение, предлагаемое в настоящем изобретении; и/или при необходимости превращения свободной карбоновой кислоты, предлагаемой в настоящем изобретении, в ее фармацевтически приемлемый сложный эфир; и/или при необходимости превращения полученной свободной кислоты в соль или полученной соли в свободную кислоту или в другую соль.
В исходных соединениях и промежуточных продуктах, которые превращают в соединения, предлагаемые в настоящем изобретении, по методикам, описанным в настоящем изобретении, содержащиеся функциональные группы, такие как аминогруппы, гидроксигруппы и карбоксигруппы, необязательно защищают обычными защитными группами, применяющимися в препаративной органической химии. Защитными группами гидроксигрупп, аминогрупп и карбоксигрупп являются такие, которые в мягких условиях можно превратить в свободные аминогруппы, гидроксигруппы и карбоксигруппы без протекания нежелательных побочных реакций. Например, защитными группами гидроксигрупп предпочтительно являются бензильная или замещенная бензильная группы или ацильные группы, такие как пивалоил.
Получение соединений формул (V) и (VI) способом (а) проводят при условиях модифицированной реакции конденсации Ульмана, использующейся для получения диариламинов, например, в присутствии порошкообразной меди и йодида меди (I) и карбоната калия, необязательно в инертном высококипящем растворителе, таком как нитробензол, толуол, ксилол или N-метилпирролидон, при повышенной температуре, например, в диапазоне 100-200°С, предпочтительно - при температуре кипения растворителя, по общей методологии, описанной в публикации Nohara, Chem Abstr, Vol.94, p.15402x (1951); и Moser et al., J Med Chem, Vol.33, p.2358 (1990). Если Z обозначает бром, то конденсацию проводят в присутствии йодида, например, йодида калия.
Гидролиз полученных орто-анилинофенилацетамидов формулы (V) проводят в водном растворе гидроксида щелочного металла, например, в 6 н. NaOH в присутствии спирта, например, этанола, пропанола и бутанола, при повышенной температуре, такой как температура кипения реакционной смеси.
Гидролиз сложных эфиров формулы (VI) проводят по методикам, известным в данной области техники, например, в щелочной среде, как описано выше для соединений формулы (V) или альтернативно в кислой среде, например, с использованием метансульфоновой кислоты.
Исходные вещества формулы (II) или (III) обычно известны или их можно получить по методикам, известным в данной области техники, например, как описал Nohara в заявке на патент Японии No.78/96434 (1978); в патенте U.S. No.6291523 и как описано в настоящем изобретении.
Например, соответствующую антраниловую кислоту превращают в орто-диазониевое производное с последующей обработкой йодидом щелочного металла в кислоте, например, серной кислоте, и получают 2-йодбензойную кислоту или ее низш. алкиловый эфир. Восстановление соответствующего бензилового спирта, например, дибораном или алюмогидридом лития в случае сложного эфира, превращение спирта сначала в бромид и затем в нитрил, гидролиз нитрила в уксусную кислоту и превращение в N,N-диалкиламида по методикам, известным в данной области техники, дает исходное вещество формулы (II).
Альтернативно, например, исходное вещество формулы (II), в которой Z обозначает Br и R обозначает циклопропил, можно получить сначала путем конденсации по методике, описанной в публикации J Am Chem Soc, Vol.123, p.4155 (2001), например, метилового эфира 2-бром-5-йодбензойной кислоты с циклопропилбромидом в присутствии трихлорида индия с получением метилового эфира 2-бром-5-циклопропилбензойной кислоты, который, как описано выше, превращают в соответствующий 2-бром-5-циклопропилфенилацетамид формулы (II).
Кроме того, исходные вещества формулы (II), в которой R обозначает, например, этил, можно получить ацетилированием по Фриделю-Крафтсу оксиндола, например, ацетилхлоридом в присутствии хлорида алюминия, восстановлением полученного кетона, например, с помощью каталитического гидрогенолиза с последующим гидролитическим расщеплением полученного 5-этилоксиндола в орто-аминофенилуксусную кислоту. Диазотирование в присутствии, например, йодида калия дает орто-йодфенилуксусную кислоту, которую превращают в амид формулы (II).
Сложные эфиры формулы (III) получают из соответствующих кислот путем этерификации по методикам, известным в данной области техники.
Анилины формулы (IV) или известны в данной области техники, или их получают по методикам, хорошо известным в данной области техники, и как показано в настоящем изобретении.
Получение, например, 5-этил- или 5-н-пропилзамещенных соединений способом (b) проводят ацетилированием по Фриделю-Крафтсу, например, в присутствии хлорида алюминия в инертном растворителе, таком как 1,2-дихлорэтан, с последующим гидрогенолизом, например, с использованием палладия на угле в качестве катализатора, предпочтительно - в уксусной кислоте в качестве растворителя, при комнатной температуре и при давлении около 3 атм.
Исходные вещества формулы (VII) обычно получают, как это описано для способа (а), с использованием в качестве исходного вещества амида формулы (II), в которой R обозначает водород, например, как описано в публикации Moser et al. (1990), см. выше.
Получение соединений, предлагаемых в настоящем изобретении, способом (с) можно провести при условиях, известных в данной области техники для гидролитического расщепления лактамов, предпочтительно - водным раствором сильного основания, таким как водный раствор гидроксида натрия, необязательно в присутствии смешивающегося с водой органического растворителя, такого как метанол, при повышенной температуре в диапазоне около 50-100°С, как это описано в патенте US No.3558690.
Исходные оксиндолы формулы (IX) получают N-ацилированием диариламина формулы (X)
в которой R и R1-R5 обладают определенными выше значениями, галогенацетилхлоридом, предпочтительно - хлорацетилхлоридом, предпочтительно - при повышенной температуре, например, около 100°С, с получением соединения формулы (XI)
в которой R и R3-R5 обладают значениями, определенными выше в настоящем изобретении. Циклизацию соединения формулы (XI) проводят алкилированием по Фриделю-Крафтсу в инертном растворителе, таком как дихлорбензол, в присутствии катализаторов Фриделя-Крафтса, например, хлорида алюминия или этилалюминийдихлорида, при повышенной температуре, например, при 120-175°С.
Исходные амины формулы (X) можно получить конденсацией по Ульману и другим методикам, известным в данной области техники, например, по реакции сочетания Бухвальда.
Эфиры карбоновых кислот формулы (I) получают конденсацией карбоновой кислоты в виде соли или в присутствии основания галогенидом (бромидом или хлоридом), соответствующим этерифицирующему спирту, таким как бензилхлорацетат, по методикам, хорошо известным в данной области техники, например, в полярном растворителе, таком как N,N-диметилформамид, и при необходимости дополнительно изменяют полученный продукт. Например, если продукт этерификации сам является эфиром, то его можно превратить в карбоновую кислоту, например, с помощью гидрогенолиза полученного бензилового эфира. Если продукт этерификации сам является галогенидом, то его, например, можно превратить в нитрооксипроизводное по реакции, например, с нитратом серебра.
Например, соединения формулы (Ia) предпочтительно получают путем конденсации соли карбоновой кислоты формулы (I), приведенной выше, с соединением формулы
в которой
Х обозначает отщепляющуюся группу и
Rb обозначает защитную группу карбоксигруппы;
с получением соединения формулы (Ia) с защищенной карбоксигруппой и с последующим удалением защитной группы Rb.
Этерификацию можно провести при условиях этерификации, известных в данной области техники, например, в полярном растворителе, таком как N,N-диметилформамид, при температуре в диапазоне от комнатной температуры примерно до 100°С, предпочтительно - в диапазоне 40-60°С, например, по методике, описанной в патенте US №5291523.
Солью кислоты формулы (I) предпочтительно является соль щелочного металла, например, соль натрия, которую можно получить in situ.
Отщепляющейся группой Х предпочтительно является галоген, например, хлор, или бром, или низш. алкилсульфонилоксигруппа, например, метансульфонилоксигруппа.
Защитной группой карбоксигруппы Rb предпочтительно является бензил.
Полученные бензиловые эфиры можно превратить в свободные кислоты формулы (Ia) предпочтительно с помощью гидрогенолиза водородом в присутствии, например, Pd/C в качестве катализатора в уксусной кислоте при атмосферном давлении или гидрированием по Парру при температуре в диапазоне от комнатной температуры примерно до 50°С.
Настоящее изобретение относится к любым новым исходным веществам и способам их получения.
Кроме того, соединения, предлагаемые в настоящем изобретении, получают в свободной форме или в виде их солей, если содержатся солеобразующие группы.
Кислотные соединения, предлагаемые в настоящем изобретении, можно превратить в соли металлов путем взаимодействия с фармацевтически приемлемыми основаниями, например, с водным раствором гидроксида щелочного металла, предпочтительно в присутствии простого эфира или спирта в качестве растворителя, такого как низш. алканол. Полученные соли можно превратить в свободные соединения путем обработки кислотами. Эти и другие соли также можно использовать для очистки полученных соединений. Соли аммония получают по реакции с соответствующим амином, например, диэтиламином и т.п.
Соединения, предлагаемые в настоящем изобретении, содержащие основные группы, можно превратить в соли присоединения с кислотами, предпочтительно в фармацевтически приемлемые соли. Они образуются, например, с неорганическими кислотами, например, серной кислотой, фосфорной или галогенводородной кислотой, или с органическими карбоновыми кислотами, такими как (С1-С4)алкаркарбоновые кислоты, которые, например, являются незамещенными или замещены галогеном, например, уксусной кислотой, такими как насыщенные или ненасыщенные дикарбоновые кислоты, например, щавелевая, янтарная, малеиновая или фумаровая кислота, такими как гидроксикарбоновые кислоты, например, гликолевая, молочная, яблочная, винная или лимонная кислота, такими как аминокислоты, например, аспарагиновая или глутаминовая кислота, или с органическими сульфоновыми кислотами, такими как (С1-С4)алкилсульфоновые кислоты, например, метансульфоновая кислота, или арилсульфоновыми кислотами, которые могут быть незамещенными или замещенными, например, галогеном. Предпочтительными являются соли, образованные с хлористоводородной кислотой, метансульфоновой кислотой и малеиновой кислотой.
Ввиду близкого родства между свободными соединениями и соединениями в форме их солей любое указание на соединение в этом контексте следует понимать и как указание на соответствующую соль, если при данных обстоятельствах это является подходящим и целесообразным.
Соединения, включая их соли, также можно получить в форме их гидратов или с включением других растворителей, использовавшихся для их кристаллизации.
Общие определения, использующиеся в настоящем изобретении, если не указано иное, в объеме настоящего изобретения обладают приведенными ниже значениями.
Фармацевтически приемлемые сложные эфиры предпочтительно являются сложными эфирами пролекарств, которые путем сольволиза или при физиологических условиях могут превращаться в свободные карбоновые кислоты, например, формулы (I). Такие сложные эфиры представляют собой, например, низш. алкиловые сложные эфиры, такие как метиловый или этиловый эфир; карбокси-низш. алкиловые сложные эфиры, такие как карбоксиметиловый эфир; нитроокси- или нитрозоокси-низш. алкиловые сложные эфиры, такие как 4-нитрооксибутиловый или 4-нитрозооксибутиловый эфир и т.п.
Предпочтительными являются фенилацетоксиуксусные кислоты формулы (Ia)
в которой R, R3, R4 и R5 обладают значениями, определенными выше в настоящем изобретении для соединений формулы (I), и его фармацевтически приемлемых солей.
Фармацевтически приемлемые соли представляют собой соли металлов, такие как соли щелочных металлов, например, соли натрия, калия, магния или кальция, а также соли аммония, которые образуются, например, с аммиаком и моно- или диалкиламинами, такими как соли диэтиламмония; и с аминокислотами, такие как соли аргинина и гистидина.
Низш. алкильная группа содержит до 6 атомов углерода, предпочтительно 1-4 атома углерода, может обладать разветвленной или линейной цепью и представляет собой, например, метил, этил, пропил, бутил, изопропил, изобутил и т.п., предпочтительно метил или этил. Низш. алкоксигруппа означает метоксигруппу, этоксигруппу и т.п.
Галоген предпочтительно означает хлор, бром или фтор, более предпочтительно хлор или фтор.
Соединения, предлагаемые в настоящем изобретении, применимы в качестве ингибиторов селективных ЦОГ-2 или в качестве их пролекарств. Селективные ингибиторы ЦОГ-2 и их пролекарства, предлагаемые в настоящем изобретении, особенно полезны для лечения, например, воспаления, нагноения, боли, остеоартрита, дисменореи, ревматоидного артрита и других патологических состояний, реагирующих на ингибирование ЦОГ-2, и обычно практически не приводят к нежелательным побочным эффектам, связанным с желудочно-кишечным трактом, обычно проявляющимся при использовании стандартных нестероидных противовоспалительных средств.
Указанные выше характеристики можно продемонстрировать с помощью проводимых in vitro и in vivo исследований, предпочтительно с использованием млекопитающих, например, крыс, мышей и обезьян и изолированных клеток или ферментных препаратов, полученных от людей или из других источников. Такие соединения можно применять in vitro в воде растворов, например, водных растворов, и in vivo, предпочтительно перорально, местно или парентерально, например, внутривенно. Доза in vitro может составлять примерно 10-5-10-9 М. Доза in vivo в зависимости от пути введения может меняться примерно от 0,1 мг/кг до 100 мг/кг.
Биологические характеристики можно продемонстрировать с помощью исследований, хорошо известных в данной области техники, например, как это описано в патенте US No.6291523 и как описано в настоящем изобретении.
Ингибирование ЦОГ-2 изучают с помощью ферментного исследования in vitro с использованием имеющегося в продаже набора (Cayman Chemical Company).
Исследуемое соединение (исходный раствор в ДМСО, разведенный буфером до разных концентраций) предварительно инкубируют с 30-50 Ед очищенного рекомбинантного ЦОГ-2 человека и гемактином (1 мкМ) в течение 30 мин при 25°С, затем инкубируют с 100 мкМ арахидоновой кислоты и субстратом для колориметрического исследования ТМПД (N,N,N',N'-тетраметил-п-фенилендиамин) в течение 5-7 мин при 25°С с последующим колориметрическим определением окисленного ТМПД при 590 нм. Активность ЦОГ-2 в присутствии исследуемого соединения сопоставляют с активностью ЦОГ-2 для контрольного образца, не содержащего исследуемого соединения.
Ингибирование ЦОГ также исследуют in vitro с использованием методик изучения ингибирования ЦОГ-1 и ЦОГ-2.
Исследования с помощью клеток для изучения ингибиторов ЦОГ хорошо известны в данной области техники и основаны на том, что фермент ЦОГ (синтеза простагландина Н) катализирует лимитирующую стадию синтеза простагландина из арахидоновой кислоты. Два фермента опосредуют эту реакцию: ЦОГ-1 является конститутивной формой фермента, а ЦОГ-2 индуцируется в ответ на различные факторы роста и цитокины.
Ингибирование ЦОГ-1 и ЦОГ-2 in vitro изучают с помощью клеток для оценки активности и селективности ингибирования ЦОГ-2 in vitro с помощью иммунологического анализа простагландина Е2 (набор Cayman PGE2). Используют клетки HEK-293 EBNA, которые трансфицированы и стабильно экспрессируют рекомбинантный ЦОГ-1 человека или рекомбинантный ЦОГ-2 соответственно. Клетки помещают в 96-луночные планшеты, в которых проводят анализ. Клетки обеих линий предварительно обрабатывают разведенными соединениями в течение 30 мин при 37°С, затем прибавляют арахидоновую кислоту (1 мкМ) в качестве экзогенного субстрата. Надосадочный слой собирают через 15 мин и с помощью иммунологического анализа определяют продуцирование PGE2. Для определения IC50 соединения исследуют при 5-9 концентрациях с однократным, двукратным или четырехкратным повтором при каждой концентрации (наибольшая концентрация равна 30 мкМ). Рассчитывают среднее ингибирование PGE2 (по сравнению с клетками, не обработанными соединением) для каждой концентрации и строят зависимость выраженного в % среднего ингибирования от логарифма концентрации соединения и значение IC50 рассчитывают с помощью 4-параметрической логистической аппроксимации. Для оценки ингибирования ЦОГ-2 сопоставляют относительное воздействие каждого фермента.
Ингибирование in vitro ЦОГ-1 и ЦОГ-2 также определяют в цельной крови человека, в которой ЦОГ-1 конститутивно экспрессируется в тромбоцитах, и экспрессирование ЦОГ-2 индуцируют в мононуклеарах путем обработки липополисахаридом (ЛПС) (10 мкг/мл). Для этого исследования гепаринизованную кровь человека делят на 2 аликвоты: одну для определения продуцирования ТхВ2 (имитатор индикатора активности ЦОГ-1) и вторую для определения продуцирования PGE2 (имитатор индикатора активности ЦОГ-2). Перед стимулированием пробы крови предварительно обрабатывают исследуемыми соединениями в течение 1 ч. Соединения исследуют в диапазоне конечных концентраций от 0,1 нМ до 300 мкМ с использованием полулогарифмического увеличения концентраций. Для исследования ингибирования генерации тромбоксана В2 (ТхВ2) прибавляют А23187 (50 мкМ) и кровь инкубируют в течение 1 ч. Продуцирование PGE2 определяют после прибавления ЛПС (10 мкг/мл) с последующим инкубированием в течение ночи. После инкубирования с А23187 или ЛПС образцы центрифугируют при 250×g в течение 10 мин при 4°С для сбора сыворотки. Количества PGE2 и ТхВ2, содержащиеся в сыворотке, определяют с помощью хемилюминесцентного иммуноферментного анализа по методике фирмы Assay Designs Inc. (Ann Arbor, MI). Содержание простагландина в каждом образце нормируют на выраженное в процентах ингибирование для каждой концентрации исследуемого соединения. Данные по выраженному в процентах ингибированию для каждого донора объединяют и аппроксимируют 4-параметричрской логистической функцией с использованием регрессионного анализа.
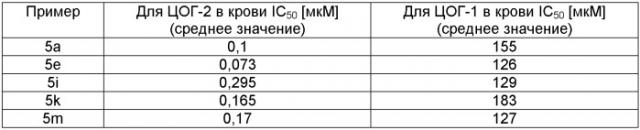
Значения IC50 для соединений формулы (I), полученные при исследовании ингибирования ЦОГ-2, составляют лишь примерно 0,10 мкМ или даже меньше. Предпочтительными являются соединения, для которых отношение значений IC50 для ингибирования ЦОГ-1 и ЦОГ-2 равно более 50, предпочтительно находится примерно в диапазоне 100-1000 или является более значительным. Например, с помощью описанного выше исследования получены следующие значения IC50, в случае проведения более одного анализа приведены средние значения.
Ингибирование продуцирования простагландина E2, выработанного посредством ЦОГ-2, исследуют in vivo при индуцировании липополисахаридом (ЛПС) в подкожном воздушном кармане у крыс. См. Advances in Inflammation Research, Raven Press (1986); J. Med. Chem., Vol.39, p.1846 (1996); J. Pathol., Vol.141, pp.483-495; и J. Pathol, Vol.134, pp.147-156.
Самок крыс линии Lewis анестезируют и с помощью подкожной инъекции 10 мл воздуха через стерильный фильтр с диаметром отверстий 0,45 мкм, встроенный в шприц, формируют дорсальные воздушные карманы. Через 6 или 7 дней после формирования в воздушные карманы путем инъекции вводят ЛПС (5 мкг на карман), суспендированный в стерильном забуференном фосфатом физиологическом растворе. Соединения для исследования вводят через желудочный зонд за 1 ч до или через 2 или большее количество часов после введения ЛПС. Содержимое карманов собирают через 5 с после введения ЛПС и с помощью иммуноферментного анализа определяют содержание PGE2 в жидкости из кармана. Иллюстрирующее настоящее изобретение соединение примера 4(j) ингибирует образование PGE2 примерно на 50% при пероральном введении в количестве 1 мг/кг.
Противовоспалительную активность изучают путем исследования индуцируемой каррагенаном отека лапки у крыс с помощью модификации методики, описанной в публикации Offerness et al., описанной в Nonsteroidal Antiinflammatory Drugs, Lombardino, Ed., John Wiley & Sons, pp.116-128 (1986).
Крысам линии Sprague Dawley (200-225 г) не дают корм в течение ночи и затем им перорально вводят соединение, растворенное в 0,5% металцеллюлозе. Через 1 ч в подподошвенный участок левой задней лапки вводят 0,1 мл 1% каррагенана, который вызывает воспалительную реакцию. Через 3 ч после введения каррагенана крыс умерщвляют и обе задние лапки отрезают по линии границы шерстяного покрова и взвешивают на электронных весах. Степень отечности в воспаленной лапке определяют путем вычитания массы невоспаленной лапки (правой) из массы воспаленной лапки (левой). Выраженное в процентах ингибирование соединением определяют для каждого животного в виде выраженного в процентах увеличения массы лапки по сравнению со средним значением для контроля.
Исследование переносимости в желудке используют для оценки полного изъязвления у крыс, его проводят через 4 ч после перорального введения исследуемого соединения. Исследование проводят следующим образом.
Самцам крыс линии Sprague Dawley не дают корм в течение ночи, затем им через желудочный зонд вводят соединение в 0,5% растворе метилцеллюлозы и через 4 ч их умерщвляют, давая вдыхать диоксид углерода. Удаляют желудки и подсчитывают и измеряют полное поражение желудка, получают полную длину поражения в расчете на 1 крысу. В каждый эксперимент включены следующие группы животных (5-6 крыс в группе): контроль с использованием только растворителя, исследуемые соединения и диклофенак в качестве соединения сравнения.
Данные рассчитывают как среднее количество изъязвлений в группе, среднюю длину изъязвлений (мм) в группе и как показатель изъязвлений (ПИ).
ПИ = средняя длина изъязвлений в группе × частота изъязвлений,
где частота изъязвлений означает долю животных с изъязвлениями в группе (для 100% частота равна 1).
Иллюстрирующие настоящее изобретение соединения примеров при пероральной дозе, равной 30 мг/кг, практически не приводят к изъязвлениям в желудке.
Переносимость в кишечнике можно исследовать путем определения влияния на проницаемость кишечника. Отсутствие увеличения проницаемости свидетельствует о переносимости в кишечнике.
Использующаяся методика является модификацией методики, описанной в публикации Davies et al., Pharm. Res., Vol.11, pp.1652-1656 (1994) и основана на том, что экскреция вводимой перорально 51Cr-ЭДТК (этилендиаминтетрауксусная кислота), маркера проницаемости тонкого кишечника, увеличивается при воздействии НСПС (нестероидные противовоспалительные средства). Группам самцов крыс линии Sprague Dawley (≥12 в каждой группе) перорально через желудочный зонд вводят одну дозу исследуемого соединения или растворителя. Сразу после введения соединения каждой крысе через желудочный зонд вводят 51Cr-ЭДТК (5 мкКи на крысу). Крыс помещают в отдельные клетки для изучения метаболизма и в неограниченном количество дают корм и воду. В течение 24 ч собирают мочу. Через 24 ч после введения 51Cr-ЭДТК крыс умерщвляют. Для количественно изучения влияния соединения на проницаемость кишечника количество выведенного 51Cr-ЭДТК, определенное в моче крыс, которым вводили соединение, сопоставляют с количеством выведенного 51Cr-ЭДТК, определенным в моче крыс, которым соединение растворялось. Относительную проницаемость определяют путем расчета радиоактивности в каждом образце мочи, выраженной в процентах от введенной дозы с поправкой на радиоактивный фон.
Аналгетическую активность соединений, предлагаемых в настоящем изобретении, исследуют путем изучения индуцируемой посредством полного адъюванта Фрейнда (ПАФ) гипералгезии у крыс. 50 мкл ПАФ путем инъекции вводят в левую заднюю лапку. Болевой порог определяют за 24 ч и после инъекции ПАФ с помощью стандартного прибора, нажимающего на лапку (Analgesymeter, Ugo Basile, Milan). Конечную точку определяют как отдергивание или движение лапки. Соединения растворяют в 0,5% метилцеллюлозе и вводят перорально и дополнительные определения болевого порога проводят через 1, 3 и 6 ч после введения соединения. В каждой подопытной группе 6 животным вводили растворитель или одну дозу соединения. Результаты представляют в виде выраженного в процентах обращения гипералгезии до введения дозы. Для каждого соединения рассчитывают дозу, при которой обеспечивается 30% ингибирование гипералгезии до введения дозы (D30), и получают общую оценку активности.
Противоартритное воздействие соединений, предлагаемых в на