Синбиотик для улучшения кишечной микробиоты
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и представляет собой применение пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, в производстве синбиотической композиции, предназначаемой для стимулирования развития ранней бифидогенной кишечной микробиоты у младенцев, рожденных с помощью кесарева сечения. Изобретение обеспечивает эффективное стимулирование развития ранней бифидогенной кишечной микробиоты у младенцев, рожденных путем кесарева сечения, снижение риска последующего развития аллергии, а также профилактику и лечение диареи у младенцев, рожденных путем кесарева сечения. 3 н. и 12 з.п. ф-лы, 2 пр., 2 табл., 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к введению младенцам, рожденным с помощью кесарева сечения, особой смеси синбиотика, то есть пробиотика и олигосахарида, способной стимулировать бифидогенную кишечную микробиоту в раннем неонатальном периоде.
Уровень техники
Считается, что непосредственно перед рождением желудочно-кишечный тракт ребенка является стерильным. Во время родов, проходящих естественным образом, он сталкивается с бактериями пищеварительного тракта, кожи матери, окружающей ее среды и начинает ими колонизироваться. В фекальной микробиоте здорового, рожденного вагинально, вскармливаемого грудью младенца в возрасте 2-4 недель, которую можно рассматривать как микробиоту, оптимальную для данной возрастной группы, преобладают виды Bifidobacteria с некоторыми видами Lactobacillus и, в меньших количествах, видами Bacteroides, такими как Bacteroides fragilis, за исключением таких потенциально патогенных микроорганизмов, как Clostridia. После окончательного отлучения ребенка от груди в возрасте около 2 лет устанавливается система кишечной микробиоты, напоминающая систему взрослого человека.
Следует заметить, что у здорового, рожденного вагинально, вскармливаемого грудью младенца бактерии рода Bifidobacteria образуют основу микробиоты, составляющую 60-90% общего количества бактерий в кишечнике младенца. Грудное вскармливание также стимулирует развитие кишечного барьера, что наряду с доминированием бифидобактерий ведет к усилению всасывания и, вследствие этого, усвоения поглощаемого питания.
Grönlund и др. изучали фекальную микробиоту здоровых младенцев, рожденных с помощью кесарева сечения, и сравнивали ее с микробиотой сопоставимой группы младенцев, рожденных вагинально. Они пришли к выводу, что кишечная флора рожденных с помощью кесарева сечения младенцев может находиться в нарушенном состоянии в течение периода времени вплоть до шести месяцев после рождения. В частности, они заметили, что нормы колонизации микроорганизмами Bifidobacteria и Lactobacilli в группе после кесарева сечения достигали уровней колонизации в группе рожденных вагинально только спустя один месяц и десять дней (Grönlund и др. "Fecal Microflora in Heathy Infants Born by Different Methods of Delivery: Permanent Changes in Intestinal Flora After Cesarean Delivery", Journal of Pediatric Gastroenterology and Nutrition, 28:19-25).
Другие исследователи предположили, что эта отсроченная/аберрантная колонизация может иметь специфические последствия в отношении последующего развития младенца, и ассоциировали эти последствия с различиями в кишечной флоре. Например, Laubereau и др. нашли, что рожденные с помощью кесарева сечения младенцы имели больший риск подверженности диарее, чем младенцы, рожденные вагинально (Laubereau и др. Caesarean Section and gastrointestinal symptoms, atopic dermatitis and sensitisation during the first year of life", Arch Dis Child 2004; 89:993-997). Negele и др. обнаружили, что родоразрешение путем кесарева сечения может быть дополнительным фактором риска для возникновения свистящего дыхания и аллергической сенсибилизации к аллергенам пищи вплоть до возраста двух лет (Negele и др. "Mode of delivery and development of atopic disease during the first 2 years of life" Pediatr Allergy Immunol 2004; 15:48 - 54). Также было предположено, что системное слабо выраженное воспаление и недостаточность кишечной микробиоты также могут быть непосредственно связаны с развитием ожирения (Adipose tissue, adipokines, and inflammation" J Allergy Clin Immunol. 2005; 115:911-919, Bäckhed F, Ding, Wang T, и др. "The gut microbiota as an environmental factor that regulates fat storage" Proc Natl Acad Sci USA. 2004; 101:15718-15723).
Материнское молоко рекомендовано для всех младенцев. Однако в некоторых случаях грудное вскармливание бывает недостаточным или безуспешным по медицинским причинам, или же мать отказывается от кормления грудью. Для таких случаев разработаны смеси для питания младенцев.
Не так давно некоторые штаммы бактерий привлекли особое внимание в связи с обнаружением их способности демонстрировать при приеме внутрь полезные для человека качества. В частности, было обнаружено, что определенные штаммы родов Lactobacilli и Bifidobacteria способны колонизировать кишечник, ослабляют способность патогенных бактерий к сцеплению с кишечным эпителием, обладают иммуномодуляторными свойствами и способствуют поддержанию хорошего самочувствия. Такие бактерии иногда называют пробиотиками, и уже было предложено добавлять подходящие пробиотические бактерии к смесям для питания младенцев.
Были выполнены обширные исследования с целью определения новых штаммов пробиотиков. Например, EP 0199535, EP 0768375, публикация WO 97/00078, EP 0577903 и публикация WO 00/53200 раскрывают определенные штаммы Lactobacilli и Bifidobacteria и проявляемые ими благоприятные эффекты.
Совсем недавно стало выражаться некоторое беспокойство в связи с добавлением пробиотических бактерий к смеси для питания младенцев, предназначаемой в качестве единственного источника питания для младенцев в первые шесть месяцев жизни. Эти опасения были подытожены в медицинском меморандуме Комитета по питанию ESPGHAN (Европейское общество педиатрической гастроэнтерологии, гепатологии и питания), названном "Пробиотические бактерии в диетических продуктах для младенцев" ("Probiotic Bacteria in Dietetic Products for Infants", Journal of Paediatric Gastroenterology and Nutrition, 38:365-374).
Другим подходом к стимулированию количества и/или активности полезных бактерий в толстой кишке является добавление в пишу пребиотиков. Пребиотик - это неусваиваемый компонент пищевого продукта, который благотворно воздействует на организм реципиента, выборочно стимулируя рост и/или активность одного или ограниченного количества бактерий в толстой кишке, тем самым улучшая состояние здоровья организма. Такие ингредиенты являются неусваиваемыми в том смысле, что они не разлагаются и не поглощаются желудком или тонкой кишкой и таким образом проходят неповрежденными в толстую кишку, где выборочно ферментируются полезными бактериями. Примеры пребиотиков включают некоторые олигосахариды, такие как фруктоолигосахариды (FOS) и галактоолигосахариды (GOS).
Женское молоко, как известно, содержит большее количество неусвояемых олигосахаридов, чем большинство других видов животного молока. Фактически неусвояемые олигосахариды представляют собой третий из наиболее значительно представленных твердых компонентов грудного молока (после лактозы и липидов), встречающийся в концентрации 12-15 г/л в молозиве и 5-8 г/л в зрелом молоке. Олигосахариды женского молока являются очень устойчивыми к ферментативному гидролизу, что говорит о том, что эти олигосахариды могут проявлять жизненно важные функции, не связанные непосредственно с их калорийностью.
По мере того как композиция женского молока становится лучше понимаемой, предлагается также прибавлять пребиотики и к смесям для питания младенцев. В продаже имеются различные смеси для питания младенцев, дополненные пребиотиками, такими как, например, смеси фруктоолигосахаридов и галактоолигосахаридов. Однако такие смеси только в общих чертах приближены к смеси олигосахаридов женского молока. В женском молоке обнаружено более 100 различных олигосахаридных компонентов, некоторые из которых пока либо вообще не найдены в молоке животных, например коровьем молоке, либо были обнаружены лишь в малых количествах. Примерами классов олигосахаридов женского молока, которые присутствуют в коровьем молоке и молозиве лишь в очень малых количествах либо вовсе отсутствуют, являются сиалированные и фукозилированные олигосахариды.
В ходе непрекращающихся поисков, имеющих целью получение смесей для питания младенцев, воспроизводящих композицию и эффективность женского молока настолько близко, насколько это возможно, были также предложены смеси для питания младенцев, содержащие одновременно и пробиотики, и пребиотики. Например, в WO 2005/000748 предлагается дополнить смесь для питания младенцев смесью штамма Bifidobacterium breve, галактоолигосахаридов и фруктоолигосахаридов (инулин). Заявляется, что эта смесь, которая характеризуется как синбиотик, регулирует популяцию Bifidobacterium в толстой кишке потребляющих данную дополненную рецептуру младенцев до состояния популяции более «близкой к младенческой», то есть имеющей сниженное содержание видов Bifidobacterium catenulatum, Bifidobacterium pseudocatenulatum и Bifidobacterium adolescentis и повышенное - видов Bifidobacterium infantis, Bifidobacterium breve и Bifidobacterium longum. Также заявляется, что смесь является полезной для профилактики или терапии состояния иммунной системы.
Кишечная микробиота играет важную роль в гидролизе неусвояемых олигосахаридов и полисахаридов, преобразующем их в поглощаемые моносахариды, а также в активации липопротеинлипазы при непосредственном воздействии на ворсинчатый эпителий. Кроме того, недавно было показано, что женское молоко содержит не только олигосахариды, но также и бифидобактерии. В то же самое время геномные исследования убедительно продемонстрировали, что присутствующие в кишечнике вскармливаемых грудью детей бифидобактерии, такие как Bifidobacterium longum, обеспечиваются специально для утилизации в качестве нутриентов олигосахаридов грудного молока. Bifidobacterium longum также адаптированы к условиям толстого кишечника, где происходит выделение энергии из медленно поглощаемых углеводов.
Одним словом, появляется все больше данных, указывающих на то, что установление подходящей кишечной микробиоты на ранних этапах жизни может иметь существеннее значение для последующего нормального развития. В то же самое время доля родоразрешений с помощью кесарева сечения продолжает возрастать, составляя в некоторых странах вплоть до 70% всех рождений. Отсюда понятна необходимость в обеспечении способа стимулирования быстрого установления у младенцев подходящей кишечной микробиоты в случаях, когда этого не происходит естественным образом. Эта потребность является особенно острой, учитывая существующую практику планового введения профилактических доз антибиотиков беременным женщинам, подвергаемым элективному кесареву сечению.
Сущность изобретения
Как отмечалось выше, у здорового, рожденного вагинально, вскармливаемого грудью младенца бактерии рода Bifidobacteria образуют основу микробиоты, составляющую 60-90% общего количества бактерий в кишечнике младенца. Виды бифидобактерий, преимущественно обнаруживаемые у таких младенцев, представлены Bifidobacterium breve, Bifidobacterium infantis и Bifidobacterium longum. Авторы настоящего изобретения с удивлением обнаружили, что совместное введение особых подвидов молочнокислых бактерий, а именно пробиотического штамма Lactobacillus rhamnosus, и смеси олигосахаридов, содержащей 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, синергически стимулирует развитие ранней бифидогенной кишечной микробиоты у младенцев, рожденных с помощью кесарева сечения.
Соответственно, настоящее изобретение обеспечивает применение пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, в производстве лекарственного средства или лечебной питательной композиции, предназначаемых для стимулирования развития ранней бифидогенной кишечной микробиоты у младенцев, рожденных с помощью кесарева сечения.
Изобретение, кроме того, обеспечивает применение пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, в производстве лекарственного средства или лечебной питательной композиции, предназначаемых для снижения риска последующего развития аллергии у младенцев, рожденных с помощью кесарева сечения.
В следующем объекте изобретение обеспечивает применение пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, в производстве лекарственного средства или лечебной питательной композиции, предназначаемых для профилактики или терапии диареи у младенцев, рожденных с помощью кесарева сечения.
Изобретение распространяется на способ стимулирования развития ранней бифидогенной кишечной микробиоты у младенцев, рожденных с помощью кесарева сечения, содержащий предоставление терапевтического количества пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, младенцу, рожденному с помощью кесарева сечения и нуждающемуся в вышеуказанном.
Изобретение, кроме того, распространяется на способ снижения риска того, что у младенца, рожденного с помощью кесарева сечения, впоследствии разовьется аллергия, содержащий предоставление терапевтического количества пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, младенцу, рожденному с помощью кесарева сечения и нуждающемуся в вышеуказанном.
Изобретение также распространяется на способ профилактики или терапии диареи у младенца, рожденного с помощью кесарева сечения, содержащий предоставление терапевтического количества пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, младенцу, рожденному с помощью кесарева сечения и нуждающемуся в вышеуказанном.
Не претендуя на теоретическую широту охвата, авторы настоящего изобретения полагают, что введение пробиотического штамма Lactobacillus rhamnosus и смеси олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc, младенцу, рожденному с помощью кесарева сечения, некоторым, пока еще не полностью понятным образом подготавливает желудочно-кишечный тракт младенца для способствования последующей колонизации теми видами бифидобактерий, которые обычно обнаруживаются в тракте здоровых младенцев, рожденных вагинально. Предполагается, что эта благоприятная колонизация снижает риск эпизодов диареи, которая, как было показано, поражает младенцев, рожденных с помощью кесарева сечения. Кроме того, предполагается, что благоприятная колонизация снижает риск последующего развития аллергии, проявляющейся, например, в свистящем дыхании и/или в повышении чувствительности к аллергенам пищи.
Следует заметить, что ни целью, ни ожидаемым эффектом такой терапии не является стимулирование колонизации самим пробиотиком Lactobacillus rhamnosus, а на самом деле они состоят в стимулировании колонизации другими видами так, чтобы обеспечить раннюю бифидогенную кишечную микробиоту, сопоставимую с обнаруживаемой у здоровых, вскармливаемых грудью, рожденных вагинально младенцев.
Краткое описание фигур
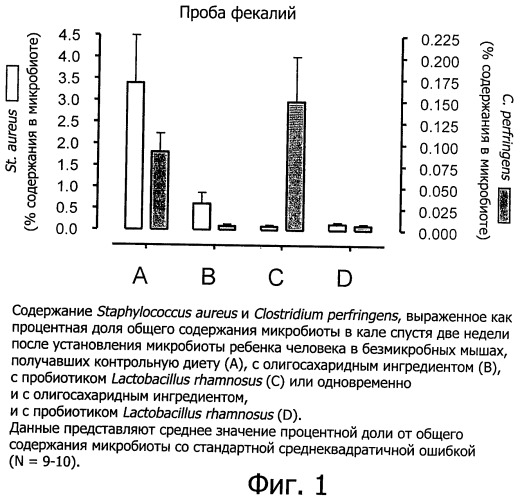
Фигура 1 показывает содержание через 14 дней Staphylococcus aureus и Clostridium perfringens в образцах фекалий гнотобиологических мышей с введенной через зонд микробиотой ребенка человека; и
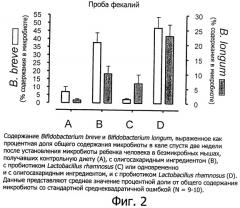
Фигура 2 показывает содержание через 14 дней Bifidobacterium breve и Bifidobacterium longum в образцах фекалий гнотобиологических мышей с введенной через зонд микробиотой ребенка человека.
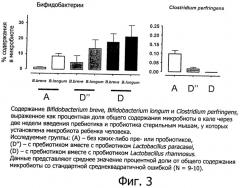
Фигура 3 показывает содержание Bifidobacterium breve, Bifidobacterium longum и Clostridium perfringens в кале через две недели введения пребиотика и пробиотика стерильным мышам с введенной через зонд микробиотой ребенка человека.
Раскрытие изобретения
В данном описании следующие термины имеют следующие значения:
«ранняя бифидогенная кишечная микробиота» обозначает кишечную микробиоту младенца в возрасте вплоть до 12 месяцев, в которой преобладают бифидобактерии, такие как Bifidobacterium breve, Bifidobacterium infantis и Bifidobacterium longum, за исключением заметных популяций таких видов, как Clostridia и Streptococci, и которая является в целом сопоставимой с обнаруживаемой у рожденного вагинально, вскармливаемого грудью ребенка того же возраста;
«младенец» означает ребенка младше 12 месяцев;
«пребиотик» обозначает неусваиваемый компонент пищевого продукта, который благотворно воздействует на организм, выборочно стимулируя рост и/или активность одного или ограниченного количества бактерий в толстой кишке, тем самым улучшая состояние здоровья организма (Gibson and Roberfroid "Dietary Modulation of the Human Colonic Microbiota: Introducing the Concept of Prebiotics" J. Nutr 125:1401-1412);
«пробиотик» обозначает препарат микробиологических клеток или компоненты микробиологических клеток, обладающие благотворным воздействием на состояние здоровья или самочувствие организма (Salminen S, Ouwehand A. Benno Y. et al "Probiotics: how should they be defined" Trends Food Sci. Technol. 1999:10 107-10).
Все указания на проценты, если не оговаривается иного, представлены массовыми процентными долями.
Подходящие пробиотические штаммы Lactobacillus rhamnosus включают Lactobacillus rhamnosus АТСС 53103, предлагаемый inter alia (в числе прочего) финской компанией Valio Оу под торговой маркой LGG, и Lactobacillus rhamnosus CGMCC 1.3724. Подходящая суточная доза составляет от 105 до 1011 KOE, более предпочтительно от 107 до 1010 KOE.
Пробиотик Lactobacillus rhamnosus вводится совместно со смесью олигосахаридов, которая содержит 5-70 мас.% по меньшей мере одного N-ацетилированного олигосахарида, выбранного из группы, содержащей GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc, 20-90 мас.% по меньшей мере одного нейтрального олигосахарида, выбранного из группы, содержащей Galβ1,6Gal, Galβ1,6Galβ1,4Glc Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,3Galβ1,4Glc, и 5-50 мас.% по меньшей мере одного сиалированного олигосахарида, выбранного из группы, содержащей NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc. Такая смесь олигосахаридов более подробно описана в WO 2007/090894, содержание которой включено здесь посредством ссылки, и в дальнейшем упоминается как «вышеописанная смесь олигосахаридов». Термин «совместное введение» включает как одновременное введение пробиотика Lactobacillus rhamnosus и смеси олигосахаридов, так и последовательное введение Lactobacillus rhamnosus и смеси олигосахаридов.
Предпочтительно вышеописанная смесь содержит 10-70 мас.% указанного N-ацетилированного олигосахарида(-ов), 20-80 мас.% указанного нейтрального олигосахарида(-ов) и 10-50 мас.% указанного сиалированного олигосахарида(-ов). Более предпочтительно смесь содержит 15-40 мас.% N-ацетилированного олигосахарида(-ов), 40-60 мас.% другого нейтрального олигосахарида(-ов) и 15-30 мас.% сиалированного олигосахарида(-ов). Особенно предпочтительная смесь представляет собой 30 мас.% N-ацетилированного олигосахарида(-ов), 50 мас.% нейтрального олигосахарида(-ов) и 20 мас.% сиалированного олигосахарида(-ов).
В качестве варианта вышеописанная смесь может содержать 5-20 мас.% указанного N-ацетилированного олигосахарида(-ов), 60-90 мас.% указанного нейтрального олигосахарида(-ов) и 5-30 мас.% указанного сиалированного олигосахарида(-ов).
Вышеописанная смесь олигосахаридов по изобретению может готовиться из молока животного одного или нескольких видов. Молоко может быть получено от любого млекопитающего, в частности от коров, коз, буйволов, лошадей, слонов, верблюдов или овец.
В качестве варианта вышеописанная смесь олигосахаридов может готовиться посредством приобретения и смешивания индивидуальных компонентов. Например, синтезированные галактоолигосахариды, такие как Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc и Galβ1,3Galβ1,6Galβ1,4Glc и их смеси имеются в продаже под торговыми марками Vivinal® и Elix'or®. Другими поставщиками олигосахаридов являются Dextra Laboratories, Sigma-Aldrich и Kyowa Hakko Kogyo Co., Ltd. В качестве варианта для получения нейтральных олигосахаридов могут использоваться определенные гликозилтрансферазы, такие как галактозилтрансферазы.
N-ацетилированные олигосахариды могут готовиться действием глюкозаминидазы и/или галактозаминидазы на N-ацетилглюкозу и/или N-ацетилгалактозу. Аналогичным образом с этой целью могут использоваться N-ацетилгалактозилтрансферазы и/или N-ацетилгликозилтрансферазы. N-ацетилированные олигосахариды также могут быть получены с помощью технологии ферментации при использовании соответствующих ферментов (рекомбинантных или естественных) и/или микробиологической ферментацией. В последнем случае микроорганизмы могут либо выделять свои естественные ферменты и субстраты, либо могут быть подвергнуты реконструкции для выработки соответствующих субстратов и ферментов. Могут использоваться индивидуальные микробиальные культуры или смешанные культуры. Образование N-ацетилированного олигосахарида может быть инициировано акцепторными субстратами с любой степенью полимеризации (DP), начиная от DP=1 и выше. Другой возможностью является химическое преобразование кетогексоз (например, фруктозы) в свободной или связанной с олигосахаридом (например, лактулоза) форме в N-ацетилгексозамин или в содержащий олигосахарид N-ацетилгексозамин, как описано в Wrodnigg, Т.М.; Stutz, А.Е. (1999) Angew. Chem. Int. Ed. 38:827-828.
Сиалированные олигосахариды 3'-сиалиллактоза и 6'-сиалиллактоза могут быть выделены хроматографическим способом или с помощью фильтрационной технологии из естественных источников, таких как молоко животных. В качестве варианта они могут быть также получены биотехнологическим способом, используя определенные сиалилтрансферазы, либо с помощью технологии ферментации при использовании соответствующих ферментов (рекомбинантных или естественных), либо технологией микробиологической ферментации. В последнем случае микроорганизмы могут либо выделять свои естественные ферменты и субстраты, либо могут быть подвергнуты реконструкции для выработки соответствующих субстратов и ферментов. Могут использоваться индивидуальные микробиальные культуры или смешанные культуры. Образование сиалилолигосахарида может быть инициировано акцепторными субстратами с любой степенью полимеризации (DP), начиная от DP=1 и выше.
Другие пробиотические бактерии могут вводиться с пробиотиком Lactobacillus rhamnosus. Могут использоваться любые молочнокислые бактерии или бифидобактерии с установленными пробиотическими свойствами. Подходящие пробиотические молочнокислые бактерии включают Lactobacillus reuteri АТСС 55730, предлагаемые компанией Biogaia, или Lactobacillus paracasei CNCM I-2116.
Подходящие пробиотические штаммы бифидобактерий включают Bifidobacterium lactis CNCM I-3446, inter alia (в числе прочего) предлагаемые в продаже датской компанией Christian Hansen под торговой маркой Bb12, Bifidobacterium longum АТСС ВАА-999, реализуемые Morinaga Milk Industry Co. Ltd. (Япония) под торговой маркой ВВ536, штамм Bifidobacterium breve, предлагаемый Danisco под торговой маркой Bb-03, штамм Bifidobacterium breve, предлагаемый Morinaga под торговой маркой M-16V, и штамм Bifidobacterium breve, предлагаемый Institut Rosell (Lallemand) под торговой маркой R0070. Может использоваться смесь молочнокислых бактерий и бифидобактерий.
Вышеописанная смесь пробиотика Lactobacillus rhamnosus и олигосахаридов предпочтительно вводится младенцу немедленно после рождения и далее на протяжении по меньшей мере первых двух месяцев жизни младенца. Более предпочтительно введение продолжается до достижения младенцем возраста шести месяцев. Вышеописанная смесь пробиотика Lactobacillus rhamnosus и олигосахаридов может удобно вводиться в смесь для питания младенцев.
Предназначаемая для применения согласно настоящему изобретению смесь для питания младенцев может содержать источник белка в количестве не более 2,0 г/100 ккал, предпочтительно от 1,8 до 2,0 г/100 ккал. Тип белка в применении к настоящему изобретению не рассматривается как критически важный при условии, что удовлетворяются минимальные требования по содержанию незаменимых аминокислот и обеспечивается удовлетворительный рост, хотя предпочтительно, чтобы более 50 мас.% источника белка являлись бы сывороткой. Так, могут использоваться источники белка, основанные на сыворотке, казеине и их смесях, а также источники белка, основанные на сое. В том, что касается сывороточных белков, источник белка может базироваться на кислой сыворотке, или сладкой сыворотке, или их смесях и может включать альфа-лактальбумин и бета-лактоглобулин в любых желаемых соотношениях.
Белки могут быть интактными или гидролизованными либо являться смесью интактных и гидролизованных белков. Может быть желательным обеспечение частично гидролизованными белками (степень гидролиза между 2 и 20%), например, в случае младенцев, которые рассматриваются как подверженные риску развития аллергии к коровьему молоку. Если необходимы гидролизованные белки, процесс гидролиза может быть осуществлен так, как желательно, и известным в данной области способом. Например, гидролизат сывороточного белка может готовиться ферментативным гидролизом сывороточной фракции в одну или несколько стадий. Обнаружено, что если используемая в качестве исходного материала сывороточная фракция является по существу не содержащей лактозы, белок претерпевает значительно меньшую степень блокирования лизина во время гидролиза. Это делает возможным снижение степени блокирования лизина от около 15 мас.% общего лизина до менее чем около 10 мас.% лизина, например около 7 мас.% лизина, что значительно улучшает питательные качества источника белка.
Смесь для питания младенцев может содержать источник углеводов. Может использоваться любой обычно обнаруживаемый в смесях для питания младенцев источник углеводов, например лактоза, сахароза, мальтодекстрин, крахмал и их смеси, хотя предпочтительным источником углеводов является лактоза. Предпочтительно вклад источников углеводов в полное энергосодержание рецептуры составляет между 35 и 65%.
Смесь для питания младенцев может содержать источник липидов. Источник липидов может быть любым липидом или жиром, являющимся пригодным для применения в смесях для питания младенцев. Предпочтительные источники жиров включают пальмовый олеин, высокоолеиновое подсолнечное масло и высокоолеиновое сафлоровое масло. Также могут добавляться незаменимые жирные кислоты: линолевая и α-линоленовая кислоты, равно как и небольшие количества масел с высоким содержанием арахидоновой кислоты и докозагексаеновой кислоты, такие как рыбий жир или масла, получаемые с помощью микробиологических технологий. Общее содержание жира предпочтительно должно быть таким, чтобы его вклад в полное энергосодержание рецептуры составлял между 30 и 55%. Источник жиров предпочтительно имеет величину отношения содержания n-6 жирных кислот к содержанию n-3 жирных кислот от около 5:1 до около 15:1; например от около 8:1 до около 10:1.
Смесь для питания младенцев может также содержать в питательно существенных количествах все витамины и минеральные вещества, которые рассматриваются в повседневном пищевом рационе в качестве незаменимых. По некоторым витаминам и минеральным веществам были установлены минимальные требования. Примеры минеральных веществ, витаминов и других питательных веществ, возможно присутствующих в смеси для питания младенцев, включают витамин A, витамин B1, витамин B2, витамин B6, витамин B12, витамин E, витамин K, витамин C, витамин D, фолиевую кислоту, инозитол, никотиновую кислоту, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлор, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества обычно прибавляются в виде солей. Наличие и количества конкретных минеральных веществ и других витаминов будут изменяться в зависимости от предназначенности для той или иной группы младенцев.
В случае необходимости смесь для питания младенцев может содержать эмульгаторы и стабилизаторы, такие как лецитин сои, моно- и диглицеридные эфиры лимонной кислоты и т.п.
Предпочтительно смесь для питания младенцев содержит вышеописанную смесь олигосахаридов в количестве от 0,2 до 5 граммов на литр разведенной рецептуры, предпочтительно от 1 до 2 г/л.
Смесь для питания младенцев может при необходимости содержать другие способные оказывать благоприятное воздействие вещества, такие как лактоферрин, нуклеотиды, нуклеозиды и т.п.
Как смесь для питания младенцев, так и вышеописанная пищевая рецептура могут готовиться любым подходящим способом. Например, они могут быть приготовлены смешиванием в соответствующих соотношениях белка, источника углеводов и источника жиров. В случае их применения на данном этапе могут быть включены эмульгаторы. На данном этапе могут добавляться также витамины и минеральные вещества, но обычно они прибавляются позднее в целях избежания теплового разложения. Перед смешиванием в источнике жиров могут быть растворены любые липофильные витамины, эмульгаторы и т.п. Затем для получения жидкой смеси может примешиваться вода, предпочтительно вода, подвергнутая обработке обратным осмосом. Подходящая для содействия диспергированию ингредиентов температура воды составляет от около 50°C до около 80°C. Для получения жидкой смеси могут использоваться имеющиеся в продаже разжижители. Затем жидкая смесь гомогенизируется, например, в два этапа.
После чего для снижения бактериальной нагрузки жидкая смесь может быть подвергнута термической обработке быстрым нагреванием до температуры в диапазоне от около 80°C до около 150°C в течение времени от около 5 секунд до около 5 минут, например. Это может быть осуществлено нагнетанием пара, автоклавированием или с помощью теплообменника, например пластинчатого теплообменника.
Затем жидкая смесь может быть охлаждена до температуры в диапазоне от около 60°C до около 85°C, например, мгновенным охлаждением. После чего жидкая смесь может быть снова гомогенизирована, например, в два этапа: при давлении от около 10 МПа до около 30 МПа на первом этапе и от около 2 МПа до около 10 МПа на втором этапе. Далее гомогенизированная смесь может быть дополнительно охлаждена для добавления каких-либо чувствительных к нагреванию компонентов, таких как витамины и минеральные вещества. На данном этапе в гомогенизированной смеси удобно регулируются величина pH и содержание сухих веществ.
Гомогенизированная смесь поступает в подходящее сушильное устройство, такое как распылительная сушилка или установка для сублимационной сушки, и преобразуется в порошок. Порошок должен иметь влажность менее чем около 5 мас.%.
Культура пробиотика Lactobacillus rhamnosus может выращиваться согласно любому подходящему способу и подготавливаться для добавления к питательной смеси или смеси для питания младенцев, например, сублимационной сушкой или распылительной сушкой. В качестве варианта Lactobacillus rhamnosus АТСС 53103 может быть приобретен под торговой маркой LGG у компании Valio Оу (Финляндия) в подходящем, уже подготовленном для добавления к пищевым продуктам, таким как питательные смеси и смеси для питания младенцев, виде. Пробиотик Lactobacillus rhamnosus может прибавляться к рецептуре в количестве между 103 и 1012 KOE на 1 г порошка, более предпочтительно между 107 и 1012 KOE на 1 г порошка.
Далее изобретение иллюстрируется на основании нижеследующих примеров.
Пример 1
Ниже представлен пример композиции подходящей для питания младенцев смеси, используемой в настоящем изобретении.
| Питательное вещество | на 100 ккал | на 1 литр |
| Энергетическая ценность (ккал) | 100 | 670 |
| Белок (г) | 1,83 | 12,3 |
| Жиры (г) | 5,3 | 35,7 |
| Линолевая кислота (г) | 0,79 | 5,3 |
| α-Линоленовая кислота (мг) | 101 | 675 |
| Лактоза (г) | 11,2 | 74,7 |
| Минеральные вещества(г) | 0,37 | 2,5 |
| Na (мг) | 23 | 150 |
| K (мг) | 89 | 590 |
| Cl (мг) | 64 | 430 |
| Ca (мг) | 62 | 410 |
| P (мг) | 31 | 210 |
| Mg (мг) | 7 | 50 |
| Mn (мкг) | 8 | 50 |
| Se (мкг) | 2 | 13 |
| Витамин A (мкг, ретиноловый эквивалент (RE)) | 105 | 700 |
| Витамин D (мкг) | 1,5 | 10 |
| Витамин E (мг, токоферольный эквивалент (ТЕ)) | 0,8 | 5,4 |
| Витамин K1 (мкг) | 8 | 54 |
| Витамин C (мг) | 10 | 67 |
| Витамин B1 (мг) | 0,07 | 0,47 |
| Витамин B2 (мг) | 0,15 | 1,0 |
| Ниацин (мг) | 1 | 6,7 |
| Витамин B6 (мг) | 0,075 | 0,50 |
| Фолиевая кислота (мкг) | 9 | 60 |
| Пантотеновая кислота (мг) | 0,45 | 3 |
| Витамин B12 (мкг) | 0,3 | 2 |
| Биотин (мкг) | 2,2 | 15 |
| Холин (мг) | 10 | 67 |
| Fe (мг) | 1,2 | 8 |
| I (мкг) | 15 | 100 |
| Cu (мг) | 0,06 | 0,4 |
| Zn (мг) | 0,75 | 5 |
| L. rhamnosus АТСС 53103 | 2·107 КОЕ на 1 г порошка, живые бактерии |
Пример 2
В этом примере сравнивается действие Lactobacillus rhamnosus CGMCC 1.3724 совместно с олигосахаридным ингредиентом, включающим N-ацетилированные олигосахариды, нейтральные олигосахариды и сиалированные олигосахариды (упоминаемые в дальнейшем как CMOS-GOS), на процесс установления ранней бифидогенной кишечной микробиоты в гнотобиологической модели с рожденными в результате кесарева сечения мышами с действием взятых по отдельности пробиотика и смеси олигосахаридов, а также с контролем. Эта модель является подходящей экспериментальной моделью на животном для младенцев, рожденных путем кесарева сечения и имеющих недостаточную кишечную микробиоту в отношении популяции бифидобактерий. В дополнение к наблюдению размера популяции бифидобактерий эта модель является также подходящей для отслеживания благоприятного действия бифидобактерий в качестве барьера против потенциально патогенных бактерий, таких как Clostridium perfringens.
Методы и материалы
Стерильные самки и самцы мышей линии С3Н были закуплены в Charles River Laboratories