Додекапептиды, обладающие кардиопротекторными свойствами
Иллюстрации
Показать всеИзобретение относится к биологически активным пептидам, способным влиять на метаболическое и функциональное состояние сердца, а также к лекарственным средствам на их основе. Предложены додекапептиды общей формулы X-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-Z, где X=CH3, Y=H, Z=OH для соединения (II), Х=CH3, Y=H, Z=NH2 для соединения (III), X=H, Y=NO2, Z=NH2 для соединения (IV), обладающие кардиопротекторными свойствами. Заявленные пептиды могут найти применение в качестве кардиопротекторных средств в кардиологии для терапии сердечно-сосудистых заболеваний, в частности ишемической болезни сердца. 2 табл., 4 пр., 1 ил.
Реферат
Изобретение относится к биологически активным пептидам, способным влиять на метаболическое и функциональное состояние сердца, а также к лекарственным средствам на их основе.
Ишемическая болезнь сердца (ИБС) - заболевание миокарда, обусловленное острым или хроническим несоответствием потребности миокарда в кислороде и реального коронарного кровообращения сердечной мышцы. ИБС является одним из наиболее распространенных заболеваний сердечно-сосудистой системы во всех экономически развитых странах. В России распространенность ИБС и смертность от нее - одни из наиболее высоких в Европе [1].
Морфологической основой ИБС более чем в 95-97% случаев является атеросклероз коронарных артерий, ведущий к их сужению и нарушению коронарного кровотока и адекватной перфузии миокарда. Одним из следствий нарушения сердечного метаболизма является окислительный стресс - появление большого количества свободных окислительных радикалов, что инициирует каскад биохимических процессов в миокарде, приводящий к повреждению сосудистого эндотелия, разрушению кардиомиоцитов и их гибели [1, 2].
Снижение степени повреждения сердца в период восстановления нормального кровотока (реперфузии) и восстановление энергетического обмена в миокарде являются важнейшими задачами при лечении ИБС и предотвращении острых коронарных состояний. В этой связи проводится огромное количество исследований, направленных на поиск новых кардиопротекторных веществ и создание эффективных противоишемических лекарственных препаратов.
Одним из перспективных направлений в этой сфере является снижение реперфузионных повреждений путем регулирования биодоступности оксида азота NO-ловушки свободных радикалов, вазодилатирующего и кардиопротекторкого агента [2, 3]. Известен эндогенный полипептид апелин [4, 5], способный восстанавливать сократительные свойства сердца через NO-зависимый механизм снижения кровяного давления, сохраняя при этом положительный ионотропный эффект (повышение силы сердечных сокращений). Этот пептид был назван апелином потому, что он является лигандом APJ-рецептора; система апелин-APJ-рецептор играет важную роль в сердечно-сосудистом гомеостазе [4-6]. Апелин принадлежит к группе адипокинов - вазоактивных пептидов, опосредующих механизмы адаптации клеток к повреждению, состоит из 77 аминокислотных остатков и подвергается дальнейшему протеолизу до более коротких фрагментов, сохраняющих его биологическую активность - апелинов -36, -19, -17, -13 и -12. Известно, что наиболее высокой биологической активностью обладают апелин -12 и -13 [5-9].
С - концевые фрагменты исходного апелина 77, содержащие менее 10 остатков аминокислот, физиологически не эффективны [10, 11].
В условиях недостаточного снабжения сердца энергетическими субстратами и кислородом активация системы апелин - АРJ рецептор апелинами-12 и -13 увеличивает восстановление функции сердца после ишемии, блокирует открытие митохондриальной поры и апоптоз [11, 12]. Принципиально важно, что апелин-12 существенно улучшает не только восстановление функции, но и энергетический обмен ишемизированных кардиомиоцитов путем сохранения фонда адениннуклеотидов и окисления глюкозы, а также уменьшает повреждения сарколеммы [8].
При ишемии, вызванной окклюзией коронарной артерии, экспрессия апелина-12 (на уровне мРНК и продукции пептида) значительно возрастает, однако при возобновлении кровоснабжения сердца - снижается до исходного уровня, указывая на уменьшение биодоступности пептида [11, 12]. Сходная ситуация наблюдается у больных ишемической болезнью сердца - сниженные уровни апелина в плазме сохраняются в течение нескольких недель после инфаркта миокарда и при развившейся сердечной недостаточности [13, 14]. Это обосновывает необходимость использования экзогенного апелина для регуляции активности системы апелин - APJ рецептор при ишемическом повреждении сердца. Изучение биологических свойств апелиновых пептидов и системы апелин - APJ рецептор открывает возможности для создания лекарственных препаратов нового поколения для терапии ИБС [15].
Известны два семейства пептидных производных на базе молекулы апелина-12, описываемых нижеприведенными формулами (1) и (2):
В обоих случаях Р1 и X1 представляют собой атом водорода, аминокислотный остаток или пептидную цепь, содержащую максимально 25 аминокислот. При этом, когда Р1 (или X1) - атом водорода, среди приведенных структур [16-17] нет соединений с модифицированным N-концевым остатком аргинина, будь то модификация его α-аминогруппы, будь то модификация гуанидиновой функции. В обоих семействах - (1) и (2) остаток метионина, как правило, заменен на норлейцин или циклогексилаланин, а С - концевая карбоксильная группа так или иначе защищена: восстановлена до спиртовой или альдегидной функции либо представляет собой соответствующие амид, эфир, соль [16-17]. Кроме того, следует заметить, что в указанных работах [16-17] пептидным производным, соответствующим формулам (1) и (2), приписываются кардиорегуляторные и многие другие свойства на том лишь основании, что они, по всей вероятности, являются лигандами APJ-рецептора и поэтому могут быть использованы как терапевтические и профилактические средства при самых различных патологиях, в том числе и в кардиологии. Однако это предположение ничем не подкреплено, так как какие-либо примеры по тестированию биологической активности этих пептидов в патентах [16-17] вообще отсутствует и остается неясным: влияют ли и, если влияют, то каким образом, многочисленные модификации и аминокислотные замены, внесенные в исходную молекулу апелина, на его биологическую активность. Поскольку в ряду пептидных аналогов не существует четкой взаимосвязи структура - активность; кардиопротекторная или любая другая биологическая активность модифицированных соединений не является очевидной и никак не доказана.
Таким образом, апелин-12 является наиболее простым фрагментом молекулы исходного апелина 77, еще сохраняющим кардиопротекторные свойства. Поэтому апелин-12 был выбран нами в качестве прототипа. Однако высокая активность пептидаз в крови снижает эффективность использования этого пептида в эксперименте и клинике [18]. Кроме того, в состав апелина-12 входит метионин, который чрезвычайно легко окисляется кислородом воздуха до соответствующего сульфоксида [19]. Известно, что подобные пептиды могут быть нестабильны при хранении [19].
В связи с этим задачей настоящего изобретения явился поиск и синтез структурных аналогов апелина-12, сочетающих высокую кардиопротекторную активность (снижение нарушений функции и метаболизма сердца при ишемии и реперфузии) с повышенной протеолитической стабильностью и устойчивостью при хранении.
Поставленная задача решается синтезом приведенных ниже додекапептидов:
Структуру заявляемых пептидов можно выразить общей формулой:
Х-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-Z,
| где X=СН3, Y=Н, Z=ОН | для соединения (II), |
| X=СН3, Y=Н, Z=NH2 | для соединения (III), |
| X=Н, Y=NO2, Z=NH2 | для соединения (IV) |
Как уже сказано выше, в ряду пептидных аналогов не существует четкой взаимосвязи структура - активность, следовательно, кардиопротекторная активность этих соединений не является очевидной. Состав заявляемых соединений оригинален и не описан в доступной литературе.
Заявляемые пептиды получали твердофазным методом пептидного синтеза с использованием Fmoc-технологии, описанным ниже в примерах.
Список сокращений:
АА - аминокислота;
Воc - трет-бутилоксикарбонил;
TBTU - N-[(1Н-бензотриазолил)(диметиламино)метилен]-N-метилметанаминиум тетрафторборат;
But - трет-бутил;
DIC - N,N'-диизопропилкарбодиимид;
DIPEA - N,N-диизопропилэтиламин;
DCM - дихлорметан;
Fmoc - 9-флуоренилметоксикарбонил;
НОВТ - 1-гидроксибензотриазол;
Mtr - 4-метокси-2,3,6-триметилбензолсульфонил;
Me - метил;
NMP - N-метилпирролидон;
Pip - пиперидин;
Рmc - 2,2,5,7,8-пентаметилхроман-6-сульфонил;
TIBS - триизобутилсилан;
TFA - трифторуксусная кислота;
ВЭЖХ - высокоэффективная жидкостная хроматография;
ИБС - ишемическая болезнь сердца;
ТФС - твердофазный синтеза пептидов;
СФ - сократительная функция.
Твердофазный синтез пептидов
В работе использованы производные L-аминокислот (Fluka и Bachem, Швейцария), DIC, DIPEA, HOBt, TIBS, (Fluka, Швейцария). Для синтеза применяли N-метилпирролидон, дихлорметан, 4-метилпиперидин, метанол и TFA (Fluka, Швейцария). Аналитическую ВЭЖХ проводили на хроматографе (Gilson, Франция), использовали колонку Nucleosil 100 С18, 5 мкм, (4.6×250 мм) (Sigma, США) в качестве элюентов использовали буфер А - 0.1% TFA, буфер Б - 80% ацетонитрила в буфере А, элюция градиентом концентрации буфера Б в буфере А от 0% до 60% за 30 мин. Скорость потока 1 мл/мин, детекция при 220 нм. Структура полученных пептидов доказана спектрами 1Н-ЯМР и данными масс-спектрометрии. 1Н-ЯМР-спектры снимали на спектрометре WM-500 (Braker) 500 МГц (ФРГ) в DMSO-d6 при 300 K, концентрация пептидов составляла 2-3 мг/мл. Химические сдвиги измерялись относительно тетраметилсилана. Масс-спектры регистрировали на приборе PC-Kompact MALDI (Kratos, Англия).
Апелин-12 (I) был получен для использования в качестве вещества сравнения при проведении биологических тестов. Соединения (I-IV), приведенные в таблице 1, были получены автоматическим твердофазным методом с использованием Fmoc-методологии. Пептидные кислоты синтезированы на полимере Ванга с гидроксиметилфеноксиметильной якорной группой, а соответствующие амиды на смоле Ринка (Rink-amide-resin). Для блокирования функциональных групп боковых цепей аминокислот во всех случаях применяли следующие защиты: Рmc - для гуанидиновой функции остатков аргинина, трет-бутильную для гидроксильной функции остатка серина, трет-бутилоксикарбонильную для ε-аминогруппы остатка лизина и тритильную для имидазольного кольца остатка гистидина. Синтез пептидов проводили, начиная с С-конца. Второй аминокислотой с С-конца в последовательности апелина 12 и выбранных аналогов является пролин. Известно, что в условиях ТФС пролинсодержащие дипептидилполимеры склонны к побочной реакции образования соответствующих дикетопиперазинов, сопровождающейся потерей пептидных цепей, с полимерного носителя [17, 20]. Для исключения из синтетического цикла проблемной стадии пролинсодержащего дипептидилполимера (H-Pro-Phe-Р) на этом этапе ТФС к фенилаланил-полимеру присоединяли дипептидные блоки Fmoc-Met-Pro-OH в случае получения апелина или Fmoc-Nle-Pro-OH при синтезе его аналогов (см. табл.1), далее пептидную цепь наращивали по одной аминокислоте. Соответствующие дипептидные блоки Fmoc-Met-Pro-OH и Fmoc-Nle-Pro-OH были получены методами классической пептидной химии в растворе, их гомогенность подтверждена данными тонкослойной хроматографии, структура спектрами 1Н-ЯМР. Для отщепления Fmoc-защиты в ходе ТФС применяли 25% раствор 4-метилпиперидина в диметилформамиде, для создания амидной связи использовали диизопропилкарбодиимид с добавкой 1-НОВТ.
Пример 1. Синтез H-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe-OH (I)-апелина-12
Для твердофазного синтеза апелина-12 (I) и [Nα(Me)Arg1, Nle10]-апелина 12 (II) использовали полимер Ванга с гидроксиметилфеноксиметильной якорной группой. Синтез проводили с С-конца, исходя из 0.4 г (0.25 ммоль) Fmoc-Phe-полимера фирмы Bachem (Швейцария) с содержанием фенилаланина - 0.67 ммоль/г. Ниже приведен стандартный протокол ТФС.
| Протокол твердофазного синтеза пептидов (I) | |||
| № | Операция | Реагент | Время обработки |
| Цикл 1 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-MePip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-Met-Pro-OH + 1 ммоль TBTU+1 ммоль НОВТ + 2 ммоль DIPEA в NMP | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| 7 | Тест с нингидрином | ||
| Цикл 2-10 |
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-AA-OH + 1 ммоль НОВТ + 1 ммоль DIC в NMP/DMF | 20 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
Заключительное деблокирование и отщепление целевого пептида от полимера проводили в одну стадию путем обработки соответствующего пептидилполимера смесью 10 мл TFA, 0.5 мл деионизованной воды, 0.5 мл тиоанизола и 0.25 мл TIBS в течение 2-3 ч. Затем полимер отфильтровывали, промывали 2×2 мл деблокирующей смеси, фильтрат упаривали и к остатку прибавляли сухой этилацетат или эфир. Осадок отфильтровывали, промывали DCM (3×3 мл), эфиром (3×5 мл), сушили в вакуум-эксикаторе. Сырой продукт твердофазного синтеза очищали с помощью препаративной ВЭЖХ, используя колонку Диасорб С16 130Т (25×250 мм), размер частиц сорбента 10 мкм. В качестве элюентов использовали буфер А - 0.1% водный раствор TFA и буфер Б - 80% ацетонитрила в воде. Элюцию проводили градиентом 0.5% в минуту буфера Б в буфере А от 100% буфера А со скоростью 10 мл/мин. Пептид детектировали при длине волны 220 нм. Фракции, содержащие целевой продукт, объединяли, ацетонитрил упаривали и лиофилизовали. Гомогенность продукта определяли с помощью аналитической ВЭЖХ, структуру подтверждали данными масс-спектрометрии и 1Н-ЯМР-спектроскопии. Выходы пептидов, данные ВЭЖХ и масс-спектрометрии приведены в таблице.
Пример 2. Синтез H-(NαMe)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-OH (II)
Синтез пептида (II) проводили аналогично синтезу пептида (I) за исключением того, что активацию Fmoc-(Me)Arg(Mtr)-OH в последнем цикле ТФС проводили с использованием TBTU/HOBT/DIPEA, см. нижеприведенный протокол.
| Протокол твердофазного синтеза пептидов (I) | |||
| № | Операция | Реагент | Время обработки |
| Цикл 1 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-MePip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-Met-Pro-OH + 1 ммоль TBTU + 1 ммоль НОВТ + 2 ммоль DIPEA в NMP | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| 7 | Тест с нингидрином | ||
| Цикл 2-9 | |||
| 1 | Промывка | 5xNMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-AA-OH + 1 ммоль НОВТ + 1 ммоль DIC в NMP/DMF | 20 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| Цикл 10 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-(Me)Arg(Mtr)-OH + 1 ммоль НОВТ + 1 ммоль TBTU + 2 ммоль DIPEA в NMP/DMF | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
Отщепление защит, очистку и идентификацию пептида (II) проводили так же, как в примере 1. Данные приведены в таблице 1.
Пример 3. Синтез H-(NαMe)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-NH2 (III) / H-Arg(NGNO2)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-NH2 (IV)
Для твердофазного синтеза соединений (III) и (IV) использовали сополимер стирола с 1% дивинилбензола с 4-(2,4-диметоксифенил)-Fmoc-аминометилфенокси - якорной группой (Rink-amide-полимер) фирмы Nova BoiChem, Швейцария, предназначенный для получения амидов пептидов, содержащий 0.60 ммоль/г аминогрупп. Синтез амида додекапептидов (III) и (IV) проводили с С-конца в соответствии с нижеприведенным протоколом твердофазного синтеза: присоединяли стартовый Fmoc-фенилаланин, затем дипептидный блок Fmoc-Nle-Pro-OH, далее ступенчато (присоединяя по одной аминокислоте), исходя из 0.20 г (0.12 ммоль) Rink-amide-полимера. Синтез проводили в полуавтоматическом режиме на пептидном синтезаторе Applied Biosystems 431А по стандартной программе для однократной конденсации Fmoc-аминокислот.
| Протокол твердофазного синтеза пептида (III) | |||
| № | Операция | Реагент | Время обработки |
| Цикл 1 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-Phe-OH + 1 ммоль НОВТ + 1 ммоль DIC в NMP/DMF | 20 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| Цикл 2 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-MePip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-Nle-Pro-OH + 1 ммоль TBTU + 1 ммоль НОВТ + 2 ммоль DIPEA в NMP | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| 7 | Тест с нингидрином | ||
| Цикл 3-10 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 20% 4-Ме Pip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-AA-OH + 1 ммоль НОВТ + 1 ммоль DIC в NMP/DMF | 20 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| Цикл 11 | |||
| 1 | Промывка | 5×NMP | 3 мин |
| 2 | Деблокирование α-аминогрупп | 25% 4-MePip/NMP | 10 мин |
| 3 | Промывка | 5×NMP | 3 мин |
| 4 | Активация | 1 ммоль Fmoc-(Me)Arg(Mtr)-OH (в случае пептида (III)) / 1 ммоль Вос-Arg(NO2)-OH (в случае пептида (IV)) + 1 ммоль TBTU + 1 ммоль НОВТ + 2 ммоль DIPEA в NMP | 3-5 мин |
| 5 | Конденсация | 1 ммоль активированного производного Fmoc-AA в NMP | 90 мин |
| 6 | Промывка | 5×NMP | 3 мин |
| 7 | Тест с нингидрином |
Отщепление защит, очистку и идентификацию пептидов (III) и (IV) проводили так же, как в примере 1. Данные приведены в таблице 1.
| Таблица 1. | ||||||
| Характеристики апелина 12 (I) и его производных (II)-(IV) | ||||||
| № | Формула пептида | Мрасчет. | Выход*, % | ВЭЖХ | MALDI-TOF, m/z | |
| Rt, мин | % | |||||
| (I) | H-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe-OH | 1422.7 | 67 | 14.80 | 98 | 1422.8 |
| (II) | H-(NαMe)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-OH | 1418.7 | 77 | 17.06 | 98 | 1418.9 |
| (III) | H-(NαMe)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-NH2 | 1417.7 | 18 | 16.47 | 96 | 1417.9 |
| (IV) | H-Arg(NGNO2)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-NH2 | 1448.7 | 20 | 16.92 | 97 | 1403.8 (-NO2), 1448.8 |
В таблице приведены выходы пептидов в расчете на стартовую аминокислоту, присоединенную к полимеру (т.е. суммарные выходы с учетом всех стадий синтеза).
Для исследования свойств пептидов использована модель тотальной ишемии и реперфузии изолированного перфузируемого сердца крыс.
Пример 4. Влияние пептидов на восстановление функции сердца и сосудов.
Перфузия изолированного сердца крысы. Опыты выполнены на сердце крыс-самцов линии Wistar (массой 300-340 г). У наркотизированных уретаном (внутрибрюшинно 1,25 мг на г массы тела) животных извлекали сердце и перфузировали ретроградно в течение 15-20 мин раствором Кребса (РК) с 11 мМ глюкозой, насыщенным карбогеном (95% O2 ± 5% CO2) pH 7,4±0,1 при 37°C, при постоянном перфузионном давлении 60 мм рт.ст. После этого сердца перфузировали антеградно по Нийли при постоянном давлении наполнения левого предсердия 15 мм рт.ст. и среднем перфузионном давлении в аорте 60 мм рт.ст. Давление в аорте и левом желудочке регистрировали при помощи тензометрических датчиков Р 50, монитора SP 1405 и регистратора SP 2010 (Gould Statham, США). Показателем интенсивности сократительной функции (ИСФ) левого желудочка служило произведение частоты сокращений сердца на развиваемое давление (разность между систолическим и минимальным диастолическим давлением). Насосную функцию левого желудочка оценивали по величине минутного (сумма коронарного потока и аортального объема) и ударного (отношение минутного объема к частоте сокращений сердца) объемов. Коронарное сопротивление рассчитывали из отношения аортального давления к коронарному потоку.
Протокол опытов. После перфузии сердца по Нийли в течение 15-20 мин регистрировали показатели функции сердца и коронарных сосудов (исходное состояние). Затем осуществляли 5-минутную инфузию РК с постоянной скоростью 4 мл/мин и подвергали сердца глобальной нормотермической (37°C) ишемии в течение 35 мин. За ишемией следовала 5-минутная ретроградная инфузия РК со скоростью 4 мл/мин и реперфузия по Нийли в течение 25 мин.
Действие прототипа (апелина-12, I) и заявляемых пептидов (II, III и IV) изучали на восстановление коронарной, сократительной и насосной функции левого желудочка после 35 мин глобальной ишемии и 30 мин реперфузии. Пептиды (I-IV) растворяли в РК при 37°C до концентрации 140 мкМ. Ранее при изучении дозозавимого эффекта апелина-12 (I) на этой модели было показано, что данная концентрация является оптимальной для восстановления функции сердца и сосудов [5]. Раствор апелина-12 или пептидов (II-IV) вводили в аорту в течение 5 мин с постоянной скоростью 4 мл/мин непосредственно перед глобальной ишемией, после ишемии вначале реперфузии вводили контрольный раствор Кребса без пептидов. В контроле в аорту до и после ишемии вводили раствор Кребса без пептидов.
В таблице 2 суммировано влияние прототипа (апелина-12 (I)) и заявляемых пептидов (II, III и IV) на восстановление показателей, характеризующих восстановление сократительной и насосной функции сердца и функции коронарных сосудов, к концу реперфузии после периода глобальной ишемии.
| Таблица 2. | |||||
| Влияние апелина-12 (I) и заявляемых пептидов (II-IV) на восстановление функции сердца и сосудов при реперфузии после глобальной ишемии. | |||||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Исходное состояние | РК (контроль) | (I) (прототип) | (II) | (III) | (IV) |
| Коронарный поток | 74±3 | 91±4a | 94±4a | 97±2a | 94±2a |
| 16±2 мл/мин | |||||
| Перфузионное давление | 93±1 | 98±1a | 98±1a | 98±1а | 98±1а |
| 61±6 мм рт.ст. | |||||
| Коронарное сопротивление | 125±4 | 108±5a | 106±5a | 103±2a | 105±2a |
| 3,80±0,05 мм рт.ст./мл | |||||
| Систолическое давление | 68±1 | 90±3a | 92±3а | 95±1а | 92±1а |
| 96±1 мм рт.ст. | |||||
| Диастолическое давление | 10±1* | 3±1*a | 2±1*а | -1±1*аб | -1±1*аб |
| -2±1 мм рт.ст. | |||||
| Развиваемое давление | 56±1 | 86±2a | 90±2а | 93±2аб | 89±2а |
| 100±1 мм рт.ст. | |||||
| Частота сокращений сердца | 78±1 | 93±2a | 95±2a | 97±1а | 94±1а |
| 299±2/минИнтенсивность СФ30341±530 мм рт.ст./мин | 44±2 | 80±2а | 89±3аб | 90±3аб | 84±3а |
| Аортальный объем | 0±1 | 64±5а | 73±4а | 84±2абв | 74±2аг |
| 26±3 мл/мин | |||||
| Минутный объем | 26±2 | 75±2а | 82±2аб | 89±2аб | 82±2абг |
| 43±1 мл | |||||
| Ударный объем | 34±2 | 80±3а | 90±3аб | 92±1аб | 87±2аг |
| 141±1 мкл |
Указаны М±m для серий из 6-8 опытов. Пептиды (140 мкМ) вводили перед глобальной ишемией, как указано в разделе "Протокол опытов". В левом столбце (1) приведены абсолютные значения показателей в исходном состоянии. В столбцах 2-6 указано восстановление показателя к окончанию реперфузии в % к исходному значению. * - мм рт.ст. Достоверно отличается (Р<0,05) от: а - контроля, б - прототипа (апелина-12, (I)), в - (II), г - (III).
Из приведенного примера (см. табл.2) видно, что введение любого из пептидов в сердце до ишемии достоверно улучшало восстановление всех показателей по сравнению с контролем. При сравнении действия заявляемых пептидов с прототипом были выявлены следующие особенности.
Под действием заявляемых пептидов не происходило достоверного увеличения показателей функции сосудов сердца (коронарного потока и коронарного сопротивления) по сравнению с таковыми при использовании прототипа. Однако каждый из заявляемых пептидов улучшал восстановление показателей сократительной функции сердца по сравнению с прототипом. В результате введения пептида (II) достоверно увеличивалось восстановление интенсивности сократительной функции; под действием пептида (III) достоверно увеличивалось развиваемое давление и интенсивность сократительной функции и снижалось диастолическое давление; при использовании соединения (IV) достоверно увеличивалось восстановление интенсивности сократительной функции и снижалось диастолическое давление.
Под влиянием заявляемых пептидов происходило также увеличение восстановления показателей насосной функции сердца по сравнению с прототипом. К окончанию реперфузии при использовании пептида (II) наблюдали достоверное увеличение минутного и ударного объема; под действием пептида (III) - достоверное возрастание аортального, минутного и ударного объемов; при введении соединения (IV)-достоверное увеличение минутного и ударного объемов.
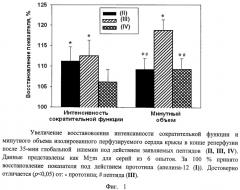
Преимущества заявляемых пептидов при восстановлении функции сердца после ишемии представлены на фиг.1. Видно, что каждый из заявляемых пептидов увеличивал восстановление интенсивности сократительной функции и показателя насосной функции - минутного объема - по сравнению с прототипом. В наибольшей степени защитные эффекты проявлялись при использовании пептида (III).
На основании анализа полученных результатов (табл.2, фиг.1) можно заключить, что эффективность защиты функции сердца от ишемического и реперфузионного повреждения под действием заявляемых пептидов увеличивается в ряду IV<II<III.
Кроме того, заявляемые пептиды (II, III, IV) более устойчивы к действию протеолитических ферментов, чем прототип апелин-12 (I), так как С-концевая часть молекулы пептидов (III, IV) защищена от действия карбоксипептидаз амидной функцией, а N-концевая часть - содержит либо остаток Nα-алкил аминокислоты-Nα-метиларгинина (пептиды II, III), либо NG-нитрогруппу (пептид IV), что повышает устойчивость к действию аминопептидаз. Все приведенные соединения вместо подверженного нежелательному окислению метионина (прототип) содержат норлейцин - природную аминокислоту небелкового происхождения, абсолютно устойчивую к окислению кислородом. Благодаря высокой устойчивости к действию ферментов, пептиды формулы (II, III, IV) могут найти применение в медицине в качестве кардиопротекторных средств.
Заявляемые пептиды малотоксичны, поскольку являются аналогами части эндогенного полипептида апелина, не обладающего токсическими свойствами, и состоит из остатков природных аминокислот, которые обычно присутствуют в организме.
Додекапептиды общей формулыX-Arg(NGY)-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-Z,где X=CH3, Y=Н, Z=ОН для соединения (II),Х=СН3, Y=H, Z=NH2 для соединения (III),X=H, Y=NO2, Z=NH2 для соединения (IV).