Антитела к dr5 и их применения
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описано антитело к DR5 или его антигенсвязывающий фрагмент, включающее тяжелую и легкую цепи, где указанное антитело содержит по меньшей мере одну замену в последовательности полноразмерного антитела 16Е2. Представлена фармацевтическая композиция для лечения рака, содержащая описанное антитело. Предложен способ индукции апоптоза, включающий в себя воздействие на злокачественные клетки млекопитающих описанного антитела или его антигенсвязывающего фрагмента. Предложен способ лечения злокачественной опухоли, включающий в себя введение млекопитающему эффективного количества описанного антитела или его антигенсвязывающего фрагмента. Изобретение расширяет арсенал средств, направленных против рака. 11 н. и 34 з.п. ф-лы, 37 ил., 13 табл., 10 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение в основном относится к антителам к DR5, включая агонистические антитела, и к способам применения таких антител к DR5.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В данной области выявлены различные лиганды и рецепторы, принадлежащие к суперсемейству фактора некроза опухоли (TNF). В число таких лигандов включены фактор некроза опухоли-альфа ("TNF-альфа"), фактор некроза опухоли-бета ("TNF-бета или "лимфотоксин-альфа"), лимфотоксин-бета ("LT-бета"), лиганд CD30, лиганд CD27, лиганд CD40, лиганд OX-40, лиганд 4-1BB, LIGHT, лиганд Apo-1 (также обозначаемый как лиганд Fas или лиганд CD95), лиганд Apo-2 (также обозначаемый как Apo2L или TRAIL), лиганд Apo-3 (также обозначаемый как TWEAK), APRIL, лиганд OPG (также обозначаемый как лиганд RANK, ODF или TRANCE) и TALL-1 (также обозначаемый как BlyS, BAFF или THANK) (см., например, Ashkenazi, Nature Review. 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997) Wallach, Cytokine Reference, Academic Press, 2000, pp.377-411; Locksley et al. Cell, 104:487-501 (2001); Grass and Dower, Blood, 85:3378-3404 (1995); Schmid et al., Proc. Natl. Acad. Sci., 83:1881 (1986); Dealtry et al., Eur. J. Immunol., 17:689 (1987); Pitti et al., J. Biol. Chem., 271:12687-12690 (1996); Wiley et al., Immunity, 3:673-682 (1995); Browning et al., Cell, 72:847-856 (1993); Arrnitage et al. Nature, 357:80-82 (1992), WO 97/01633, опубликованную 16 января 1997 года; WO 97/25428, опубликованную 17 июля 1997 года; Marsters et al., Curr. Biol., 8:525-528 (1998); Chicheportiche et al., Biol. Chem., 272:32401-32410 (1997); Hahne et al., J. Exp. Med., 188:1185-1190 (1998); WO 98/28426, опубликованную 2 июля 1998 года; WO 98/46751, опубликованную 22 октября 1998 года; WO 98/18921, опубликованную 7 мая 1998 года; Moore et al., Science, 285:260-263 (1999); Shu et al., J. Leukocyte Biol., 65:680 (1999); Schneider et al., J. Exp. Med., 189:1747-1756 (1999); Mukhopadhyay et al., J. Biol. Chem., 274:15978-15981 (1999)).
Как правило, индукцию различных видов клеточного ответа, опосредованного такими лигандами семейства TNF, вызывает их связывание со специфичными клеточными рецепторами. Некоторые, но не все, лиганды семейства TNF связываются с "рецепторами смерти" на поверхности клетки и индуцируют посредством их различные виды биологической активности, активируя каспазы или ферменты, приводящие к гибели клетки или осуществляющие каскад реакций апоптоза (Salvesen et al., Cell, 91:443-446 (1997)). В число выявленных к настоящему времени представителей суперсемейства рецепторов TNF входят TNFR1, TNFR2, TACI, GITR, CD27, OX-40, CD30, CD40, HVEM, Fas (также обозначаемый как Apo-1 или CD95), DR4 (также обозначаемый как TRAIL-R1), DR5 (также обозначаемый как Apo-2 или TRAIL-R2), DcR1, DcR2, остеопротегерин (OPG), RANK и Apo-3 (также обозначаемый как DR3 или TRAMP) (см., например, Ashkenazi, Nature Reviews, 2:420-430 (2002); Ashkenazi and Dixit, Science, 281:1305-1308 (1998); Ashkenazi and Dixit, Curr. Opin. Cell Biol., 11:255-260 (2000); Golstein, Curr. Biol., 7:750-753 (1997); Wallach, Cytokine Reference. Academic Press, 2000, pp.377-411; Locksley et al. Cell, 104:487-501 (2001); Grass and Dower, Blood, 85:3378-3404 (1995); Hohman et al., J. Biol. Chem., 264:14927-14934 (1989); Brockhaus et al., Proc. Natl. Acad. Sci., 87:3127-3131 (1990); EP 417563, опубликованную 20 марта 1991 года; Loetscher et al., Cell, 61:351 (1990); Schall et al., Cell, 61:361 (1990); Smith et al., Science, 248:1019-1023 (1990); Lewis et al., Proc. Natl. Acad. Sci., 88:2830-2834 (1991); Goodwin et al., Mol. Cell. Biol., 11:3020-3026 (1991); Stamenkovic et al., EMBO J., 8:1403-1410 (1989); Mallett et al., EMBO J., 9:1063-1068 (1990); Anderson et al., Nature, 390:175-179 (1997); Chicheportiche et al., J. Biol. Chem., 272:32401-32410 (1997); Pan et al., Science, 276:111-113 (1997); Pan et al., Science, 277:815-818 (1997); Sheridan et al., Science, 277:818-821 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997); Marsters et al. Curr. Biol., 7:1003-1006 (1997); Tsuda et al., BBRC, 234:137-142 (1997); Nocentini et al., Proc. Natl. Acad. Sci., 94:6216-6221 (1997); vonBulow et al., Science, 278:138-141 (1997)).
Большинство этих представителей семейства рецепторов TNF обладает обычной структурой рецепторов клеточной поверхности, включая внеклеточную, трансмембранную и внутриклеточную области, тогда как у других рецепторов, встречающихся в природе в виде растворимых белков, отсутствуют трансмембранный и внутриклеточный домены. Внеклеточный участок типичных TNFR, начиная с NH2-конца, содержит повторяющийся характерный участок аминокислотной последовательности из множества богатых цистеином доменов (CRD).
Несколько лет назад как представитель семейства цитокинов TNF был идентифицирован лиганд, обозначаемый как Apo-2L или TRAIL (см., например, Wiley et al., Immunity, 3:673-682 (1995); Pitti et al., J. Biol. Chem., 271:12697-12690 (1996); WO 97/01633; WO 97/25428; патент США №5763223, выданный 9 июня 1998 года; патент США №6284236, выданный 4 сентября 2001 года). Полноразмерная природная последовательность полипептида Apo2L/TRAIL человека представляет собой трансмембранный белок II типа, длиной в 281 аминокислоту. Некоторые клетки могут продуцировать природную растворимую форму полипептида посредством ферментативного отщепления внеклеточной области полипептида (Mariani et al., J. Cell. Biol., 137:221-229 (1997)). Кристаллографические исследования растворимых форм Apo2L/TRAIL выявили гомотримерную структуру, сходную со структурами TNF и других родственных белков (Hymowitz et al., Molec. Cell, 4:563-571 (1999); Cha et al., Immunity, 11:253-261 (1999); Mongkolsapaya et al., Nature Structural Biology, 6:1048 (1999); Hymowitz et al., Biochemistry, 39:633-644 (2000)). Однако было обнаружено, что в отличие от других представителей семейства TNF, Apo2L/TRAIL обладает уникальным структурным свойством в том, что три остатка цистеина (в положении 230 каждой субъединицы в гомотримере) вместе координируют атом цинка и что связывание цинка важно для стабильности и биологической активности тримера (Hymowitz et al., выше; Bodmer et al., J. Biol. Chem., 275:20632-20637 (2000)).
В литературе было описано, что Apo2L/TRAIL может играть роль в регуляции иммунной системы, в том числе при аутоиммунных заболеваниях, таких как ревматоидный артрит (см., например, Thomas et al., J. Immunol, 161:2195-2200 (1998); Johnsen et al., Cytokine, 11:664-672 (1999); Griffith et al., J. Exp. Med., 189:1343-1353 (1999); Song et al., J. Exp. Med., 191:1095-1103 (2000)).
Также было описано, что растворимые формы Apo2L/TRAIL индуцируют апоптоз во множестве раковых клеток, включая опухоли толстой кишки, легких, молочной железы, предстательной железы, мочевого пузыря, почек, яичников и головного мозга, а также меланому, лейкоз и множественную миелому (см., например, Wiley et al., выше; Pitti et al., выше; патент США № 6030945, выданный 29 февраля 2000 года; патент США № 6746668, выданный 8 июня 2004 года; Rieger et al., FEBS Letters, 427:124-128 (1998); Ashkenazi et al., J. Clin. Invest., 104:155-162 (1999); Walczak et al., Nature Med., 5:157-163 (1999); Keane et al., Cancer Research, 59:734-741 (1999); Mizutani et al., Clin. Cancer Res., 5:2605-2612 (1999); Gazitt, Leukemia, 13:1817-1824 (1999); Yu et al., Cancer Res., 60:2384-2389 (2000); Chinnaiyan et al., Proc. Natl. Acad. Sci., 97:1754-1759 (2000)). Исследования на моделях опухолей на мышах in vivo позволили предположить, что Apo2L/TRAIL, отдельно или в сочетании с химиотерапией или лучевой терапией, может оказывать значительные противоопухолевые эффекты (см., например, Ashkenazi et al., выше; Walzcak et al., выше; Gliniak et al., Cancer Res., 59:6153-6158 (1999); Chinnaiyan et al., выше; Roth et al., Biochem. Biophys. Res. Comm., 265:1999 (1999); заявка PCT США/00/15512; заявка PCT США/01/23691). В отличие от многих типов злокачественных клеток у большинства обычных типов клеток человека наблюдают устойчивость к индукции апоптоза определенными рекомбинантными формами Apo2L/TRAIL (Ashkenazi et al., выше; Walzcak et al., выше). Jo et al. описывали, что меченная полигистидином растворимая форма Apo2L/TRAIL индуцировала апоптоз in vitro в нормальных выделенных гепатоцитах человека, но не в не принадлежащих человеку гепатоцитах (Jo et al., Nature Med., 6:564-567 (2000); см. также Nagata, Nature Med., 6:502-503 (2000)). Полагают, что определенные препараты рекомбинантного Apo2L/TRAIL могут различаться по биохимическим свойствам и биологической активности в отношении патологических клеток по сравнению с нормальными, в зависимости, например, от наличия или отсутствия молекулы-метки, содержания цинка и % содержания тримера (см., Lawrence et al., Nature Med., Letter to the Editor, 7:383-385 (2001); Qin et al., Nature Med., Letter to the Editor, 7:385-386 (2001)).
Обнаружено, что Apo2L/TRAIL связывает, по меньшей мере, пять различных рецепторов. По меньшей мере, два из рецепторов, связывающихся с Apo2L/TRAIL, содержат функциональный цитоплазматический домен смерти. Один такой рецептор был обозначен как "DR4" (а альтернативно как TR4 или TRAIL-R1) (Pan et al., Science, 276:111-113 (1997); см. также WO 98/32856, опубликованную 30 июля 1998 года; WO 99/37684, опубликованную 29 июля 1999 года; WO 00/773349, опубликованную 7 декабря 2000 года; патент США №6433147, выданный 13 августа 2002 года; патент США №6461823, выданный 8 октября 2002 года, и патент США №6342383, выданный 29 января 2002 года).
Другой такой рецептор для Apo2L/TRAIL был обозначен как DR5 (также он был альтернативно обозначен как Apo-2; TRAIL-R или TRAIL-R2, TR6, Tango-63, hAPO8, TRICK2 или KILLER) (см., например, Sheridan et al., Science, 277:818-821 (1997), Pan et al., Science, 277:815-818 (1997), WO 98/51793, опубликованную 19 ноября 1998 года; WO 98/41629, опубликованную 24 сентября 1998 года; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованную 20 августа 1998 года; EP870827, опубликованную 14 октября 1998 года; WO 98/46643, опубликованную 22 октября 1998 года; WO 99/02653, опубликованную 21 января 1999 года; WO 99/09165, опубликованную 25 февраля 1999 года; WO 99/11791, опубликованную 11 марта 1999 года; патент США №2002/0072091, выданный 13 августа 2002 года; патент США №2002/0098550, выданный 7 декабря 2001 года; патент США №6313269, выданный 6 декабря 2001 года; патент США №2001/0010924, выданный 2 августа 2001 года; патент США №2003/01255540, выданный 3 июля 2003 года; патент США №2002/0160446, выданный 31 октября 2002 года; патент США №2002/0048785, выданный 25 апреля 2002 года; патент США №6342369, выданный в феврале 2002 года; патент США №6569642, выданный 27 мая 2003 года; патент США №6072047, выданный 6 июня 2000 года; патент США №6642358, выданный 4 ноября 2003 года; патент IS 6743625, выданный 1 июня 2004 года). Описано, что, подобно DR4, DR5 содержит три богатых цистеином домена в своей внеклеточной части и один цитоплазматический домен смерти и способен передавать сигнал апоптоза при связывании лиганда (или при связывании молекулы, такой как антитело-агонист, воспроизводящей активность лиганда). Кристаллическая структура комплекса, формируемого Apo-2L/TRAIL и DR5, описана в Hymowitz et al., Molecular Cell, 4:563-571 (1999).
При связывании лиганда DR4 и DR5 способны запускать апоптоз независимо от вовлечения и активации инициатора апоптоза, каспазы-8, посредством содержащей домен смерти вспомогательной молекулы, которую обозначают как FADD/Mort1 (Kischkel et al., Immunity, 12:611-620 (2000); Sprick et al., Immunity, 12:599-609 (2000); Bodmer et al., Nature Cell Biol., 2:241-243 (2000)). В частности, DR5 передает сигнал апоптоза через "внешний по отношению к клетке" путь, независимый от опухолевого супрессорного гена p53 (Ashkenazi and Dixit, Science 281:1305-8 (1998); Ashkenazi, Nat. Rev. Cancer 2:420-30 (2002)). Активация этого пути включает в себя формирование воздействия индуцирующего смерть сигнального комплекса (DISC) на цитоплазматический домен смерти активированного рецептора. Сначала адаптерная молекула FADD связывается с DR5 посредством гомофильного взаимодействия доменов смерти (Kischkel et al., выше, Sprick et al., выше, Bodmer et al., выше). Затем FADD привлекает инициирующие апоптоз протеазы каспазу-8 и каспазу-10, опосредуя их активацию посредством индуцированного сближения. Каспаза-9 и каспаза-10 претерпевают самопроцессинг с высвобождением растворимых активных субъединиц каспаз в цитоплазму, где они собираются и расщепляют эффекторные каспазы, такие как каспаза-3 и каспаза-7. Расщепление приводит к активации эффекторных каспаз, осуществляющих клеточную программу апоптоза (Thornberry and Lazebnik, Science 281:1312-6 (1998)).
Было описано, что Apo2L/TRAIL также связывает те рецепторы, которые обозначены как DcR1, DcR2 и OPG, как предполагают, функционирующие, в качестве ингибиторов, а не передатчиков сигнала (например, см., DcR1 (также обозначаемый как TRID, LIT или TRAIL-R3) (Pan et al., Science, 276:111-113 (1997); Sheridan et al., Science, 277:818-821 (1997); McFarlane et al., J. Biol. Chem., 272:25417-25420 (1997); Schneider et al., FEBS Letters, 416:329-334 (1997); Degli-Esposti et al., J. Exp. Med., 186:1165-1170 (1997) и Mongkolsapaya et al., J. Immunol., 160:3-6 (1998)); DcR2 (также называемый TRUNDD или TRAIL-R4) (Marsters et al., Curr. Biol., 7:1003-1006 (1997); Pan et al., FEBS Letters, 424:41-45 (1998); Degli-Esposti et al., Immunity, 7:813-820 (1997)) [Simonet et al., выше], а также OPG. В отличие от DR4 и DR5, рецепторы DcR1 и DcR2 не передают сигнал апоптоза.
В литературе были описаны определенные антитела, связывающиеся с рецепторами DR4 и/или DR5. Например, антитела к DR4, направленные к рецептору DR4 и обладающие агонистической или апоптотической активностью в определенных клетках млекопитающих, описаны, например, в WO 99/37684, опубликованной 29 июля 1999 года; WO 00/73349, опубликованной 12 июля 2000 года; WO 03/066661, опубликованной 14 августа 2003 года. См. также, например, Griffith et al., J. Immunol., 162:2597-2605 (1999); Chuntharapai et al., J. Immunol., 166:4891-4898 (2001); WO 02/097033, опубликованную 2 декабря 2002 года; WO 03/042367, опубликованную 22 мая 2003 года; WO 03/038043, опубликованную 8 мая 2003 года; WO 03/037913, опубликованную 8 мая 2003 года. Также были описаны некоторые антитела против DR5, например, см. WO 98/51793, опубликованную 8 ноября 1998 года; Griffith et al., J. Immunol., 162:2597-2605 (1999); Ichikawa et al., Nature Med., 7:954-960 (2001); Hylander et al., "An Antibody to DR5 (TRAIL-Receptor 2) Suppresses the Growth of Patient Derived Gastrointestinal Tumors Grown in SCID mice", Abstract, 2d International Congress on Monoclonal Antibodies in Cancers, Aug. 29-Sept. 1, 2002, Banff, Alberta, Canada; WO 03/038043, опубликованную 8 мая 2003 года; WO 03/037913, опубликованную 8 мая 2003 года. Кроме того, были описаны некоторые антитела, обладающие перекрестной реактивностью в отношении обоих рецепторов DR4 и DR5 (см., например, патент США №6252050, выданный 26 июня 2001 года).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам к DR5, которые способны к специфическому связыванию с DR5 человека и/или способны к регуляции биологической активности, ассоциированной с DR5 и/или его лигандом(ами), в частности апоптоза, и, таким образом, пригодны для лечения различных заболеваний и патологических состояний, включая злокачественную опухоль или связанные с иммунной системой заболевания.
В одном из аспектов изобретение относится к антителу к DR5, несущему, по меньшей мере, одну мутацию в тяжелой и/или легкой цепи полноразмерного антитела 16E2 (SEQ ID NO: 11 и 13, соответственно), или его фрагменту, где антитело или фрагмент антитела демонстрирует, по меньшей мере, такую же аффинность к DR5 и/или проявляет, по меньшей мере, такую же биологическую активность и/или эффективность, как антитело 16E2. В конкретном варианте осуществления антитело или фрагмент антитела связываются по существу с тем же эпитопом, что и полноразмерное антитело 16E2. В другом варианте осуществления антитело к DR5 проявляет большую аффинность к DR5, чем полноразмерное антитело 16E2, и/или демонстрирует увеличенную биологическую активность и/или увеличенную эффективность по отношению к полноразмерному антителу 16E2. В еще одном варианте осуществления антитела и фрагменты антител к DR5 по настоящему изобретению демонстрируют, по меньшей мере, такую же аффинность к DR5 и/или проявляют, по меньшей мере, такую же биологическую активность и/или эффективность, как и антитело к DR5 с одной цепью Fc 16E2, описанное в WO 98/51793.
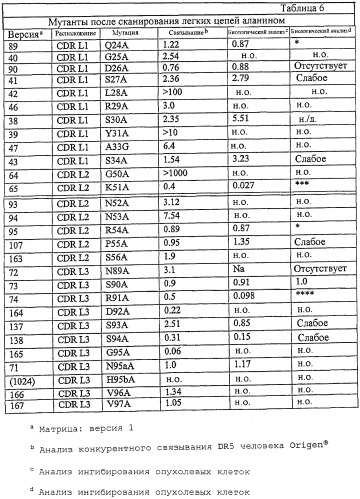
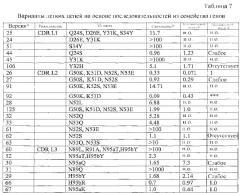
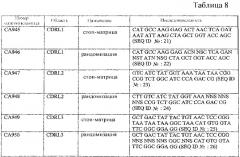
В одном из вариантов осуществления антитело к DR5 содержит тяжелую и/или легкую цепь, по меньшей мере, с одной заменой из перечисленных в любой из таблиц с 1 по 7 и 9-12 или их фрагмент.
В другом варианте осуществления антитело к DR5 несет одну или несколько мутаций в каркасной области вариабельного домена тяжелой цепи антитела 16E2.
В еще одном варианте осуществления антитело к DR5 несет мутацию в каркасной области, выбранную из группы, состоящей из Q6E, V11L, E12V, R13Q и K105Q.
В дополнительном варианте осуществления антитело к DR5 несет все мутации в каркасной области Q6E, V11L, E12V, R13Q и K105Q.
В еще одном дополнительном варианте осуществления антитело к DR5 несет, по меньшей мере, одну мутацию в тяжелой цепи (SEQ ID NO: 11) полноразмерного антитела 16E2 или его фрагмента.
В другом варианте осуществления антитело к DR5 несет, по меньшей мере, одну мутацию в аминокислотной последовательности SEQ ID NO: 11 или ее фрагменте, выбранную из группы, состоящей из T28A, G33A, M34L, M34A, M34I, M34S, N53Q, N53Y и L102Y.
В другом варианте осуществления антитело к DR5 несет, по меньшей мере, одну из мутаций G99A и R100A в аминокислотной последовательности SEQ ID NO: 11 или ее фрагменте.
В еще одном варианте осуществления антитело к DR5 в аминокислотной последовательности SEQ ID NO: 11 или ее фрагменте несет набор мутаций, выбранный из группы, состоящей из (i) N53Q, L102Y; (ii) M34L, N53Q, L102Y; (iii) N53Y, L102Y; (iv) M34L, N53Y, L102Y; (v) G33A, N53Q, L102Y; (vi) M34L, N53Y, L102Y; (vii) G33A, N53Q, L102Y; (viii) G33A, N53Y, L102Y; (ix) T28A, N53Q, L102Y и (x) T28A, N53Y, L102Y.
В дополнительном варианте осуществления антитело к DR5 несет, по меньшей мере, одну мутацию в легкой цепи (SEQ ID NO: 13) полноразмерного антитела 16E2 или его фрагменте.
В конкретном варианте осуществления легкая цепь представляет собой лямбда-цепь.
В другом конкретном варианте осуществления мутация в легкой цепи находится в L1 CDR.
В дополнительном варианте осуществления мутация в легкой цепи в аминокислотной последовательности SEQ ID NO: 13 выбрана из группы, состоящей из Q24A, Q24S, G25A, D26E, S27A, L28A, R29A, S30A, Y31A, Y31K, Y32H, A33G, S34A и S34Y.
В еще одном дополнительном варианте осуществления мутация в легкой цепи в аминокислотной последовательности SEQ ID NO: 13 выбрана из группы, состоящей из (i) Q24S, D26E, Y31K, S34Y и (ii) D26E, Y31K.
В другом варианте осуществления мутация в легкой цепи находится в L2 CDR.
Например, таким образом, мутацию можно выбрать из группы, состоящей из G50A, G50K, G50S, K51D, N52A, N52S, N52L, N52Q, N53A, N53E, N53Q, N53S, P55A и S56A в аминокислотной последовательности SEQ ID NO: 13.
В другом варианте осуществления антитело может нести набор мутаций, выбранных из группы, состоящей из (i) G50K, K52S, N53E; (ii) G50S, K51D, N52S, N53E; (ii) N52S, N53E и (iv) N52Q, N53S в аминокислотной последовательности SEQ ID NO: 13.
В дополнительном варианте осуществления мутация в легкой цепи находится в L3 CDR.
В еще одном дополнительном варианте осуществления антитело несет, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N89A, N89L, N89Q, R91A, S93A, N95aA, N95aT, N95aQ, H95bA, N95bY, V96A, V97A в SEQ ID NO: 13.
Альтернативно антитело к DR5 может нести набор мутаций, выбранных из группы, состоящей из (i) N89L, R91A, N95aT, H95bY и (ii) N95aT, H95bY в последовательности SEQ ID NO: 13.
В дополнительном варианте осуществления антитело к DR5 несет набор мутаций в легкой цепи, выбранный из группы, состоящей из (i) Q24S, G50K, K51D, H95bY; (ii) Q24S, K51A, D92S, S93Y и (iii) Q24S, K51A, R91A в аминокислотной последовательности SEQ ID NO: 13, и может дополнительно нести набор мутаций в тяжелой цепи, выбранный из группы, состоящей из (i) M34L, N53Q, L102Y; (ii) M34L, N53Y, L102Y; (iii) G33A, N53Q, L102Y; (iv) G33A, N53Y, L102Y; (v) M34L, N53Q, L102Y; (vi) M34L, N53Y, L103Y; (vii) G33A, N53Q, L102Y; (viii) G33A, N53Y, L102Y и (ix) T28A, N53Q, L102Y в аминокислотной последовательности SEQ ID NO: 11, и, необязательно, набор мутаций в каркасной области, перечисленных в таблице 5.
В конкретном варианте осуществления антитело к DR5 несет следующие мутации: G33A, N53Q, L102Y в последовательности SEQ ID NO: 11 и Q24S, K51A, R91A в последовательности SEQ ID NO: 13, и может дополнительно нести, по меньшей мере, одну мутацию в каркасной области, которая может представлять собой, например, по меньшей мере, один из остатков 6, 11, 12, 13 и 105 SEQ ID NO: 11.
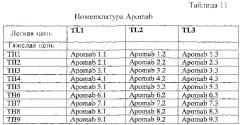
В конкретном варианте осуществления антитело к DR5 выбрано из группы, состоящей из Apomab 1.1, 2.1, 3.1, 4.1, 5.1, 6.1, 7.1, 8.1, 9.1, 1.2, 2.2, 3.2, 4.2, 5.2, 6.2, 7.2, 8.2, 9.2, 1.3, 2.2, 3.3, 4.3, 5.3, 6.3, 7.3, 8.3 и 9.3.
В конкретном варианте осуществления антитело к DR5 выбрано из группы, состоящей из Apomab 5.2, 5.3, 6.2, 6.3, 7.2, 7.3, 8.3 и 25.3.
В еще одном конкретном варианте осуществления антитело к DR5 представляет собой Apomab 7.3 или Apomab 8.3, особенно Apomab 7.3.
В еще одном дополнительном варианте осуществления антитело к DR5 представляет собой фрагмент антитела, который можно выбрать из группы, состоящей из фрагментов Fab, Fab', F(ab')2 и Fv, димерных антител, одноцепочечных молекул антител и полиспецифических антител, сформированных из фрагментов антител.
В других вариантах осуществления антитело может представлять собой одноцепочечное антитело.
Например, антитела к DR5 могут обладать активностью в отношении злокачественных опухолей, например, такой, что они могут обладать способностью активировать или стимулировать апоптоз в злокачественных клетках.
Злокачественная опухоль включает в себя, например, карциному, лимфому, бластому, саркому и лейкоз.
Более конкретные примеры злокачественной опухоли включают плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких (NSCLC), неходжкинскую лимфому, бластому, желудочно-кишечный рак, рак почек, рак яичников, рак печени, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, рак поджелудочной железы, карциному эндометрия, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному и рак головы и шеи.
Конкретные группы злокачественных опухолей включают в себя рак легких (например, немелкоклеточную карциному легких - NSCLC) или аденокарциному, которая может представлять собой, например, колоректальную аденокарциному, аденокарциному поджелудочной железы или метастатическую аденокарциному. Также включены злокачественные опухоли гематологического происхождения.
В объем настоящего документа включены химерные, гуманизированные антитела и антитела человека, такие как антитела, опосредующие обусловленную антителами клеточную цитотоксичность (ADCC).
В предпочтительном варианте осуществления антитело к DR5 представляет собой Apomab 7.3 или Apomab 8.3 или его фрагмент.
Антитела могут находиться в димерной форме и/или в форме, перекрестно связанной, например, с Fc-областью IgG к антителам человека.
В других вариантах осуществления антитела к DR5 по настоящему документу слиты с последовательностью эпитопной метки.
В другом аспекте изобретение относится к химерной молекуле, содержащей антитело или фрагмент антитела к DR5 по настоящему документу, слитые с гетерологичной аминокислотной последовательностью, где гетерологичная аминокислотная последовательность, например, может содержать иммуноглобулиновую последовательность, такую как Fc-область IgG к антителам человека.
В еще одном аспекте изобретение относится к выделенным молекулам нуклеиновой кислоты, кодирующим антитела или фрагменты антител к DR5 по настоящему документу, векторам, несущим такие молекулы нуклеиновой кислоты, клеткам-хозяевам, несущим такие молекулы нуклеиновой кислоты, и способам получения антител и фрагментов антител по настоящему документу.
Изобретение дополнительно относится к композиции, содержащей антитело к DR5, как определено выше в настоящем документе, и носитель.
Носитель может представлять собой фармацевтически приемлемый носитель, а композиция может дополнительно содержать дополнительное противораковое средство и/или дополнительное антитело к DR5.
В дополнительном аспекте изобретение относится к способу индукции апоптоза, включающему в себя воздействие на злокачественные клетки млекопитающих антитела к DR5, как определено выше в настоящем документе.
В еще одном дополнительном аспекте изобретение относится к способу лечения злокачественной опухоли, включающему в себя введение млекопитающему эффективного количества антитела к DR5, как определено выше.
Во всех аспектах субъект может представлять собой пациента-человека, а злокачественная опухоль может представлять собой любую злокачественную опухоль, включая злокачественные опухоли, перечисленные выше.
В дополнительном аспекте изобретение относится к промышленному изделию, содержащему контейнер и композицию, содержащуюся в указанном контейнере, где композиция содержит антитело к DR5 по настоящему изобретению. Промышленное изделие может дополнительно содержать инструкции по применению антитела к DR5 in vitro или in vivo. В предпочтительном варианте осуществления инструкции относятся к лечению злокачественной опухоли.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 приведена нуклеотидная последовательность кДНК лиганда Apo-2 человека (SEQ ID NO: 2) и выведенная из нее аминокислотная последовательность (SEQ ID NO: 1). "N" в положении нуклеотида 447 (в SEQ ID №2) используют для указания того, что нуклеотидное основание может представлять собой "T" или "G".
На фиг.2A-2C приведена нуклеотидная последовательность кДНК (SEQ ID NO: 4) полноразмерного рецептора DR4 человека и полученная из нее аминокислотная последовательность (SEQ ID NO: 3). О соответствующих нуклеотидной и аминокислотной последовательностях рецептора DR4 человека также сообщалось Pan et al., Science, 276:111 (1997).
На фиг.3A-3C приведена последовательность DR5 человека из 411 аминокислот рецептора (SEQ ID NO: 5), как опубликовано в WO 98/51793 19 ноября 1998 года, и кодирующая нуклеотидная последовательность (SEQ ID NO: 6).
На фиг.4A-4C приведена последовательность DR5 человека из 440 аминокислот (SEQ ID NO: 7) и кодирующая нуклеотидная последовательность (SEQ ID NO: 8), как также опубликовано в WO 98/35986 20 августа 1998 года.
На фиг.5 приведена нуклеотидная последовательность одноцепочечного антитела к DR5 16E2 (scFv 16E2) (SEQ ID NO: 9).
На фиг.6 приведена аминокислотная последовательность одноцепочечного антитела к DR5 16E2 (scFv 16E2) (SEQ ID NO: 10), где показаны сигнальная последовательность и CDR тяжелой и легкой цепей.
На фиг.7 приведена аминокислотная последовательность тяжелой цепи полноразмерного антитела 16E2 (SEQ ID NO: 11).
На фиг.8 приведена нуклеотидная последовательность тяжелой цепи полноразмерного антитела 16E2 (SEQ ID NO: 12).
На фиг.9 приведена аминокислотная последовательность легкой цепи полноразмерного антитела 16E2 (SEQ ID NO: 13).
На фиг.10 приведена нуклеотидная последовательность легкой цепи полноразмерного антитела 16E2 (SEQ ID NO: 14).
На фиг.11A и B приведена последовательность плазмиды pDR1 (SEQ ID NO: 15, 5391 п.н.) для экспрессии легких цепей иммуноглобулинов. pDR1 содержит последовательности, кодирующие не относящееся к изобретению антитело, легкую цепь гуманизированного антитела к CD3 (Shalaby et al., J. Exp. Med. 175:217-225 (1992)), старт- и стоп-кодоны которого указаны жирным шрифтом и подчеркнуты.
На фиг.12A и B приведена последовательность плазмиды pDR2 (SEQ ID NO: 16) для экспрессии тяжелых цепей иммуноглобулинов. pDR2 содержит последовательности, кодирующие не относящееся к изобретению антитело, тяжелую цепь гуманизированного антитела к CD3 (Shalaby et al., выше), старт- и стоп-кодоны которого указаны жирным шрифтом и подчеркнуты.
На фиг.13 приведена нуклеотидная последовательность тяжелой цепи Apomab 7.3 (SEQ ID NO: 17).
На фиг.14 приведена аминокислотная последовательность тяжелой цепи Apomab 7.3 (SEQ ID NO: 18).
На фиг.15 приведена нуклеотидная последовательность легкой цепи Apomab 7.3 (SEQ ID NO: 19).
На фиг.16 приведена аминокислотная последовательность легкой цепи Apomab 7.3 (SEQ ID NO: 20).
На фиг.17A и B приведено выравнивание тяжелых цепей 16E2 и Apomab 7.3.
На фиг.18 приведено выравнивание легких цепей 16E2 и Apomab 7.3.
Фиг.19 представляет собой модель гомологии для тяжелой цепи антитела к DR5.
Фиг.20 представляет собой модель гомологии для легкой цепи антитела к DR5.
На фиг.21 показана противораковая активность одной интраперитонеальной (и/п) дозы Apomab 5.3, 6.3 и 8.3 по сравнению с полноразмерным антителом 16E2 (версия 1) в модели рака толстой кишки человека у бестимусной мыши "nude" с ксенотрансплантатом Colo205.
На фиг.22 показана противораковая активность одной и/п дозы Apomab 5.2, 6.2, 5.3, 7.2 и 7.3 по сравнению с полноразмерным антителом 16E2 (версия 1) в модели рака толстой кишки человека у бестимусной мыши "nude" с ксенотрансплантатом Colo205.
На фиг.23 показана противораковая активность одной и/п дозы Apomab 5.2, 7.3 и 8.3 по сравнению с полноразмерным антителом 16E2 (версия 1) в модели рака толстой кишки человека у бестимусной мыши "nude" с ксенотрансплантатом Colo205.
На фиг.24 показана противораковая активность Apomab 23.3 и 25.3 по сравнению с Apomab 7.3 в модели рака толстой кишки человека у бестимусной мыши "nude" с ксенотрансплантатом Colo205.
На фиг.25 показана противораковая активность Apomab 7.3, полученного из стабильной клеточной линии, по сравнению с транзиторной клеточной линией в модели рака толстой кишки человека у бестимусной мыши "nude" с ксенотрансплантатом Colo205.
На фиг.26 показана противораковая активность Apomab 7.3 отдельно и в сочетании с CPT-11 в модели рака легких на ксенотрансплантате HCT15.
На фиг.27 показана противораковая активность Apomab 7.3 отдельно и в сочетании с CPT-11 в модели саркомы человека на ксенотрансплантате LS180.
На фиг.28 показана противораковая активность Apomab 7.3 отдельно и в сочетании с RITUXAN® (ритуксимаб) в модели неходжкинской лимфомы у мышей SCID CB17 ICR с ксенотрансплантатом BJAB.
На фиг.29 показана противораковая активность Apomab 7.3 отдельно и в сочетании с гемцитабином в модели аденокарциномы поджелудочной железы человека у бестимусных мышей "nude" с ксенотрансплантатом BxPC3.
На фиг.30 показана противораковая активность Apomab 7.3 отдельно и в сочетании с карбоплатином и таксолом в модели рака легких человека на ксенотрансплантате H460.
На фиг.31 показана противораковая активность Apomab 7.3 отдельно и в сочетании с карбоплатином и таксолом в модели рака легких человека на ксенотрансплантате H2122.
На фиг.32 приведена кривая доза-ответ Apomab 7.3 в модели рака легких человека на ксенотрансплантате H2122.
На фиг.33 показана противораковая активность Apomab 23.3 и 25.3 по сравнению с Apomab 7.3 в модели рака толстой кишки человека на ксенотрансплантате Colo205.
На фиг.34 приведены средний рост опухоли и диаграмма Каплана-Майера для Apo2L.0 отдельно, Apomab 7.3 отдельно и различных сочетаний по отношению к ксенотрансплантатам карциномы толстой кишки Colo205 у мышей "nude".
На фиг.35 и 36 приведены средний рост опухоли и диаграмма Каплана-Майера для Apo2L.0 отдельно, Apomab 7.3 отдельно и различных сочетаний по отношению к модели немелкоклеточной карциномы легких (NSCLC) человека у бестимусных мышей "nude" с ксенотрансплантатом клеток SKMES-I.
На фиг.37 приведены средний рост опухоли и диаграмма Каплана-Майера для Apo2L.0 отдельно, Apomab 7.3 отдельно и различных сочетаний в модели карциномы толстой кишки человека на ксенотрансплантате Colo205.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
I. Определения
Термины "лиганд Apo-2", "Apo-2L", "Apo2L", "лиганд Apo-2/TRAIL" и "TRAIL" в настоящем документе применяют взаимозаменяемо для обозначения полипептидной последовательности, содержащей аминокислотные остатки 114-281, включительно, 95-281, включительно, остатки 92-281, включительно, остатки 91-281, включительно, остатки 41-281, включительно, остатки 39-281, включительно, остатки 15-281, включительно, или остатки 1-281, включительно, аминокислотной последовательности, приведенной на фиг.1 (SEQ ID NO: 1), а также биологически активных фрагментов, делеционных, инсерционных и/или замещенных вариантов указанных выше последовательностей. В одном из вариантов осуществления полипептидная последовательность содержит остатки 114-281 из фиг.1 (SEQ ID NO: 1). Необязательно полипептидная последовательность содержит остатки 92-281 или остатки 91-281 из фиг.1 (SEQ ID NO: 1). Полипептиды Apo-2L может кодировать природная нуклеотидная последовательность, приведенная на фиг.1 (SEQ ID NO: 2). Необязательно кодон, кодирующий остаток Pro119 (фиг.1; SEQ ID NO: 2), может представлять собой "CCT" или "CCG". Необязательно фрагменты или варианты являются биологически активными и обладают, по меньшей мере, приблизительно 80% идентичностью аминокислотных последовательностей, или, по меньшей мере, приблизительно 90% идентичностью последовательностей, или, по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичностью последовательностей с любой из указанных выше последовательностей. Определение включает в себя заместительные варианты лиганда Apo-2, в которых, по меньшей мере, одна из его природных аминокислот замещена другой аминокислотой, такой как аланиновый остаток. Определение также включает в себя природную последовательность лиганда Apo-2, выделенную из источника лиганда Apo-2 или полученную рекомбинантными и/или синтетическими способами. Лиганд Apo-2 по изобретению включает в себя полипептиды, обозначаемые как лиганд Apo-2 или TRAIL, описанные в WO 97/01633, опубликованной 16 января 1997 года, WO 97/25428, опубликованной 17 июля 1997 года, WO 99/36535, опубликованной 22 июля 1999 года, WO 01/00832, опубликованной 4 января 2001 года, WO02/09755, опубликованной 7 Февраля 2002 года, WO 00/75191, опубликованной 14 декабря 2000 года, и в патенте США №6030945, выданном 29 февраля 2000 года. Термины, как правило, используют для обозначения форм лиганда Apo-2, которые включают в себя мономерные, димерные, тримерные, гексамерные или высоко олигомерные формы полипептида. Если не указано иначе, при нумерации аминокислотных остатков, указанных в последовательности Apo-2L, используют нумерацию в соответствии с фиг.1 (SEQ ID NO: 1).
"Рецептор лиганда Apo-2" включает в себя рецепторы, обозначаемые в данной области как "DR4" и "DR5", полинуклеотидные и полипептидные последовательности которых показаны на фиг.2A-2C (SEQ ID NO: 4 и 3) и 3A-3C (SEQ ID NO: 6 и 5), соответственно. У Pan et al. описан представитель семейства рецептора TNF, обозначаемый как "DR4" (Pan et al., Science, 276:111-113 (1997); также см. WO 98/32856, опубликованную 30 июля 1998 года; WO 99/37684, опубликованную 29 июля 1999 года; WO 00/73349, опубликованную 7 декабря 2000 года; патент США №6433147, выданный 13 августа 2002 года; патент США №6461823, выданный 8 октября 2002 года, и патент США №6342383, выданный 29 января 2002 года). У Sheridan et al., Science, 277:818-821 (1997), и Pan et al., Science, 277:815-818 (1997), описан другой рецептор для Apo2L/TRAIL (также см., WO 98/51793, опубликованную 19 ноября 1998 года; WO 98/41629, опубликованную 24 сентября 1998 года). Этот рецептор обозначают как DR5 (этот рецептор также альтернативно обозначают как Apo-2; TRAIL-R, TR6, Tango-63, hAPO8, TRICK2 или KILLER; Screaton et al., Curr. Biol., 7:693-696 (1997); Walczak et al., EMBO J., 16:5386-5387 (1997); Wu et al., Nature Genetics, 17:141-143 (1997); WO 98/35986, опубликованная 20 августа 1998 года; EP 870827, опубликованный 14 октября 1998 года; WO 98/46643, опубликованная 22 октября 1998 года; WO 99/02653, опубликованная 21 января 1999 года; WO 99/09165, опубликованная 25 февраля 1999 года; WO 99/11791, опубликованная 11 марта 1999 года; US 2002/0072091, опубликованная 13 августа 2002 года; US 2002/0098550, опубликованная 7 декабря 2001 года; патент США №6313269, выданный 6 декабря 2001 года; US 2001/0010924, опубликованная 2 августа 2001 года; US 2003/01255540, опубликованная 3 июля 2003 года; US 2002/0160446, опубликованная 31 октября 2002 года, US 2002/0048785, опубликованная 25 апреля 2002 года; патент США №6569642, выданный 27 мая 2003 года, патент США №6072047, выданный 6 июня 2000 года, патент США №6642358, выданный 4 ноября 2003 года). Как описано выше, другие рецепторы для Apo-2L включают в себя DcR1, DcR2 и OPG (см. Sheridan et al., выше; Marsters et al., выше, и Simonet et al., выше). Когда применяют в настоящем документе, термин "рецептор Apo-2L" относится к природной последовательности рецептора и вариантам рецептора. Эти термины относятся к рецептору Apo-2L, экспрессируемому у ряда млекопитающих, включая людей. Рецептор Apo-2L может быть эндогенно экспрессируемым, как происходит в природе в ряде тканевых линий человека, или может экспрессироваться рекомбинантным или синтетическим способами. "Рецептор Apo-2L с природной последовательностью" содержит полипептид с такой же аминокислотной последовательностью, что и рецептор Apo-2L, полученный в природных условиях. Таким образом, рецептор Apo-2L с природной последовательностью может обладать аминокислотной последовательностью встречающегося в природе рецептора Apo-2L любого млекопитающего, включая людей. Такой рецептор Apo-2L с природной последовательностью можно выделять в природных условиях или можно получать рекомбинантными или синтетическими способами. Термин "рецептор Apo-2L с природной последовательностью", в частности, относится к встречающимся в природе укороченным или секретируемым формам рецептора (например, растворимая форма, содержащая, например, последовательность внеклеточного домена), встречающимся в природе вариантным формам (например, формы альтернативного сплайсинга) и встречающимся в природе аллельным вариантам. Варианты рецептора могут включать в себя фрагменты и делеционные мутанты рецептора Apo-2L с природной последовательностью. На фиг.3A-3C показана последовательность DR5 человека из 411 аминокислот, как опубликовано в WO 98/51793 19 ноября 1998 года. В данной области известен вариант сплайсинга продукта транскрипции DR5 человека. Этот вариант сплайсинга DR5 кодирует последовательность DR5 человека из 440 аминокислот, как показано на фиг.4A-4C, вместе с ее нуклеотидной последовательностью (SEQ ID NO: 7 и 8), и как опубликовано в WO 98/35986 20 августа 1998 года.
"Антитело к рецептору смерти" применяют в настоящем документе в основном для обозначения антитела или антител к рецептору, входящему в суперсемейство рецептора фактора некроза опухоли и содержащему домен смерти, способный к передаче сигнала апоптоза, и такие антитела включают в себя антитело к DR5 и антитело к DR4.
"Антитело к рецептору DR5", "антитело к DR5" или "антитело против DR5" используют в широком смысле для обозначения антител, связывающихся, по меньшей мере, с одной формой рецептора DR5 или его внеклеточного домена. Необязательно антитело к DR5 слито или связано с гетерологичной последовательностью или молекулой. Предпочтительно гетерологичная последовательность позволяет антителу формировать комплексы более высокого порядка или олигомерные комплексы или способствует этому. Необязательно антитело к DR5 связывается с рецептором DR5, но не связывается или не вступает в перекрестную реакцию с любым дополнительным рецептором Apo-2L (например, DR4, DcR1 или DcR2). Необязательно антитело представляет собой агонист сигнальной активности DR5. Термин "антитело против DR5" и его грамматические эквиваленты, в частности, относится к антителам, описанным в примерах, и включает в себя в качестве неограничивающих примеров антитела "Apomab", перечисленные в таблицах 11 и 12, например, такие как Apomab 1.1, 2.1, 3.1, 4.1, 5.1, 6.1, 7.1, 8.1, 9.1, 1.2, 2.2, 3.2, 4.2, 5.2, 6.2, 7.2, 8.2, 9.2, 1.3, 2.2, 3.3, 4.3, 5.3, 6.3, 7.3, 8.3 и 9.3, предпочтительно Apomab 7.3.
Необязательно антитело к DR5 по изобретению связывается с рецептором DR5 в диапазоне концентраций от приблизительно 0,1 нМ до приб