Способ идентификации токсигенных штаммов v. cholerae o1, определения их биовара и дифференциации штаммов биовара эльтор на типичные и измененные методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления
Иллюстрации
Показать всеИзобретение касается идентификации токсигенных штаммов Vibrio cholerae O1, определения их биоваров и дифференциации V.cholerae биовара эльтор на типичные изоляты и измененные варианты. Согласно изобретению мультиплексную полимеразную цепную реакцию (ПЦР) проводят в один прием в двух реакционных смесях, где каждая из смесей содержит специально подобранное сочетание праймеров: одна - к генам rfbO1, cas3 и ctxBClass, вторая - к генам rfbO1, rtxC и ctxBEltor. Тест-система для осуществления способа включает компоненты для выделения ДНК, компоненты для проведения ПЦР и компоненты для анализа результатов. Компоненты для проведения ПЦР содержат: 10-кратный буферный раствор, рН 8,4, минеральное масло, деионизированную стерильную воду, два положительных контроля, фермент Taq-полимеразу, смесь дНТФ, смесь праймеров №1 - rfbO1-F - rfbO1-R, cas3-F - cas3-R, ctxBClass-F-ctxBClass и смесь праймеров №2 - rfbO1-F - rfbO1-R, rtxC-F - rtxC-R, ctxBEltor-F - ctxBEltor-R. Изобретение позволяет быстро и достоверно выявлять биовар холерных вибрионов O1 серогруппы, определять их токсигенность и проводить дифференциацию выявленных токсигенных штаммов V.cholerae биовара эльтор на типичные изоляты и измененные варианты. 2 н. и 1 з.п. ф-лы, 2 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к области медицинской микробиологии, в частности к идентификации токсигенных штаммов Vibrio cholerae O1, определению их биовара (классического или эльтор) и дифференциации V. cholerae O1 биовара эльтор на типичные изоляты и измененные варианты.
Холера - особо опасная инфекционная болезнь с диарейным синдромом. Инфицирование человека происходит после употребления пищи или воды, зараженной холерными вибрионами, которые после попадания в организм человека продуцируют холерный токсин (XT), являющийся ключевым фактором вирулентности возбудителя. Возбудитель холеры Vibrio cholerae относится к двум серогруппам - O1 и O139. В свою очередь, холерные вибрионы O1 серогруппы подразделяются на два биовара - классический и эльтор, отличающихся по биохимическим свойствам и структуре генома. V. cholerae классического биовара был возбудителем первых шести пандемий азиатской холеры (1817-1923 гг.). Высокая вирулентность возбудителя холеры этого биовара обусловлена эффективной продукцией им XT. Возбудитель текущей, 7-й, пандемии холеры - V. cholerae биовара эльтор, который является менее токсигенным и менее вирулентным по сравнению с V. cholerae O1 классического биовара. Продукция XT у V. cholerae O1 обоих биоваров определяется генами ctxA и ctxB, образующими оперон ctxAB, который входит в состав профага СТХ. Одно из основных отличий холерных классических и эльтор вибрионов заключается в разных нуклеотидных последовательностях гена ctxB из оперона ctxAB, кодирующего биосинтез XT, а также гена - репрессора rstR, участвующего в контроле синтеза этого белка. Вследствие этого аллели указанных генов у классических холерных вибрионов обозначены как ctxBClass и rstRClass, у вибрионов эльтор - как ctxBEltor и rstREltor. Разная нуклеотидная последовательность генов ctxBClass и ctxBEltor определяет неодинаковую аминокислотную последовательность В-субъединиц их токсинов. Вследствие этого различают XT классического (или 1-го) типа, продуцируемый классическими вибрионами, и XT эльтор (или 2-го) типа, характерный для вибрионов эльтор. Несмотря на широкое распространение типичного возбудителя 7-й пандемии холеры на ее первом этапе (1960-1990 гг.), в последние годы в процессе эволюции возникли и заняли доминирующее положение новые варианты V. cholerae биовара эльтор с повышенной вирулентностью, получившие обозначение измененные варианты. Различия между типичными штаммами V.cholerae биовара эльтор и измененными вариантами состоят в разной нуклеотидной последовательности гена ctxB и в ряде случаев гена rstR, входящих в состав профага вирулентности СТХ и связанных с продукцией XT. Геном типичных токсигенных (вирулентных) штаммов содержит гены ctxBEltor и rstREltor, тогда как у измененных вариантов присутствуют гены ctxBClass и в ряде случаев rstRClass. Продукция с измененными вариантами V. cholerae O1 биовара эльтор XT классического типа приводит к повышению их вирулентности по сравнению с типичными штаммами (4, 12, 10).
Генетическое разнообразие возбудителя холеры O1 серогруппы указывает на необходимость определения его биовара (классического или эльтор). Кроме того, в связи с возникновением высоковирулентных измененных вариантов V. cholerae биовара эльтор, продуцирующих XT классического типа, которые могут быть завезены в любую страну мира, о чем свидетельствуют последние события на Гаити (7), и нанести значительный экономический ущерб, для повышения эффективности системы эпидемиологического надзора за холерой необходима разработка способа быстрой и достоверной их дифференциации от типичных вирулентных штаммов V. cholerae биовара эльтор с использованием современных методов анализа.
Из источников научно-технической информации известен способ определения серогруппы и биовара холерных вибрионов на основе выявления гена wbeO, входящего в состав кластера генов gmd-wbeO, встречающихся только у холерных вибрионов O1 серогруппы, и фрагмента гена hlyA, типичного для холерных вибрионов биовара эльтор (2).
Известна комплексная гено- и иммунодиагностическая тест-система для идентификации холерных вибрионов O1 и O139 серогрупп и оценки их вирулентности, позволяющая осуществлять идентификацию природных штаммов холерного вибриона O1 и O139 серогрупп и определять их вирулентность. Генодиагностическая тест-система включает набор специфических праймеров wbeW1-wbeW2, wbfR1-wbeW2, ctxA1-ctxA2, tepAclassica1 - tcpAclassica2, tcpAeltor1 - tcpAeltor2 к участкам генов wbeW, wbfR, ctxA, tcpAclassica, tcpAeltor (1).
Известна мультиплексная ПЦР тест-система с использованием праймеров на видоспецифический ген hapA и основных генов вирулентности ctxA, tcpA и toxR, позволяющая одновременно проводить идентификацию штаммов V. cholerae и дифференцировать их по эпидемической значимости (3).
Известен способ детекции и определения биовара, серогруппы и токсигенности возбудителя холеры и набор для его осуществления (5) с использованием метода мультилокусной ПЦР, которую проводят с применением трех пар синтезированных праймеров к генам wbeN, hlyA и ctxA, а набор состоит из комплекта реагентов для выделения ДНК из материала, комплекта для амплификации, содержащего праймеры wbeN1-wbeN2, hly1-hly2 и ctx2-ctx3, специфичные соответственно для генов wbeN, hlуА и ctxA, положительного и отрицательного контроля и комплекта для анализа продукта.
Однако описанные способы и тест-системы предназначены исключительно для идентификации типичных штаммов холерного вибриона биовара эльтор и не способны выявлять токсигенные измененные варианты с повышенной вирулентностью.
Известно выявление измененных токсигенных штаммов V. cholerae биовара эльтор методом ПЦР с использованием аллельспецифических праймеров для детекции классического или эльтор типа гена ctxB (11). Однако данный метод применим только для штаммов холерных вибрионов с предварительно установленными серогруппой и биоваром.
В то же время при мониторинговых исследованиях необходима не только идентификация токсигенных штаммов V. cholerae O1 серогруппы и определение их биовара, но и своевременная и быстрая дифференциация V. cholerae биовара эльтор по структуре гена ctxB с целью выявления измененных вариантов возбудителя холеры эльтор для повышения эффективности проводимых противоэпидемических мероприятий.
Таким образом, в данной области существует очевидная потребность в разработке информативного и быстрого способа, также тест-системы для идентификации токсигенных штаммов холерного вибриона O1 серогруппы, выяснения их биовара и дифференциации V. cholerae биовара эльтор на типичные штаммы и измененные варианты.
Техническим результатом изобретения является обеспечение возможности осуществления одновременной идентификации штаммов V. cholereae O1 серогруппы классического и эльтор биоваров (на основе присутствия в их геноме гена rfbO1 и биовароспецифических генов cas3 и rtxC), выяснения их токсигенности (на основе тестирования гена ctxB) и дифференциации V. cholerae биовара эльтор на типичные изоляты и измененные варианты по присутствию в их геноме генов ctxBClass или ctxBEltor.
Технический результат достигается способом идентификации и дифференциации типичных и измененных токсигенных штаммов V. cholerae O1 методом мультиплексной полимеразной цепной реакции, характеризующимся тем, что ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров к генам rfbO1, cas3, ctxBClass в первой, и rfbO1, rtxC, ctxBEltor во второй, с температурой отжига праймеров 58,2°С в течение 10 с при числе циклов амплификации, равном 25, с последующим анализом путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов. Для типичных токсигенных штаммов V. cholerae классического биовара характерно наличие ампликонов генов rfbO1, cas3 и ctxBClass, идентичных контрольному образцу. Для типичных токсигенных штаммов V. cholerae O1 биовара эльтор характерно наличие ампликонов генов rfbO1, rtxC и ctxBEltor, идентичных контрольному образцу, а для измененных вариантов V. cholereae O1 биовара эльтор наряду с фрагментами генов rfbO1 и rtxC характерно наличие ампликона к гену ctxBClass.
В качестве контроля используют ДНК типичных токсигенных штаммов V. cholerae классического и эльтор биоваров.
Технический результат также достигается тест-системой для идентификации и дифференциации типичных и измененных токсигенных штаммов V. cholerae O1 биовара эльтор методом мультиплексной полимеразной цепной реакции, включающей компоненты для выделения ДНК и компоненты для проведения ПНР: 10-кратный буферный раствор, рН 8,4, минеральное масло, деионизованную стерильную воду, два положительных контроля, фермент Taq-полимеразу, смесь четырех дНТФ, смесь праймеров №1, содержащую rfbO1-F - rfbO1-R, cas3-F - cas3-R, ctxBClass-F - ctxBClass-R в соотношении 1,5:1:1 соответственно, смесь праймеров №2, содержащую rfbO1-F - rfbO1-R, rtxC-F - rtxC-R, ctxBEltor-F - ctxBEltor-R в соотношении 1,5:1:1, соответственно, а также компоненты для анализа результатов.
При разработке способа особое значение придавали выбору новой ДНК-мишени для определения биовара холерных вибрионов. В результате исследований на основании анализа нуклеотидной последовательности CRISPR/CAS-системы отобран ген cas3, кодирующий хеликазу и присутствующий только у холерных вибрионов классического биовара, что повышает эффективность их идентификации. Ген cas3 использован в качестве ДНК-мишени для определения биовара впервые. Праймеры для выявления биовароспецифического гена cas3 сконструированы авторами с помощью программы Oligo 6.0 на основании представленных в базе данных нуклеотидных последовательностей выбранного гена и являются высокоспецифичными.
Праймеры на ген cas3, кодирующий хеликазу CRISPR/CAS-системы, имеют прямую и обратную нуклеотидные последовательности: cas3-F (5'-CAGCAGGTAAAAGGTGTAGTG-3') и cas3-R (5'-CGCATTTCCTCGCTTATCATC-3'), обеспечивающие образование фрагмента размером 415 п.н.
Праймеры были подобраны на уникальные последовательности гена cas3 в геноме V. cholerae таким образом, чтобы минимизировать вероятность их неспецифичного отжига. Праймеры были проверены на возможность образования шпилечных структур с высокими температурами плавления, а также образования димерных соединений как одноименных праймеров, так и двух праймеров между собой. Выбор длины и GC% состава праймеров производился в соответствии с режимом отжига других праймеров, входящих в набор. Размер получаемого фрагмента был подобран для упрощения процесса учета результатов таким образом, чтобы амплифицируемый фрагмент был визуально отделим от прочих.
Для подтверждения специфичности праймеров с помощью ПЦР было изучено 50 штаммов V. cholerae O1 биовара эльтор и 15 штаммов V. cholerae O1 классического биовара. При этом фрагмент, соответствующий гену cas3, был получен только для штаммов V. cholerae классического биовара.
Праймеры на другие использованные гены - rfbO1, rtxC и аллельспецифические праймеры для генов ctxBClass и ctxBEltor взяты из литературных данных (9, 8, 6, 11).
Пары праймеров, используемые в заявляемом способе, характеризуют как:
rfbO1-F - rfbO1-R - праймеры на ген rfbO1 (кодирующий биосинтез O1-антигена), обеспечивающие образование фрагмента размером 638 п.н.;
cas3-F - cas3-R - праймеры на ген cas3 (кодирующий хеликазу CRISPR/CAS-системы), обеспечивающие образование фрагмента размером 415 п.н. и имеющие прямую и обратную последовательности: cas3-F 5'-CAGCAGGTAAAAGGTGTAGTG-3', cas3-R 5'-CGCATTTCCTCGCTTATCATC-3'.
rtxC-F- rtxC-R праймеры на ген rtxC из кластера rtx генов (кодирующих биосинтез RTX-токсина), обеспечивающие образование фрагмента размером 265 п.н.;
ctxBClass-F - ctxBClass-R праймеры на аллель гена ctxB классического типа, обеспечивающие образование фрагмента размером 189 п.н.;
ctxBEltor-F - ctxBEltor-R - праймеры на аллель гена ctxB эльтор типа, обеспечивающие образование фрагмента размером 189 п.н.
Экспериментально установлен оптимальный состав реакционной смеси для проведения мультиплексной цепной реакции, подобрано сочетание праймеров, необходимое и достаточное соотношение компонентов реакционной смеси и определен режим постановки ПЦР, что является важным при проведении ПЦР анализа.
Заявляемая тест-система разделена на 3 комплекта:
комплект 1 содержит компоненты для выделения ДНК, упакованные в шесть пластиковых флаконов, содержащих раствор 1 (6М раствор гуанидинтиоционата), раствор 2 (4М раствор гуанидинтиоционата), раствор 3 (спиртосолевой раствор), ацетон, элюент для ДНК (ТЕ-буфер), 2 пластиковые пробирки с нуклеосорбентом;
комплект 2 содержит компоненты для проведения ПЦР и включает 2 пластиковые пробирки со смесью 1 (праймеры, дНТФ и вода), 2 пластиковые пробирки со смесью 2 (праймеры, дНТФ и вода), 1 пластиковую пробирку с 10-кратным буфером, 1 пластиковую пробирку, содержащую Taq-полимеразу, 1 пластиковую пробирку с ТЕ-буфером, 1 пластиковую пробирку, содержащую контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 классического биовара, и 1 пластиковую пробирку, содержащую контрольный положительный образец с ДНК типичного токсигенного штамма V. cholerae O1 биовара эльтор;
комплект 3 содержит компоненты для учета результатов анализа и включает 1 пластиковый флакон, содержащий ТАЕ буфер, 2 флакона с агарозой для электрофореза и 1 флакон с буфером для нанесения проб.
Тест-система предназначена для определения методом мультилокусной полимеразной цепной реакции серогруппы, биовара, токсигенности исследуемых штаммов холерного вибриона и дифференциации выявленных токсигенных штаммов V. cholerae O1 биовара эльтор на типичные и измененные.
Система рассчитана на проведение 50 определений, включая контрольные образцы.
Заявляемый способ идентификации включает следующие этапы.
а) Выделение ДНК (комплект 1).
б) Проведение ПНР (комплект 2).
ПЦР проводят в один этап по следующей программе: предварительная денатурация 96°С - 2 мин, 25 циклов из 96°С - 10 с, 58,2°С - 10 с, 72°С - 30 с, заключительная достройка цепи 72°С - 5 мин.
в) Анализ результатов (комплект 3).
Детекцию амплифицированной ДНК после ПЦР осуществляют методом горизонтального гельэлектрофореза в 1,5% агарозном геле. Учет результатов ПЦР-анализа проводят путем сравнения полученных ампликонов с контрольными образцами в соответствии с идентификационной таблицей (табл.1).
Способ осуществляют следующим образом.
1. Подготовку проб проводят согласно МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» в боксе биологической безопасности II класса в противочумном костюме IV типа в резиновых или латексных перчатках. Клетки холерных вибрионов, выращенные на LB-агаре в течение 18 часов, ресуспендируют в 0,85% растворе натрия хлорида до концентрации
109 микробных клеток в 1 мл и последующим разведением в деионизованной воде доводят до концентрации 1×107 м.к./мл. Затем к суспензии добавляют мертиолят натрия до конечной концентрации 1:10000 (0,01%) и прогревают его при 56°С в течение 30 мин. Далее, 100 мкл образца переносят в микроцентрифужные пробирки объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6М гуанидинизотиоцианата, и инкубируют 15 мин при 65°С. После выполнения данных процедур материал считается обеззараженным.
Выделение ДНК осуществляют с использованием комплекта 1.
Комплект для выделения ДНК извлекают из холодильника и выдерживают при комнатной температуре. Все реагенты комплекта добавляют отдельными наконечниками с помощью автоматических микропипеток.
Раствор 1 прогревают при температуре 60-65°С до полного растворения кристаллов, после чего добавляют к обеззараженным пробам в объеме 300 мкл. Пробы тщательно перемешивают на микроцентрифуге/встряхиватиле и инкубируют при температуре 65°С. Сорбент тщательно ресуспендируют на микроцентрифуге/встряхиватиле. В каждую пробирку вносят 25 мкл подготовленного сорбента, перемешивают на микроцентрифуге/встряхиватиле 30 с и оставляют в штативе на 2 минуты. Процедуру повторяют дважды. Затем пробирки центрифугируют при 12000 g в течение 30 с, супернатант удаляют.
К осадку добавляют 300 мкл раствора 2. Содержимое пробирки перемешивают на микроцентрифуге/встряхивателе до гомогенного состояния, центрифугируют при 12000 g в течение 30 с, супернатант удаляют.
К осадку добавляют 500 мкл раствора 3. Содержимое пробирки перемешивают на микроцентрифуге/встряхивателе до гомогенного состояния и центрифугируют при 12000 g в течение 30 с. Супернатант удаляют, отмывку раствором 3 повторяют.
К осадку добавляют 400 мкл ацетона. Содержимое перемешивают на микроцентрифуге/встряхивателе, затем центрифугируют при 12000 g в течение 30 с, супернатант удаляют. Осадок высушивают при температуре 65°С в течение 5-7 мин.
К осадку добавляют 50 мкл ТЕ-буфера и выдерживают при температуре 65°С в течение 10 мин, встряхивая на микроцентрифуге/встряхивателе 2-3 раза. По окончании взвесь центрифугируют при 12000 g в течение 1 мин. Супернатант содержит очищенную ДНК.
2. Для проведения ПЦР готовят необходимое количество микропробирок, соответствующее числу исследуемых проб, а также еще по три для каждой реакционной смеси: двух дифференцирующих положительных контролей (ПК-Class и ПК-Eltor), в качестве которых берут ДНК штаммов типичного классического и типичного эльтор биоваров, и отрицательного контроля (H2O).
Компоненты 2 комплекта извлекают из морозильной камеры, размораживают содержимое пробирок и готовят реакционные смеси для проведения ПЦР.
Для приготовления реакционной смеси №1 смешивают 11,7 мкл смеси 1, содержащей сочетание праймеров rfbO1-F - rfbO1-R, cas3-F - cas3-R, ctxBClass-F - ctxBClass-R в соотношении 1,5:1:1, смесь дНТФ и деионизованную воду с 3 мкл 10-кратного буфера и 0,3 мкл Taq-полимеразы. Для приготовления реакционной смеси для №2 смешивают 11,7 мкл смеси 2, содержащей сочетание праймеров rfbO1-F - rfbO1-R, rtxC-F - rtxC-R, ctxBEltor-F - ctxBEltor-R в соотношении 1,5:1:1, соответственно, смесь дНТФ и деионизованную воду с 3 мкл 10-кратного буфера и 0,3 мкл Taq-полимеразы. В подготовленные пробирки вносят по 10 мкл пробы. В пробирку, обозначенную как отрицательный контроль, вносят 10 мкл деионизованной воды, а в пробирки с положительными контролями соответственно по 10 мкл ДНК из пробирок ПК-Class и ПК-Eltor. В качестве положительных контролей используют ДНК штамма V. cholerae 569B классического биовара (rfbO1+, cas3+, ctxBClass+ и rtxC-) и штамма V. cholerae M818 биовара эльтор (rfbO1+, rtxC+, ctxBEltor+ и cas3-).
Амплификацию ДНК осуществляют с использованием программируемого термостата с горячей крышкой «IQ5» (BioRad, США), либо используют его аналоги при следующих температурных режимах (по матричному способу регулирования): температура денатурации - 96°С в течение 2 мин; 25 циклов - денатурация ДНК при температуре 96°С в течение 10 с, отжиг праймеров 58,2°С - 10 с, синтез комплементарной цепи при температуре 72°С - 30 с; заключительный синтез комплиментарной цепи при температуре 72°С в течение 5 мин. Амплификацию контрольных образцов ПК-Class и ПК-Eltor проводят одновременно с исследуемыми пробами в том же приборе и при тех же условиях.
3. Для подготовки 50 мл 1,5% агарозного геля к 750 мг агарозы добавляют 50 мл ТАЕ буфера, разведенного в 50 раз. Агарозу доводят до кипения, охлаждают до 50°С и заливают в специальную ванночку, затем устанавливают гребенку и оставляют застывать. После полимеризации осторожно извлекают гребенку и переносят гель в камеру для проведения электрофореза. Затем к амплификату добавляют 5 мкл буфера для нанесения проб, перемешивают при помощи того же наконечника и вносят в карманы геля. Камеру подключают к источнику тока и задают напряжение 7-10 В/см. Электрофоретическое разделение продолжают в течение 50 мин до прохождения лидирующим красителем около 4/5 длины трека (рекомендуемая длина трека - 10 см), после чего гель извлекают из камеры и помещают на стекло трансиллюминатора с УФ-излучением 310 нм. Фрагменты анализируемой ДНК проявляются в виде оранжево-красных полос.
Оценивают результаты путем сравнения полученных в ПЦР ампликонов с маркерными фрагментами типичных токсигенных штаммов V. cholerae классического и эльтор биоваров. Учет результатов проводят в соответствии с идентификационной таблицей (табл.1).
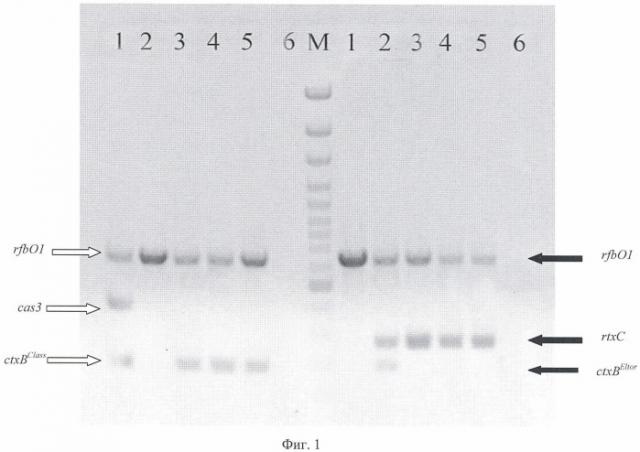
На фиг.1 приведена электрофореграмма ампликонов, полученных при постановке мультиплексной ПЦР с различными штаммами V. cholerae. На дорожках 1 и 2 показано положение ампликонов типичных токсигенных штаммов соответственно классического и эльтор биоваров, на дорожках 3-5 представлены ампликоны измененных токсигенных вариантов холерного вибриона эльтор биовара. Дорожка 6 - отрицательный контроль.
Выявление ампликонов размером 638, 415 и 189 п.н. в смеси №1 указывает на присутствие в пробе токсигенного штамма холерного вибриона классического биовара;
присутствие ампликонов размером 638, 265 и 189 п.н. в смеси №2 указывает на присутствие в пробе токсигенного штамма холерного вибриона биовара эльтор;
присутствие в пробе токсигенных измененных вариантов холерных вибрионов биовара эльтор, продуцирующих классический XT, тестируют на основе получения данных о наличии ампликонов размером 638 и 189 п.н. в реакционной смеси №1 и 638, 265 п.н. в смеси №2.
Специфичность заявляемого способа и тест-системы подтверждена на основе использования штаммов близкородственных видов - V. mimicus, V. anguillarum, V. parahae-molyticus, V. vulnificus, V. alginoliticus, V. albensis, а также энтеробактерий - E.coli, S. enteritidis, Sh. flexneri, A. hydrofilae. Результаты ПЦР тестирования указанных штаммов были отрицательными. При использовании заявляемой тест-системы со штаммами V. cholerae O139 и неО1/неО139 серогрупп показано отсутствие фрагментов, соответствующих локусу rfbO1 (638 п.н.). Результаты специфичности представлены в таблице 2.
Изобретение иллюстрируется следующим примером.
Пример 1. Для определения эффективности заявляемого способа и тест-системы исследовано 23 клинических штамма V. cholerae, выделенных на различных территориях и в разные годы.
У всех исследуемых штаммов присутствовал ампликон размером 638 п.н., свидетельствующий об их принадлежности к O1 серогруппе.
Установлено, что среди них 5 изолятов относятся к токсигенным штаммам классического биовара, так как у них происходила амплификация фрагментов ДНК размером 415 п.н. и 189 п.н. в реакционной смеси №1, что свидетельствует о присутствии в их геноме соответственно биовароспецифического гена cas3, а также гена ctxBClass, связанного с продукцией XT - основного фактора вирулентности (табл.3).
У 18 штаммов V. cholerae при ПЦР-анализе наблюдалась иная картина. В их геноме присутствовал биовароспецифический ген rtxC, выявляемый с помощью реакционной смеси №2, поскольку во всех случаях формировался ампликон размером 265 п.н., что указывает на их принадлежность к холерным вибрионам биовара эльтор. При этом 5 изолятов относятся к типичным токсигенным штаммам V. cholerae O1 биовара эльтор, так как для них характерно наличие ампликона размером 189 п.н в реакционной смеси №2, указывающего на наличие в их геноме гена ctxBEltor. В то же время у 13 изолятов обнаружено присутствие в геноме гена ctxB классического типа (ctxBClass), о чем свидетельствует образование ампликона размером 189 п.н. со специфическими праймерами ctxBClass-F и ctxBClass-R в реакционной смеси №1. Анализ полученных данных свидетельствует о том, что исследование природных штаммов холерных вибрионов с помощью предложенного способа и мультиплексной ПЦР тест-системы позволяет не только определять биовар и токсигенность штаммов холерного вибриона O1 серогруппы, но и дифференцировать штаммы V. cholerae биовара эльтор на типичные изоляты и измененные варианты, несущие в геноме ген ctxB классического типа. Данные проведенного ПЦР-анализа сведены в таблицу 3.
Для подтверждения результатов по дифференциации типичных штаммов и измененных вариантов V. cholerae биовара эльтор, полученных с использованием заявляемого способа и ПЦР тест-системы, был секвенирован ген ctxB изучаемых штаммов. На фиг.2 представлены нуклеотидные последовательности гена ctxB исследуемых штаммов холерного вибриона. В результате проведенного анализа в последовательности гена ctxB у 13 изолятов обнаружены две нуклеотидные замены тимина (Т) на цитозин (С) в положениях 115 и 203, что указывает на присутствие в их геноме ctxB классического типа (ctxBClass). Таким образом, данные секвенирования полностью подтвердили результаты, полученные с использованием разработанного способа и мультиплесной ПЦР тест-системы, указав на принадлежность выявленных 13 штаммов холерного вибриона биовара эльтор действительно к измененным вариантам.
Таким образом, предлагаемый способ и мультиплексная ПЦР тест-система позволяют быстро и достоверно идентифицировать холерные вибрионы O1 серогруппы классического и эльтор биовара, определять их токсигенность и одновременно проводить дифференциацию выявленных токсигенных штаммов V. cholerae биовара эльтор на типичные изоляты и измененные варианты.
Литература
1. Комплексная гено- и иммунодиагностическая тест-система для идентификации холерных вибрионов O1 и O139 серогруппы и оценки их вирулентности. Патент РФ №2404257, опубликован 20.11.10 г.
2. Осина Н.А., Бугоркова Т.В., Казакова Е.С., Шарова И.Н., Грачева И.В., Валова Т.В., Куличенко А.Н. Разработка метода биотипирования холерных вибрионов с помощью полимеразной цепной реакции. Сборник материалов проблемной комиссии «Холера и патогенные вибрионы». 2002; 15:59-61.
3. Смирнова Н.И., Кириллина О.А., Челдышова Н.Б., Кутырев В.В. Дифференциация штаммов Vibrio cholerae eltor по их эпидемической значимости с помощью новых диагностических холерных бактериофагов эльтор ctx- и ctx+ и полимеразной цепной реакции. Журнал эпидемиол., микробиол. и иммунологии. 2001. 6:11-16.
4. Смирнова Н.И., Челдышова Н.Б., Горяев А.А. и др. Эволюция генома Vibrio cholerae: пути формирования атипичных штаммов. Пробл. особо опасных инф. 2008, 3(97): 3-12.
5. Способ детекции и определения биотипа, серогруппы и токсигенности возбудителя холеры и набор для его осуществления. Патент РФ 2360972, опубликован 10.07.10 г.
6. Bhattacharya Т., Chatterjee S., Maiti D. et al. Molecular analysis of the rstR and orfU genes of the CTX prophages integrated in the small chromosomes of environmental Vibrio cholerae non-O1, non-O139 strains. Environ. Microbiol. 2006; 8:526-534.
7. Chin C.S., Sorenson J., Harris J.B. et al. Origin of the Haitian cholera outbreak strain. N. Engl. J. Med. 2010; 364:33-42.
8. Chow, K.H., Ng, Т.К., Yuen, K.Y., Yam, W.C. Detection of RTX toxin gene in Vibrio cholerae by PCR. J Clin Microbiol. 2001; 39: 2594-2597.
9. Goel A.K., Ponmariappan, S., Kamboj, D.V., Singh, L. Single multiplex polymerase chain reaction for environmental surveillance of toxigenic-pathogenic O1 and non-O1 Vibrio cholerae. Folia Microbiol (Praha). 2007; 52: 81-85.
10. Kumar P., Jain M., Goel A.K. et al. A large cholera outbreak due to a new cholera toxin variant of the Vibrio cholerae O1 El Tor biotype in Orissa, Eastern India. J. Med. Microbiol. 2009, 58:234-238.
11. Morita M., Ohnishi M., Arakawa E. et al. Development and validation of a mismatch amplification mutation PCR assay to monitor the dissemination of an emerging variant of Vibrio cholerae O1 biotype El Tor. Microbiol. Immunol. 2008, 52(6): 314-317.
12. Nair G.В., Qadri F., Holmgren J. et al. Cholera due to altered El Tor strains of Vibrio cholerae O1 in Bangladesh. J. Clin. Microbiol. 2006, 44: 4211-4213.
| Таблица 1 | ||||||
| Реакционная смесь №1 | Реакционная смесь №2 | Результаты идентификации и дифференциации | ||||
| rfbO1 | cas3 | ctxBClass | rfbO1 | rtxC | ctxBEltor | |
| 638 п.н. | 415 п.н. | 189 п.н. | 638 п.н. | 265 п.н. | 189 п.н. | |
| - | - | - | - | - | - | Штамм не относится к роду Vibrio |
| - | +/- | +/- | - | +/- | +/- | Штамм относится к роду Vibrio не O1-серогруппы |
| + | + | + | + | - | - | Типичный токсигенный штамм V. cholerae O1 классического биовара |
| + | - | - | + | + | + | Типичный токсигенный штамм V. cholerae O1 эльтор биовара |
| + | - | + | + | + | - | Измененный токсигенный штамм V. cholerae O1 эльтор биовара |
| Таблица 2 | |||||||||||
| № | Вид | Серогруппа и биовар | Штамм | Место и год выделения | Реакционная смесь №1 | Реакционная смесь №2 | Характеристика штамма на основе мПЦР* | ||||
| rfbO1 | cas3 | ctxBClass | rfbO1 | rtxC | ctxBEltor | ||||||
| 1. | V. cholerae | O139 | М028 | Индия, 1993 | - | - | - | - | + | + | не O1 |
| 2. | V. cholerae | O139 | 55 | Франция, 1994 | - | - | - | - | + | + | не O1 |
| 3. | V. cholerae | O139 | 62 | Франция, 1994 | - | - | - | - | + | + | не O1 |
| 4. | V. cholerae | O37 | 1322-69 | Коллекция Саказаки | - | - | + | - | - | - | не O1 |
| 5. | V. cholerae | O20 | 10332-62 | Коллекция Саказаки | - | - | - | - | - | - | не O1 |
| 6. | V. cholerae | O4 | NCTC4716 | Коллекция Саказаки | - | - | - | - | + | - | не O1 |
| 7. | V. cholerae | O41 | 14520 | Астрахань, 1976 | - | + | - | - | - | - | не O1 |
| 8. | V. cholerae | O42 | 13030 | Астрахань, 1976 | - | - | - | - | + | - | не O1 |
| 9. | V. cholerae | O41 | Р-4107 | Ростов, 1976 | - | - | - | - | + | - | не O1 |
| 10. | V. cholerae | н.и. | 16893 | Саратов, 1977 | - | - | - | - | - | - | не O1 |
| 11. | V. cholerae | O62 | KM3 | Узбекистан, 1971 | - | - | + | - | + | - | не O1 |
| 12. | V. cholerae | н.и. | Р-13673 | Узбекистан, 1987 | - | - | + | - | + | - | не O1 |
| 13. | V. cholerae | н.и. | Р-16149 | Узбекистан, 1998 | - | - | + | - | + | - | не O1 |
| 14. | V. cholerae | н.и. | KM159 | Узбекистан, 1988 | - | - | + | - | + | - | не O1 |
| 15. | V. cholerae | O9 | Р-16140 | Узбекистан, 1990 | - | - | + | - | + | - | не O1 |
| 16. | V. cholerae | O74 | Р-16148 | Узбекистан, 1990 | - | - | + | - | + | - | не O1 |
| 17. | V. cholerae | 074 | P-16135 | Узбекистан, 1990 | - | - | + | - | + | - | не O1 |
| 18. | V. cholerae | н.и. | P-16142 | Узбекистан, 1990 | - | - | + | - | + | - | не O1 |
| 19. | V. mimicus | - | ATCC 33653 | Институт Пастера | - | - | - | - | - | - | другой |
| 20. | V. anguillarum | - | ATCC 19264 | Институт Пастера | - | - | - | - | - | - | другой |
| 21. | V. parahaemoliticus | - | 745 | Новороссийск, 1975 | - | - | - | - | - | - | другой |
| 22. | V. parahaemoliticus | - | 4779 | Япония | - | - | - | - | - | - | другой |
| 23. | V. vulnificus | - | ATCC27562 | Калифорнийский университет | - | - | - | - | - | - | другой |
| 24. | V. alginoliticus | - | 281 | Новороссийск, 1976 | - | - | - | - | - | - | другой |
| 25. | V. albensis | - | 37263 | Ставрополь,1970 | - | - | - | - | - | - | другой |
| 26. | V. parahaemoliticus | - | 964 | н/и | - | - | - | - | - | - | другой |
| 27. | V. anguilanum | - | ATCC 19624 | н/и | - | - | - | - | - | - | другой |
| 28. | E. coli | - | M17 | н/и | - | - | - | - | - | - | другой |
| 29. | S. enteritidis | - | ВОЗ | н/и | - | - | - | - | - | - | другой |
| 30. | Sh. flexneri | - | 26 «C» | н/и | - | - | - | - | - | - | другой |
| 31. | A. hydrofilae | - | 401 | н/и | - | - | - | - | - | - | другой |
| Примечания: н/и - не известно; | |||||||||||
| * - штаммы: не O1, штаммы холерного вибриона не O1 серогруппы; другой, штаммы, не относящиеся к роду Vibrio. |
| Таблица 3 | |||||||||
| № | Штамм V. cholerae | Место и год выделения | Реакционная смесь №1 | Реакционная смесь №2 | Характеристика штамма на основе мПЦР | ||||
| rfbO1 | cas3 | ctxBClass | rfbO1 | rtxC | ctxBElton | ||||
| 1. | M8 | Волгоград, 1942 | + | + | + | + | - | - | ТК |
| 2. | М14 | Саратов, 1942 | + | + | + | + | - | - | ТК |
| 3. | 569В | Индия, 1950 | + | + | + | + | - | - | ТК |
| 4. | J89 | Пакистан, 1958 | + | + | + | + | - | - | ТК |
| 5. | Дакка 3 | Пакистан, 1958 | + | + | + | + | - | - | ТК |
| 6. | М295 | Туркменистан, 1965 | + | - | - | + | + | + | ТЭ |
| 7. | М818 | Саратов, 1970 | + | - | - | + | + | + | ТЭ |
| 8. | М1013 | Башкирия, 1972 | + | - | - | + | + | + | ТЭ |
| 9. | P13762 | Узбекистан, 1986 | + | - | + | + | + | - | ИЭ |
| 10. | M1259 | Пермь, 1990 | + | - | - | + | + | + | ТЭ |
| 11. | M1261 | Пермь, 1990 | + | - | - | + | + | + | ТЭ |
| 12. | P15384 | Украина, 1991 | + | - | + | + | + | - | ИЭ |
| 13. | M1264 | Сочи, 1993 | + | - | + | + | + | - | ИЭ |
| 14. | M1266 | Пермь, 1993 | + | - | + | + | + | - | ИЭ |
| 15. | Р17647 | Приморье, 1997 | + | - | + | + | + | - | ИЭ |
| 16. | Р17644 | Приморье, 1997 | + | - | + | + | + | - | ИЭ |
| 17. | М1293 | Дагестан, 1994 | + | - | + | + | + | - | ИЭ |
| 18. | М1344 | Казань, 2001 | + | - | + | + | + | - | ИЭ |
| 19. | М1345 | Казань, 2001 | + | - | + | + | + | - | ИЭ |
| 20. | М1349 | Казань, 2001 | + | - | + | + | + | - | ИЭ |
| 21. | М1429 | Башкирия, 2004 | + | - | + | + | + | - | ИЭ |
| 22. | М1430 | Тверь, 2005 | + | - | + | + | + | - | ИЭ |
| 23. | Р18899 | Мурманск, 2006 | + | - | + | + | + | - | ИЭ |
| Примечание: * - штаммы: ТК - типичный токсигенный классического биовара; ТЭ - типичный токсигенный эльтор биовара; ИЭ - измененный токсигенный вариант эльтор биовара. |
1. Способ идентификации токсигенных штаммов V.cnolerae O1, определения их биовара и дифференциации штаммов биовара эльтор на типичные и измененные методом мультиплексной полимеразной цепной реакции, характеризующийся тем, что полимеразную цепную реакцию проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров к генам rfbO1, cas3, ctxBClass в первой и rfbO1, rtxC, ctxBEltor во второй, с температурой отжига праймеров 58,5°С в течение 10 с при числе циклов амплификации, равном 25, с последующим анализом путем сравнения амплифицированных фрагментов генов исследуемых и контрольных штаммов; для типичных токсигенных штаммов V.cholerae O1 классического биовара характерно наличие ампликонов генов rfbO1, cas3 и ctxBClass, идентичных контрольному образцу; для типичных токсигенных штаммов V.cholerae O1 биовара эльтор характерно наличие ампликонов генов rfbO1, rtxC и ctxBEltor, идентичных контрольному образцу; для измененных вариантов V.cholerae биовара эльтор, наряду с фрагментами генов rfbO1 и rtxC, характерно наличие ампликона к гену ctxBClass.
2. Способ по п.1, отличающийся тем, что праймеры cas3-F - cas3-R конструируют на участки гена cas3 и они имеют прямую и обратную последовательности: cas3-F 5'-CAGCAGGTAAAAGGTGTAGTG-3', cas3-R 5'-CGCATTTCCTCGCTTATCATC-3'.
3. Тест-система для осуществления способа по п.1 методом мультиплексной полимеразной цепной реакции, характеризующаяся тем, что включает компоненты для выделения ДНК, компоненты для проведения ПЦР, компоненты для анализа результатов, при этом компоненты для проведения ПЦР содержат: 10-кратный буферный раствор, рН 8,4, минеральное масло, деионизированную стерильную воду, два положительных контроля, фермент Taq-полимеразу, смесь четырех дНТФ, смесь праймеров №1, содержащую rfbO1-F - rfbO1-R, cas3-F - cas3-R, ctxBClass-F - ctxBClass-R в соотношении 1,5:1:1 соответственно, смесь праймеров №2, содержащую rfbO1-F - rfbO1-R, rtxC-F - rtxC-R, ctxBEltor-F - ctxBEltor-R в соотношении 1,5:1:1 соответственно.