Способ прогнозирования формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания
Иллюстрации
Показать всеИзобретение относится к медицине и описывает способ прогнозирования формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания, включающий выделение ДНК из периферической венозной крови, отличающийся тем, что проводят анализ полиморфизма гена рецептора фактора некроза опухоли 2-го типа (+1663 A/G TNFR2) и прогнозируют повышенный риск формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания в случае выявления аллеля +1663 G TNFR2. 1 пр., 3 табл., 1 ил.
Реферат
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования риска развития и неблагоприятного течения хронического лимфолейкоза.
Хронический лимфолейкоз представляет собой доброкачественное опухолевое заболевание лимфоидной (иммунокомпетентной) ткани, не обнаруживающую, в отличие от других форм лейкозов, опухолевой прогрессии на всем протяжении болезни. Основным морфологическим субстратом опухоли являются зрелые лимфоциты, которые разрастаются и накапливаются в повышенном количестве в лимфатических узлах, селезенке, печени, костном мозге. Среди всех лейкозов хронический лимфолейкоз занимает особое место. Несмотря на морфологическую зрелость лимфоцитов, функционально они неполноценны, что выражается в снижении иммуноглобулинов. Поражение иммунокомпетентной системы обусловливает склонность больных к инфекциям и развитию аутоиммунных анемий, тромбоцитопений, реже гранулоцитопений. Заболевание встречается преимущественно в пожилом возрасте, чаще у мужчин, нередко встречается у кровных родственников [1].
Хронический лимфолейкоз - наиболее распространенный вид лейкоза в странах Европы. На его долю приходится около 30% среди всех лейкозов. Ежегодная заболеваемость ХЛЛ составляет 3-3.5% на 100000 населения, а среди лиц старше 65 лет - до 20% на 100000 [2].
Анализ литературных данных по патогенезу хронического лимфолейкоза позволяет заключить, что до настоящего времени имеются разные взгляды на природу этого заболевания и в основе развития хронического лимфолейкоза лежат сложные многоэтапные иммунопатологические механизмы [3, 4, 5]. Одним из ключевых звеньев в реализации каскада этих механизмов являются процессы взаимодействия цитокинов. При этом центральное место в данных взаимодействиях занимают факторы некроза опухоли и их рецепторы и, в частности, рецептор фактора некроза опухоли 2-го типа [6]. Согласно данным литературы рецептор фактора некроза опухоли 2-го типа (TNFR2) является белком с молекулярным весом 75-80 кД. Он экспрессируется клетками большинства типов тканей. При активации клеток происходит протеолиз мембранных рецепторов, в результате чего образуются растворимые формы. TNFR2 стабилизирует циркулирующий фактор некроза опухоли альфа и увеличивает период полураспада данного цитокина в сыворотке крови. Ген TNFR2 локализован в 1-й хромосоме в регионе р36.2 [7].
Известен метод для диагностики и прогнозирования онкологических заболеваний, основанный на изучении соматических мутаций в гене многофункционального опухолевого супрессора (MTS) в случае неоплазий человека. Патент США №2164419, 27.03.2001. «Ген MTS, Мутации данного гена и способы диагностики злокаческтвенных опухолей с использованием последовательности гена MTS» (Мириад Дженетикс, инк. (US) и др). Изобретение относится к мутациям гена MTS в зародышевой линии и использованию данных мутаций для диагностики предрасположенности к таким формам рака, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, хлоангиосаркома, чешуеклеточная карцинома, хронический лимфоидный лимфолейкоз (CLL), а также опухоли поджелудочной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Изобретение также имеет отношение к терапии тех неоплазий человека, при которых произошла мутация в гене MTS, включая гемотерапию, заменяющую белковую терапию и использование миметиков. Техническим результатом изобретения является расширение арсенала средств диагностики и терапии опухолей.
Недостаток метода заключается в сложности анализа, его длительности и дороговизне.
За аналог выбран патент РФ №2248574 по заявке РФ №2003123171/15, 22.07.2003 «Способ прогнозирования развития и течения хронического лимфолейкоза» (Бакиров А.Б. (RU), Бакиров Б.A. (RU), где предложен способ прогнозирования развития и течения хронического лимфолейкоза, путем типирования полиморфизма ДНК лимфоцитов, выделенных из крови больного, генов TNF-alfa и TNF-beta, включающий забор периферической венозной крови, из лимфоцитов которой выделяют ДНК методом полимеразно цепной реакции синтеза ДНК, проводят генотипирование полиморфизма промоторных областей генов TNF-α и β и при выявлении генотипа LT*22, характеризующегося наличием мутации гена TNF-β в гомозиготном состоянии, выявляют лиц, предрасположенных к развитию хронического лимфолейкоза, а при определении комбинаций генотипов TNF*22/LT*22 и TNF*12/LT*11 у больных хроническим лимфолейкозом прогнозируют агрессивное течение заболевания.
Недостаток прототипа заключается в том, что он может быть использован только после постановки диагноза.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания по данным о генетическом полиморфизме +1663 A/G TNFR2.
Технический результат использования изобретения - получение критериев оценки риска формирования хронического лимфолейкоза и развития сочетанных осложнений при возникновении заболевания.
В соответствии с поставленной задачей был разработан способ прогнозирования формирования и развития сочетанных осложнений в дебюте заболевания хроническим лимфолейкозом, включающий:
- выделение ДНК из периферической венозной крови;
- анализ полиморфизма гена рецептора фактора некроза опухоли 2-го типа;
- прогнозирование повышенного риска формирования и развития сочетанных осложнений в дебюте заболевания хроническим лимфолейкозом в случае выявления высокопродуктивного аллеля +1663 G TNFR2.
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза формирования и особенностей клинического проявления хронического лимфолейкоза по наличию аллеля +1663 G гена рецептора фактора некроза опухоли 2-го типа (полиморфизм +1663 A/G TNFR2).
Способ осуществляют следующим образом:
ДНК выделяют из образцов периферической венозной крови больных хроническим лимфолейкозом в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-НСl (рН 7,6). Полученную смесь перемешивают и центрифугируют при 4°С, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН 8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°С в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием стандартных олигонуклеотидных праймеров (таблица 1).
Изучение полиморфного локуса рецептора фактора некроза опухоли 2-го типа +1663 A/G TNFR2 проводили методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов (табл.1) с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 67 мМ трис-НСl (рН 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пкмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (4 мин при 95°С) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при 59°С; денатурация - 15 сек при 95°С.
| Таблица 1 | |||
| Структура праймеров и зондов, используемых для генотипирования исследуемого ДНК-маркера | |||
| Ген | Полиморфизм и его локализация в гене | Структура праймеров | Литература |
| TNFR2 | +1663A>G | F: 5'-TGACCTGCAGGCCAAGAG-3' | (Sainz J. et al, 2007) |
| R: 5'-CCATGGCAGCAGAGGCTTT-3' | |||
| 5'-FAM: CACAACCCGCTGCC-RTQ1-3' | |||
| 5'-ROX:CCACAACTCGCTGCC-BHQ2-3' |
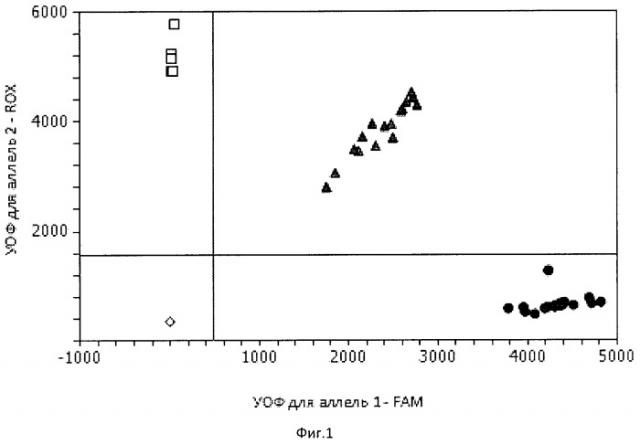
Изобретение характеризуется на фиг.1, где представлена дискриминация аллелей по локусу +1663 A/G TNFR2 (где • - гомозиготы +1663GG, - гомозиготы +1663АА, ▲- гетерозиготы +1663AG), которая осуществляется методом Tag Man зондов по данным величин RFU, где RFU это уровень относительной флуоресценции (УОФ) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует аллелю А, зонд с красителем FAM - аллелю G.
Две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием RFU для одного флуopoфopa (на оси х) относительно RFU для другого флуорофора (на оси у) на диаграмме дискриминации аллелей.
- Если значения RFU неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (AG).
- Если значения RFU неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю А (RFU аллеля А отложены по оси у).
- Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю G (RFU аллеля G отложены по оси х).
- Если значения RFU неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно (в данном случае неопределенный образец - отрицательный контроль).
Формирование базы данных и статистические расчеты осуществлялись с использованием программы «STATISTICA 6.0». Ассоциации аллелей и генотипов изученных ДНК-маркеров с предрасположенностью к хроническому лимфолейкозу, а также с качественными признаками, характеризующими его клинические особенности, оценивали с помощью анализа таблиц сопряженности 2×2 с расчетом критерия χ2 с поправкой Йетса на непрерывность и отношения шансов (OR) с 95% доверительными интервалами (CI). С целью минимизации ошибок первого рода, связанных с получением ложноположительных результатов в работе использована поправка Бонферони (рсоr).
Возможность использования предложенного способа для оценки риска формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания подтверждает анализ результатов наблюдений 207 больных хроническим лимфолейкозом и 305 человек популяционного контроля. Пациенты включались в соответствующую группу больных только после установления диагноза заболевания, подтвержденного с помощью клинических и лабораторно-инструментальных методов обследования.
В исследуемую группу включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой.
Установлено, что аллель +1663 G TNFR2 и генотип +1663 GG являются факторами риска формирования ХЛЛ (OR=1,67, p=0,0007 и OR=1,83, p=0,009, с учетом поправки Бонферони рсоr=0,027), а аллель +1663 А TNFR2 и генотип +1663 АА TNFR2 являются протективными факторами формирования ХЛЛ (OR=0,59, p=0,0007 и OR=0,50, р=0,002, рсоr=0,006) (таблица 2).
| Таблица 2 | ||||||
| Сравнительный анализ частот аллелей и генотипов полиморфного маркера +1663 A/G TNFR2 у больных ХЛЛ и в контрольной группе | ||||||
| Локусы | Аллели, генотипы | Больные ХЛЛ (207 человек) | Контрольная группа (305 человек) | OR (95% CI) χ2, Р | ||
| n | % | n | % | |||
| +166А/G TNFR2 | G | 280 | 67,72 | 341 | 55,74 | 1,67 (1,48-1,81); χ2=14,76; p=0,0007 |
| А | 134 | 32,28 | 269 | 44,26 | 0,59 (0,45-0,78); χ2=14,76; p=0,0007 | |
| GG | 98 | 47,57 | 101 | 33,12 | 1,83 (1,25-2,67); χ2=10,21; p=0,002 | |
| AG | 84 | 40,29 | 138 | 45,24 | 0,81 (0,56-1,18); χ2=1,03; p=0,30 | |
| AA | 25 | 12,14 | 66 | 21,64 | 0,50 (0,29-0,84); χ2=6,95; р=0,009 |
Где n - количество аллелей и генотипов
В дебюте заболевания у 24,87% больных ХЛЛ регистрировались осложнения, в том числе у 6,82% - анемия, у 8,78% - тромбоцитопения, у 3,39% - септические осложнения и у 5,85% - сочетанные осложнения.
Пациенты, имеющие сочетанные осложнения в дебюте заболевания характеризуются наибольшей частотой аллеля +1663 G гена TNFR2 по сравнению с контрольной группой (79,17% против 55,74%; χ2=4,18, р=0,04), таким образом, аллель +1663 G TNFR2 может быть ассоциирован с развитием сочетанных осложнений в дебюте заболевания, (табл.3).
| Таблица 3 | ||||
| Сравнительный анализ частот аллелей и генотипов полиморфного маркера +1663 A/G TNFR2 у больных ХЛЛ с сочетанными осложнениями в дебюте заболевания и в контрольной группе | ||||
| Ген | Аллели, генотипы | Контрольная группа (305 человек) | Больные ХЛЛ с сочетанными осложнениями (12 человек) | OR (95% CI) χ2, p |
| +166А/G TNFR2 | G | 341 (55,74) | 19 (79,17) | 2,99 (1,04-9,28); χ2=4,18; p=0,04 |
| A | 269 (44,26) | 5 (20,83) | 0,33 (0,10-0,96); χ2=4,18; p=0,04 | |
| GG | 101 (33,12) | 7 (58,34) | 0,33 (0,09-1,27); χ2=2,24; p=0,13 | |
| АG | 138 (45,24) | 5 (41,66) | 1,15 (0,32-4,30); χ2=0,00; р=1,00 | |
| AА | 66 (21,64) | 0 | infi (0,62-inFi) χ2=2,09; p=0,14 |
Таким образом, полученные данные свидетельствуют о том, что аллель +1663 G гена TNFR2 является фактором риска формирования хронического лимфолейкоза (OR=1,67) и развития сочетанных осложнений в дебюте заболевания (OR=2,99).
Применение данного способа позволит предпринять профилактические меры для предупреждения возникновения хронического лимфолейкоза у здоровых индивидуумов, а также предупредить появление сочетанных осложнений у больных хроническим лимфолейкозом.
Литература
1. Клиническая онкогематология /Под ред. М.А.Волковой. - М.: Медицина, 2001 - С.376-394.
2. Воробьев А.И., Кременецкая А.М, Харазишвили Д.В. Опухоли лимфатической системы // Гематол. и трансфузиология. - 2000. - №3. - С.3-14.
3. Волкова М.А. Биологические особенности хронического лимфолейкоза и современные подходы к его терапии // Материалы V Российской онкологической конференции, Москва - 2001. - 240 с.
4. Зарецкая Ю.М. Клиническая иммуногенетика. - М.: Медицина, 1983. - 208 с.
5. Чухриенко Н.Д. Аллергия и иммунология //Днепропетровск, издат. БИ - 2005. - 112 с.
6. Хаитов P.M., Алексеев Л.П., Дедов И.И. и соавт. Достижения иммуногенетики в медицине // Иммунология. - 1999. - №1. - С.9-13.
7. Glossop J.R., Dawes P.T., Nixon N.B., Matter D.L. Polymorphism in the tumour necrosis factor receptor II gene is associated with circulating levels of soluble tumour necrosis factor receptors in rheumatoid arthritis//Arthritis Res Ther. - 2005. - Vol.7. - P.1227-1234.
Способ прогнозирования формирования хронического лимфолейкоза и сочетанных осложнений в дебюте заболевания, включающий выделение ДНК из периферической венозной крови, отличающийся тем, что проводят анализ полиморфизма гена рецептора фактора некроза опухоли 2-го типа (+1663 A/G TNFR2) и прогнозируют повышенный риск формирования хронического лимфолейкоза и развития сочетанных осложнений в дебюте заболевания в случае выявления аллеля +1663 G TNFR2.