Нападизилатная соль антагониста мускаринового м3-рецептора
Иллюстрации
Показать всеНастоящее изобретение относится к соединению, представляющему собой [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат. Указанное соединение обладает свойствами антагониста мускаринового М3 рецептора, и применяют в изготовлении лекарственного средства для применения в лечении хронического обструктивного заболевания легких и астмы. Технический результат - [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат, обладающий химической и физической стабильностью, с длительным сроком хранения. 4 н. и 5 з.п. ф-лы, 1 ил.
Реферат
Настоящее изобретение относится к соли мускаринового антагониста, фармацевтической композиции, содержащей ее, и к ее применению в терапии.
Мускариновые рецепторы представляют собой семейство рецепторов, сопряженных с белком G (GPCR), состоящее из пяти членов семейства M1, М2, М3, М4 и М5. Известно, что три из пяти мускариновых подтипов (M1, М2 и М3) оказывают физиологические воздействия на легочную ткань человека. Парасимпатические нервы являются главным путем для рефлекторной бронхоконстрикции в дыхательных путях человека и опосредуют тонус дыхательных путей посредством высвобождения ацетилхолина на мускариновых рецепторах. Тонус дыхательных путей увеличен у пациентов с респираторными расстройствами, такими как астма и хроническое обструктивное заболевание легких (COPD), и по этой причине были разработаны антагонисты мускариновых рецепторов для использования в лечении заболеваний дыхательных путей. Антагонисты мускариновых рецепторов, в клинической практике часто называемые антихолинергиками, широко использовались в качестве терапии первой линии для индивидуумов с COPD, и их применение было широко рассмотрено в литературе (например, Lee et al, Current Opinion in Pharmacology 2001, 1, 223-229).
При использовании для лечения респираторных расстройств антагонисты мускариновых рецепторов обычно вводят посредством ингаляции. Однако при введении посредством ингаляции значительная часть антагониста мускариновых рецепторов часто абсорбируется в системе кровообращения, приводя к описанным побочным эффектам, таким как сухость во рту. Кроме того, большая часть мускариновых антагонистов имеет сравнительно небольшую продолжительность действия, из-за чего требуется вводить их несколько раз в сутки. Такой режим многократногой суточного дозирования не только неудобен для пациента, но также создает значительный риск неадекватного лечения из-за несоблюдения пациентом схемы лечения, связанного с частым повторением приема доз. Таким образом, сохраняется потребность в новых соединениях, которые способны блокировать мускариновые рецепторы. В частности существует потребность в новых мускариновых антагонистах, которые обладают высокой эффективностью и пониженными системными побочными эффектами при введении посредством ингаляции. Кроме того, существует потребность в новых мускариновых антагонистах, которые обладают большой продолжительностью действия при дозировании посредством ингаляции и которые следует принимать или один, или два раза в сутки.
При изготовлении фармацевтических композиций важно, чтобы активное соединение находилось в форме, в которой с ним удобно обращаться и его удобно обрабатывать для получения рентабельного способа получения. В связи с этим, важными факторами являются химическая стабильность и физическая стабильность активного соединения. Активное соединение и композиции, содержащие его, должны эффективно храниться в течение значительных периодов времени, не демонстрируя какого-либо значительного изменения физико-химических характеристик (например, химической структуры, плотности, гигроскопичности и растворимости) активного соединения.
Кроме того, если активное соединение подлежит включению в композицию для легочного введения, желательно, чтобы активное соединение можно было легко микронизировать с получением порошка с хорошими реологическими свойствами, содержащего большую фракцию мелкокристаллических частиц (то есть фракцию, в которой частицы активного соединения имеют средний массовый аэродинамический диаметр менее 10 мкм (микрометров)). Такая фракция способна переноситься глубоко в легкие, приводя к более быстрой и усиленной абсорбции активного соединения.
В международной патентной заявке WO 2007/017669 (PCT/GB 2006/002956) описан новый класс мускаринового антагониста, который показывает высокую активность в отношении рецептора М3. Один из таких мускариновых антагонистов, описанный в PCT/GB 2006/002956, представляет собой [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония метансульфонат. При приготовлении [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония метансульфоната, описанного в PCT/GB2006/002956, получают аморфное твердое вещество, которое не является кристаллическим и, таким образом, не пригодно для микронизации и легочного введения. В настоящее время была обнаружена возможность получить альтернативную [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммониевую соль, которая обладает хорошими физико-химическими свойствами и которая может быть пригодна для использования в сухой порошковой композиции для легочного введения.
Таким образом, согласно настоящему изобретению предлагается соль, которая представляет собой нападизилатную (нафталин-1,5-дисульфонатную) соль [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония. В настоящем описании изобретения данная соль может называться «нападизилатная соль».
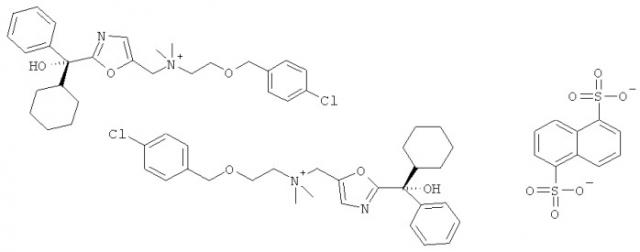
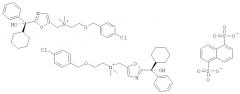
В данном описании изобретения соль по настоящему изобретению упоминается как [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат. Название [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммоний образовано с помощью Autonom 2000, интегрируемого программного модуля для IsisDraw Version 2.5, который поставляется MDL Information Systems Inc., и означает структуру, изображенную на Фиг.А. Стереохимию устанавливали согласно системе Кана-Ингольда-Прелога.
Фиг.А
Соотношение катион/анион в нападизилатной соли по настоящему изобретению может варьироваться и, например, может составлять 1:1 или 2:1 или иметь значение от 1:1 до 2:1.
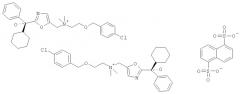
В одном воплощении изобретения нападизилатная соль имеет соотношение катион/анион 2:1, то есть она представляет собой [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфонат, который показан на Фиг.Б. В настоящем описании изобретения данная соль может упониматься как «геми-нападизилатная соль».
Фиг.Б
Настоящее изобретение охватывает сольваты (например, гидраты) нападизилатной соли.
В одном воплощении изобретения нападизилатная соль обладает кристаллическими свойствами и является предпочтительно по меньшей мере на 50% кристаллической, более предпочтительно по меньшей мере на 60% кристаллической, еще более предпочтительно по меньшей мере на 70% кристаллической и наиболее предпочтительно по меньшей мере на 80% кристаллической. Кристалличность можно определить с помощью обычных методик рентгеновской дифрактометрии.
В еще одном воплощении изобретения нападизилатная соль имеет степень кристалличности от 50%, 60%, 70%, 80% или 90% до 95%, 96%, 97%, 98%, 99% или 100%.
Примером кристаллической формы [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната является кристаллическая Форма А, как определено ниже в данном описании изобретения. Таким образом, в одном воплощении настоящего изобретения предложена солевая форма (солевая Форма А) [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната, которая демонстрирует по меньшей мере следующие характерные пики дифракции рентгеновских лучей на порошке (выраженные в градусах 2θ):
1) 5.3, 10.5, 15.8 и 16.5, или
2) 5.3, 10.5, 15.8, 16.5, 18.6 и 19.4 или
3) 5.3, 10.5, 15.8, 16.5, 18.6, 19.4, 19.7 и 20.4 или
4) 5.3, 10.5, 15.8, 16.5, 17.8, 18.6, 19.4, 19.7, 20.4 и 21.7.
В настоящем изобретении также предложена солевая форма (солевая Форма А) [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната, имеющая диаграмму дифракции рентгеновских лучей на порошке, содержащую характерные пики при 5.3, 7.1, 9.2, 10.5, 10.9, 11.1, 11.6, 12.6, 13.0, 13.8, 14.2, 15.2, 15.8, 16.5, 17.0, 17.4, 17.8, 18.4, 18.6, 19.4, 19.7, 20.3, 20.7, 21.2, 21.7, 22.3, 22.5, 22.9, 23.3, 25.8, 26.5 и 27.1.
В настоящем описании изобретения пики дифракции рентгеновских лучей на порошке (выраженные в градусах 2θ) определяют, используя рентгеновское излучение меди с длиной волны 1,5418 Å. В настоящем описании изобретения, если не указано иное, предел погрешности для пиков дифракции рентгеновских лучей на порошке (выраженных в градусах 2θ) согласуется с общим разделом Фармакопеи Соединенных Штатов, относящимся к дифракции рентгеновских лучей (USP941) - смотри United States Pharmacopeia Convention. X-Ray Diffraction, General Test <941>. United States Pharmacopeia, 25th ed. Rockville, MD: United States Pharmacopeial Convention; 2002: 2088-2089). В одном воплощении по изобретению предел погрешности для пиков дифракции рентгеновских лучей на порошке (выраженных в градусах 2θ) составляет (±0,1°).
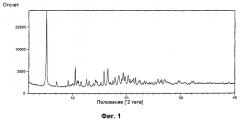
На Фиг.1 показана картина дифракции рентгеновских лучей на порошке солевой Формы А [2-(4-хлорбензилокси)этил]-[2-((R)-цикпогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната. В настоящем изобретении также предлагается солевая форма, имеющая картину дифракции рентгеновских лучей на порошке по существу идентичную, показанной на Фиг.1.
В одном воплощении настоящего изобретения предложена солевая форма (солевая Форма А) [2-(4-хлорбензилокси)этил]-[2-(®-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната, которая демонстрирует по меньшей мере следующие характеристические значения расстояния d:
1) 16.8, 8.4, 5.6 и 5.4, или
2) 16.8, 8.4, 5.6, 5.4, 4.8, и 4.6 или
3) 16.8, 8.4, 5.6, 5.4, 4.8, 4.6, 4.5 и 4.4 или
4) 16.8, 8.4, 5.6, 5.4, 5.0, 4.8, 4.6, 4.5, 4.4 и 4.1.
В настоящем изобретении также предложена солевая форма (солевая Форма А) [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната, имеющая картину дифракции рентгеновских лучей на порошке, содержащую следующие значения расстояния d: 16.8, 12.5, 9.6, 8.4, 8.1, 8.0, 7.7, 7.0, 6.8, 6.4, 6.2, 5.8, 5.6, 5.4, 5.2, 5.1, 5.0, 4.8, 4.8, 4.6, 4.5, 4.4, 4.3, 4.2, 4.1, 4.0, 4.0, 3.9, 3.8, 3.5, 3.4 и 3.3.
В одном воплощении изобретения солевая Форма А представляет ангидрат (то есть кристаллическую фазу, которая не содержит воду).
В одном воплощении изобретения солевая Форма А имеет значение водопоглощения менее 1% при измерении по увеличению массы, определенному посредством GVS (гравиметрическая сорбция пара) при относительной влажности 80% и температуре 25°С.
В одном воплощении изобретения предложена солевая Форма А по существу свободная от других физических форм. «По существу свободная от других физических форм» означает, что по меньшей мере 90% по массе, например 90, 91, 92, 93, 94, 95, 96, 97, 98 или 100% нападизилатной соли, находится в такой физической форме.
Нападизилатная соль по настоящему изобретению может быть получена следующим образом: Смесь [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония бромида и динатриевой соли нафталин-1,5-дисульфоната приводят во взаимодействие в подходящем растворителе (например, смеси дихлорметан/вода) и перемешивают при подходящей температуре (например, 20-25°С) в течение периода времени (например, 6-24 часа). Твердый продукт может быть выделен путем отделения органического слоя от реакционной смеси и выпаривания растворителя с получением неочищенного [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната в виде аморфного твердого вещества. Альтернативно, твердый продукт можно выделять путем добавления к реационной смеси н-гептана. Смесь перемешивают, затем дают возможность отстояться, добавляют дополнительное количество дихлорметана, и смесь снова перемешивают вплоть до осаждения твердого продукта. Затем твердое вещество может быть собрано и высушено с получением [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната.
Для получения солевой Формы А [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната можно взять неочищенный [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфонат (например, полученный способом, описанным в данном описании изобретения выше) и получить суспензию соли в ацетонитриле, перемешивая суспензию вплоть до получения суспензии, которая содержит солевую Форму А, и наконец собрать и высушить твердое вещество. В одном воплощении суспензию поддерживают при температуре окружающей среды (например, 20°С). В другом воплощении суспензия можно нагреть до подходящей температуры и затем охладить опять до температуры окружающей среды. Альтерантивно, солевая Форма А может быть получена путем растворения неочищенного [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната в ацетонитриле, нагревания раствора в течение подходящего времени (то есть до тех пор, пока образец не находится в растворе, например, от 0,5 до 48 часов), и затем охлаждения раствора до температуры окружающей среды (например, 20°С).
Дополнительные получения [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната и солевой Формы А описаны ниже в данном описании изобретения в экспериментальном разделе.
Нападизилатная соль по изобретению обладает активностью в качестве фармацевтического средства, в частности в качестве антихолинергического агента, включая антагонист мускариновогоых рецепторов (М1, М2, и М3), в частности антагонист М3. Заболевания и состояния, которые можно лечить этой солью, включают:
1) дыхательные пути: обструктивные заболевания дыхательных путей, включающие: астму, включая бронхиальную, аллергическую, наследственную, приобретенную, вызванную нагрузкой, индуцированную лекарствами (включая аспириновую и индуцированную NSAID (нестероидными противовоспалительными лекарственными средствами)) и астму, вызванную вдыханием пыли как периодическую, так и постоянную, и всех степеней тяжести, и другие случаи гиперчувствительности дыхательных путей; хроническую обструктивную болезнь легких (COPD); бронхит, включая инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; муковисцидоз; саркоидоз; "легкое фермера" и родственные заболевания; гиперчувствительный пневмонит; фиброз легкого, включая криптогенный фиброзирующий альвеолит, идиопатическую интерстициальную пневмонию, фиброз, осложненный антинеопластической терапией и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения при пересадке легкого; сосудистые и тромботические расстройства легочной сосудистой сети и легочную гипертензию; противокашлевое действие, включая лечение хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенного кашля; острый и хронический ринит, включая медикаментозный ринит, и вазомоторный ринит; хронический и сезонный аллергический ринит, включая нервный ринит (сенную лихорадку); назальный полипоз; острую вирусную инфекцию, включая насморк, и инфекцию, вызванную респираторно-синцитиальным вирусом, гриппом, коронавирусом (включая SARS (тяжелый острый респираторный синдром)) и аденовирусом;
2) кости и суставы: артриты, ассоциированные с остеоартритом/остеоартрозом или включающие его как первичные, так и вторичные по отношению к, например, врожденной бедренной дисплазии; шейный и поясничный спондилит, и поясничная боль и боль в шее; ревматоидный артрит и болезнь Стилла; серонегативные спондилоартропатии, включая анкилозный спондилит, псориатический артрит, реактивный артрит и недифференцированная спондилоартропатия; септический артрит и другие связанные с инфекцией артопатии и расстройства костей, такие как тубекулез, включая болезнь Потта и синдром Понсе; острый и хронический кристалл-индуцированный синовит, включая уратную подагру, заболевание, вызванное отложением пирофосфата кальция, и связанное с кальциевыми апатитами воспаление сухожилий, бурсальное и синовиальное воспаление; болезнь Бехчета; первичный и вторичный синдром Шегрена; системный склероз и ограниченная склеродермия; системная красная волчанка, смешанное заболевание соединительной ткани и недифференцированное заболевание соединительной ткани; воспалительные миопатии, включая дерматомиозиты и полимиозиты; ревматическая полимиалгия; ювенильный артрит, включая идиопатические воспалительные артриты любого суставного распределения и ассоциированные синдромы, и ревматоидная лихорадка и ее системные осложнения; васкулиты, включая гигантоклеточный артериит, артериит Такаясу, синдром Черджа-Стросса, нодозный полиартериит, микроскопический полиартериит и васкулиты, ассоциированные с вирусной инфекцией, реакциями гиперчувствительности, криоглобулинами и парапротеинами; поясничная боль; семейная средиземноморская лихорадка, синдром Макла-Уэлса, и семейная ирландская лихорадка, заболевание Кикучи; вызванные лекарствами арталгии, тендониты и миопатии;
3) боль и ремоделирование соединительной ткани при скелетно-мускульных расстройствах в результате травмы [например, спортивной травмы] или заболевания: артриты (например, ревматоидный артрит, остеоартрит, подагрическая или кристаллическая артропатия), другое суставное заболевание (такое как дегенерация межпозвоночного диска или дегенерация височно-нижнечелюстного сустава), заболевание ремоделирования кости (такое как остеопороз, болезнь Педжета или остеонекроз), полихондрит, склеродерма, смешанное расстройство соединительной ткани, спондилоартропатии или периодонтальное заболевание (такое как периодонтит);
4) кожа: псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы, и реакции гиперчувствительности замедленного типа; фито- и фотодерматит; себорейный дерматит, герпетиформный дерматит, красный плоский лишай, склеротический атрофический лишай, гангренозная пиодермия, кожный саркоид, волчанка красная дисковидная, пузырчатка, пемфигоид, буллезный эпидермолиз, крапивница, ангиоэдема, васкулиты, токсическая эритема, кожная эозинофилия, гнездная алопеция, облысение мужского типа, синдром Свита, синдром Вебера-Крисчена, многоформная эритема; целлюлит, так инфекционный так и неинфекционный; панникулит; лимфома кожи, немеланомный рак кожи и другие диспластические поражения; расстройства, вызванные лекарственными средствами, включая стойкие лекарственные эритемы;
5) глаза: блефарит; конъюнктивит, включая хронический и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хориоидит; аутоиммунные, дегенеративные или воспалительные расстройства, поражающие сетчатку; офтальмия, включая симпатическую офтальмию; саркоидоз; инфекции, включая вирусные, грибковые и бактериальные;
6) желудочно-кишечный тракт: глоссит, гингивит, периодонтит; эзофагит, включая рефлюкс; эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, колит, включая язвенный колит, проктит, анальный зуд; целиакия, синдром раздраженного кишечника, и пищевые аллергии, которые могут оказывать действия, отдаленные от кишечника (например, мигрень, ринит или экзема);
7) абдоминальные: гепатит, включая аутоиммунный, алкогольный и вирусный; фиброз и цирроз печени; холецистит; панкреатит как острый, так и хронический;
8) мочеполовые: нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и язву Ханнера; острый и хроническую уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильная дисфункция (как мужская, так и женская);
9) отторжение трансплантата: острое и хроническое после, например, трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы, или после переливания крови; или хроническая реакция «трансплантант против хозяина»;
10) ЦНС (центральная нервная система): болезнь Альцгеймера и другие дементные расстройства, включая CJD (болезнь Крейцфельда-Якоба) и nvCJD (новый вариант болезни Крейцфельда-Якоба); амилоидоз; рассеянный склероз и другие демиелинизирующие синдромы; церебральный атеросклероз и васкулит; височный артериит; тяжелая псевдопаралитческая миастения; острая и хроническая боль (острая, периодическая или длительная, либо центрального, либо периферического происхождения), включая висцеральную боль, головную боль, мигрень, невралгию тройничного нерва, атипичную лицевую боль, боли суставов и костей, боль, вызванная раком и опухолевой инвазией, невропатические болевые синдромы, включая диабетические, постгерпетические, и ВИЧ-ассоциированные невропатии; нейросаркоидоз; осложнения со стороны центральной и периферической нервной системы при злокачественных, инфекционных или аутоиммунных процессах;
11) другие аутоиммунные и аллергические расстройства, включая тиреоидит Хашимото, базедову болезнь, болезнь Аддисона, сахарный диабет, идиопатическая тромбоцитопеническая пурпура, эозинофильный фасцит, гипер-IgE-синдром, антифосфолипидный синдром;
12) другие расстройства с воспалительной или иммунологической компонентой; включая синдром приобретенного иммунодефицита (AIDS), проказу, синдром Сезари и паранеопластические синдромы;
13) сердечно-сосудистые: атеросклероз, поражающий коронарное и периферическое кровообращение; перикардит; миокардит, воспалительные и аутоиммунные кардиомиопатии, включая миокардиальный саркоид; ишемические реперфузионные повреждения; эндокардит, вальвулит и аортит, включая инфекционный (например, сифилитический); васкулит; расстройства проксимальных и периферических вен, включая флебит и тромбоз, включая тромбоз глубоких вен и осложнения варикозных вен;
14) онкологические: лечение обычных видов рака, включая опухоли простаты, молочной железы, легкого, яичников, поджелудочной железы, кишечника и толстой кишки, желудка, кожи и мозга, и злокачественные заболевания, поражающие костный мозг (включая лейкемии) и лимфопролиферативные системы, такие как лимфома Ходжкина и неходжкинская лимфома; включая предотвращение и лечение метастатического заболевания и рецидивов опухоли, и паранеопластических синдромов; и,
15) желудочно-кишечного тракта: целиакия, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, язвенный колит, микроскопический колит, недифференцированный колит, расстройство раздраженного кишечника, синдром раздраженного кишечника, невоспалительная диарея, пищевые аллергии, которые оказывают действия, отдаленные от кишечника, такие как мигрень, риниты и экзема.
Соответственно, в настоящем изобретении дополнительно предложен [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат, как определено выше в данном описании изобретения, для применения в терапии.
В другом аспекте изобретения предложено применение [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат, как определено выше в данном описании изобретения, в изготовлении лекарственного средства для применения в терапии.
В контексте настоящего описания изобретения, термин "терапия" также включает "профилактику", если нет специальных указаний на обратное. Термины "терапевтический" и "терапевтически" следует истолковывать соответственно.
В дополнительном аспекте изобретения предложен способ лечения болезненного состояния у млекопитающего, страдающего от, или подверженного риску указанного заболевания, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилата, как определено выше в данном описании изобретения.
Также в настоящем изобретении предложен [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат для применения в лечении хронического обструктивного заболевания легких (COPD) (такого как необратимое COPD).
В настоящем изобретении также предложено применение [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилата, как определено выше в данном описании изобретения, в изготовлении лекарственного средства для применения в лечении хронического обструктивного заболевания легких (COPD) (такого как необратимое COPD).
В настоящем изобретении также предложено применение [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилата, как определено выше в данном описании изобретения, в изготовлении лекарственного средства для применения в лечении астмы.
Кроме того, в настоящем изобретении предложен способ лечения хронического обструктивного заболевания легких (COPD) (такого как необратимое COPD) у теплокровного животного, такого как человек, который включает введение млекопитающему, нуждающемуся в таком лечении эффективного количества [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилата, как определено выше в данном описании изобретения.
С целью применения соединения по изобретению для терапевтического лечения теплокровного животного, такого как человек, указанный ингредиент обычно приготавливают в виде препарата согласно обычной фармацевтической методики в виде фармацевтической композиции.
Для вышеуказанных терапевтических применений вводимая дозировка, разумеется, будет варьироваться в зависимости от способа введения, требуемого лечения и указанного расстройства, но типично может находиться в диапазоне от 0,001 мг/кг до 30 мг/кг.
Соль по изобретению можно применять саму по себе, но, как правило, вводят в форме фармацевтической композиции, в которой [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат (активный ингредиент) находится вместе с фармацевтически приемлемым вспомогательным веществом, разбавителем или носителем. Обычные методики подбора и получения подходящих фармацевтических композиций описаны, например, в "Pharmaceuticals - The Science of Dosage Form Designs", M.E.Aulton, Churchill Livingstone, 1988.
В зависимости от способа введения, фармацевтическая композиция может содержать от 0,05 до 99 мас.% (процент по массе), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.%, и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, где все процентные содержания по массе основаны на итоговой композиции.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилат в ассоциации с фармацевтически приемлемым вспомогательным веществом, разбавителем или носителем.
Кроме того, в изобретении предложен способ получения фармацевтической композиции по изобретению, который включает смешивание [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония нападизилата с фармацевтически приемлемым вспомогательным веществом, разбавителем или носителем.
Фармацевтические композиции могут быть введены местно (например, в кожу, или в легкие, и/или дыхательные пути) в форме, например, кремов, раствора, суспензий, гептафторалкановых (HFA) аэрозолей и сухих порошковых композиций, например композиций в устройстве для ингаляции, известном как Turbuhaler®; или системно, например, путем перорального введения в форме таблеток, капсул, сиропов, порошков или гранул; или посредством парентерального введения в форме растворов или суспензий; или посредством подкожного введения; или посредством ректального введения в форме суппозиториев; или трансдермально.
В одном воплощении по изобретению активный ингредиент вводят посредством ингаляции. В еще одном воплощении активный ингредиент вводят с помощью сухого порошкового ингалятора. Ингалятор может представлять собой одно- или многодозовый ингалятор, и может представлять собой активируемый вдохом сухой порошковый ингалятор.
При введении посредством ингаляции доза активного ингредиента может в основном находиться в диапазоне от 0,1 мкг до 10000 мкг, от 0,1 до 5000 мкг, от 0,1 до 1000 мкг, от 0,1 до 500 мкг, от 0,1 до 200 мкг, от 0,1 до 200 мкг, от 0,1 до 100 мкг, от 0,1 до 50 мкг, от 5 мкг до 5000 мкг, от 5 до 1000 мкг, от 5 до 500 мкг, от 5 до 200 мкг, от 5 до 100 мкг, от 5 до 50 мкг, от 10 до 5000 мкг, от 10 до 1000 мкг, от 10 до 500 мкг, от 10 до 200 мкг, от 10 до 100 мкг, от 10 до 50 мкг, от 20 до 5000 мкг, от 20 до 1000 мкг, от 20 до 500 мкг, от 20 до 200 мкг, от 20 до 100 мкг, от 20 до 50 мкг, от 50 до 5000 мкг, от 50 до 1000 мкг, от 50 до 500 мкг, от 50 до 200 мкг, от 50 до 100 мкг, от 100 до 5000 мкг, от 100 до 1000 мкг или от 100 до 500 мкг.
Сухие порошковые композиции и находящиеся под давлением HFA (гидрофторалкановые) аэрозоли активного ингредиента можно вводить посредством пероральной или назальной ингаляции. Для ингаляции соединение желательно тонко измельчить. Тонкоизмельченное соединение предпочтительно имеет средний массовый диаметр менее 10 мкм и может быть суспендировано в смеси пропеллентов с помощью диспергирующего агента, такого как С8-С20 жирная кислота или ее соль (например, олеиновая кислота), соль желчной кислоты, фосфолипид, алкилсахарид, перфорированное или полиэтоксилированное поверхностно-активное вещество, или другого фармацевтически приемлемого диспергирующего агента.
Одним из возможных вариантов является смешивание тонкоизмельченного соединения по изобретению с веществом-носителем, например моно-, ди- или полисахаридом, сахарным спиртом или другим полиолом. Подходящими носителями являются сахара, например лактоза, глюкоза, рафиноза, мелицитоза, лактитол, мальтитол, трегалоза, сахароза, маннитол и крахмал. Альтерантивно, тонкоизмельченное соединение может быть покрыто другим веществом. Порошковая смесь также может быть распределена в твердые желатиновые капсулы, каждая из которых содержит требуемую дозу активного соединения.
Другим возможным вариантом является переработка тонкоизмельченного порошка в сферы, которые распадаются в процессе ингаляции. Таким сферонизированным порошком можно заполнять лекарственный резервуар многодозового ингалятора, например известный как Turbuhaler®, в котором дозатор отмеряет требуемую дозу, которая затем вдыхается пациентом. При помощи такой системы активный ингредиент, в присутствии или в отсутствие вещества-носителя, доставляется пациенту.
Для перорального введения соединение по изобретению можно смешивать со вспомогательным веществом или носителем, например лактозой, сахарозой, сорбитом, маннитом, крахмалом, например картофельным крахмалом, кукурузным крахмалом или амилопектином; производным целлюлозы; связывающим веществом, например желатином или поливинилпирролидоном; и/или смазывающим веществом, например магния стеаратом, кальция стеаратом, полиэтиленгликолем, воском, парафином и тому подобными, и затем прессовать в таблетки. Если требуются таблетки, покрытые оболочкой, сердцевины, полученные как описано выше, могут быть покрыты концентрированным сахарным раствором, который может содержать, например, гуммиарабик, желатин, тальк и диоксид титана. Альтерантивно, таблетка может быть покрыта подходящим полимером, растворенным в легкоиспаряемом органическом растворителе.
Для получения мягких желатиновых капсул, соединение по изобретению может быть смешано, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы соединения с использолванием любого из вышеуказанных эксципиентов для таблеток. Также жидкими или полужидкими композициями соединения по изобретению могут быть заполнены твердые желатиновые капсулы.
Жидкие препараты для перорального применения могут находиться в форме сиропов или суспензий, например растворов, содержащих соединение по изобретению, остальное составляет сахар и смесь этанола, воды, глицерина и пропиленгликоля. Такие жидкие препараты возможно могут содержать красящие вещества, вкусоароматические агенты, сахарин и/или карбоксиметилцеллюлозу в качестве загустителя, или другие эксципиенты, известные специалисту в данной области техники.
Далее изобретение иллюстрируется следующими неограничивающими Примерами. В Примерах представлены следующие фигуры:
Фиг.1: картина дифракции рентгеновских лучей на порошке солевой Формы А [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-гидрокси-фенил-метил)-оксазол-5-илметил]-диметил-аммония геминафталин-1,5-дисульфоната.
Синтез [2-(4-хлорбензилокси)этил]-[2-((R)-циклогексил-хлор-фенил-метил)-оксазол-5-илметил]-диметил-аммония геми-нафталин-1,5-дисульфоната
Получение [1]
Общие экспериментальные подробности для Получения [1]
Все взаимодействия выполняли в атмосфере азота, если не указано иное.
Спектры NMR получали на спектрометре Varian Unity Inova 400 с 5 мм датчиком для инвесного детектирования тройного резонанса, работающим при 400 МГц или на спектрометре Bruker Avance DRX 400 с 5 мм датчиком для инвесного детектирования тройного резонанса типа TXI, работающим при 400 МГц или на спектрометре Bruker Avance DPX 300 со стандартным 5 мм датчиком двухчастотным датчиком, работающим при 300 МГц. Сдвиги приведены в м.д. относительно тетраметилсилана.
Когда продукты очищали колоночной хроматографией, «флэш-силикагель» относится к силикагелю для хроматографии, 0,035-0,070 мм (220-440 меш) (например, силикагель 60 Fluka), и приложенное давление азота вплоть до 10 фунт на кв. дюйм (6,895×104 Па) ускоряло элюирование колонки. Когда использовали тонкослойную хроматографию (TLC), этот термин относится к TLC на силикагеле с использованием пластинок, обычно 3×6 см силикагеля на пластинах из алюминиевой фольги с флюоресцентным индикатором (254 нм), (например, Fluka 60778). Все растворители и имеющиеся в продаже реагенты использовали такими, как они были получены.
Все соединения, содержащие основный(е) центр(ы), который очищали с помощью HPLC (высокоэффективной жидкостной хроматографии), получали в виде соли TFA (тфрифторуксусной кислоты), если не указано иное.
Условия проведения препаративной HPLC:
Колонка с обращенной фазой С18 (колонка со внутренним диаметром (вн.д.) 100×22,5 мм Genesis, с размером частиц 7 мкм). УФ-детектирование при 230 нм.
Системы LC/MS
Используемые системы жидкостной хроматографии/масс-спектроскопии (LC/MS):
LC-MS Способ 1
Масс-спектрометр Waters Platfom с колонкой с обращенной фазой С18 (100×3,0 мм Higgins Clipeus с размером частиц 5 мкм), элюирование А: вода + 0,1% муравьиной кислоты; Б: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
| Градиент - Время | Поток мл/мин | % А | % Б |
| 0,00 | 1,0 | 95 | 5 |
| 1,00 | 1,0 | 95 | 5 |
| 15,00 | 1,0 | 5 | 95 |
| 20,00 | 1,0 | 5 | 95 |
| 22,00 | 1,0 | 95 | 5 |
| 25,00 | 1,0 | 95 | 5 |
Определение - MS, ELS (испарительное светорассеяние), УФ (100 мкл расщепление в MS с последовательно встроенным УФ-детектором при 254 нм)
Способ ионизации при MS - электрораспыление (положительный ион)
LC-MS Способ 2
Waters Micromass ZQ с колонкой с обращенной фазой С18 основе (30×4,6 мм Phenomenex Luna, размер частиц 3 мкм), элюирование А: воду + 0,1% муравьиной кислоты; Б: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
| Градиент - Время | Поток мл/мин | % А | % Б |
| 0,00 | 2,0 | 95 | 5 |
| 0,50 | 2,0 | 95 | 5 |
| 4,50 | 2,0 | 5 | 95 |
| 5,50 | 2,0 | 5 | 95 |
| 6,00 | 2,0 | 95 | 5 |
Определение - MS, ELS, УФ (100 мкл расщепление в MS с последовательно встроенным УФ-детектором)
Способ ионизации MS - электрораспыление (положительный и отрицательный ион)
Сокращения, используемые в Подготовительном примере [1]:
Водн = водный
DCM = дихлорметан
DMF = диметилформамид
EtOAc = этилацетат
EtOH = этанол
GVS = гравиметрическая сорбция пара
МеОН = метанол
к.т. = комнатная температура
Rt = время удерж