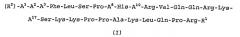Аналоги грелина с замещением на n-конце
Иллюстрации
Показать всеДанное изобретение относится к пептидильным аналогам грелина, имеющим повышенную стабильность, которые активны в отношении рецептора GHS, соответствующим формуле, приведенной ниже:
(R2)-A1-А2-А3-А4-А5-А6-А7-А8-А9-А10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-А21-А22-А23-А24-А25-А26-А27-А28-R1, где значения A1-A28, R1 и R2 приведены в описании, их фармацевтически приемлемым солям и фармацевтическим композициям, содержащим эффективное количество указанного соединения, а также их терапевтическим и не терапевтическим применениям. 6 н. и 16 з.п. ф-лы, 3 табл., 11 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к пептидильным аналогам грелина и их терапевтическому применению.
ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Грелин, недавно открытый орексигенный гормон, продуцируется в виде препрогормона, который подвергается протеолитической обработке с образованием пептида со следующей последовательностью: H-Gly-Ser-Ser-Phe-Leu-Ser-Pro-Glu-His-Gln-Arg-Val-Gln-Gln-Arg-Lys-Glu-Ser-Lys-Lys-Pro-Pro-Ala-Lys-Leu-Gln-Pro-Arg-NH2 (Kojima, M. et al., Nature, (1999), 402(6762):656-60; SEQ ID NO:1). Грелин продуцируется эпителиальными клетками, выстилающими внутренние стенки желудка, и его функцией является стимуляция аппетита, его уровни возрастают перед приемом пищи и снижаются после него.
Известны природные структуры грелина из некоторых видов млекопитающих и не млекопитающих (Kaiya, H. et al., J. Biol. Chem., (2001), 276(44):40441-8; и международная патентная заявка PCT/JPOO/04907 [WO 01/07475]). Активный центр, имеющийся в грелине, отвечает за активность, проявляющуюся в отношении рецептора GHS, и включает четыре N-концевых аминокислоты, где серин в третьем положении обычно модифицирован н-октановой кислотой. Помимо ацилирования н-октановой кислотой природный грелин может также быть ацилирован н-декановой кислотой (Kaiya, H. et al., J. Biol. Chem., (2001), 276(44):40441-8).
Уровни грелина в плазме тучных людей ниже, чем таковые у более худых людей, и уровни грелина возрастают на протяжении суток с полуночи до рассвета у более худых людей, что свидетельствует о нарушениях в кровеносной системе тучных людей (Yildiz, B. O. et al., Proc. Natl. Acad. Sd. USA, (2004), 101(28):10434-9). Установлено, что люди, страдающие нарушением употребления пищи anorexia nervosa, и пациенты с вызванной раком кахексией имеют более высокие уровни грелина в плазме (Garcia, J. M. et al., J. Clin. Endocrin. Metab., (2005), 90(5):2920-6).
Как у животных, так и у людей грелин в значительной степени стимулирует секрецию гормона роста (GH) из передней доли гипофиза, главным образом на уровне гипоталамуса, посредством взаимодействия с рецептором (GHS-R) стимулятора секреции GH (GHS) (Ukkola, O. et al., Ann. Med., (2002), 34(2):102-8; и Kojima, M. et al., Nature, (1999), 402(6762):656-60). GH-высвобождающая активность грелина опосредована активацией рецепторов GHS в гипофизе и, главным образом, на уровне гипоталамуса (Kojima, M. et al., Nature, (1999), 402(6762):656-60).
До того, как было установлено, что грелин является природным лигандом рецептора GHS, было известно, что пульсирующее высвобождение GH из гипофизарных соматотропных клеток регулируется двумя гипоталамическими нейропептидами: GH-высвобождающим гормоном (GHRH) и соматостатином. GHRH стимулирует высвобождение GH, тогда как соматостатин ингибирует секрецию GH (Frohman, L. A. et al., Endocr. Rev., (1986), 7(3):223-53; и Strobl, J. S. et al., Pharmacology Review (1994) 46:1-34). Грелин, вероятно, усиливает активность секретирующих GHRH нейронов, при этом параллельно действуя как функциональный антагонист соматостатина (Ghigo, E. et al., Eur. J Endocri., (1997), 136(5):445-60).
Высвобождение GH из гипофизарных соматотропных клеток может также контролироваться GH-высвобождающими пептидами (GHRP). Установлено, что гексапептид His-D-Trp-Ala-Trp-D-Phe-Lys-амид (GHRP-6, SEQ ID NO:27) высвобождает GH из соматотропных клеток дозозависимым образом у некоторых видов, включая человека (Bowers, C. Y. et al., Endocrinology, (1984), 114(5):1537-45). Дальнейшие химические исследования GHRP-6 привели к обнаружению других сильных синтетических стимуляторов секреции GH, таких как GHRP-1, GHRP-2 и гексарелин (Cheng, K. et al., Endocrinology, (1989), 124(6):2791-8; Bowers, C. Y., Novel GH-Releasing Peptides, Molecular and Clinical Advances in Pituitary Disorders, Ed: Melmed, S., Endocrine Research and Education, Inc., Los Angeles, CA, USA, (1993), 153-7; и Deghenghi, R. et al., Life Sci., (1994), 54(18):1321-8). Структуры этих трех соединений таковы:
GHRP-1 Ala-His-D-(2')-Nal-Ala-Trp-D-Phe-Lys-NH2, SEQ ID NO:2)
GHRP-2 D-Ala-D-(2')-Nal-Ala-Trp-D-Nal-Lys-NH2, SEQ ID NO:3) и
гексарелин His-D-2-MeTrp-Ala-Trp-D-Phe-Lys-NH2. SEQ ID NO:4)
GHS может стимулировать секрецию GH при помощи иного механизма, чем механизм действия GHRH (Bowers, C. Y. et al., Endocrinology, (1984), 114(5):1537-45; Cheng, K. et al., Endocrinology, (1989), 124(6):2791-8; Bowers, C. Y., Novel GH-Releasing Peptides, Molecular and Clinical Advances in Pituitary Disorders, Ed: Melmed, S., Endocrine Research and Education, Inc., Los Angeles, CA, USA, (1993), 153-7; и Deghenghi, R et al., Life Sci., (1994), 54(18):1321-8).
Низкая пероральная биодоступность (<1%) пептидильного GHS явилась причиной поиска непептидильных соединений, имитирующих действие GHRP-6 в гипофизе. Имеются сообщения, что некоторые бензолактамы и спироинданы стимулируют высвобождение GH у различных видов животных, включая человека (Smith, R G et al., Science, (1993), 260(5114):1640-3, Patchett, A. A. et al., Proc. Natl. Acad. Sci. USA, (1995), 92(15):7001-5; Chen, M.-H. et al., Bioorg. Med. Chem. Letts., (1996), 6(18):2163-8). Конкретным примером малого спироиндана является MK-0677 (Patchett, A. A. et al., Proc. Natl. Acad. Sci. USA, (1995), 92(15):7001-5):
Действия GHS (как пептидных, так и непептидных), очевидно, опосредованы определенным рецептором GHS (GHSR, Howard, A. D. et al., Science, (1996), 273(5277):974-7; и Pong, S. S. et al., Mol. Endocri., (1996), 10(1):57-61). Рецептор GHS присутствует в гипофизе и гипоталамусе у различных видов млекопитающих (GHSR1a) и отличается от рецептора GH-высвобождающего гормона. Рецептор GHS также обнаружен в других областях центральной нервной системы и в периферических тканях, например тканях надпочечника, щитовидной железы, сердца, легкого, почки и мышцы (Chen, M.-H. et al., Bioorg. Med. Chem. Letts., (1996), 6(18):2163-9, Howard, A. D. et al., Science, (1996), 273(5277):974-7, Pong, S. S. et al., Mol. Endocri., (1996), 10(1):57-61, Guan, X.-M. et al., Mol. Brain Res., (1997), 48(1):23-9; и McKee, K. K. et al., Genomics, (1997), 46(3):426-34). Имеются сообщения об укороченном варианте GHSR1a (Howard, A. D. et al., Science, (1996), 273(5277):974-7).
Рецептор GHS представляет собой рецептор, связанный с G-белком. Эффекты активации рецептора GHS включают деполяризацию и ингибирование калиевых каналов, возрастание межклеточных концентраций инозитолтрифосфата (IP3) и временное возрастание концентраций внутриклеточного кальция (Pong, S. S. et al., Mol. Endocri., (1996), 10(1):57-61; Guan, X.-M. et al., Mol. Brain Res., (1997), 48(1):23-9; и McKee, K. K. et al., Genomics, (1997), 46(3):426-34).
Молекулы GHS, такие как грелин и его аналоги, имеют множество терапевтических (патент США № 6566337; Inui, A., FASEB J., (2004), 18(3):439-56; Muller, E. E. et al., Neurobiol., Aging, (2002), 23(5):907-19; Casanueva, F. F. et al., Trends Endocrinol. Metab., (1999), 10(1):30-8; и Ankerson, M. et al., Drug Discovery Today, (1999), 4:497-506) и диагностических применений. Соединения, проявляющие агонистические эффекты на рецептор GHS, показаны для улучшения GH-дефицитного состояния патенты США №№ 6861409 и 6967237; и Casanueva, F. F. et al., Trends Endocrinol. Metab., (1999), 10(1):30-8), увеличения мышечной массы (патенты США №№ 6861409 и 6967237) и/или физической силы (Ankerson, M. et al., Drug Discovery Today, (1999), 4:497-506), повышения плотности костей (патенты США №№ 6861409, 6967237 и 6251902; и Sibilia, V. et al., Growth Horm. IGF Res., (1999), 9(4):219-27), лечения остеопороза (международные патентные заявки №№ PCT/IB96/01353 [WO 97/24369] и PCT/IB98/00873 [WO 98/58947]; и Casanueva, F. F. et al., Trends Endocrinol. Metab., (1999), 10(1):30-8), преодоления половой дисфункции (патент США № 6967237; и Casanueva, F. F. et al., Trends Endocrinol. Metab., (1999) 10(1):30-8), лечения сердечно-сосудистого заболевания (международные патентные заявки №№ PCT/IB96/01353 [WO 97/24369] и PCT/IB98/00873 [WO 98/58947]; патент США № 6251902; De Gennaro Colonna, V. et al., Eur. J. Pharmacol., (1997), 334(2-3):201-7; и Casanueva, F. F. et al., Trends Endocrinol. Metab., (1999), 10(1):30-8), облегчения боли при артрите (Granado, M., Am. J. Endo. Metab., (2005), 288:486-92), предотвращения или смягчения проявления болезни Альцгеймера (патенты США №№ 6686359 и 6566337) и/или лечения системной красной волчанки или воспалительного заболевания кишечника, например болезни Крона или язвенного колита (патентная публикация США № 2002/0013320).
Агонистические аналоги грелина могут способствовать прибавлению в весе (патент США № 6967237; Tschop, M. et al., Nature, (2000), 407(6806):908-13; и Tschop, M. et al., Endocrinology, (2002), 143(2):558-68), что, в свою очередь, можно использовать для поддержания желательного веса тела (патенты США №№ 6861409 и 6967237) и/или восстановления физической функции (патенты США №№ 6967237 и 6251902; и международная патентная заявка № PCT/IB96/01353 [WO 97/24369]).
Грелин также повышает аппетит (патент США № 6967237; и Okada, K. et al., Endocrinology, (1996), 137(11):5155-8). В силу этого, грелин часто используют для лечения пациентов, страдающих определенными заболеваниями или нарушениями, либо подвергающихся схемам лечения, обычно сопровождающимися нежелательной потерей веса, например, пациентов, страдающих анорексией (патент США № 6967237; и Tschop, M. et al., Endocrinology, (2002), 143(2):558-68), булимией (патент США № 6967237), кахексией (патенты США №№ 6967237 и 6251902), особенно вызванной раком кахексией (патент США № 6967237; международная патентная заявка № PCT/DK2004/000529 [WO 05/014032]; и Tschop, M. et al., Endocrinology, (2002), 143:558-68), СПИДом (патенты США №№ 6861409 и 6967237; и Tschop, M. et al., Endocrinology, (2002), 143(2):558-68), синдромом атрофии у ослабленных и/или пожилых людей (патенты США №№ 6861409 и 6967237; международная патентная заявка № PCT/IB96/01353 [WO 97/24369]; и Ankerson, M. et al., Drug Discovery Today, (1999) 4:497-506), а также хронической почечной недостаточностью (Casanueva, F. F. et al., Trends Endocri. Metab., (1999), 10(1):30-8). Медикаментозное лечение, обычно сопровождающееся потерей веса, включает химиотерапию, лучевую терапию, временную или постоянную иммобилизацию и/или диализ (патенты США №№ 6967237 и 6251902).
Ожирение является основным фактором риска для возникновения диабета, и большая часть пациентов с инсулиннезависимым сахарным диабетом (иначе называемым «NIDDM») имеют избыточный вес. Оба состояния характеризуются повышенными уровнями циркулирующего инсулина и пониженными уровнями GH. Показано, что лечение при помощи GH взрослых людей с дефицитом GH (Jorgensen, J. O. et al., Lancet, (1989), 1(8649):1221-5), тучных женщин (Richelsen, B. et al., Am. J. Physiol., (1994), 266(2 Pt 1):E211-6) и пожилых мужчин (Rudman, D. et al., Horm. Res., (1991), 36 (Suppl 1):73-81) вызывает увеличение безжировой массы тела, печеночной и мышечной массы, при этом жировая масса уменьшается. Соответственно, введение агониста грелина представляет собой привлекательную терапию ожирения, если не считать диабетогенных эффектов GH (патент США № 6251902; Ankerson, M. et al., Drug Discovery Today, (1999) 4:497-506; и Casanueva, F. F. et al., Trends Endocri. Metab., (1999), 10(1):30-8). Осложнения диабета, такие как ретинопатия, и/или для лечения сердечно-сосудистых заболеваний (патент США № 6967237; и публикация патентной заявки США № 2003/0211967) также можно косвенно лечить грелином.
Считается также, что пептиды, влияющие на высвобождение гормона роста (GH), такие как GHRP-1, GHRP-2 и грелин, проявляют гастрокинетические или «прокинетические» эффекты (патент США № 6548501; Peeters, T. L., J. Physiol. Pharmacol., (2003), 54 (supp 4):95-103 и приведенные там ссылки; Trudel, L. et al., J. Physiol. Gastrointest. Liver Physiol, (2002), 282:G948-52). Вследствие этого аналоги стимуляторов секреции GH также применяют для стимуляции моторики желудочно-кишечного тракта, особенно у пациентов, страдающих пониженной моторикой желудочно-кишечного тракта в результате послеоперационной непроходимости кишечника или в результате гастропареза, связанного с возникновением диабета или хронического диабетического состояния (патент США № 6548501).
Моторика желудочно-кишечного тракта (ЖКТ) (GI) представляет собой согласованный нервно-мышечный процесс, обеспечивающий продвижение питательных веществ по пищеварительной системе (Scarpignato, C., Dig. Dis., (1997), 15:112), нарушение которого может приводить к различным недомоганиям, включая гастроэзофагеальное рефлюксное заболевание (GERD), гастропарез (например, диабетический и послеоперационный), синдром раздраженного кишечника (IBS), запор (например, ассоциированный с гипокинетической фазой IBS), рвоту (например, вызванную средствами противораковой химиотерапии), непроходимость кишечника и псевдозакупорку толстого кишечника (патент США № 6548501; патентная заявка США № 20040266989). Эти различные осложнения, связанные с нарушением моторики ЖКТ, вносят значительный вклад в издержки здравоохранения в промышленно развитых государствах (патент США № 6548501; Feighner, S. D. et al., Science, (1999), 284:2184-8).
«Непроходимость кишечника» означает закупорку кишечника или кишки, особенно толстой кишки (смотри, например, Dorland's Illustrated Medical Dictionary, p. 816, 27th ed. (W.B. Saunders Company, Philadelphia 1988)). Как правило, любая травма кишечника, в результате которой высвобождаются воспалительные медиаторы, ведущие к активации ингибирующих нервных рефлексов, приводит к возникновению непроходимости кишечника. Непроходимость кишечника можно диагностировать по нарушению нормальных согласованных движений кишечника, что приводит к невозможности проталкивания содержимого кишечника (Resnick, J., Am. J. of Gastroentero., (1997), 92:751; Resnick, J., Am. J. of Gastroentero., (1997), 92:934). Непроходимость кишечника следует отличать от запора, который означает редкое или затрудненное опорожнение кишечника (смотри, например, Dorland's Illustrated Medical Dictionary, p. 375, 27th ed. (W.B. Saunders Company, Philadelphia 1988)).
Непроходимость кишечника может быть вызвана множеством причин, таких как роды; ишемия кишечника; забрюшинная гематома; внутрибрюшинный сепсис; внутрибрюшинное воспаление, например, острый аппендицит, холецистит, панкреатит; переломы позвоночника; мочеточниковая колика; грудные повреждения; базальная пневмония; переломы ребер; инфаркт миокарда и нарушения обмена веществ. Послеродовая непроходимость кишечника является обычной проблемой у женщин в период после рождения ребенка и, как считают, возникает вследствие флуктуаций уровней природных опиоидов из-за родового стресса. Пациенты, перенесшие вмешательство, такое как большая полостная операция, включая лапаротомию, по поводу абсцесса в брюшной полости или трансплантации тонкой кишки (SITx), операция в грудной клетке, области таза или ортопедическая хирургия, часто страдают временным нарушением функции кишечника, называемым постхирургической или послеоперационной непроходимостью кишечника (далее в данном документе называемая POI).
POI обычно имеет место в течение 24-72 часов после операции. В некоторых случаях дисфункция кишечника может принимать весьма тяжелую форму, продолжаясь более недели и поражая более чем одну область ЖК тракта (Livingston, E. H. et al., Digest. Dis. and Sci., (1990), 35:121). Нарушение моторики желудочно-кишечного тракта, связанное с POI, принимает наиболее тяжелую форму в толстой кишке. POI характеризуется тошнотой, вздутием живота, рвотой, стойким запором, неспособностью принимать пищу и спазмами. POI не только отсрочивает восстановление нормального приема пищи после хирургического вмешательства и продлевает госпитализацию, но также способствует развитию послеоперационных осложнений, особенно аспирационной пневмонии.
Введение пациенту после хирургического вмешательства опиоидных анальгетиков часто может способствовать и/или усиливать существующую дисфункцию кишечника, тем самым отсрочивая восстановление нормальной функции кишечника. Поскольку практически все пациенты получают опиоидные анальгетики, такие как морфин или другие наркотики, для облегчения боли после хирургической операции, особенно большой хирургической операции, существующее послеоперационное обезболивание может фактически замедлить восстановление нормальной функции кишечника, что приводит к более поздней выписке больного и увеличивает стоимость медицинского обслуживания.
Средства, которые оказывают влияние на моторику желудочно-кишечного тракта, могут также оказывать благоприятное действие на пациентов, страдающих рвотой. Рвота, или извержение рвотных масс, часто предваряется рвотными позывами и может сопровождаться сухой рвотой. Рвоту может вызывать дисбаланс в пищеварительном тракте, такой как непроходимость кишечника, диспепсия или воспаление стенки желудка, либо дисбаланс в сенсорной системе или мозге, такой как укачивание, мигрень или опухоли. Рвота может быть вызвана намеренно, как при анорексии или булимии, и может также возникать в ответ на сильную боль, эмоциональные реакции (например, в ответ на неприятное зрелище или запах), или при беременности. Рвота является обычным осложнением после введения многих лекарственных средств, особенно при противораковом лечении, таком как химиотерапия. Продолжительные приступы или повторная рвота могут приводить к различным травмам организма, включая обезвоживание и электролитный дисбаланс (Quigley, E. M. et al., Gastroentero., (2001), 120:263-86).
Средства, которые оказывают влияние на моторику желудочно-кишечного тракта, могут также оказывать благоприятное действие на пациентов, страдающих гастропарезом. Гастропарез, также называемый замедленным опорожнением желудка, является заболеванием, при котором нервы, подходящие к желудку, повреждены или перестают действовать, и опорожнение желудка занимает слишком много времени. Например, после повреждения блуждающего нерва, который контролирует продвижение пищи по пищеварительному тракту, мышцы желудка и кишечника перестают работать нормально и продвижение пищи замедляется или прекращается. Высокое содержание глюкозы в крови вызывает химические изменения в нервах и повреждения кровеносных сосудов, которые переносят кислород и питательные вещества к нервам. Если уровни глюкозы в крови остаются высокими на протяжении долгого периода времени, что часто происходит при диабете, блуждающий нерв может быть поврежден; гастропарез часто возникает у людей с диабетом 1 типа или диабетом 2 типа (Murray, C. D. et al., Gut, (2005), 54:1693-8).
Традиционные виды терапии нарушений моторики ЖКТ, таких как непроходимость кишечника, гастропарез и рвота, считаются неэффективными. Существующие виды терапии для лечения непроходимости кишечника включают функциональную стимуляцию кишечного тракта, разжижители стула, слабительные средства, такие как дульколакс®, смазывающие средства, внутривенную гидратацию, назогастральную аспирацию, прокинетические средства, раннее зондовое питание и назогастральную декомпрессию. Назогастральную интубацию для декомпрессии желудка также традиционно применяют для лечения непроходимости кишечника.
Традиционные фармацевтические препараты, применяемые для лечения нарушений моторики ЖКТ, таких как непроходимость кишечника, включают лекарственные средства, которые усиливают перистальтику толстой кишки, такие как Leu13-мотилин и простагландин F2 альфа, а также прокинетические средства, такие как цисаприд®. Пропульсид®, который содержит цисаприда® моногидрат, представляет собой пероральное желудочно-кишечное средство (патент США № 4962115), предназначенное для симптоматического лечения взрослых пациентов с ночной изжогой вследствие гастроэзофагеального рефлюксного заболевания. Другие прокинетические средства включают, например, метоклопрамид, домперидон, ондансетрон, трописетрон, мозаприд и итоприд. Другие виды лечения включают введение антагонистов аденозина - соединений пиразолопиридина (патент США № 6214843); антагониста рецептора гипофизарного пептида, активирующего аденилатциклазу (PACAP), в сочетании с антагонистом рецептора вазоактивного пептида кишечника (VIP) (патент США № 6911430); федотозина (патент США № 5362756); нейропептидов (патент США № 5929035); и антагонистов активируемого протеиназой рецептора-2 (патент США № 5929035). В экстремальных ситуациях непроходимость кишечника лечат при помощи хирургического вмешательства, снимающего закупорку толстой кишки.
Однако данные схемы лечения сопряжены с множеством проблем. Например, пропульсид® недавно был изъят из продажи из-за его способности вызывать сердечные аритмии (патент США № 6548501). В настоящее время корпорация Adolor проводит фазу III клинических испытаний способа лечения послеоперационной непроходимости кишечника при помощи алвимопана (энтерег®). Однако в терапии корпорации Adolor применяют антагонисты опиоидного рецептора, которые всего лишь блокируют побочные эффекты опиатных анальгетиков, а не облегчают в действительности состояние непроходимости кишечника. Результаты фазы III испытаний свидетельствуют о предельно низкой эффективности и минимальной применимости средства для лечения непроходимости кишечника, особенно послеоперационной непроходимости кишечника.
Более того, данные способы предшествующего уровня техники для лечения нарушений моторики ЖКТ не обладают специфичностью в отношении различных видов нарушений, например, послеоперационной непроходимости кишечника или послеродовой непроходимости кишечника. Кроме того, данные способы предшествующего уровня техники не способны предотвращать нарушения моторики ЖКТ, такие как непроходимость кишечника, гастропарез и рвота. Если бы удалось предотвращать или более эффективно лечить нарушения моторики ЖКТ, такие как непроходимость кишечника, гастропарез и рвота, длительность пребывания в больнице, восстановительный период и медицинские затраты можно было бы значительно сократить и при этом свести к минимуму дискомфорт пациента.
Лекарственные средства, которые избирательно направлены на моторику кишечника с целью исправления желудочно-кишечной дисфункции, вызванной послеоперационной непроходимостью кишечника, являлись бы идеальными средствами-кандидатами для предотвращения и/или лечения послеоперационной и послеродовой непроходимости кишечника. Такие лекарственные средства являлись бы также превосходными средствами-кандидатами для лечения гастропареза и/или рвоты, особенно рвоты, связанной с желудочно-кишечной дисфункцией, вызванной химиотерапией или другими лекарственными средствами. Среди них лекарственные средства, которые не мешают действию опиоидных анальгетиков, принесут наибольшую пользу, поскольку их можно вводить одновременно с лекарственными средствами для обезболивания при минимальных побочных эффектах.
В ряде недавних исследований продемонстрирована потенциальная возможность использования GHS, таких как грелин, GHRP-6 и другие, для стимуляции моторики кишечного тракта и для лечения состояний, таких как непроходимость кишечника и рвота. Например, показано, что грелин и GHRP-6 ускоряют опорожнение желудка у крыс и мышей (Peeters, T. L., J. Physiol. Pharmacol., (2003), 54 (supp 4):95-103). Показано, что у крыс грелин отменяет задержку опорожнения желудка на модели послеоперационной непроходимости кишечника (Peeters, T. L., J. Physiol. Pharmacol., (2003), 54 (supp 4):95-103; Trudel, L. et al., J. Physiol. Gastrointest. Liver Physiol., (2002), 282(6):G948-52), а также показано, что у собак, подвергшихся лапаректомии, грелин облегчает POI у животных, подвергшихся лечению (Trudel, L. et al., Peptides, (2003), 24:531-4). У мышей с сепсисом грелин и GHRP-6 ускоряли опорожнение желудка, хотя оказывали незначительный эффект на увеличение проходимости в тонком кишечнике (De Winter, B. Y. et al., Neurogastroenterol. Motil., (2004), 16:439-46).
В экспериментах, спланированных так, чтобы имитировать условия госпитализации пациентов-людей, страдающих POI, подвергшихся лапаректомии крысам, вводили опиаты, а также аналог грелина RC-1139 (Poitras, P. et al., Peptides, (2005), 26:1598-601). При аналитическом измерении опорожнения желудка установлено, что RC-1139 отменяет POI у контрольных и лапаректомированных крыс в присутствии морфина. Таким образом, сделан вывод, что грелин обладает гастрокинетическими эффектами, не препятствуя проявлению активности опиатов.
У хорьков, подвергшихся воздействию цитотоксического противоракового средства цисплатина, наблюдали значительно меньшее число отрыжек и рвоты после введения грелина в желудочки мозга (Rudd, J. A. et al., Neurosci. Lett., (2006), 392:79-83), что явилось подтверждением способности грелина уменьшать рвоту, в полном согласии с его ролью в модуляции желудочно-кишечных функций. Считается, что роль грелина в модуляции моторики желудка не зависит от активации секреции GH и может быть опосредована вагально-холинергическим мускариновым каскадом реакций (патентная заявка США № 20060025566).
Показано также, что грелин стимулирует опорожнение желудка у пациентов с диабетическим гастропарезом (Murray, C. D. et al., Gut, (2005), 54:1693-8).
Интересно отметить, что в приведенных выше исследованиях грелин или аналог грелина вводили внутрибрюшинной (в/б) (ip), внутривенной (в/в) (iv) или внутрижелудочковой (в/ж) (icv) инъекцией. В описаниях из других источников (патент США № 6548501; патентная заявка США № 20020042419; патентная заявка США № 20050187237; патентная заявка США № 20060025566) сообщается о пероральном введении GHS в качестве средств для лечения нарушенной моторики желудочно-кишечного тракта.
В данной области известно крайне мало соединений, которые являются полезными для лечения нарушенной моторики ЖКТ, и существует большая потребность в новых соединениях, оказывающих влияние на моторику желудочно-кишечного тракта, например, стимулирующих моторику. Соединения, оказывающие влияние на кинетику желудочно-кишечного тракта, являются полезными для лечения нарушений нормальных функций ЖКТ, таких как непроходимость кишечника и рвота.
Парадоксально, но антагонисты грелина можно также применять для достижения благоприятного эффекта у пациентов (патентные публикации США №№ 2002/187938, 2003/0211967 и 2004/0157227; а также патент США № 6967237). Например, соединения, оказывающие антагонистическое действие на рецептор GHS, способствуя подавлению секреции GH, например, антагонистические аналоги грелина, показаны для отмены избыточной секреции GH (публикация патентной заявки США № 2002/0187938), для содействия потере веса у людей, не страдающих ожирением (патент США № 6967237), для поддержания идеального веса и/или для снижения аппетита (патент США № 6967237). Антагонисты грелина можно также применять для содействия потере веса у тучных людей, если указанная тучность не возникает вследствие развития NIDDM (патент США № 6967237; и публикация патентной заявки США № 2003/0211967).
Избыточный вес является фактором, способствующим возникновению многих заболеваний или состояний, таких как гипертензия, дислипидемия и сердечно-сосудистое заболевание (публикация патентной заявки США № 2003/0211967; и патент США № 6967237), а также желчные камни, остеоартрит (патент США № 6967237), определенные виды рака (публикация патентной заявки США №№ 2003/0211967 и 2004/0157227; а также патент США № 6967237) и синдром Прадера-Вилли (патент США № 6950707; международная патентная заявка № PCT/US2004/008385 [WO 04/084943]; Haqq, A. M. et al., J. Clin. Endocri. Metab., (2003), 88(1):174-8; и Cummings, D. E. et al., Nat. Med., (2002), 8(7):643-4). Антагонисты грелина, которые способствуют снижению веса, вследствие этого будут снижать вероятность подобных заболеваний или состояний и/или являться по меньшей мере частью лечения таких заболеваний или состояний. Также описаны антагонисты молекул GHS, демонстрирующие связывание с онкогенной тканью, что приводило к уменьшению числа онкогенных клеток в тканях-мишенях, например, опухолях легкого, молочных желез, щитовидной железы или поджелудочной железы (международная патентная заявка № PCT/EP99/08662 [WO 00/29011]).
Природный грелин, однако, имеет относительно короткое время полужизни, что ограничивает доступные пути введения и дозы, необходимые для достижения заметного эффекта на употребление пищи и/или снижение веса. Имеются сообщения, что кажущееся время полужизни экзогенного грелина в организме крыс составляет 30 минут (Tolle, V. et al., Endocrin., (2002), 143:1353-61), а в организме человека - только 10 минут (Nagaya, N. et al., Am. J. Physiol. Regul. Integr. Comp. Physiol., (2001), 280:R1483-R1487). Учитывая широкое разнообразие благоприятных воздействий, которые должны оказывать GHS, в данной области существует потребность в эффективных биологически стабильных молекулах аналогов грелина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Аналоги грелина, описанные в данном документе, проявляют активность в отношении рецептора GHS. Данные аналоги могут связываться с рецептором и стимулировать или ингибировать активность рецептора GHS. Аналоги грелина имеют множество различных применений, включая, но не ограничиваясь ими, применение в качестве инструмента исследования или в качестве терапевтического средства.
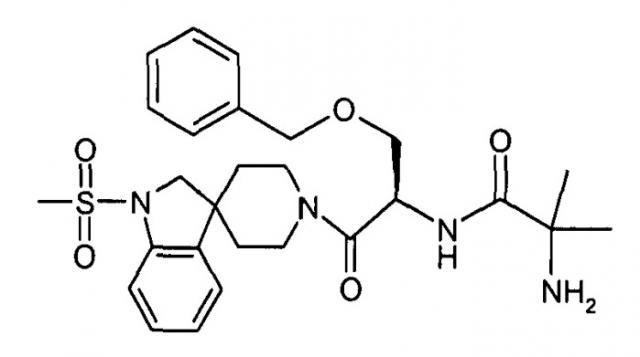
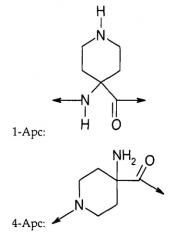
Установлено, что аналоги грелина с замещениями синтетическими аминокислотами изонипекотиновой кислотой (Inp) или (1-Apc или 4-Apc) на N-конце обладают большей устойчивостью к протеолизу по сравнению с природным грелином, а также повышенной активностью в отношении рецептора GHS.
Аспект настоящего изобретения относится к аналогам грелина, где первая аминокислота, перечисленная в определениях от A1 до A28, представляет собой аминокислоту, обнаруженную в соответствующем положении в последовательности природного грелина, то есть H-Gly-Ser-Ser-Phe-Leu-Ser-Pro-Glu-His-Gln-Arg-Val-Gln-Gln-Arg-Lys-Glu-Ser-Lys-Lys-Pro-Pro-Ala-Lys-Leu-Gln-Pro-Arg-NH2 (SEQ ID NO:1), за исключением первой аминокислоты в последовательности, то есть N-концевого остатка, имеющей формулу (I):
(R2)-A1-A2-A3-A4-A5-A6-A7-A8-A9-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-A28-R1
(I)
в которой:
A1 представляет собой Inp, 1-Apc или 4-Apc;
A2 представляет собой Ser, Abu, Acc, Act, Aib, Ala, Ava, Thr или Val;
A3 представляет собой Ser, Asp(NH-R3), Asp(O-R4), Cys(S-R5), Dab(S(O)2-R6), Dap(S(O)2-R7), Glu(NH-R8), Glu(O-R9), Ser(C(O)-R10), Thr(C(O)-R11) или HN-CH((CH2)n-N(R12R13))-C(O);
A4 представляет собой Phe, Acc, Aic, Cha, 2-Fua, 1-Nal, 2-Nal, 2-Pal, 3-Pal, 4-Pal, hPhe, (X1,X2,X3,X4,X5)Phe, Taz, 2-Thi, 3-Thi, Trp или Tyr;
A5 представляет собой Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle или Val;
A6 представляет собой Ser, Abu, Acc, Act, Aib, Ala, Gly, Thr или Val;
A7 представляет собой Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz или Tic;
A8 представляет собой Glu, Acc, Aib, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn или HN-CH((CH2)n-N(R12R13))-C(O);
A9 представляет собой His, Acc, Apc, Aib, 2-Fua, 2-Pal, 3-Pal, 4-Pal, (X1,X2,X3,X4,X5)Phe, Taz, 2-Thi или 3-Thi;
A10 представляет собой Gln, Acc, Aib, Asn, Asp или Glu;
A11 представляет собой Arg, Apc, hArg, Dab, Dap, Lys, Orn или HN-CH((CH2)n-N(R12R13))-C(O);
A12 представляет собой Val, Abu, Acc, Aib, Ala, Cha, Gly, Ile, Leu, Nle, Nva или Tle;
A13 представляет собой Gln, Acc, Aib, Asn, Asp или Glu;
A14 представляет собой Gln, Acc, Aib, Asn, Asp или Glu;
A15 представляет собой Arg, Acc, Aib, Apc, hArg, Dab, Dap, Lys или Orn;
A16 представляет собой Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn или делетирована;
A17 представляет собой Glu, Arg, Asn, Asp, Dab, Dap, Gln, Lys, Orn, Asp(NH-R3), Asp(O-R4), Cys(S-R5), Dab(S(O)2-R6), Dap(S(O)2-R7), Glu(NH-R8), Glu(O-R9), Ser(C(O)-R10), Thr(C(O)-R11), HN-CH((CH2)n-N(R12R13))-C(O) или делетирована;
A18 представляет собой Ser, Abu, Acc, Act, Aib, Ala, Thr, Val или делетирована;
A19 представляет собой Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn или делетирована;
A20 представляет собой Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn или делетирована;
A21 представляет собой Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирована;
A22 представляет собой Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирована;
A23 представляет собой Ala, Abu, Acc, Act, Aib, Apc, Gly, Nva, Val или делетирована;
A24 представляет собой Lys, Acc, Aib, Apc, Arg, hArg, Dab, Dap, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или делетирована;
A25 представляет собой Leu, Abu, Acc, Aib, Ala, Cha, Ile, hLeu, Nle, Nva, Phe, Tle, Val или делетирована;
A26 представляет собой Gln, Aib, Asn, Asp, Glu или делетирована;
A27 представляет собой Pro, Dhp, Dmt, 3-Hyp, 4-Hyp, Inc, Ktp, Oic, Pip, Thz, Tic или делетирована;
A28 представляет собой Arg, Acc, Aib, Apc, hArg, Dab, Dap, Lys, Orn, HN-CH((CH2)n-N(R12R13))-C(O) или делетирована;
R1 представляет собой -OH, -NH2, -(C1-C30)алкокси или NH-X6-CH2-Z0, где X6 представляет собой (С1-C12)алкил или (С2-C12)алкенил и Z0 представляет собой -H, -OH, -CO2H или -C(O)-NH2;
R2 представляет собой H, (C1-C30)алкил, (C1-C30)гетероалкил, (C1-C30)ацил, (C2-C30)алкенил, (C2-C30)алкинил, арил(C1-C30)алкил, арил(C1-C30)ацил, замещенный (C1-C30)алкил, замещенный (C1-C30)гетероалкил, замещенный (C2-C30)ацил, замещенный (C2-C30)алкенил, замещенный арил(C1-C30)алкил, замещенный (C2-C30)алкинил или замещенный арил(C1-C30)ацил;
каждый из R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо в каждом случае выбирают из группы, состоящей из (C1-C40)алкила, (C2-C40)алкенила, замещенного (C1-C40)алкила, замещенного (C2-C40)алкенила, алкиларила, замещенного алкиларила, арила и замещенного арила;
каждый из R12 и R13 независимо в каждом случае выбирают из группы, состоящей из H, (C1-C40)алкила, (C1-C40)гетероалкила, (C1-C40)ацила, (C2-C40)алкенила, (C2-C40)алкинила, арил(C1-C40)алкила, арил(C1-C40)ацила, замещенного (C1-C40)алкила, замещенного (C1-C40)гетероалкила, замещенного (C1-C40)ацила, замещенного (C2-C40)алкенила, замещенного (C2-C40)алкинила, замещенного арил(C1-C40)алкила, замещенного арил(C1-C40)ацила, (C1-C40)алкилсульфонила или -C(NH)-NH2;
n независимо в каждом случае равен 1, 2, 3, 4 или 5;
каждый из X1, X2, X3, X4 и X5 независимо в каждом случае выбирают из группы, состоящей из H, F, Cl, Br, I, (C1-10)алкила, замещенного (C1-10)алкила, арила, замещенного арила, OH, NH2, NO2 и CN;
при условии, что:
если R12 представляет собой (C1-C40)ацил, арил(C1-C40)ацил, замещенный (C1-C40)ацил, замещенный арил(C1-C40)ацил, (C1-C40)алкилсульфонил или -C(NH)-NH2, то R13 представляет собой H или (C1-C40)алкил, (C1-C40)гетероалкил, (C2-C40)алкенил, (C2-C40)алкинил, арил(C1-C40)алкил, замещенный (C1-C40)алкил, замещенный (C1-C40)гетероалкил, замещенный (C2-C40)алкенил, замещенный (C2-C40)алкинил или замещенный арил(C1-C40)алкил; или их фармацевтически приемлемую соль.
Предпочтительной группой соединений, соответствующих вышеприведенной формуле (I), называемой группой 1 соединений, является такая, в которой:
A2 представляет собой Ser или Aib,
A3 представляет собой Ser или Glu(NH-R8),
A4 представляет собой Phe,
A5 представляет собой Leu,
A6 представляет собой Ser,
A7 представляет собой Pro,
A8 представляет собой Glu или Aib,
A9 представляет собой His,
A10 представляет собой Gln или Aib,
A11 представляет собой Arg,
A12 представляет собой Val,
A13 представляет собой Gln,
A14 представляет собой Gln,
A15 представляет собой Arg,
A16 представляет собой Lys,
A17 представляет собой Glu или Ser(C(O)-R10),
A18 представляет собой Ser,
A19 представляет собой Lys,
A20 представляет собой Lys,
A21 представляет собой Pro,
A22 представляет собой Pro,
A23 представляет собой Ala,
A24 представляет собой Lys,
A25 представляет собой Leu,
A26 представляет собой Gln;
A27 представляет собой Pro, и
A28 представляет собой Arg,
или их фармацевтически приемлемую соль.
Другой предпочтительной группой соединений вышеприведенной формулы, называемой группой 2 соединений, является такая, в которой:
R1 представляет собой NH2,
R2 представляет собой H или ацил,
R8 представляет собой гексил, и
R10 представляет собой октанил,
или их фармацевтически приемлемые соли.
Еще более предпочтительной группой соединений из непосредственно предшествующей группы соединений, называемой группой 3 соединений, являются соединения, в которых:
A2 представляет собой Aib,
A3 представляет собой Glu(NH-гексил),
A8 представляет собой Aib,
A10 представляет собой Aib, и
A17 представляет собой Ser(н-октаноил),
или их фармацевтически приемлемую соль.
Другая предпочтительная группа соединений, соответствующих вышеприведенной формуле (I), называемая повсеместно группой 4 соединений, состоит из соединений формулы:
(Inp1)чГрелин(1-28)-NH2, (SEQ ID NO:5)
(Inp1, Aib2)чГрелин(1-28)-NH2, (SEQ ID NO:6)
(Inp1, Aib2, Glu(NH-гексил)3)чГрелин(1-28)-NH2, (SEQ ID NO:7)
(Inp1, Aib2,10)чГрелин(1-28)-NH2, (SEQ ID NO:8)
(Inp1, Aib2,8)чГрелин(1-28)-NH2, (SEQ ID NO:9)
(Inp1, Aib2, Ser(н-октаноил)17)чГрелин(1-28)-NH2, (SEQ ID NO:10)
(Inp1, Ser(н-октаноил)17)чГрелин(1-28)-NH2, (SEQ ID NO:11) и
(Inp1, Aib2,8, Ser(н-октаноил)17)чГрелин(1-28)-NH2, (SEQ ID NO:12)
[Inp1, Ser3]чГрелин(1-28)-NH2, (SEQ ID NO:13)
[Inp1, Aib2, Ser3]чГрелин(1-28)-NH2, (SEQ ID NO:14)
[Inp1, Aib2, Ser3, Ser(н-октаноил)17)чГрелин(1-28)-NH2, (SEQ ID NO:15)
[Inp1, Aib2,10, Ser3]чГрелин(1-28)-NH2, (SEQ ID NO:16)
или их фармацевтически приемлемые соли.
В одном аспекте предпочтительным соединением из вышеуказанных является (Inp1)чГрелин(1-28)-NH2 (SEQ ID NO:5) или его фармацевтиче