Способ получения l-аминокислот с использованием бактерий семейства enterobacteriaceae
Иллюстрации
Показать всеНастоящее изобретение относится к области биохимии. Представлен белок, способный придавать бактерии семейства Enterobacteriaceae устойчивость к ингибированию роста L-цистеином и выбранный из группы, состоящей из: (а) белка, представленного в SEQ ID NO: 2 или его варианта; и (в) белка, представленного в SEQ ID NO: 4 или его варианта; а также представлен фрагмент ДНК, кодирующий указанный белок. Описана бактерия-продуцент L-аминокислоты семейства Enterobacteriaceae, содержащая указанный фрагмент ДНК. Предложен способ получения L-аминокислоты, включающий культивирование указанной бактерии в питательной среде и выделение указанной L-аминокислоты из культуральной жидкости. Изобретение позволяет увеличить выход продуцируемой L-аминокислоты. 4 н. и 8 з.п. ф-лы, 12 табл., 1 ил., 8 пр.
Реферат
Уровень техники
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-аминокислоты с использованием бактерии семейства Enterobacteriacea, которая содержит белок, полученный из бактерии, принадлежащей роду Pantoea, и белку, способному придавать устойчивость к цистеину.
Предшествующий уровень техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов. Обычно микроорганизмы модифицированы для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Другие методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот, и/или уменьшении чувствительности целевого фермента к ингибированию продуцируемой L-аминокислотой по типу обратной связи (см., например, патенты США 4346170; 5661012 и 6040160).
Описан новый микробиологический штамм, пригодный для ферментативного получения L-цистеина, L-цистина, N-ацетилсерина, который образуется в результате неферментативной реакции конверсии О-ацетил-L-серина, и/или производных тиазолидина. Такой новый штамм имеет избыточную экспрессию, по крайней мере, одного из генов, кодирующих белок, который обеспечивает секрецию из клетки антибиотиков или других токсичных для микроорганизма веществ (ЕР 0885962).
Хромосомный фрагмент был идентифицирован в банке генов Escherichia coli по способности увеличивать выход цистеина в промышленном штамме-продуценте. Субклонирование и генетический анализ показали, что за это увеличение отвечает открытая рамка считывания, кодирующая продукт длиной 299 аминокислот, названный Orf299. Orf299 был синтезирован с помощью системы промоторов для Т7-полимеразы, и было показано, что он обладает свойствами интегрального мембранного белка. Такие результаты дополнительно указывают на то, что ORF299 кодирует экспортную помпу, ответственную за выведение различных метаболитов цистеинового пути (Dassler Т. et al, Mol. Microbiol.; 36(5):1101-12(2000).
Было обнаружено, что усиление экспрессии открытой рамки считывания гена yfiK в промышленном штамме-продуценте Е. coli способно увеличивать его продукцию цистеина. Продукт гена yfiK представляет собой интегральный мембранный белок с шестью предсказанными трансмембранными спиралями и относится к RhtB-семейству экспортных белков. Избыточная продукция YfiK за счет введения плазмиды приводит к значительной и параллельной секреции О-ацетил-L-серина и цистеина в культуральную жидкость только в том случае, если организм содержит не чувствительную к ингибированию цистеином по типу обратной связи трансацетилазу. При добавлении в среду избытка О-ацетил-L-серина указанное условие наличия при секреции цистеина устойчивой к ингибированию по типу обратной связи серинтрансацетилазы может быть исключено как в трансформантах, несущих yfiK, так и в клетках дикого типа. Делеционный мутант yfiK не имел каких-либо фенотипических нарушений и был способен экспортировать О-ацетил-L-серин и цистеин, в случае, когда он был трансформирован плазмидой, несущей ранее охарактеризованный ydeD вместо экспортера О-ацетил-L-серина/цистеина. Поскольку двойной мутант ydeD-yfiK демонстрировал такой же результат, предполагается, что YfiK и YdeD действуют независимо. Необходимость клетки регулировать размер внутреннего пула О-ацетил-L-серина через синтез экспортных белков может быть связана с тем, что данное вещество (при добавлении извне) ингибирует рост. Избыточная экспрессия любого из генов ydeD или yfiK ослабляет ингибирование и увеличивает устойчивость к азасерину, который является аналогом О-ацетил-L-серина (Franke I et.al., J Bacteriol.; 185(4):1161-6(2003)).
Объединение цитохрома bd и периплазматических цитохромов Е. coli требует АТФ-связывающий кассетный транспортер CydDC, субстрат которого неизвестен. Сравнение с помощью двухмерного SDS-PAGE периплазмы из штаммов дикого типа и cydD мутанта выявило, что последний был лишен некоторых транспортных связывающих белков периплазмы, несмотря на то, что ни один мажорный белок не отсутствовал в периплазме мутанта cydD. CydDC экспортирует из цитоплазмы в периплазму аминокислоту цистеин, для которого далее, с помощью обращенных мембранных везикул с радиомеченным цистеином может быть показано, что транспорт внутрь осуществляется АТФ-зависимым несопряженным способом. Были описаны новые плейотропные фенотипы мутанта cydD, в том числе появление чувствительности к бензилпенициллину и дитиотреитолу и потеря подвижности. Оба этих фенотипа согласуются с периплазматическими дефектами при формировании дисульфидных связей. Наличие экзогенного цистеина было способно восстановить эти фенотипы и оказывать влияние на уровень периплазматических цитохромов с-типа в штаммах cydD и дикого типа, но не восстанавливать уровень цитохрома d. Согласно функции CydDC, являющегося экспортером цистеина, рост мутанта cydD был гиперчувствителен к высокой концентрации цистеина и продуцировал более высокий цитоплазматический уровень цистеина, чем мутант дефектный по ORF299, кодирующей главный посредник суперсемейства. Двойной мутант cydD ORF299 был высокочувствителен к цистеину и имел повышенный уровень цитоплазматического цистеина, в то время как избыточная экспрессия CydDC придавала устойчивость к его высокой внутриклеточной концентрации. По-видимому, CydDC отвечает за экспорт цистеина, который является ключевым для окислительно-восстановительного гомеостаза в периплазме (Pittman M.S. et al., J Biol Chem.; 277(51):49841-9(2002)).
Кроме YdeD и YfiK, которые были ранее определены как белки, экспортирующие L-цистеин в Е. coli, было проанализировано влияние 33 предполагаемых генов лекарственных транспортеров Е. coli на экспорт L-цистеина и их избыточной продукции. Избыточная экспрессия генов acrD, acrEF, bcr, cusA, emrAB, emrKY, ybjYZ и yojIH снимала ингибирование роста клеток Е. coli, которые имели нарушенный ген tnaA, L-цистеином. Ген tnaA является главным цистеиндесульфогидразным геном. Было обнаружено, что после культивирования в присутствии L-цистеина избыточная экспрессия восьми вышеперечисленных генов снижает внутриклеточный уровень L-цистеина. Исследование транспорта аминокислот показало, что избыточная экспрессия Bcr, обеспечивающего устойчивость к бицикломицину и тетрациклину, в частности, способствует экспорту L-цистеина, направляемому за счет энергии, которая генерируется протонным градиентом. Когда штамм Е. coli с нарушенным геном tnaA, экспрессирующий поврежденный ген cysE, был трансформирован плазмидой, несущей ген bcr, полученный трансформант продуцировал больше L-цистеина, чем клетки, несущие только вектор. Анализ репортерных генов дал основания полагать, что ген bcr конститутивно экспрессируется на высоком уровне. Такие результаты показывают, что обеспечивающий множественную лекарственную устойчивость транспортер Bcr главного семейства посредников, вовлечен в экспорт L-цистеина и его избыточную продукцию в сконструированных методами генетической инженерии клетках Е. coli (Yamada S. et al., Appl Environ Microbiol.; 72(7):4735-42(2006)).
Но в настоящее время нет данных об использовании для продукции L-аминокислот бактерии, содержащей белок, полученный из бактерии рода Pantoea и который способен придавать бактерии устойчивость к ингибированию L-цистеином.
Описание изобретения
Цели настоящего изобретения могут включать увеличение продуктивности продуцирующих L-аминокислоты штаммов и предоставление способа получения неароматических или ароматических L-аминокислот с использованием указанных штаммов.
Данные цели были достигнуты за счет обнаружения того факта, что активность белка, придающего бактерии устойчивость к ингибированию роста L-цистеином, может приводить к увеличению продукции L-аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Настоящее изобретение предоставляет бактерию семейства Enterobacteriaceae, обладающую повышенной способностью к продукции аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Целью настоящего изобретения является предоставление белка, способного придавать бактерии устойчивость к ингибированию роста L-цистеином, отличающийся тем, что указанный белок выбран из группы, состоящей из:
(A) белка, представленного в SEQ ID NO: 2; или его варианта и
(B) белка, представленного в SEQ ID NO: 4; или его варианта.
Также целью настоящего изобретения является предоставление фрагмента ДНК, кодирующего описанный выше белок.
Также целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae, содержащей описанный выше фрагмент ДНК.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая трансформирована вышеупомянутым фрагментом ДНК.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой экспрессия вышеупомянутого фрагмента ДНК усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая способна продуцировать L-аминокислоты.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая принадлежит к роду Pantoea.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, включающего культивирование описанной выше бактерии в питательной среде, и выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором указанная L-аминокислота выбрана из группы, включающей ароматическую L-аминокислоту и неароматическую L-аминокислоту.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором ароматическая L-аминокислота выбрана из группы, включающей L-фенилаланин, L-тирозин и L-триптофан.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором неароматическая L-аминокислота выбрана из группы, включающей L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновую кислоту, L-глутамин, L-глутаминовую кислоту, L-пролин, L-аргинин и О-ацетил-L-серин.
Настоящее изобретение более детально описано ниже.
Подробное описание наилучшего способа осуществления изобретения
1. Бактерия согласно настоящему изобретению
Бактерия может представлять собой бактерию - продуцент L-аминокислоты, принадлежащую к семейству Enterobacteriaceae, отличающуюся тем, что указанная бактерия содержит белок, полученный из бактерии, принадлежащей к роду Pantoea, и указанный белок способен придавать устойчивость к ингибированию роста L-цистеином.
Термин "бактерия - продуцент L-аминокислоты" может обозначать бактерию, которая имеет способность к продукции и выделению L-аминокислоты в среду, когда такая бактерия культивируется в среде.
Термин "бактерия - продуцент L-аминокислоты" может также обозначать бактерию, которая способна производить и накапливать L-аминокислоту в среде в количестве большем, чем штамм дикого типа или родительский штамм Е. coli, такой как Е. coli K-12, и предпочтительно может обозначать, что микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее чем 0.5 г/л и более предпочтительно не менее чем 1.0 г/л. Термин «L-аминокислота» включает в себя L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин, L-глутаминовую кислоту, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин, L-валин и О-ацетил-L-серин.
Термин "ароматическая L-аминокислота" означает L-фенилаланин, L-тирозин и L-триптофан. Термин "неароматическая L-аминокислота" означает L-треонин, L-лизин, L-цистеин и производные L-цистеина, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновую кислоту, L-глутамин, L-глутаминовую кислоту, L-пролин, L-аргинин и О-ацетил-L-серин. L-треонин, L-лизин, L- цистеин, L-лейцин, L-гистидин, L-глутаминовая кислота, L-фенилаланин, L-триптофан, L-пролин, L-аргинин и О-ацетил-L-серин являюстя другими вариантами.
Некоторое количество продуцируемого бактерией L-цистеина за счет формирования дисульфидных связей может превратиться в среде в L-цистин. S-сульфоцистеин может быть получен в реакции между L-цистеином и тиосерной кислотой, которые присутствуют в среде (Szczepkowski Т. W., Nature, vol. 182 (1958)). Образующийся в среде S-сульфоцистеин может быть восстановлен в L-цистеин восстановителем, таким как дитиотриетол. Кроме того, для получения производного тиазолидина через промежуточный полутиокеталь L-цистеин, образующийся в бактериальных клетках, может быть сконденсирован кетоном, альдегидом или, например, пировиноградной кислотой, которая также присутствует в клетках (см. патент Японии 2992010). Производное тиазолидина и полутиокеталь могут сосуществовать как равновесная смесь. Когда тиазолидиновое производное цистеина производится в среде, L-цистеин может быть получен путем отбора производного тиазолидина из среды для того, чтобы нарушить равновесие между производным и L-цистеином так, чтобы L-цистеин продуцировался в избытке. Следовательно, способность производить L-цистеин не ограничивается способностью накапливать только L-цистеин в среде или клетках, но также включает способность накапливать в среде L-цистин или его производные, такие как S-сульфоцистеин, производное тиазолидина, полутиокеталь или их смесь в среде.
Некоторые производные L-цистеина, такие как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, например, могут быть синтезированы из цистеина как важный исходный материал. Производные L-цистеина могут также включать метилцистеин, этилцистеин, карбоцистеин, сульфоцистеин, ацетилцистеин и другие. L-цистеин, полученный, как описано выше, может использоваться для получения таких производных L-цистеина.
Ферментативное производство этих соединений может быть осуществлено с использованием соответствующих микроорганизмов-продуцентов в качестве хозяйских штаммов, в сочетании со способностью продуцировать цистеин. Таким образом, способность продуцировать L-цистеин включает и вышеупомянутые соединения, такие как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, которые производят цистеин как важный интермдиат.
Для того чтобы придать способность синтезировать из цистеина такие соединения, как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, могут быть использованы хорошо известные методы селекции коринеформных бактерий или бактерий рода Escherichia (см. "Amino Acid Fermentation", Gakkai Shuppan Center (Ltd.), 1st Edition, published May 30, 1986, pp.77-100). Такие методы включают получение микроорганизма, имеющего свойства ауксотрофного мутанта, штамма, устойчивого к аналогу, или мутанта с нарушением метаболической регуляции или конструкцию рекомбинантного штамма, с избыточной экспрессией соответствующего фермента биосинтеза. Также эффективным для увеличения количества продукта может быть снижение активности ферментов, которые катализируют реакции, ответвляющиеся от основного пути, и/или вовлечены в деградацию соответствующих соединений или их инетермедиатов. В данном случае при селекции каждая бактерия-продуцент может быть наделена одним или несколькими вышеописанными свойствами. Экспрессия соответствующего фермента(ов) биосинтеза может быть усилена отдельно или в сочетании с одним или несколькими ферментами. К тому же, наделение такими свойствами, как ауксотрофная мутация, устойчивость к аналогу или мутация, нарушающая метаболическую регуляцию, могут сочетаться с методами усиления активности ферментов биосинтеза.
Термин "бактерия, которая имеет устойчивость к ингибированию роста L-цистеином" может означать бактерию, полученную из родительского бактериального штамма, который имеет такие генетические свойства, что может расти в среде, содержащей L-цистеин. Может быть использована твердая питательная среда.
Бактерия, которая имеет устойчивость к ингибированию роста цистеином, демонстрирует более благоприятный рост по сравнению с родительским штаммом, когда культивируется в среде, содержащей L-цистеин. Например, бактерия, которая может формировать колонии при выращивании при 34°C в течение 20 часов на чашках с минимальной средой М9, содержащей 50 мкМ или более или предпочтительно 200 мкМ L-цистеина, может быть устойчивой к L-цистеину.
Штаммы, несущие описанные выше гены, которые могут расти быстрее, чем контрольный штамм в среде, содержащей 50 мкМ L-цистеина, или, предпочтительно, 200 мкМ, показывают, что данный ген или локус генов могут придавать устойчивость к цистеину.
Семейство Enlerobacteriaceae включает бактерии, относящиеся к родам Escherichia, Enterobacfer, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и так далее. В особенности предпочтительны бактерии, отнесенные к семейству Enterobacteriaceae согласно классификации базы данных NCB1 (National Center for Biotechnology Information) database (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Может быть использована бактерия, принадлежащая к роду Escherichia или Pantoea.
Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия может быть отнесена к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. Среди примеров бактерий, принадлежащих к роду Escherichia, но не ограничивающихся ими, может быть упомянута бактерия Escherichia coli (E. coli).
Бактерия, принадлежащая к роду Escherichia, не ограничена каким-либо образом, при этом, например, может быть использована бактерия описанная Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Table 1).
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия может быть отнесена к роду Pantoea согласно системе классификации, известной специалисту в области микробиологии. Некоторые виды Enterobacter agglomerans недавно были переклассифицированы в Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или другие аналогичные, на основании нуклеотидного анализа последовательности 16S РНК, и др. (International Journal of Systematic Bacteriology, July 1989, 39(3), pp.337-345). Кроме того, некоторые бактерии рода Erwinia были переклассифицированы в Pantoea ananatis или Pantoea stewartii (International Journal of Systematic Bacteriology, Jan. 1993, 43(1), pp.162-173). Среди типичных штаммов бактерий Pantoea, но не ограничивающих их, могут быть упомянуты Pantoea ananatis, Pantoea stewartii, Pantoea agglomerans и Pantoea citrea. Конкретными примерами штаммов являются Pantoea ananatis AJ 13355 (FERM BP-6614, Европейский патент No. 0952221), Pantoea ananatis AJ 13356 (FERM BP-6615, Европейский патент No. 0952221), Pantoea ananatis AJ 13601 (FERM BP-7207, Европейский патент No. 0952221). В качестве примера способа осуществления настоящего изобретения штамм Pantoea ananatis SC17(0) может быть использован как λ-Red устойчивая бактерия (VKPM В-9246, патентная заявка России 2006134574).
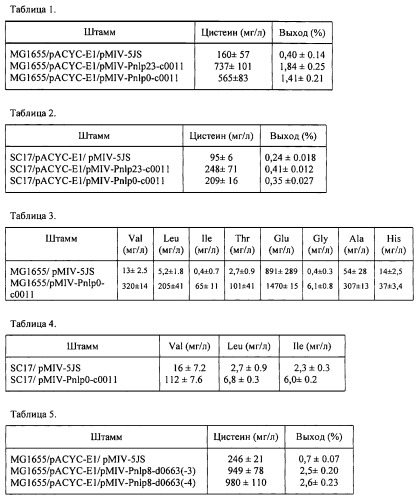
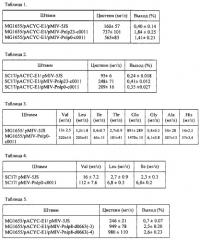
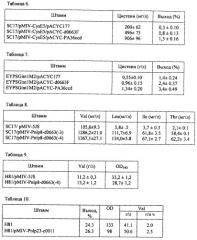
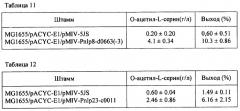
Нуклеотидная последовательность гена c0011 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном c0011, представлены в SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
Нуклеотидная последовательность гена d0663 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном d0663, представлены в SEQ ID NO: 3 и SEQ ID NO: 4 соответственно.
Нуклеотидная последовательность гена с09478 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном с09478, представлены в SEQ ID NO: 5 и SEQ ID NO: 6 соответственно.
Поскольку у представителей различных родов и штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, гены c0011, d0663 и с09478 не ограничиваются генами, последовательности которых представлены в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5, и могут включать гены, гомологичные генам, представленным в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5.
Ген c0011 может кодировать предполагаемый трансмембранный белок из Klebsiella pneumoniae (GenBank Accession No. ABR77369.1), гипотетический белок KCO_01469 из Citrobacter koseri (GenBank Accession No. ABV 12602.1), пермеазу суперсемейства (DMT) из Acinetobacter baumannii (GenBank Accession No. ABO12139.2) и предполагаемый мембранный белок из Pseudomonas aerugmosa (GenBank Accession No. ABR86455.1). Ген d0663 может кодировать экспортер лизина (LYSE/YGGA) из Erwinia tasmaniensis (GenBank Accession No. CA095150.1), предполагаемый мембранный белок из Pectobacterium atrosepticum (GenBank Accession No. CAG76207.1), предполагаемый транспортный белок из Chromobacterium violaceum (GenBank Accession No. AAQ59575.1) и экспортер лизина (LYSE/YGGA) из Burkholderia vietnamiensis (GenBank Accession No. ABO58107.1).
Поэтому вариант белка, кодируемый генами c0011, d0663 и с09478, может быть представлен белком с гомологией не менее 80%, предпочтительно не менее 90% и наиболее предпочтительно не менее 95% по отношению к полным аминокислотным последовательностям, представленным в SEQ ID No:2, SEQ ID No:4 и SEQ ID No:6, соответственно, при условии, что белок наделяется устойчивостью к цистеину. Термин «вариант белка» означает белки с изменениями в последовательностях, будь то делеции, вставки, добавления или замены аминокислот. Количество изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Возможно от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 изменений в последовательностях, представленных в SEQ ID No:2, SEQ ID No:4 и SEQ ID No:6. Эти изменения в вариантах белка могут иметь место в областях белка, которые некритичны для функционирования белка. Такие изменения допускаются благодаря тому, что некоторые аминокислоты имеют высокую гомологию друг к другу, поэтому такие изменения не влияют на третичную структуру или активность.
Гомология между двумя аминокислотными последовательностями может быть установлена с использованием известных методов, например, компьютерной программы BLAST 2.0, которая считает три параметра: счет, идентичность и сходство.
Замена, делеция, вставка или добавление одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации является консервативная замена. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val or Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, гены c0011, d0663 и с09478 могут быть представлены вариантами, которые гибридизуются при жестких условиях с нуклеотидной последовательностью, представленной в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5 соответственно или с зондами, которые могут быть синтезированы на основе указанных нуклеотидных последовательностей, при условии, что указанные варианты кодируют функциональный белок. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды со степенью гомологии не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90%, наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например, гибриды со степенью гомологии ниже вышеуказанной - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например, 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°C. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, рекомендуется производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при жестких условиях составляет 15 минут. Предпочтительна двухтрехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Усиление экспрессии генов c0011, d0663 и с09478 может быть достигнуто за счет увеличения числа копий генов c0011, d0663 и с09478, изменения регуляторных последовательностей генов c0011, d0663 и с09478, амплификации гена, кодирующего регуляторный фактор, ответственный за усиление экспрессии генов c0011, d0663 и с09478 соответственно или за счет нарушения или снижения экспрессии гена, кодирующего регуляторный фактор, ответственный за подавление экспрессии генов c0011, d0663 и с09478 соответственно, с использованием методов трансформации или гомологичной рекомбинации.
Например, фрагмент рекомбинантной ДНК может быть приготовлен путем лигирования фрагмента, содержащего гены c0011, d0663 и с09478 с вектором, предпочтительно многокопийным вектором, который может реплицироваться в микроорганизме-хозяине, и полученный вектор может быть введен в микроорганизм-хозяин.
Также число копий генов c0011, d0663 и с09478 может быть увеличено путем интеграции нескольких копий гена в хромосомную ДНК микроорганизма. Интеграция множественных копий генов c0011, d0663 и с09478 в хромосомную ДНК микроорганизма может быть осуществлена с помощью гомологичной рекомбинации нацеливанием на последовательность, существующую в хромосомной ДНК в нескольких копиях. Могут быть использованы повторяющаяся ДНК и инвертированные повторы на концах транспозонов. Или же, как описано в JP2-109985A, возможно ввести гены c0011, d0663 и с09478 в транспозон, что позволит их перенести так, что несколько копий гена будут интегрированы в хромосомную ДНК. Интеграция генов c0011, d0663 и с09478 в хромосому может быть подтверждена с помощью зонда, который имеет часть последовательности c0011, d0663 и с09478 генов.
Усиление экспрессии генов c0011, d0663 и с09478 может быть также достигнуто за счет замены регуляторной последовательности, включающей промоторы генов c0011, d0663 и с09478 на хромосомную ДНК или плазмиду с более сильным промотором, как описано в заявке РСТ WO 00/18935. Например, могут быть использованы lac-промотор, trp-промотор, trc-промотор, PL-промотор и другие, известные как сильные промоторы. Кроме того, можно ввести несколько нуклеотидных замен в промоторные районы генов так, что промоторы станут сильнее. Способ оценки силы промоторов и примеры сильных промоторов описаны в книге Goldstein et al. (Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128). К тому же, известно, что спейсерные последовательности между сайтом связывания рибосомы (RBS-ribosome binding site) и инициирующим трансляцию кодоном, особенно несколько нуклеотидов до инициирующего кодона, оказывают существенное влияние на эффективность трансляции. Вследствие этого такая последовательность может быть изменена. Регулирующие экспрессию последовательности генов c0011, d0663 и с09478 могут быть определены с использованием вектора для идентификации промотора или программы для генетического анализа, такой как GENETYX. Экспрессия может быть также улучшена за счет продления срока жизни РНК. Кроме того, активность фермента также может быть увеличена за счет предотвращения деградации фермента.
Для того чтобы усилить активность белка, кодируемого генами c0011, d0663 и с09478, в указанные гены может быть введена мутация, усиливающая экспорт L-аминокислот. Примерами мутаций, которые увеличивают активность белков, кодируемых генами c0011, d0663 и с09478 (белки С0011, D0663 и С09478), могут служить мутация в последовательности промотора, увеличивающая транскрипцию генов c0011, d0663 и с09478, и мутация в кодирующем районе гена c0011, d0663 и с09478, увеличивающая специфическую активность белков С0011, D0663 и С09478.
Методами получения плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и подобными им могут являться обычные методы, хорошо известные специалисту в данной области. Эти методы описаны, например, в книге Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Бактерия-продуцент L-аминокислоты
Может быть использована бактерия, способная к продукции ароматических или неароматических L-аминокислот.
Бактерия может быть получена путем введения гена, который кодирует белок, способный придавать бактерии, имеющей способность производить L-аминокислоты, устойчивость к цистеину. С другой стороны, бактерия может быть получена путем придания способности производить L-аминокислоты бактерии, которая уже содержит белок, придающий ей устойчивость к цистеину.
Бактерия-продуцент L-треонина
Примеры родительского штамма для получения бактерии-продуцента L-треонина включают, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США 5175107 и 5705371), штамм Е. coli 472T23/pYN7 (ATCC 98081) (патент США 5631157), штамм Е. coli NRRL-21593 (патент США 5939307), штамм Е. coli FERM ВР-3756 (патент США 5474918), штаммы Е. coli FERM BP-3519 и FERM BP-3520 (патент США 5376538), штамм Е. coli MG442 (Гусятинер и др., Генетика, 14, 947-956 (1978)), штаммы Е. coli VL643 и VL2055 (Европейская патентная заявка ЕР 1149911 А) и подобные им.
Штамм TDH-6 является дефектным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией типа "leaky". Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*BC, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 117105, Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный штамм также был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545, Москва, 1-й Дорожный проезд, 1) с инвентарным номером В-3996.
В качестве родительского штамма для получения бактерии-продуцента L-треонина согласно настоящему изобретению также может быть использован штамм E. coli ВКПМ В-5318 (Европейская заявка ЕР0593792 В). Штамм В-5318 является прототрофным относительно изолейцина, регуляторная область треонинового оперона на плазмиде pVIC40 заменена чувствительным к температуре С1 репрессором фага λ и промотором PR. Штамм ВКПМ В-5318 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) 3 мая 1990 г. с инвентарным номером ВКПМ В-5318.
Бактерия может быть дополнительно модифицирована таким образом, чтобы иметь повышенную экспрессию одного или нескольких следующих генов:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, предположительно кодирующего трансмембранный белок;
- гена asd, кодирующего аспартат-β-семиальдегиддегидрогеназу, и
- гена aspC, кодирующего аспартатаминотрансферазу (аспартаттрансаминазу).
Нуклеотидная последовательность гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I из Escherichia coli, известна (номера нуклеотидов с 337 по 2799 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrA расположен на хромосоме штамма Е. coli K-12 между генами thrL и thrB. Нуклеотидная последовательность гена thrB, кодирующего гомосеринкиназу из Escherichia coli, известна (номера нуклеотидов с 2801 по 3733 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrB расположен на хромосоме штамма Е. coli K-12 между генами thrA и thrC. Нуклеотидная последовательность гена thrC, кодирующего треонинсинтазу из Escherichia coli, известна (номера нуклеотидов с 3734 по 5020 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrC расположен на хромосоме штамма Е. coli K-12 между геном thrB и открытой рамкой считывания уааХ. Все три указанных гена функционируют как один треониновый оперон. Для усиления экспрессии треонинового оперона область аттенюатора, влияющего на транскрипцию, удаляется из оперона (заявки РСТ WO 2005/049808, WO 2003/097839).
Мутантный ген thrA, кодирующий аспартокиназу-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи, так же, как и гены thrB и thrC могут быть получены в виде единого оперона из хорошо известной плазмиды pVIC40, которая представлена в штамме-продуценте Е. coli ВКПМ В-3996. Плазмида pVIC40 подробно описана в патенте США 5705371.
Ген rhtA расположен на 18 минуте хромосомы Е. coli около оперона glnHPQ, который кодирует компоненты транспортной системы глутамина, ген rhtA идентичен ORF1 (ген ybiF, номера нуклеотидов с 764 по 1651 в последовательности с инвентарным номером ААА218541 в базе данных GenBank, gi:440181), расположен между генами рехВ и ompX. Участок ДНК, экспрессирующийся с образованием белка, кодируемого рамкой считывания ORF1, был назван геном rhtA (rht: resistance to homoserine and threonine). Также было показано, что мутация rhtA23 представляет собой замену А-на-G в положении -1 по отношению к старт кодону ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457, EP 1013765 A).
Нуклеотидная последовательность гена asd из E. coli известна (номера нуклеотидов с 3572511 по 3571408 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi; 16131307) и может быть получена с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе нуклеотидной последовательности указанного гена. Гены asd из других микроорганизмов могут быть получены сходным образом.
Также нуклеотидная последовательность гена aspC из E. coli известна (номера нуклеотидов с 983742 по 984932 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi:16128895) и может быть получена с помощью ПЦР. Гены aspC из других микроорганизмов могут быть получены сходным образом.
Бактерия-продуцент L-лизина
Примеры бактерий-продуцентов L-лизина, принадлежащих к роду Escherichia, включают мутанты, обладающие устойчивостью к аналогу L-лизина. Аналог L-лизина ингибирует рост бактерий, принадлежащих к роду Escherichia, но это ингибирование полностью или частично снимается, когда в среде также присутствует L-лизин. Примеры аналога L-лизина включают, но не ограничиваются оксализином, лизингидроксаматом, S-(2-аминоэтил)-L-цистеином (АЕС), γ-метиллизном, α-хлорокапролактамом и так далее. Мутанты, обладающие устойчивостью к указанным аналогам лизина, могут быть получены путем обработки бактерий, принадлежащих к роду Escherichia, традиционными мутагенами. Конкретные примеры бактериальных штаммов, используемых для получения L-лизина, включают штамм Escherichia coli AJ11442 (PERM BP-1543, NRRL В-12185; смотри патент США 4346170) и штамм Escherichia coli VL611. В этих микроорганизмах аспартокиназа устойчива к ингибированию L-лизином по типу обратной связи.
Штамм WC196 может быть использован в качестве бактерии-продуцента L-лизина Escherichia coli. Данный бактериальный штамм был получен путем селекции фенотипа устойчивости к АЕС у штамма W3110, производного от штамма Escherichia coli K-12. Полученный штамм был назван Escherichia coli AJ13069 и был депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology), в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 6 декабря 1994 года и получил инвентарный номер PERM P-14690. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора 29 сентября 1995 года, и штамм получил инвентарный номер PERM BP-5252 (смотри патент США 5827698).
Примеры родительских штаммов для получения бактерий, продуцирующих L-лизин, также включают штаммы, в которых усилена экспрессия одного или нескол